Bu içeriği görüntülemek için JoVE aboneliği gereklidir. Oturum açın veya ücretsiz deneme sürümünü başlatın.
Method Article
Lipid Raft belirlenmesi Flüoresan Korelasyon Spektroskopisi (FCS) tarafından Yaşayan hücreler içinde floresan etiketli Soruşturmasının Bölümleme
Bu Makalede
Özet
Yaşayan hücrelerin plazma membranında flüoresan proteinlerin lipid sal bölümleme araştırmak için bir yöntem tarif edilmiştir. Bu lipid sallar içinde veya dışında bulunan proteinlerin difüzyon zamanlarda eşitsizlik yararlanır. Kazanım kontrol koşullarda ya da ilaç eklenmesinden sonra dinamik olarak gerçekleştirilebilir.
Özet
Son on beş yıl içinde hücre zarları homojen değildir ve işlevleri sarfetmek microdomains güveniyor görüşünü yaygın olarak kabul haline gelmiştir. Lipid sallar kolesterol ve spingolipitler zenginleştirilmiş membran microdomains vardır. Bunlar sinyalizasyon gibi hücresel fizyolojik süreçlerin bir rol oynar ve ticareti 1,2 değil, aynı zamanda viral veya bakteriyel enfeksiyonlar ve nörodejeneratif hastalıklar 3 dahil olmak üzere çeşitli hastalıklarda önemli oyuncular olduğu düşünülmektedir.
Ancak varlıklarını hala tartışma 4,5 meselesidir. Gerçekten de, lipid sal boyutu böylece doğrudan görüntüleme engelleyen, çok konvansiyonel mikroskobu (200 nm dolaylarında) çözünürlük sınırının altında, yaklaşık 20 nm 6 olarak tahmin edilmiştir. Şimdiye kadar, lipid sallar içinde ilgi proteinlerin bölümü değerlendirmek için kullanılan ana teknikleri Deterjan Dayanıklı Membranlar (DRMS) antikorları ile izolasyon ve co-yama vardı. Rağmen yaygın olarak kullanılan becaonların yerine kolay uygulama kullanımı, bu tekniklerin eserler eğilimli oldukları ve böylece 7,8 eleştirdi. Teknik gelişmeler dolayısıyla bu eserlerin aşmak ve canlı hücrelerin lipid sallar bölüm soruşturma edebilmek için gerekli idi.
Burada yaşayan hücrelerin plazma membranında floresan etiketli protein veya lipitlerin lipid sallar bölümünün hassas analizi için bir yöntem sunuyoruz. Bu yöntem, Flüoresan Korelasyon Spektroskopisi (FCS) olarak adlandırılan, lipid salların içinde veya dışında bulunan flüoresan prob difüzyon zamanlarda eşitsizliği dayanır. Aslında, yapay membranlar ve hücre kültürlerinde hem de kanıtlandığı, probları çok daha hızlı dışında yoğun lipid sallar 9,10 içinde daha dağılırdı. Difüzyon kez belirlemek için, dakikalık bir floresans dalgalanmaları (Şekil bir konfokal mikroskop ile hücre plazma membranında bulunan, bir odak hacmi (yaklaşık 1 femtoliter) zamanın bir fonksiyonu olarak ölçülmektedir1). Oto-korelasyon eğrileri sonra bu dalgalanmaların alınan ve uygun matematiksel difüzyon modelleri 11 ile takılabilir.
FCS bunlar floresan etiketlenmiş olduğu sürece, çeşitli prob bölümleme lipid sal belirlemek için kullanılabilir. Floresan etiketleme flüoresan füzyon proteinlerinin ifadesini ya da flüoresan ligand bağlanması ile elde edilebilir. Ayrıca, yakın zamanda 12 FCS olarak tanımlanan, suni membranları ve hücre çizgileri, ama aynı zamanda primer kültürler olarak değil yalnızca kullanılabilir. Ayrıca ilaç eklenmesi veya membran lipid kompozisyonunda değişim 12 sonrası lipid sal bölümleme dinamiklerini takip için kullanılabilir.
Protokol
1. FCS Kur Kalibrasyon
- Konfokal mikroskop, lazerler, bilgisayarlar, sıcaklık için kuvöz ve CO 2 kontrolü başlatın.
- SPAD (Single Photon Çığ Diyot) üzerindedir ve SPAD içinde floresan filtre iyi numunenin uygun olduğundan emin olun. SPAD zaman içinde senkronize olup olmadığını kontrol edin. Lütfen SPAD ayarları edinimi için hazır kez sadece FCS yazılımı başlatmak için dikkat edin.
- 1 ug / ml (17.5 nM) bir konsantrasyona ulaşmak için PBS ile seyreltilerek kolera toksini-Alexa488 taze bir çözeltisi hazırlayın.
- Mikroskop iç algılama kullanarak çözüm konfokal görüntüleme Optimize.
- Tarama modu gelin ve çözüm örnek bir nokta seçin geçin. Lazer aydınlatma süresi (> 5 dakika) sizin FCS alımları gerçekleştirmek için yeterince uzun olduğundan emin olun.
- SPAD dış algılama ve FCS yazılım geçin. Lütfen floresans sinyal izlemek ve iyi sui olduğundan emin olunSPAD için ted (yeterli sinyal ancak doygunluk, 10 50 000 sayımları 000 / s iyidir). Gerekirse, z konumunu, kazanç ve / veya doğru floresan sinyal elde etmek için lazer gücü değiştirin.
- 30 saniye ölçümleri 10 takım edinin. Zaman kazancı (en iyi örnekleme ve photobleaching sorunları arasında uzlaşma) için numune için optimize edilmelidir.
- Eğer çözüm difüzyon bir floresan türlerin karşılık gelen bir oto-korelasyon eğrisi (Şekil. 2 denklemi) sahip olmasını sağlamak ve montaj sonrası elde edilen difüzyon süresi (Şekil (yaklaşık 0,2 ms) doğru olduğunu verilerinizi (bkz: adım 4) analiz . 3).
2. Lipid Rafts Marker ile Yaşayan hücreler boyanması
- Poli-L-lisin (1mg/ml) yapışmasının doğru olduğundan emin olmak için görüntüleme önceki gün kaplı 8-iyi Labteks üzerine Plaka HEK293 hücreleri. Floresan sinyal hiçbir karışıklık yoktur sağlamak için fenol kırmızısı olmadan orta kullanın.
- HBSS (Hank Tamponlu Tuz Çözeltisi) ile iki kez hücre yıkayın.
- 37 de 30 dakika boyunca hücrelere 500 ul HBSS kolera toksini-Alexa488 (1 ug / ml) / BSA (% 0.1) ekleyin ° C. Kolera toksini tercihen lipid sallar bölümlenmiş olması bilinen gangliozid GM1, bağlanacaktır.
- HBSS (Hank Tamponlu Tuz Çözeltisi) ile iki kez hücre yıkayın.
3. Yaşayan hücreler üzerindeki FCS Veri Toplama
- Mikroskop sahnede boyanan hücrelerin yerleştirin. 2 durumları bu difüzyon zamanlarda eserlerin yol açabilir aksi takdirde uygun olduğundan emin Sıcaklık ve CO olun.
- Mikroskop iç algılama (Şekil 4) kullanarak bir ilgi hücrenin konfokal görüntüleme Optimize.
- Tarama modunu işaret ve faiz hücrenin plazma membranı bir nokta seçin geçin. Hücre edinimi sırasında hareket olmadığından emin olmak için hücrenin 1-2 canlı görüntüleri gerçekleştirin.
- SPAD dış algılama geçin ve FCS yumuşakware. Lütfen floresans sinyal izlemek ve iyi (yeterli sinyal ancak doygunluk, 10 000 50 000 sayım / s ince) SPAD uygun olduğundan emin olun. Gerekirse, z konumunu, kazanç ve / veya doğru floresan sinyal elde etmek için lazer gücü değiştirin. Bu yeterli değil ise, boyama, değişen koşullara düşünebilirsiniz.
- 30 saniye ölçümlerin 10 örnek edinin. En hücreleri otomatik floresan olduğundan, otomatik floresans solma nedeniyle, ilk satın almalar sırasında floresans bir düşüş görebilirsiniz.
4. FCS Veri Analizi
- Korelasyon aralığı ayarlayın ve FCS yazılımı ile oto-korelasyon eğrileri oluşturmak. Korelasyon aralığı genellikle kısa çözülebilir gecikme zaman kadar olası en uzun süre (ölçüm istatistikleri daha yetersiz maksimum korelasyon zaman toplam satın alma zamanı yaklaştığında olur, azami gecikme süresini% 80 ile sınırlıdır uzanacağım Picoqua üzerine alma süresint yazılım).
- Her numune için, zamanın bir fonksiyonu olarak floresans dalgalanmalar ve oto-korelasyon karşılık gelen dosyaları ihracat.
- Bir veri analizi ve bu dosyaları almak için Pro Origin gibi uydurma yazılımı kullanın.
- Her bir örnek için, floresans 30 saniye boyunca sabit kalır yani hiçbir photobleaching edinimi sırasında olduğundan emin olun. Bu yapay uzun difüzyon kez neden olabilir photobleaching gösteren herhangi bir önlem atın.
- Kalan FCS eğrilerinin şekli (Şekil 5) doğru olup olmadığını kontrol edin. Ortalama FCS eğrisi belirleyin.
- Uygun matematiksel model (Şekil 2) ile eğrisi uyar. Bu uygun bir difüzyon süresi (ler) ve bunun (ese) difüzyon süresi (lar) ile difüzyon moleküllerinin oranı verecektir.
5.. Temsilcisi Sonuçlar
Bir kolera toksini-Alexa488 solüsyonu ile bir FCS kalibrasyon bir örneği, Şekil 3 'de gösterilmiştir . Zamanın bir fonksiyonu olarak floresans bireysel tedbirlerin photobleaching (Şekil 3A), bireysel göstermek ve FCS eğrileri gelmediğini kontrol ettikten sonra hesaplandı. Anlamına FCS eğrileri çeşitli difüzyon modelleri (Şekil 2'de örnekler) tekabül eden denklem ile donatılmış edildi. Klasik bir uyum kalitesini belirlemek için kabul parametre belirleme katsayısı R 2 dir. R 2 yakın daha iyi bir uyum, 1 etmektir. Bu durumda, ortalama FCS eğrisi uyacak şekilde en doğru modeli üç boyutlu (Şekil 2 ve Şekil 3B, denklem 1) serbestçe difüzyon flüoresan moleküller nüfusu tarif biridir. Uyum elde difüzyon süresi 0.32 ms. Eğri (Şekil 3C) ve R 2 faktörü (0,99906) gelen artıklar uyum kaliteli bir tahmin sağlar.
Kolera toksini-Alexa488 lekeli HEK2 için FCS analizi bir örneği93 hücreleri Şekil 5 de gösterilmiştir. Multifazik ortalama FCS eğrisi şekli farklı difüzyon kez floresan moleküllerin nüfusun varlığını ortaya koymaktadır. Bir engel difüzyon (membran düzlemde gibi, iki boyutlu difüzyon) ve üç boyutta serbestçe difüzyon biri (Şekil 2 ve Şekil 5 denklem 2) iki: Bu eğri için en uygun floresan probların üç nüfusa sahip bir model tekabül . Bu ikinci nüfusu salgılanması veya geri dönüşüm yol aracılığıyla membran ulaşan veya endositoz ile membran bırakarak, bunların membran hedefler için bağlayıcı ya da bağlantısını kesme düzlemi membranı, yani, hareket dışındaki moleküller flüoresan karşılık gelir. GM1 bağlı kolera toksini tekabül membran iki kez difüzyonu, lipid salların dışında difüzyon tekabül 2 MS (moleküllerinin% 25), ve lipid sallara difüzyon karşılık gelen 75 ms (moleküllerinin% 50), idi . Unutmayın ki herhangi bir photobleachedinimi sırasında ing yapay uzun difüzyon kez böylece muhtemelen lipid sal alanlarda GM1 lokalizasyonu konusunda bir önyargı oluşturmaya yol açacaktır.

Şekil 1. FCS kurulumu (Marquer ark modifiye resim. 12) şematik

Şekil 2. Difüzyon modelleri ve otokorelasyon eğrileri sığdırmak için kullanılacak karşılık gelen denklem örneği. Yapısı parametresi S 1 / e 2 yoğunluğu ve W0 etkili la azından optik ekseni boyunca S = z z 0 / W 0 0 etkili odak uzunluğu gibi yazılabilir1 / e 2 yoğunlukta teral odak yarıçapı. Bu değerler, klasik bir nokta dağılım fonksiyonu (PSF) ölçümü elde edilebilir.
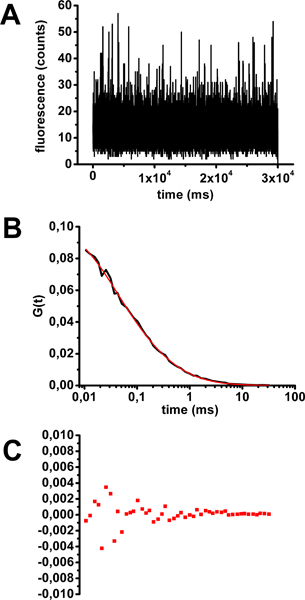
Şekil 3. FCS kalibrasyon için çözüm kolera toksin Alexa488 difüzyon zaman değerlendirilmesi. Bir 30 saniye kazanım bir temsili örneğin zamanın bir fonksiyonu olarak A) Floresans dalgalanması. B) denklemi 1 ile donatılmış 30 saniye edinimi 10 örnek (bkz. Şekil 2). C) eğri gelen artıklardan elde edilen otokorelasyon eğrisi ortalama.
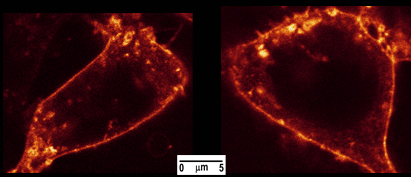
Şekil 4. HEK-293 hücre kolera toksin Alexa488 ile boyandı. Hücreler iç 488nm lazer çizgisi ile bir SP5 konfokal mikroskop (Leica Microsystems, Wetzlar, Almanya) görüntülendi. Floresans 500 arasında bir x60 planı apochromat immersiyon yağı amacı ile toplanmışve 650 nm.
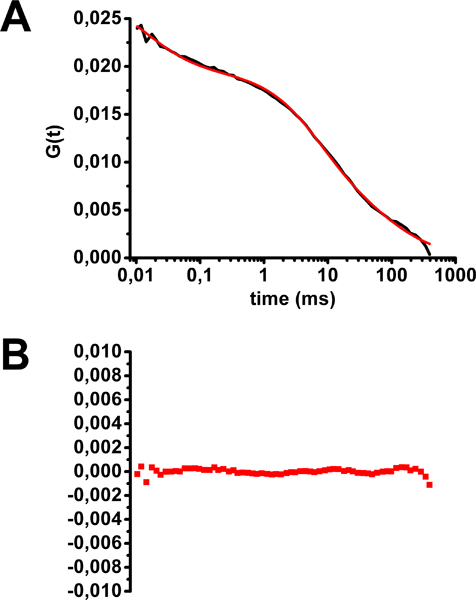
Şekil 5. HEK293 hücrelerinin plazma membranında kolera toksini-Alexa488 yayılma süresi değerlendirmesi. A) (bkz. Şekil 2) denklemi 2 ile donatılmış otokorelasyon eğrisi ortalama. B eğri itibaren) artıklar. (Marquer ve ark modifiye. 12)
Tartışmalar
FCS yöntemi burada sunulan canlı hücrelerin ilgi floresan probların lipid sal bölümleme bir hassas ve hızlı analiz sağlar. FCS tek foton sayma duyarlılığı ile konfokal mikroskopi lokalizasyonu doğruluğunu birleştirir. FCS ve standart biyokimyasal teknikler arasındaki temel fark DRMS izolasyon ya da eş-yama için olduğu gibi FCS hedef lipid sallar bölümü değil, göreceli bölüm mutlak belirlenmesi olanak tanımasıdır.
FCS veri kazanım her bir örnek için yakl...
Açıklamalar
Çıkar çatışması ilan etti.
Teşekkürler
Bu çalışma, Agence Nationale de la Recherche (ChoAD) bir hibe ile desteklenmiştir. Biz de kendi mali destek için Fondation ICM (Institut du Cerveau et de la Moelle) minnettarız.
Malzemeler
| Name | Company | Catalog Number | Comments |
| Reaktif Adı | Şirket | Katalog numarası | Yorumlar |
| Kolera toksini B alt birimi-Alexa 488 | Invitrogen | C-34775 | MW (pentamer) = 57 kg / mol |
| Konfokal mikroskop | Leica | SP5 | |
| Sıcaklık ve CO 2 kontrolü için İnkübatör | Yaşam görüntüleme hizmetleri | Küp ve Kutu | |
| SPAD (Single Photon Çığ Diyot) | MPD (Photon Micro Devices) | PDM serie (100 mikron Hassas Alan) | |
| Yüksek geçiren 488 nm filtre | Semrock | Kenar BrightLine uzun-pass filtre engelleme 488 nm Part #ails.aspx? id = FF01-488/LP-25 "target =" _blank "> FF01-488/LP-25 | |
| FCS algılama ünitesi | Picoquant | Picoharp 300 modülü | |
| Toplama ve oto-korelasyon yazılımı | Picoquant | SymPhoTime | |
| Fitting yazılım | OriginLab | OriginPro8 |
Referanslar
- Brown, D. A., London, E. Functions of lipid rafts in biological membranes. Annu. Rev. Cell Dev. Biol. 14, 111-136 (1998).
- Simons, K., Gerl, M. J. Revitalizing membrane rafts: new tools and insights. Nat. Rev. Mol. Cell Biol. 11, 688-699 (2010).
- Simons, K., Ehehalt, R. Cholesterol, lipid rafts, and disease. J. Clin. Invest. 110, 597-603 (2002).
- Munro, S. Lipid rafts: elusive or illusive. Cell. , 115-377 (2003).
- Shaw, A. S. Lipid rafts: now you see them, now you don't. Nat. Immunol. 7, 1139-1142 (2006).
- Pralle, A., Keller, P., Florin, E. L., Simons, K., Horber, J. K. Sphingolipid-cholesterol rafts diffuse as small entities in the plasma membrane of mammalian cells. J. Cell Biol. 148, 997-1008 (2000).
- Brown, D. A., London, E. Structure and function of sphingolipid- and cholesterol-rich membrane rafts. J. Biol Chem. 275, 17221-17224 (2000).
- Sharma, P., Sabharanjak, S., Mayor, S. Endocytosis of lipid rafts: an identity crisis. Semin. Cell Dev. Biol. 13, 205-214 (2002).
- Kahya, N., Scherfeld, D., Bacia, K., Poolman, B., Schwille, P. Probing lipid mobility of raft-exhibiting model membranes by fluorescence correlation spectroscopy. J. Biol. Chem. 278, 28109-28115 (2003).
- Bacia, K., Scherfeld, D., Kahya, N., Schwille, P. Fluorescence correlation spectroscopy relates rafts in model and native membranes. Biophys J. 87, 1034-1043 (2004).
- Kim, S. A., Heinze, K. G., Schwille, P. Fluorescence correlation spectroscopy in living cells. Nat. Methods. 4, 963-973 (2007).
- Marquer, C. Local cholesterol increase triggers amyloid precursor protein-Bace1 clustering in lipid rafts and rapid endocytosis. FASEB J. 25, 1295-1305 (2011).
- Tian, Y., Martinez, M. M., Pappas, D. Fluorescence correlation spectroscopy: a review of biochemical and microfluidic applications. Appl. Spectrosc. 65, 115A-124A (2011).
- Haustein, E., Schwille, P. Fluorescence correlation spectroscopy: novel variations of an established technique. Annu. Rev. Biophys. Biomol. Struct. 36, 151-169 (2007).
- Ilien, B. Pirenzepine promotes the dimerization of muscarinic M1 receptors through a three-step binding process. J. Biol. Chem. 284, 19533-19543 (2009).
- Lieto, A. M., Cush, R. C., Thompson, N. L. Ligand-receptor kinetics measured by total internal reflection with fluorescence correlation spectroscopy. Biophys. J. 85, 3294-3302 (2003).
- Thompson, N. L., Burghardt, T. P., Axelrod, D. Measuring surface dynamics of biomolecules by total internal reflection fluorescence with photobleaching recovery or correlation spectroscopy. Biophys. J. 33, 435-454 (1981).
- Thompson, N. L., Steele, B. L. Total internal reflection with fluorescence correlation spectroscopy. Nat. Protoc. 2, 878-890 (2007).
- Eggeling, C. Direct observation of the nanoscale dynamics of membrane lipids in a living cell. Nature. 457, 1159-1162 (2009).
- Kolin, D. L., Wiseman, P. W. Advances in image correlation spectroscopy: measuring number densities, aggregation states, and dynamics of fluorescently labeled macromolecules in cells. Cell Biochem. Biophys. 49, 141-164 (2007).
- Shvartsman, D. E., Kotler, M., Tall, R. D., Roth, M. G., Henis, Y. I. Differently anchored influenza hemagglutinin mutants display distinct interaction dynamics with mutual rafts. J. Cell Biol. 163, 879-888 (2003).
- White, R. Holin triggering in real time. Proc. Natl. Acad. Sci. U.S.A. 108, 798-803 (2011).
- Petersen, N. O., Hoddelius, P. L., Wiseman, P. W., Seger, O., Magnusson, K. E. Quantitation of membrane receptor distributions by image correlation spectroscopy: concept and application. Biophys. J. 65, 1135-1146 (1993).
- Hebert, B., Costantino, S., Wiseman, P. W. Spatiotemporal image correlation spectroscopy (STICS) theory, verification, and application to protein velocity mapping in living CHO cells. Biophys. J. 88, 3601-3614 (2005).
- Digman, M. A. Measuring fast dynamics in solutions and cells with a laser scanning microscope. Biophys. J. 89, 1317-1327 (2005).
- Digman, M. A. Fluctuation correlation spectroscopy with a laser-scanning microscope: exploiting the hidden time structure. Biophys. J. 88, L33-L36 (2005).
- Nohe, A., Keating, E., Fivaz, M., van der Goot, F. G., Petersen, N. O. Dynamics of GPI-anchored proteins on the surface of living cells. Nanomedicine. 2, 1-7 (2006).
- Semrau, S., Schmidt, T. Particle image correlation spectroscopy (PICS): retrieving nanometer-scale correlations from high-density single-molecule position data. Biophys. J. 92, 613-621 (2007).
- Bates, I. R. Membrane lateral diffusion and capture of CFTR within transient confinement zones. Biophys. J. 91, 1046-1058 (2006).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiDaha Fazla Makale Keşfet
This article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır