Для просмотра этого контента требуется подписка на Jove Войдите в систему или начните бесплатную пробную версию.
Method Article
Определение липидного плота разделов флуоресцентно с метками зонды в живых клетках при флуоресцентной спектроскопии корреляции (FCS)
В этой статье
Резюме
Техника для исследования разделов липидного плота флуоресцентных белков в мембране живой клетки описывается. Он использует различия в диффузии время белки, расположенные внутри или за пределами липидного плоты. Приобретение может осуществляться динамически в контрольных условиях или после наркомании.
Аннотация
In the past fifteen years the notion that cell membranes are not homogenous and rely on microdomains to exert their functions has become widely accepted. Lipid rafts are membrane microdomains enriched in cholesterol and sphingolipids. They play a role in cellular physiological processes such as signalling, and trafficking1,2 but are also thought to be key players in several diseases including viral or bacterial infections and neurodegenerative diseases3.
Yet their existence is still a matter of controversy4,5. Indeed, lipid raft size has been estimated to be around 20 nm6, far under the resolution limit of conventional microscopy (around 200 nm), thus precluding their direct imaging. Up to now, the main techniques used to assess the partition of proteins of interest inside lipid rafts were Detergent Resistant Membranes (DRMs) isolation and co-patching with antibodies. Though widely used because of their rather easy implementation, these techniques were prone to artefacts and thus criticized7,8. Technical improvements were therefore necessary to overcome these artefacts and to be able to probe lipid rafts partition in living cells.
Here we present a method for the sensitive analysis of lipid rafts partition of fluorescently-tagged proteins or lipids in the plasma membrane of living cells. This method, termed Fluorescence Correlation Spectroscopy (FCS), relies on the disparity in diffusion times of fluorescent probes located inside or outside of lipid rafts. In fact, as evidenced in both artificial membranes and cell cultures, probes would diffuse much faster outside than inside dense lipid rafts9,10. To determine diffusion times, minute fluorescence fluctuations are measured as a function of time in a focal volume (approximately 1 femtoliter), located at the plasma membrane of cells with a confocal microscope (Fig. 1). The auto-correlation curves can then be drawn from these fluctuations and fitted with appropriate mathematical diffusion models11.
FCS can be used to determine the lipid raft partitioning of various probes, as long as they are fluorescently tagged. Fluorescent tagging can be achieved by expression of fluorescent fusion proteins or by binding of fluorescent ligands. Moreover, FCS can be used not only in artificial membranes and cell lines but also in primary cultures, as described recently12. It can also be used to follow the dynamics of lipid raft partitioning after drug addition or membrane lipid composition change12.
протокол
1. Калибровка установки FCS
- Начать конфокальной микроскопии, лазеры, компьютеры, инкубатор для температуры и CO 2 контроля.
- Убедитесь в том, SPAD (Single лавины фотонов Diode) на флуоресценцию и фильтр внутри SPAD хорошо подходит для вашего образца. Убедитесь, что SPAD синхронизированы во времени. Остерегайтесь только начать ФТС программное обеспечение только ваш SPAD настройки готовы к приобретению.
- Подготовить новое решение холерного токсина-Alexa488 разводят в PBS достичь концентрации 1 мкг / мл (17,5 нм).
- Оптимизация конфокальной микроскопии решения с использованием внутреннего обнаружения под микроскопом.
- Включите отметить режим сканирования и выбрать точку в решении образца. Убедитесь, что длительность лазерного освещения достаточно долго, чтобы выполнить свой ФТС приобретения (> 5 минут).
- Переключение в режим внешнего обнаружения SPAD и программное обеспечение ФТС. Следите за своим флуоресцентного сигнала и убедитесь, что он также специальнойТед SPAD (достаточно сигнала, но не насыщение, от 10 000 до 50 000 имп / с нормально). В случае необходимости, изменить положение г, усиление и / или мощности лазера для достижения правильного сигнала флуоресценции.
- Получите 10 комплектов 30 секунд измерений. Время сбора данных должны быть оптимизированы для вашего образца (компромисс между лучшим отбора проб и фотообесцвечивания проблем).
- Анализ данных (см. шаг 4), чтобы гарантировать, что у вас есть авто-корреляции кривой, соответствующей одному флуоресцентный вид диффузии в растворе (уравнение на рис. 2) и о том, что время диффузии, полученные после установки правильно (около 0,2 мс) (рис. . 3).
2. Окраска живых клеток с маркером липидов Плоты
- Пластина НЕК293 на 8-а Labteks покрытые поли-L-лизин (1mg/ml) за день до изображения, чтобы убедиться, что их адгезии является правильным. Используйте среде без фенола красного обеспечения нет возмущения сигнала флуоресценции.
- Промойте клетки дважды HBSS (буферизованный солевой раствор Хэнка).
- Добавить холерного токсина-Alexa488 (1 мкг / мл) / BSA (0,1%) в 500 мкл HBSS в клетки в течение 30 минут при температуре 37 ° C. Холерный токсин связывается с ганглиозида GM1, как известно, преимущественно разделы в липидных плотах.
- Промойте клетки дважды HBSS (буферизованный солевой раствор Хэнка).
3. ФТС сбора данных на живые клетки
- Поместите окрашенных клеток на предметном столике микроскопа. Убедитесь, что температура и CO2 условия являются оптимальными в противном случае это может привести к артефактов в диффузии раз.
- Оптимизация конфокальной микроскопии клетки интереса с использованием внутреннего обнаружения под микроскопом (рис. 4).
- Включите отметить режим сканирования и выбрать пункт в плазматической мембране клетки интерес. Выполните 1-2 изображения в реальном времени клетки, чтобы убедиться в клетке не двигается во время приобретения.
- Переключение в режим внешнего обнаружения SPAD и ФТС мягкийизделия. Следите за своим флуоресцентного сигнала и убедитесь, что он хорошо подходит для SPAD (достаточно сигнала, но не насыщение, от 10 000 до 50 000 имп / с это нормально). В случае необходимости, изменить положение г, усиление и / или мощности лазера для достижения правильного сигнала флуоресценции. Если этого не достаточно, вы можете рассмотреть вопрос об изменении условий окрашивания.
- Получите 10 образцов 30 секунд измерений. Как и большинство клеток самофлюоресцирующими, вы можете увидеть снижение флуоресценции в течение первых приобретений, в связи с авто-флуоресценция исчезает.
4. Анализ данных ФТС
- Установить интервал корреляции и создавать авто-корреляции кривых с помощью программного обеспечения ФТС. Интервал корреляции, как правило, варьируется от кратчайшие разрешимы задержкой до самого длинного сроки (в статистике измерений становится все более и более неадекватным, когда максимальное время корреляция приближается общее время приобретения, максимальное время задержки ограничено до 80% Приобретение время на PicoquaП программное обеспечение).
- Для каждого образца, экспорт файлов, соответствующих флуктуации флуоресценции и авто-корреляции в зависимости от времени.
- С помощью анализа данных и установки программ, таких как происхождение Pro импортировать файлы.
- Для каждого образца, убедитесь, что нет фотообесцвечивания во время приобретения, т.е. флуоресценции остается стабильной в течение 30 секунд. Отменить любые меры отображения фотообесцвечивания как это может привести к искусственной более длительное время диффузии.
- Убедитесь, что форма оставшихся ФТС кривые правильно (см. рис 5). Определение средней кривой FCS.
- Установите кривой с соответствующей математической модели (рис. 2). Это подходит даст вам время диффузии (ы), а доля молекул, диффундирующих с этим (ESE), диффузия раз (а).
5. Представитель Результаты
Пример калибровки FCS с холерного токсина-Alexa488 решение показано на рисунке 3 . Убедившись, что отдельные меры флуоресценции в зависимости от времени не показали фотообесцвечивания (рис. 3А), индивидуальные и средний ФТС кривые были рассчитаны. Средний ФТС кривые были оснащены уравнений, соответствующих различным моделям диффузии (пример на рисунке 2). Параметр классически считается определить качество подгонка коэффициент детерминации R 2. Чем ближе R 2 к 1, тем лучше подходит. В этом случае наиболее точную модель, чтобы соответствовать средней кривой FCS является одним описанием населения флуоресцентных молекул, диффундирующих свободно в трех измерениях (уравнения 1 на рисунке 2 и рис. 3б). Время диффузии происходит от нужным составляет 0,32 мс. Остатки от построения кривой (рис. 3) и R 2 фактора (0,99906) дают оценки качества подгонки.
Пример анализа ФТС для холерного токсина-Alexa488 окрашенных HEK293 клеток показано на рисунке 5. Многостадийного среднего ФТС форма кривой свидетельствует о существовании населения флуоресцентных молекул с различным временем диффузии. Наилучшим образом подходит для этой кривой соответствует модели с тремя популяциями флуоресцентных зондов: два с препятствуют диффузии (диффузия в двух измерениях, как в плоскости мембраны) и один свободно диффундирующих в трех измерениях (уравнения 2 на рисунке 2 и рис 5) . Последнее населения соответствует флуоресцентных молекул, движущихся вне плоскости мембраны, т. е. либо обязательными или отмены привязки к цели мембраны, достигая через мембраны путем секреции или утилизации, или выходе из мембраны путем эндоцитоза. Два раза в диффузионной мембраны, соответствующие холерного токсина связаны с GM1, были 2 мс (25% молекул), что соответствует диффузии вне липидного плоты, и 75 мс (50% молекул), что соответствует диффузии в липидных рафтах . Пожалуйста, обратите внимание, что любое photobleachING во время сбора приведет к искусственному увеличению времени диффузии таким образом, возможно создание уклон в сторону локализации GM1 в липидных области плот.

Рисунок 1. Схематическое изображение ФТС настройки (картинка изменилась с Marquer соавт. 12)

Рисунок 2. Пример диффузионной модели и соответствующие уравнения, используемые в соответствии автокорреляционной кривой. Структура параметра S можно записать в виде S = Z 0 / б 0, Z 0 эффективное фокусное радиус вдоль оптической оси на 1 / е 2 интенсивность и w0 эффективного лаteral координационного радиусом в 1 / е 2 интенсивности. Эти значения могут быть извлечены из классической точки распространения функции (НПФ) измерений.
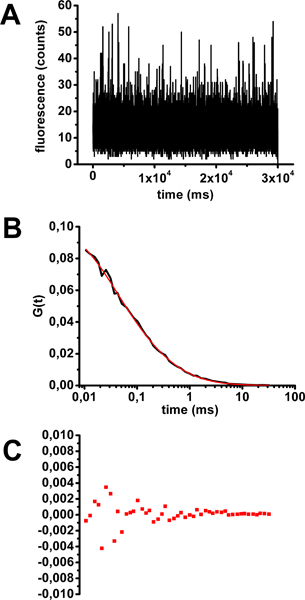
Рисунок 3. Оценка времени диффузии холерного токсина-Alexa488 в раствор для калибровки FCS. А) флуоресценции колебания в зависимости от времени типичный пример приобретения 30 секунд. Б) средняя автокорреляционной кривой, полученной из 10 образцов 30 секунд приобретение оснащены уравнение 1 (см. рисунок 2). C) Остатки от кривой.
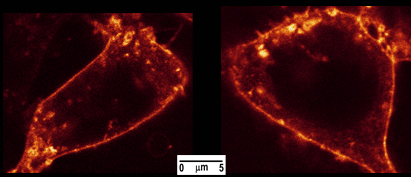
Рисунок 4. НЕК-293 клетки окрашиваются холерного токсина-Alexa488. Клетки были обследованы на микроскоп SP5 конфокальной (Leica Microsystems, Wetzlar, Германия) с внутренним 488nm лазерного луча. Флуоресценции были собраны с x60 план апохромат цель погружения нефти от 500 дои 650 нм.
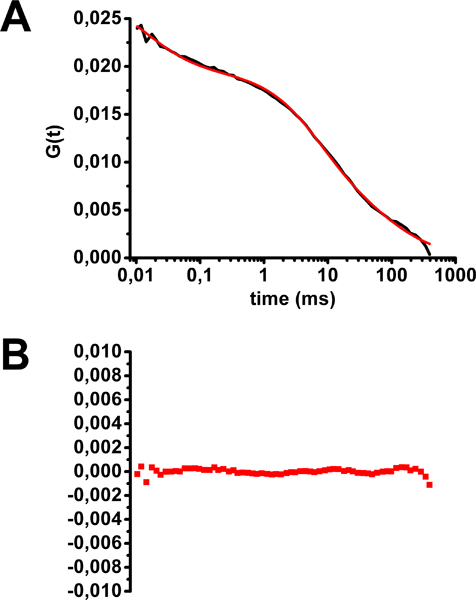
Рисунок 5. Оценка времени диффузии холерного токсина-Alexa488 в плазматической мембране клеток НЕК293. А) Средние автокорреляционной кривой оснащены уравнение 2 (см. рисунок 2). Б) Остатки от кривой. (С изменениями от Marquer соавт. 12)
Обсуждение
Метод ФТС представленные здесь позволяет чувствительный и быстрый анализ разделов липидного плота флуоресцентных зондов интерес в живых клетках. ФТС сочетает в себе точность локализации конфокальной микроскопии с чувствительностью одного счета фотонов. Основное различие между ФТС ...
Раскрытие информации
Нет конфликта интересов объявлены.
Благодарности
Эта работа была поддержана грантом Agence Nationale-де-ла Recherche (ChoAD). Мы также благодарны Фонду ICM (институт дю Cerveau и др. де-ла-Moelle) за их финансовую поддержку.
Материалы
| Name | Company | Catalog Number | Comments |
| Название реагента | Компания | Номер по каталогу | Комментарии |
| Холерный токсин субъединицы B-Alexa 488 | Invitrogen | C-34775 | МВт (пентамера) = 57 кг / моль |
| Конфокальной микроскопии | Leica | SP5 | |
| Инкубатор для температуры и СО2 контроль | Жизнь изображений услуги | Куба и коробки | |
| SPAD (Single лавины фотонов Diode) | MPD (Micro фотонных устройств) | PDM серии (100 мкм чувствительная область) | |
| Высокий перевал 488 нм фильтра | Semrock | 488 нм блокирование края BrightLine долго фильтр Part #ails.aspx? ID = FF01-488/LP-25 "целевых =" _blank "> FF01-488/LP-25 | |
| ФТС блок детектирования | Picoquant | Picoharp 300 модулей | |
| Приобретение и автокорреляции программного обеспечения | Picoquant | SymPhoTime | |
| Установка программного обеспечения | OriginLab | OriginPro8 |
Ссылки
- Brown, D. A., London, E. Functions of lipid rafts in biological membranes. Annu. Rev. Cell Dev. Biol. 14, 111-136 (1998).
- Simons, K., Gerl, M. J. Revitalizing membrane rafts: new tools and insights. Nat. Rev. Mol. Cell Biol. 11, 688-699 (2010).
- Simons, K., Ehehalt, R. Cholesterol, lipid rafts, and disease. J. Clin. Invest. 110, 597-603 (2002).
- Munro, S. Lipid rafts: elusive or illusive. Cell. , 115-377 (2003).
- Shaw, A. S. Lipid rafts: now you see them, now you don't. Nat. Immunol. 7, 1139-1142 (2006).
- Pralle, A., Keller, P., Florin, E. L., Simons, K., Horber, J. K. Sphingolipid-cholesterol rafts diffuse as small entities in the plasma membrane of mammalian cells. J. Cell Biol. 148, 997-1008 (2000).
- Brown, D. A., London, E. Structure and function of sphingolipid- and cholesterol-rich membrane rafts. J. Biol Chem. 275, 17221-17224 (2000).
- Sharma, P., Sabharanjak, S., Mayor, S. Endocytosis of lipid rafts: an identity crisis. Semin. Cell Dev. Biol. 13, 205-214 (2002).
- Kahya, N., Scherfeld, D., Bacia, K., Poolman, B., Schwille, P. Probing lipid mobility of raft-exhibiting model membranes by fluorescence correlation spectroscopy. J. Biol. Chem. 278, 28109-28115 (2003).
- Bacia, K., Scherfeld, D., Kahya, N., Schwille, P. Fluorescence correlation spectroscopy relates rafts in model and native membranes. Biophys J. 87, 1034-1043 (2004).
- Kim, S. A., Heinze, K. G., Schwille, P. Fluorescence correlation spectroscopy in living cells. Nat. Methods. 4, 963-973 (2007).
- Marquer, C. Local cholesterol increase triggers amyloid precursor protein-Bace1 clustering in lipid rafts and rapid endocytosis. FASEB J. 25, 1295-1305 (2011).
- Tian, Y., Martinez, M. M., Pappas, D. Fluorescence correlation spectroscopy: a review of biochemical and microfluidic applications. Appl. Spectrosc. 65, 115A-124A (2011).
- Haustein, E., Schwille, P. Fluorescence correlation spectroscopy: novel variations of an established technique. Annu. Rev. Biophys. Biomol. Struct. 36, 151-169 (2007).
- Ilien, B. Pirenzepine promotes the dimerization of muscarinic M1 receptors through a three-step binding process. J. Biol. Chem. 284, 19533-19543 (2009).
- Lieto, A. M., Cush, R. C., Thompson, N. L. Ligand-receptor kinetics measured by total internal reflection with fluorescence correlation spectroscopy. Biophys. J. 85, 3294-3302 (2003).
- Thompson, N. L., Burghardt, T. P., Axelrod, D. Measuring surface dynamics of biomolecules by total internal reflection fluorescence with photobleaching recovery or correlation spectroscopy. Biophys. J. 33, 435-454 (1981).
- Thompson, N. L., Steele, B. L. Total internal reflection with fluorescence correlation spectroscopy. Nat. Protoc. 2, 878-890 (2007).
- Eggeling, C. Direct observation of the nanoscale dynamics of membrane lipids in a living cell. Nature. 457, 1159-1162 (2009).
- Kolin, D. L., Wiseman, P. W. Advances in image correlation spectroscopy: measuring number densities, aggregation states, and dynamics of fluorescently labeled macromolecules in cells. Cell Biochem. Biophys. 49, 141-164 (2007).
- Shvartsman, D. E., Kotler, M., Tall, R. D., Roth, M. G., Henis, Y. I. Differently anchored influenza hemagglutinin mutants display distinct interaction dynamics with mutual rafts. J. Cell Biol. 163, 879-888 (2003).
- White, R. Holin triggering in real time. Proc. Natl. Acad. Sci. U.S.A. 108, 798-803 (2011).
- Petersen, N. O., Hoddelius, P. L., Wiseman, P. W., Seger, O., Magnusson, K. E. Quantitation of membrane receptor distributions by image correlation spectroscopy: concept and application. Biophys. J. 65, 1135-1146 (1993).
- Hebert, B., Costantino, S., Wiseman, P. W. Spatiotemporal image correlation spectroscopy (STICS) theory, verification, and application to protein velocity mapping in living CHO cells. Biophys. J. 88, 3601-3614 (2005).
- Digman, M. A. Measuring fast dynamics in solutions and cells with a laser scanning microscope. Biophys. J. 89, 1317-1327 (2005).
- Digman, M. A. Fluctuation correlation spectroscopy with a laser-scanning microscope: exploiting the hidden time structure. Biophys. J. 88, L33-L36 (2005).
- Nohe, A., Keating, E., Fivaz, M., van der Goot, F. G., Petersen, N. O. Dynamics of GPI-anchored proteins on the surface of living cells. Nanomedicine. 2, 1-7 (2006).
- Semrau, S., Schmidt, T. Particle image correlation spectroscopy (PICS): retrieving nanometer-scale correlations from high-density single-molecule position data. Biophys. J. 92, 613-621 (2007).
- Bates, I. R. Membrane lateral diffusion and capture of CFTR within transient confinement zones. Biophys. J. 91, 1046-1058 (2006).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены