Bu içeriği görüntülemek için JoVE aboneliği gereklidir. Oturum açın veya ücretsiz deneme sürümünü başlatın.
Method Article
Bakteriyel için iki bileşenli Düzenleme Sistemleri Gen Hedefler belirlemek için DNA afinite-saflaştırılmış Chip (DAP-chip) Yöntem
Bu Makalede
Özet
Bu video makalede, iki bileşenli bir sistem yanıt düzenleyici gen hedef ve birleştirme bölgelerini belirlemek için bir in vitro mikro-dizi göre bir yöntem açıklanır.
Özet
Böyle chip çip gibi in vivo yöntemlerde transkripsiyon faktörleri için küresel gen hedefleri tespit etmek için kullanılan iyi bilinen tekniklerdir. Bununla birlikte, aktivasyon koşulları karakterize edilmemiş bakteriyel, iki bileşenli düzenleyici bir sistem keşfetmek kısıtlı kullanımı vardır. Benzersiz sinyallerin varlığında kullanıldığı zaman bu tür sistemler sadece transkripsiyonunu düzenler. Bu sinyaller genellikle bilinmediği için, bu video makalede tarif edilen in vitro mikro-dizi göre yöntem gen hedefleri ve tepki düzenleyicileri için birleştirme bölgelerini belirlemek için kullanılabilir. Bu DNA-afiniteyle saflaştırılmış yongalı yöntem Sıralı bir genomu olan, herhangi bir organizmanın herhangi bir saflaştırılmış kontrolü için kullanılabilmektedir. Protokol arıtıldı etiketli protein özel bir fayans dizisine DNA'nın melezleşme ve floresan etiketleme ve ardından protein-bağlı DNA, kesilmiş genomik DNA'ya bağlanan ve daha sonra afinite saflaştırılması için izin içerir. Öz dirençli için tahlil optimize etmek için kullanılabilir olan adımlarıc düzenleyiciler de tarif edilmektedir. Dizi veri analizi ile üretilmiştir Tepeler daha sonra, deneysel olarak doğrulanmış bağlanma yeri motifleri, tahmin etmek için kullanılır. Motif tahminler daha yakından ilgili türlerinde ortolog yanıt düzenleyici gen hedeflerini belirlemek için kullanılabilir. Böylece, bu genin tespiti ve hedef sitesi motifleri bağlanması ve bu nedenle, çevresel bir bakteri Desulfovibrio vulgaris Hildenborough bir sigma54 bağımlı tepki regülatör DVU3023 fonksiyonunu tahmin bu yöntemin uygulanabilirliğini göstermektedir.
Giriş
Hayatta kalmak ve gelişmek için bakterilerin yetenek ki algılarlar ve kendi ortamlarında tedirginlikler cevap verebilecek kadar iyi kritik bir şekilde bağlıdır, ve bu da onların sinyal iletimi sistemlerine bağlıdır. Sinyalizasyon sistemleri bir bakteri kodlar sayısı onun "mikrobiyal IQ" adı olmuştur ve çevresinin değişkenliği ve çoklu sinyallerini algılayan kabiliyeti ve ince ayar onun tepki 1 hem de bir göstergesi olabilir. İki bileşenli sinyal iletim sistemleri (ASR) bakteriler tarafından kullanılan en yaygın sinyal sistemleri de vardır ve bunlar, harici sinyali algılar ve bir efektör yanıt düzenleyici (RR) 2 fosforilasyon yoluyla ileten bir histidin kinaz (HK) oluşur. RR bir çıkış alanlarının çeşitliliği ve böylece farklı efektör modları olabilir, ancak en yaygın tepki alanı 1 bağlayıcı bir DNA aracılığıyla transkripsiyon düzenlemedir. Algılanan sinyaller ve vaz ilgili fonksiyonlarıntestis kanseri yaşayanlarının t çoğunluğu hala bilinmiyor.
Böyle chip yonga gibi in vivo yöntemler rutin olarak transkripsiyon faktörleri 3 genomik bağlanma sitelerinin belirlenmesi için kullanılır, ancak aktive etme koşulları veya sinyaller bilinmektedir, bunlar sadece bakteriyel iki bileşenli sistem RR için kullanılabilir. Genellikle bir TCS etkinleştirmek çevre ipuçları kendi gen hedefleri belirlemek daha zordur. In vitro mikro-dayalı tahlil, burada açıklanan etkili ve hızlı bir şekilde gen hedefleri tespit etmek ve testis kanseri yaşayanlarının fonksiyonları tahmin etmek için de kullanılabilir. Bu deney, RR fosforile ve bu nedenle asetil fosfat gibi 4 küçük molekül vericiler kullanılarak in vitro aktive edilebilir gerçeğinden yararlanır.
Bu yöntemde, DNA-afiniteyle saflaştırılmış yonga (Şekil 1) için DAP-chip adlı, ilgi konusu gen RR E'de bir His-tag ile klonlanır coli ve daha sonra saf hale etiketli protein bi bırakılırnd kesilmiş genomik DNA için. Protein-bağlı DNA, daha sonra afinite saflaştırma ile zenginleştirilmiştir, zenginleştirilmiş ve giriş DNA çoğaltılır, floresan bir araya toplanmış ve özel ilgilenilen organizmadan (Şekil 1) için yapılan bir fayans dizisine hibridize etiketli. Mikrodizi deneyler eserler tabidir ve bu nedenle ek adımlar tahlili optimize etmek için kullanılır. Böyle bir adım (Şekil 2 iş akışını bakınız) elektroforetik mobilite kayma analizleri (EMSA) kullanarak çalışma kapsamında RR için bir hedef belirlemek için teşebbüs etmektir. Sonra, genomik DNA ve DAP adımları bağlanma ardından, protein-bağlı olduğu ve bu nedenle giriş DNA için uygun bağlama koşulları teyit pozitif hedef giriş fraksiyonuna göre protein-bağlı fraksiyon içinde zenginleştirilmiş olup olmadığını görmek için qPCR incelenir RR (Şekil 2). Dizi Hibritlemeden sonra, veri genomik lokus gösteren yüksek yoğunluğu sinyalinin tepe noktaları bulmak için analiz edilmektedir burada protein hreklam bağlı. Fonksiyonlar elde gen hedeflere göre RR için tahmin edilebilir. Hedef genomik loci sonra deneysel EMSA (Şekil 2) kullanılarak doğrulanır bağlanma sitesi motifleri, tahmin etmek için kullanılır. RR için fonksiyonel tahminler ve gen hedefleri sonra yakından benzer bağlama motifleri için olanlar genomları (Şekil 2) tarayarak orthologous RR'lerle kodlamak ilgili türlerinde uzatılabilir. DAP-çip yöntemi daha önce yok oldu, bir TCS için bilgi hazinesi sağlayabilir. Yöntem, aynı zamanda, protein saflaştırılabilir ve DNA bağlanma şartları tespit edilebilir, herhangi bir kopyalama düzenleyicisi için kullanılır ve bir genom sekansı ile çıkar organizma için uygun olabilir.
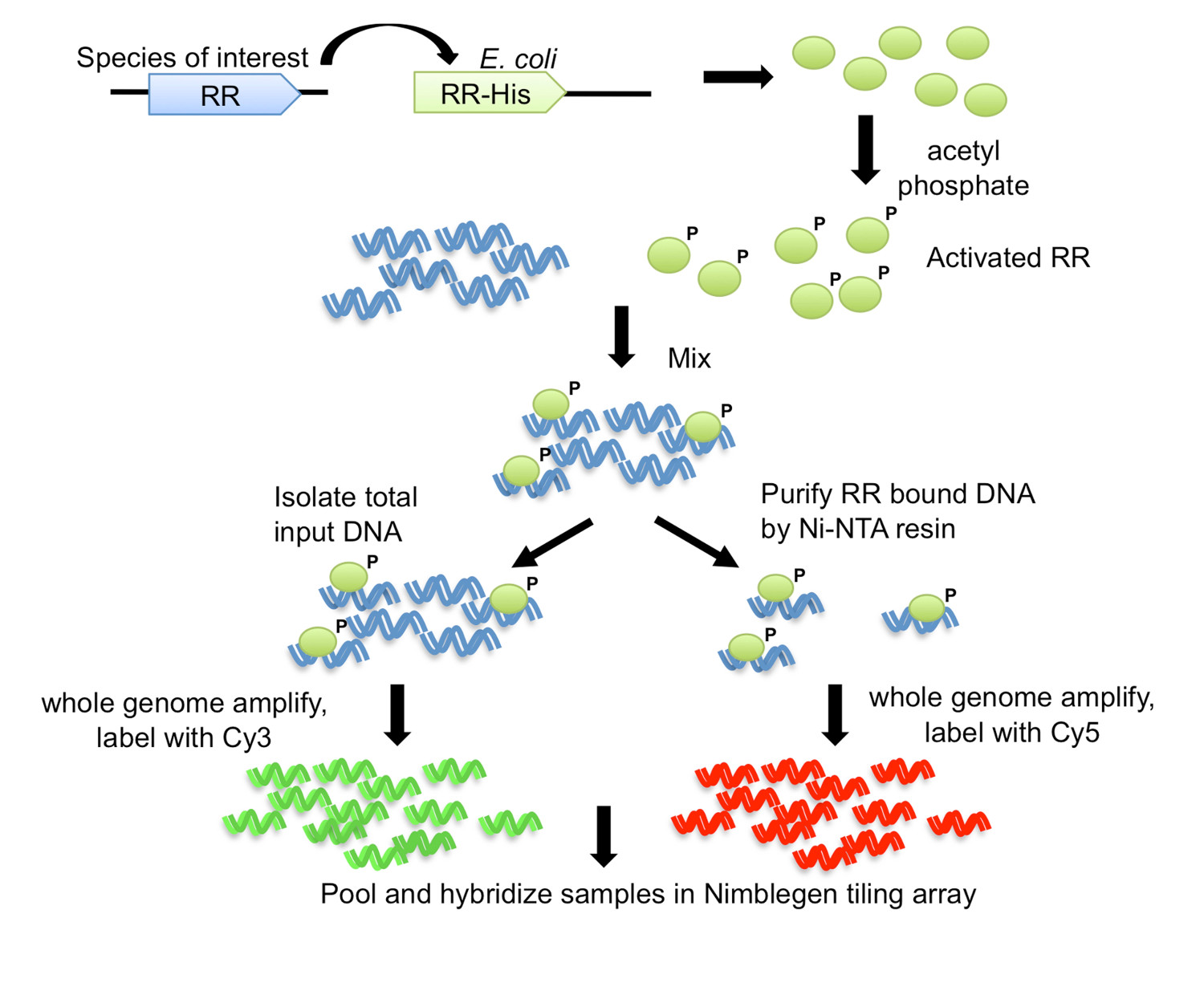
Şekil 1. DNA-afiniteyle saflaştırılmış yonga (DAP-chip) stratejisi 7. Ilgilenilen organizmadan RR geni, bir E bir karboksi-terminal His-tag ile klonlanır Coli suşu. Saflaştırılmış His-etiketli protein asetil fosfat ile birlikte fosforilasyon ile aktive edilir ve kesilmiş genomik DNA ile karıştırılır. Geri kalanı Ni-NTA reçinesi kullanılarak afinite saflaştırma işlemine tabi tutulur ise, bağlama reaksiyonunun bir alikosu, giriş DNA olarak kaydedilir. Giriş ve RR-bağlı DNA büyütülmüş bütün genom, ve sırasıyla Cy3 ve Cy5 etiketli. Etiketlenmiş DNA bir araya toplanmış ve daha sonra gen hedeflerini belirlemek için analiz edilir bir döşeme tadını hibridize edilir. Şekil değiştirilmiş ve Creative Commons License 7'den kullanılarak yeniden basıldı.
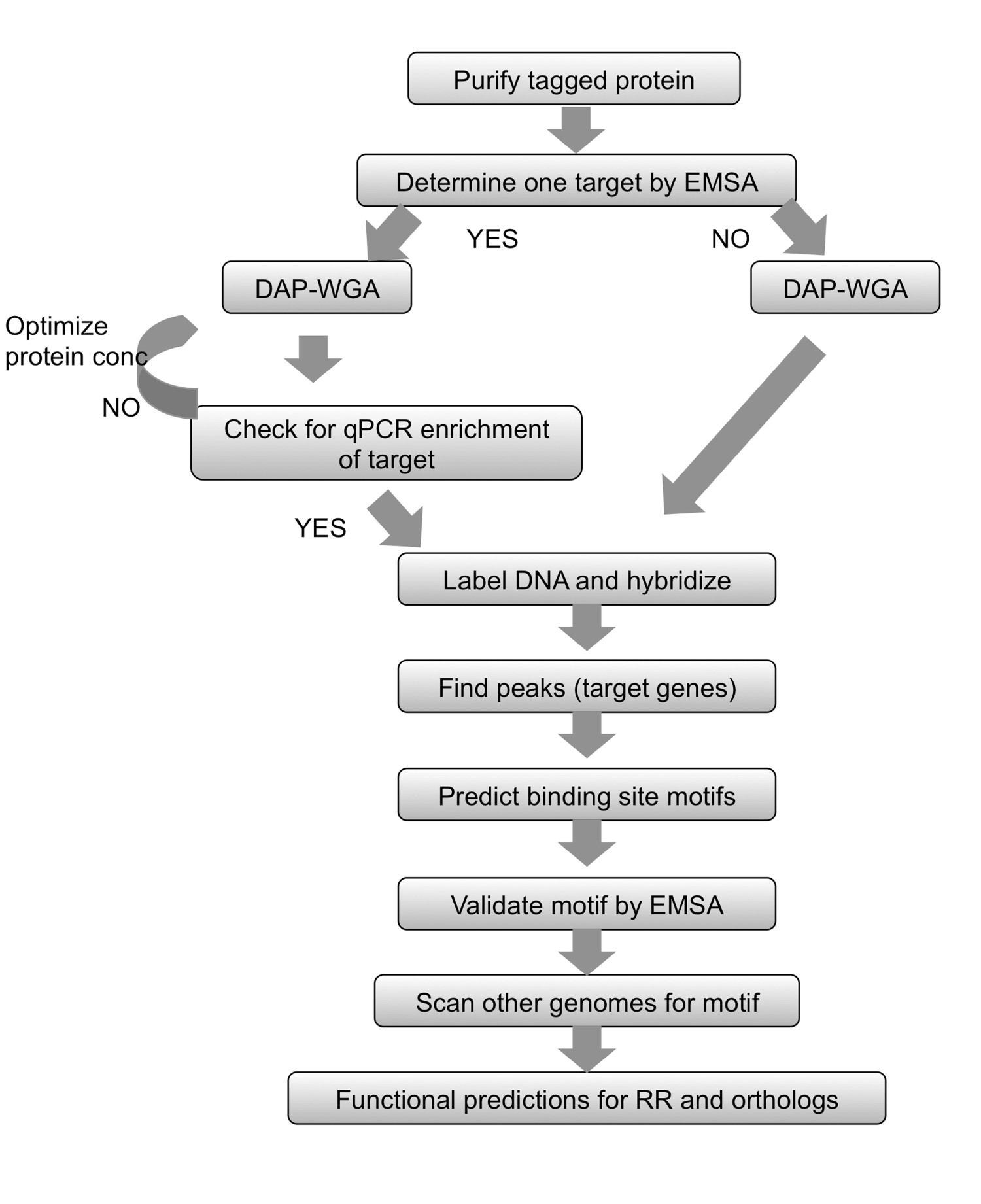
Iş akışı Şekil 2.. Özeti. Herhangi arıtılmış etiketlendi Protei içinn Emsa kullanarak bir hedef belirleyerek başlar. (WGA) ile zenginleştirilmiş ve giriş amplifiye DNA, genomik DNA ve DNA afiniteli saflaşır (DAP) ve tam genom bağlamak için protein izin verin. Bir gen hedef biliniyorsa, bilinen bir hedef proteine bağlı fraksiyonunda zenginleştirilmiş olmasını sağlamak için qPCR kullanın. Hiçbir hedef belirlenebilir olsaydı, DNA etiketleme ve dizi melezleme doğrudan geçin. QPCR zenginleştirme gözlenen olamazdı, o bağlayıcı protein-gDNA ve farklı protein miktarları kullanılarak DAP-WGA adımları tekrarlayın. Zirveleri bulmak ve genlerin hedef bunları eşleştirmek için dizi analizi kullanın. Bağlanma yeri motifleri tahmin etmek için, hedef genlerin yukarı bölgelerini kullanarak. Deneysel EMSA kullanarak motifleri doğrulayın. Çalışma altında RR ortologları kodlayan, ilgili türlerin genom taraması için motifi kullanarak ve aynı zamanda bu türlerin hedef genleri tahmin. Elde edilen gen hedeflere bağlı olarak, RR ve ortologlar fizyolojik işlevi tahmin edilebilir. Şekil değiştirilmiş ve yaratıcı c kullanarak yeniden basıldıommons 7'den lisans.
Protokol
Not: Aşağıdaki protokol bakterinin Desulfovibrio vulgaris Hildenborough gelen RR DVU3023 gen hedefleri belirlenmesi için hazırlanmıştır. Bu ilgi çekici başka bir kopyalama düzenleyicisi adapte edilebilir.
1.. Klon ve Purify RR
- RR geni, D., bilhassa da DVU3023, Clone vulgaris Hildenborough bir Escherichia coli sentezleme vektörü içine gen C-terminal His-etiketli ve ifade bir T7 promoterinin kontrolü altında olacak şekilde seçilir.
Not: Birkaç klonlama yöntemleri kullanılabilir ve araştırmacı tarafından belirlenir. Alternatif afinite etiketleri de kullanılabilmektedir. - Sentezleme E içine inşa Transform E. coli BL21 (DE3) ekspresyon suşu.
- 37 ° C 'de ekspresyon suşu BL21 1 L büyümek Mid-log fazında, protein ekspresyonunu başlatmak için 0.5 mM IPTG ekleyin. 24 saat boyunca, oda sıcaklığında büyümesi devam edin.
- 10 mil boyunca 5.000 xg'de Santrifüj hücreleri4 ° C de, n Liziz tamponu içerisinde yeniden süspanse hücreler (20 mM sodyum fosfat, pH 7.4, 500 mM NaCl, 40 mM imidazol, 1 mg / ml lizozim, 1 x benzonaz nükleaz). 4 ° C'de bir Fransız presi kullanılarak Hücreleri,
- 4 ° C'de 30 dakika boyunca 15,000 x g'de santrifüjleyin lisatı 0.45 um'lik bir şırınga filtresi kullanılarak filtre.
- Yıkama tamponu, 10 ml (20 mM sodyum fosfat, pH 7.4, 500 mM NaCl, 40 mM imidazol) ile bir FPLC alet üzerinde bir 1 ml Ni Sepharose sütun yıkayın.
- Kolon üzerinde lizat yerleştirin. Yıkama tamponu, 20 ml ile kolondan yıkanır.
- % 0-100 elüsyon tamponu gradyanı (20 mM sodyum fosfat, pH 7.4, 500 mM NaCl, 500 mM imidazol) ile Elute DVU3023.
- Bir tuz giderme kolonu üzerinde taşınan fraksiyonların yük ve tuz giderici tampon (20 mM sodyum fosfat pH 7.4, 100 mM NaCl) ile yıkayın.
- Protein konsantre yüksek molekül ağırlıklı bir kesim santrifüj filtre Santrifüj protein örneği. -20 ° C 'de% 50 ve saklamak proteine 0.1 mM DTT ve gliserol ekleyin
Not: Saflaştırma yöntemleri üzerinde çalışma yapılan her protein için ayrı ayrı optimize edilmesi gerekir.
2.. Elektroforetik mobilite kayma deneyiyle (EMSA) kullanarak RR için Gen Hedef belirleme
- PCR D kullanılarak, aday hedef gen DVU3025 400 bp bölgesi üst akışında yükseltmek vulgaris Hildenborough şablon olarak genomik DNA, ve bir ileri primer ve etiketlenmemiş bir ters 5'-biotin-etiketli primer.
Not: Genellikle RR kendi gen / operonunun yukarı bölgeleri bağlamak, ya da proksimale kodlanan genleri düzenleyen olabilir: Aday hedef geni seçmek için ipuçları. RR diğer türlerde ortologlarını varsa, mahallede korunmuş genlerin arayın. Alternatif yöntemler, kendileri sigma54 bağımlıdır RR için regulon tahminler (örn. RegPrecise 5) veya tahmin sigma54 bağımlı promotörler 6 göre tercih aday genleri içerir. - 400 b kesilmiş, bir% 1 agaroz jeli üzerinde PCR ürünü çalıştırınp boyutlu ürün, ve bir jel ekstraksiyon kiti temizlemek kullanarak DNA arındırmak.
- 10 mM Tris HCI, pH 7.5, 50 mM KCI, 5 mM MgCI2, 1 mM DTT,% 25 gliserol ve 1 ug / ml poli dI.dC (non içinde biotinilat edilmiş DNA alt tabakası 100 fmol ile DVU3023 protein (0.5 pmol) karıştırın 20 ul bir toplam hacimde spesifik rakip DNA). Ayrıca, bir kontrol olarak herhangi bir proteini olmayan bir reaksiyon kurmak. 20 dakika için tezgah üzerinde oda sıcaklığında reaksiyonları inkübe edin.
- Not: Bu listede ve diğer reaksiyon bileşenleri, ilgi konusu RR bağlı olarak ilave edilebilir standart koşullardır. Aktivasyon isteniyorsa, reaksiyonun (genellikle RR aktivasyon olmadan in vitro olarak DNA bağlama doyurmaya) 50 mM asetil fosfat ekleyin.
- 30 dakika boyunca 100 V'de 0.5x TBE tampon maddesi içinde bir prekast% poliakrilamid mini 6-0.5x TBE jel ön çalıştırın. G üzerine bağlanma reaksiyonları ve reaksiyon yükü 18 ul 5x yükleme tamponu içinde 5 ul (% 0.1 bromofenol mavisi,% 0.1 iksilen siyanol, 1 x TBE içinde% 30 gliserol) eklemeEl. 2 saat için 100 V çalıştırın.
Not: jel çoğunluğu tamponu ile izole edilecek şekilde çalışan tampon ile elektroforez sistemi, dış tampon bölmeyi doldurmak için, protein-DNA kompleksleri ayrılmasına yol açabilir aşırı ısınmasını önlemek için. Alternatif olarak, jel, 4 ° C 'de çalıştırılabilir - Jelin boyutu yüklü bir naylon zar kesim ve en az on dakika süre ile 0.5x TBE içinde ıslatın. Kaset jel çıkarın. Jelin kapalı bir sırtlar kesme ve 0.5x TBE içinde ıslatılmış iki kalın filtre kağıtları arasında jel ve membran sandviç ve yarı-kuru bir lekeleme aparatı içine yerleştirin ve 30 dakika için 20 V çalıştırın.
- Ticari bir UV ışık çapraz bağlayıcı enstrümanın içindeki zarı yerleştirin ve 3 dakika için zaman ayarlayın.
Not: Zar, şimdi bir sonraki aşamaya geçmeden önce birkaç gün boyunca, oda sıcaklığında, kuru saklanabilir. - Bir streptavidin-yaban turpu peroxida kullanan bir ticari olarak temin edilebilir kimyasal parlak saptama kiti kullanınüreticinin talimatlarına uygun olarak leke geliştirmek se eşlenik.
- Görüntü bir bilgisayar kullanarak leke bir CCD donanımlı kamera bağladım ve RR test edilen DNA bağlar olduğunu gösterir RR, varlığında DNA substrat hareketlilik bir değişim arayın.
Not: protein-DNA kaymasının spesifikliği, reaksiyonda ortadan kaldırmak ya da görülen değişim azaltmalıdır etiketsiz rakip DNA, bir fazlalığı içerecek şekilde test edilebilir.
3.. Genomik DNA-protein bağlama sonra Hedef Zenginleştirme doğrulayın
- Genomik DNA-protein bağlanma reaksiyonu
- Arasında 2 sn boşluk, 1 saniye 9 düşük genlik darbelerle bir mikrotip kullanarak bir 1.5 ml mikrofüj tüpüne (konsantrasyonları 100-200 ng / ml 'da) 100 ul genomik DNA sonikasyonu ile 500 bp bir ortalama boyuta kesme genomik DNA Her.
Not: borunun kenarlarına DNA splatters, her 3 darbe sonra içerik aşağı spin edin. Kullanılan tam koşullarKullanılan alet sonikatör ile değişecektir. Kesilmiş DNA fragmanları, 100-1000 bp arasında değişebilir, ancak ortalama boyutu 400-600 bp içinde olmalıdır. Çok fazla kesme daha az sağlam bağlanma sitelerinin neden olabilir, ve çok fazla veya çok az kesme ya da alt baş tüm genom amplifikasyonu adımları sırasında kütüphane hazırlanmasını etkileyecektir. - 10 mM Tris-HCl, pH 7.5, 1 mM DTT, 50 mM KCI, 5 mM MgCl2,% 25 gliserol, ve 50 mM fosfat içinde asetil RR proteinin (DVU3023 0.5 pmol) ile kesilmiş genomik DNA 2-3 ug karıştırın. 30 dakika boyunca 25 ° C 'de reaksiyonlar inkübe edin. Giriş DNA olarak 1.5 ml tüp ve etiket oluşturmak için bu tepkimeye transferi 10 ul.
Not: Asetil fosfat in vitro protein fosforilasyonu ile aktif hale getirmek için ilave edilir. Fosforilasyon bağlayıcı DNA uyarır, ancak birçok RR, aynı zamanda aktivasyon 7 olmadan in vitro olarak DNA bağlama. Reaksiyona ilave protein miktarı, protein prep aktivitesine bağlıdır. EMSA tercih için kullanılabilecektirBu miktar imize.
- Arasında 2 sn boşluk, 1 saniye 9 düşük genlik darbelerle bir mikrotip kullanarak bir 1.5 ml mikrofüj tüpüne (konsantrasyonları 100-200 ng / ml 'da) 100 ul genomik DNA sonikasyonu ile 500 bp bir ortalama boyuta kesme genomik DNA Her.
- Affinity proteine bağlı DNA saflaştırılması
- Bir 0.6 ml mikrofüj tüpe Ni-NTA agaroz reçinesine 30 ul ekle. Altındaki reçineyi toplamak için, 1 dakika boyunca 100 x g'de santrifüj ve supernatant çıkarın. 100, yıkama tamponu (10 mM Tris-HCI, pH 7.5, 5 mM MgCI2, 50 mM KCI,% 25 gliserol) içinde ul, fiske tüp karıştırmak ve 2 dakika boyunca 100 x g'de santrifüj ekleyin. Süpernatantı.
- Yıkanan Ni-NTA reçinesine bağlanma reaksiyonunun kalan 90 ul ekleyin ve 30 dakika için bir döner sallayıcı içinde inkübe edilir.
- 2 dakika boyunca 100 x g'de santrifüj ve süpernatant (bağlanmamış DNA) çıkarın. , Yıkama tamponu içinde 100 ul içerikleri karıştırmak için tüp fiske ve 2 dakika boyunca 100 x g 'de santrifüj. Süpernatantı. Iki kez daha yıkama işlemi tekrarlayın.
- Reçineye elüsyon tampon maddesi 35 ul (20 mM sodyum fosfat tamponu, pH 8, 500 mM NaCl, 500 mM imidazol) ilave edilir ve vorteks ile karıştırın. 5 dakika boyunca oda sıcaklığında tezgah üzerinde inkübe. 2 dakika boyunca 100 x g'de santrifüj. Proteine bağlı DNA bölümü olarak, yeni bir 1.5 ml tüp ve etikete süpernatantı aktarın.
- Ayrıca giriş DNA'ya elüsyon tamponu 35 ul ekle.
- Giriş ve bir PCR saflaştırma kiti kullanılarak protein-bağlı DNA fraksiyonları arındırın.
- Tüm genom giriş ve protein-bağlı DNA örnekleri yükseltmek.
- PCR tüpleri giriş ve ayrılması için protein-bağlı DNA 10 ul ekle. Parçalanma 10x tampon 1 ul, Kütüphane Preparasyon 2 ul tampon maddesi ve her bir örnek için Kütüphane Stabilizasyon çözeltinin 1 ul ekleyin. Vorteks ile iyice karıştırın. 2 dakika, ve buz üzerinde soğuk boyunca 95 ° C 'de bir PCR ısı.
Not: DNA başlangıç miktarı amplifikasyon önyargı tanıtan önlemek amacıyla, en az 10 ng olmalıdır. - Kütüphane Preparasyon enzim 1 ul ekle pipetleme ile karıştırın ve 16 ° C/20 dk 'da termal döngüleyici içinde 24 ° C/20 dk, 20 dk, 75 ° C / 5 dk için 37 ° C de inkübe4 ° C de, uzun süreli
- Her bir tüpe, 47.5 ul su, 10x büyütme ana karışımı 7.5 ul ve polimeraz 5 ul ekle. 94 ° C/15 saniye 20 döngü, 65 ° C / 5 dk, ardından 95 ° C / 3 dakika, ve de iyi bir ısı karıştırın. 4 ° C'de tutun reaksiyonlar
- Bir PCR saflaştırma kiti kullanılarak büyütülmüş DNA numuneleri arındırmak ve DNA konsantrasyonu spektrofotometrik olarak ölçülür.
- PCR tüpleri giriş ve ayrılması için protein-bağlı DNA 10 ul ekle. Parçalanma 10x tampon 1 ul, Kütüphane Preparasyon 2 ul tampon maddesi ve her bir örnek için Kütüphane Stabilizasyon çözeltinin 1 ul ekleyin. Vorteks ile iyice karıştırın. 2 dakika, ve buz üzerinde soğuk boyunca 95 ° C 'de bir PCR ısı.
- QPCR kullanılarak protein-bağlı DNA hedef zenginleştirme doğrulama
- Design QPCR primerler, her serbestçe primer dizayn yazılımı kullanılarak EMSA tarafından doğrulanmış bir hedef genin (DVU3025) akış yukarı bölgesi 200 bp amplifiye etmek.
- Her bir primer seti ile her bir DNA şablon için üçlü QPCR tepkiler kurmak. Her bir primer seti için bir master karışımı hazırlayın. 1x ana karışım 2 x SYBR Green QPCR karışımı 10 ul, 18 ul bir toplam için her bir primerin su ve 0.5 uM içerir. 96 çukurlu bir PCR levha başına ana karışımı kısım 18 ul.
- Zaman dilüe olabilmee yükseltilir ve 5 ng saflaştırılmış giriş ve protein-bağlı DNA numuneleri / su ile ul ve DNA şablon olarak kullanmak. Oyuklara DNA şablonu 2 ul ekle.
- , Ultra net QPCR sızdırmazlık film ile plaka Seal 200 xg / 1 dak bir santrifüj plaka aşağı spin. Bir gerçek zamanlı QPCR makinesine tabak koyun. Döngü ilgili QPCR yazılımı kullanılarak, aşağıdaki gibi: 95 ° C / 1 dakika, ve 95 ° C/10 saniye 40 döngü, 59 ° C/15 saniye, 70 ° C/35 saniye.
- Ayrıca, ilgisiz bir genle (negatif kontrol) yukarı bölgelerini çoğaltmak için primerler ile üç nüsha QPCR tepkileri ayarlamak.
- Giriş DNA bu protein-bağlı DNA'nın C T değeri çıkarılarak ΔC T hesaplayın. 2 ΔC T gibi protein-bağlı DNA, hedef genin kat zenginleştirme hesaplayın.
Not: Hedef yukarı bölgesi, giriş DNA vs protein-bağlı DNA'nın in zenginleştirilmiştir, bu bağlanma reaksiyonları ve afinite saflaştırma succ olduğunu göstermektediressful. 4. adıma devam edin. Hedef yukarı akış bölgesinin zenginleştirme gözlenmemiştir ise, proteinin farklı bir miktarı ile bağlanma reaksiyonları (adım 3.1) tekrarlayın.
4. DNA Etiketleme ve Dizi Hibridizasyon
- Cy5 ile Cy3 ve Zenginleştirilmiş DNA ile Label Input DNA
OT: Cy3 ve Cy5 boyalar ışığa duyarlıdır ve bakım minimumda ışık maruz kalmasını sağlamak için alınmalıdır.- 40 ul ile karıştırın 1 mg DNA 9-mers Cy3/Cy5-labeled ve su ile 80 ul ses seviyesini ayarlamak.
- Isı (bir PCR), karanlıkta, 10 dakika boyunca 98 ° C'de denatüre. 2 dakika boyunca buz üzerinde hızlı soğuk.
- Iyice karıştırın, her bir reaksiyon için, 5 mM dNTPs ve 8 ul su, ve (karanlıkta, 2 saat boyunca 37 ° C'de inkübe - 2 ul Klenow polimeraz (50.000 U / ml 3'-5'-ekzo) ekleme a PCR).
- 0.5 M. reaksiyonu ve NaCl çözeltisi durdurmak için 50 mM EDTA ekleyin
- 1.5 ml tüpler devam transfer örnekleri10 dakika için 12,000 xg'de 0.9 izopropanol hacmi, 10 dakika boyunca karanlıkta inkübe edilir ve santrifüj Aining. Topak Cy5-etiketli DNA için Cy3-etiketli DNA ve mavi için pembe olmalıdır.
- 2 dakika için 12,000 xg'de% 80 etanol (500 ul) ve santrifüj ile pelet yıkayın. Karanlıkta 5-10 dakika boyunca hava kuru peletler.
Not: granüller, -20 ° C'de saklanabilir - 25 ul su içinde süspanse edin pelet. Spektrofotometrik DNA konsantrasyonu ölçün.
- Havuz birlikte 6 ug karanlıkta düşük ateşte bir santrifüj içinde bir 1.5 ml tüp ve vakum kuru olarak Cy3 ve Cy5-etiketli DNA (bu saydam ise, santrifüj kapağını kapak) her biri.
Not: Topaklar hibridizasyon için hazır olana kadar -20 ° C'de muhafaza edilebilir.
- Mikrodizi hibridizasyon
- C kullanmak ve 42 ° sıcaklığını ayarlamak için önce 3-4 saat üzerinde melezleme Sistemi açın
- 1x çözelti, 11.8 ul 2x Hybridi içeren bir hibridizasyon solüsyonu ana karışımı hazırlayınyon tamponu, 4.7 ul hibridizasyon Bileşen A ve 0.5 ul hizalama oligo.
- 5 ul su içinde yeniden süspanse pelet. Örnek bu karışımı 13 ul ekle. 15 saniye vorteksleyin, 5 dakika boyunca, kuru banyosu içinde 95 ° C de inkübe edilir. Yükleme için hazır olana kadar, hibridizasyon sisteminde 42 ° C 'de örnekleri tutun.
- Üreticinin protokolüne uygun olarak, mikrodizi kızaklı karıştırıcı düzeneği hazırlayın.
- Hibridizasyon sistemi içinde karıştırıcı kaymalı düzeneğini. Doldurma portuna yük örnek 16 ul, bir yapıştırıcı film ile bağlantı noktaları mühür sistemde yapılan karıştırma açmak ve 42 ° C'de 16-20 saat boyunca hibridize
- Su içinde 10x ticari olarak temin edilebilen tamponlar seyreltilerek 1x yıkama tamponları I (250 mi), II (50 mi) ve III (50 mi) Hazırlama ve her 1 mM DTT ekleyin. Sıcak Tampon Ben 42 ° C.
- , Sıcak Tampon I. Peel kapalı karıştırıcı içeren bir çanak içinde bir sökme aracı haline mikser-slayt, yer ve slayt şiddetle sh iseelle sökme aracı aking.
- Yıkama tamponu I, 50 ml ile bir kap içine koyun ve slayt el ile 2 dakika boyunca kuvvetli bir şekilde çalkalanır.
- Aktarım 50 ml yıkama tamponu II ile ikinci bir kaba slayt ve elle 1 dakika boyunca kuvvetli bir şekilde çalkalanır.
- Aktarım 50 ml yıkama tamponu III ile üçüncü bir kap içine kayar, ve el ile 15 saniye boyunca kuvvetli bir şekilde çalkalanır.
- Çabuk bir kağıt havlu üzerine slayt kenarlarını kurulayın ve bir slayt rafa yerleştirin. Slayt kuruması 2 dakika boyunca 200 x g'de santrifüj. , Slayt halinde içinde yerleştirin folyo ile sarın ve bir desikatörde saklayın.
- Array taranıyor
- Cihazın talimatlarına uygun mikrodizi tarayıcı içindeki slayt yerleştirin.
- 532 nm = Cy3 ve 635 nm = Cy5'in olarak dalga boylarını ayarlamak için bir tarayıcı yazılımı kullanın ve 350 ile 400 arasında ilk photomultiplier kazanır.
- Slaytta dizisini bulmak için slayt önizleme. Tarama için dizi bölgeyi seçin.
- Dizi Tarama ve dizi özellikleri çoğunlukla sarı olduğu photomultiplier ayarları gibi ayarlayın. Histogram kırmızı ve yeşil üst üste eğrileri ya da mümkün olduğunca birbirine yakın olarak göstermelidir. Eğrileri doymuşluktaki 10 -5 normalize sayıları yukarıda bitmeli.
- Ayrı ayrı hem de 532 ve 635 nm görüntüleri kaydedin.
- Array Veri Analizi
- Bir dizi analiz yazılımı içine görüntüleri aktarmak. Yazılımı kullanılarak, (Cy3 ve Cy5 görüntüler için) Her dizi için iki çift raporları (. Çifti) oluşturun. Çift dosyaları kullanarak ölçekli log 2 oranı dosyaları oluşturun. 500 bp kayan bir pencere kullanarak zirveleri aramak için oturum 2 oranı dosyaları kullanın. Gen hedeflerin yukan bölgelerine zirve lokuslar haritada.
- Pozitif hedef (EMSA kullanılarak belirlenir ve bu örnekte qPCR, DVU3025 tarafından teyit) üst doruklarına içinde görünür olmadığını kontrol edin.
Not: pozitif hedef üst isabet arasında değilse, bunun mümkün olduğunu consi altında RRvergi oranlarını düşürmek birkaç gen hedefleri olan ve DAP-fiş çoğaltmak yapılabilir ve tekrarlanmış için ortak bir tepe noktaları hedef listesi oluşturmak için de kullanılabilir.
5.. Binding Site Motif Tahmin ve Doğrulama
- DAP-çip analizi ile oluşturulan gibi üst gen hedefleri için yukarı bölgelerinde (400 bp) için dizileri almak. Motifleri tahmin Online (meme.nbcr.net) Mikroplar ile bu dizilere mem uygulayın.
Not: sigma54 bağımlı düzenleyicileri olarak Enhancer bağlanma proteinleri başlangıç sitesinin yukarı birkaç yüz baz çifti bağlanabilir. Diğer transkripsiyonel düzenleyici için, bu gibi bir 200 bp kısa bir bölgenin üst yeterli olacaktır. - Tasarım ve üst ucunda ya da üzerinde 10 bazlar ile çevrili öngörülen bağlanma yerinin motifi içeren alt sicim DNA oligomerleri. Biyotinilat top iplikçik 5 'sipariş.
- 10 mM Tris HCI, pH 8.0, 1 mM EDTA, 50 mM NaCl in 1:1.5 oranında üst ve alt kordon oligos karıştırınPCR tüplerine 20 ul toplam reaksiyon hacmi. Isı 25 ° C'ye kadar yavaş soğutma ve ardından bir termal döngüleyici içinde 5 dakika boyunca 95 ° C'ye kadar On misli seyreltilir ve EMSA için vahşi tipli dsDNA alt-tabaka olarak kullanmak.
- , Yukarıdaki ile aynı adımları kullanarak değiştirilmiş alt tabakalar hazırlanır, ancak tasarım oligomerler bağlanma motifinin korunmuş tabanlarında 4-6 ikameleri taşımak için.
- RR ve vahşi tip ya da değiştirilmiş substratlar ile bağlama reaksiyonları kurmak ve aşama 2'de tarif edildiği gibi EMSA ile incelemek.
- Not: RR alt-tabakanın, ancak, yabani tip olmayan değiştirilmiş bir bağlar durumunda tahmin motif doğrulanır.
İlgili Diğer Bakteriyel Türlerin Motif 6.. Korunması
- DVU3023 arasında ortologlarını içeren ilgi genomalara seçin. NCBI sitesinden genomları için dizi ve açıklama dosyası edinin.
- Bir Poz oluşturmak için DAP-çip hedeflerinden motif dizileri kullanacak komut yazmak için Perl gibi bir programlama dili kullanınTV'nizi yerleştirmeden ağırlıklı matris ve diğer sıralı genomları mevcut benzer motifler puan matris kullanın.
Sonuçlar
Yukarıdaki yöntem Desulfovibrio vulgaris Hildenborough 7 bakteri indirgeme modeli sülfat RR küresel gen hedeflerini belirlemek için uygulanmıştır. Bu organizma algılar ve tepki olası sinyallerin çeşitli belirten üzerinde 70 RR tarafından temsil testis kanseri yaşayanlarının büyük bir numarası vardır. In vivo bu sinyalizasyon sistemlerinin fonksiyonları üzerine analizleri kendi sinyallerine beri gerçekleştirmek zor ve böylece aktive koşulları bilinmemektedir. Burad...
Tartışmalar
Burada açıklanan DAP çipli bir yöntemi başarılı bir şekilde temsil eden bir sonucu olarak burada gösterilen bir Desulfovibrio vulgaris Hildenborough 7 birkaç RR için gen hedef belirlemek için kullanılmıştır. RR DVU3023 için, bir aday gen hedef seçerek kolay oldu. DVU3025 RR geninin hemen alt baş tarafında bulunur, ve RR ve hedef genlerin çeşitli Desulfovibrio türlerinde muhafaza edilir, ve buna ek olarak DVU3025 öngörülen sigma54 bağımlı promoteri bulunmaktadır....
Açıklamalar
Yazarlar ifşa etmek çıkar çatışması bulunmamaktadır.
Teşekkürler
Biz video çekimi için hazırlanıyor ona yardım için ve tekniği göstermek için Amy Chen teşekkür ederim. ENIGMA tarafından yürütülen bu çalışma: Genler ve Moleküler Meclisleri (http://enigma.lbl.gov) ile Ekosistemler ve Ağlar Entegre, Lawrence Berkeley Ulusal Laboratuvarı Bilimsel Odak Alanı Programı, Bilim, Biyolojik Ofisi Ofisi tarafından desteklenen Sözleşme No: DE-AC02-05CH11231 altında ABD Enerji Bakanlığı Çevre Araştırma,.
Malzemeler
| Name | Company | Catalog Number | Comments |
| Name of Material/Equipment | Company | Catalog number | Comments |
| HisTrapFF column (Ni-Sepharose column) | GE Lfe Sciences, Pittsburgh, PA, USA | 17-5255-01 | |
| Akta explorer (FPLC instrument) | GE Lfe Sciences, Pittsburgh, PA, USA | ||
| HiPrep 26/10 Desalting column | GE Lfe Sciences, Pittsburgh, PA, USA | 17-5087-01 | |
| Qiaquick Gel extraction kit | Qiagen Inc, Valencia, CA, USA | 28704 | |
| Biotin-labeled oligonucleotides | Integrated DNA Technologies | N/A | |
| 6% polyacrylamide-0.5X TBE precast mini DNA retardation gel | Life Technologies, Grand Island, NY, USA | EC63652BOX | Alternately, you can pour your own gel. |
| Nylon membrane | EMD Millipore, Billerica, MA, USA | INYC00010 | |
| Trans-Blot SD Semi-dry electrophoretic transfer cell | Biorad, Hercules, CA, USA | 170-3940 | |
| Extra thick blot paper, 8 x 13.5 cm | Biorad, Hercules, CA, USA | 170-3967 | |
| UV crosslinker Model XL-1000 | Fisher Scientific | 11-992-89 | |
| Nucleic Acid chemiluminescent detection kit (Pierce) | Thermo fisher Scientific, Rockford, IL, USA | 89880 | |
| Ni-NTA agarose resin | Qiagen Inc, Valencia, CA, USA | 30210 | |
| GenomePlex Whole genome amplification kit (Fragmentation buffer, library preparation buffer, library stabilization solution, library preparation enzyme, 10X amplification master mix, WGA polymerase ) | Sigma-Aldrich, St. Louis, MO, USA | WGA2-50RXN | |
| Nanodrop ND-1000 | Thermo Scientific, Wilmington, DE, USA | For quantitation of DNA | |
| Perfecta Sybr Green SuperMix, with ROX | Quanta biosciences | 95055-500 | Any Sybr Green PCR mix may be used |
| PlateMax Ultra clear heat sealing film for qPCR | Axygen | ||
| 96 well clear low profile PCR microplate | Life Technologies, Grand Island, NY, USA | PCR-96-LP-AB-C | |
| Applied Biosystems StepOne Plus Real time PCR system | Life Technologies, Grand Island, NY, USA | 4376600 | Any real time PCR system may be used |
| Qiaquick PCR purification kit | Qiagen Inc, Valencia, CA, USA | 28104 | Any PCR clean up kit may be used |
| Cy3/Cy5-labeled nonamers | Trilink biotechnologies, San Diego, CA, USA | N46-0001, N46-0002 | |
| Klenow polymerase 50,000U/ml, 3'-5' exo- | New England Biolabs, Ipswich, MA | M0212M | |
| Hybridization system | Roche-Nimblegen, Madison, WI, USA | N/A | This company no longer makes arrays or related items, so alternate sources such as Agilent or Affymetrix will need to be used, |
| Custom printed microarrays and mixers | Roche-Nimblegen, Madison, WI, USA | N/A | |
| Hybridization kit (2X Hybridization buffer, Hybridization component A, Alignment oligo) | Roche-Nimblegen, Madison, WI, USA | N/A | |
| Wash buffer kit (10X Wash buffer I, II, III, 1 M DTT) | Roche-Nimblegen, Madison, WI, USA | N/A | |
| GenePix 4200A microarray scanner | Molecular Devices, Sunnyvale CA, USA | This model has been replaced by superior ones | |
| GenePix Pro microarray software | Molecular Devices, Sunnyvale CA, USA | ||
| Nimblescan v.2.4, ChIP-chip analysis software | Roche-Nimblegen, Madison, WI, USA | N/A | |
Referanslar
- Galperin, M. Y. Diversity of structure and function of response regulator output domains. Curr Opin Microbiol. 13, 150-159 (2010).
- Casino, P., Rubio, V., Marina, A. The mechanism of signal transduction by two-component systems. Curr Opin Struct Biol. 20, 763-771 (2010).
- Aparicio, O., Geisberg, J. V., Struhl, K. Chromatin immunoprecipitation for determining the association of proteins with specific genomic sequences in vivo. Curr Protoc Cell Biol. 17 (17), (2004).
- McCleary, W. R., Stock, J. B. Acetyl phosphate and the activation of two-component response regulators. J Biol Chem. 269, 31567-31572 (1994).
- Novichkov, P. S., et al. RegPrecise web services interface: programmatic access to the transcriptional regulatory interactions in bacteria reconstructed by comparative genomics. Nucleic Acids Res. 40, 604-608 (2012).
- Studholme, D. J., Buck, M., Nixon, T. Identification of potential sigma(N)-dependent promoters in bacterial genomes. Microbiology. 146 (12), 3021-3023 (2000).
- Rajeev, L., et al. Systematic mapping of two component response regulators to gene targets in a model sulfate reducing bacterium. Genome Biol. 12, 99 (2011).
- Crooks, G. E., Hon, G., Chandonia, J. M., Brenner, S. E. WebLogo: a sequence logo generator. Genome Res. 14, 1188-1190 (2004).
- Barbieri, C. M., Mack, T. R., Robinson, V. L., Miller, M. T., Stock, A. M. Regulation of response regulator autophosphorylation through interdomain contacts. J Biol Chem. 285, 32325-32335 (2010).
- Bourret, R. B. Receiver domain structure and function in response regulator proteins. Curr Opin Microbiol. 13, 142-149 (2010).
- Gao, R., Stock, A. M. Molecular strategies for phosphorylation-mediated regulation of response regulator activity. Curr Opin Microbiol. 13, 160-167 (2010).
- Hung, D. C., et al. Oligomerization of the response regulator ComE from Streptococcus mutans is affected by phosphorylation. J Bacteriol. 194, 1127-1135 (2012).
- Ladds, J. C., et al. The response regulator Spo0A from Bacillus subtilis is efficiently phosphorylated in Escherichia coli. FEMS Microbiol Lett. 223, 153-157 (2003).
- Wen, Y., Feng, J., Scott, D. R., Marcus, E. A., Sachs, G. Involvement of the HP0165-HP0166 two-component system in expression of some acidic-pH-upregulated genes of Helicobacter pylori. J Bacteriol. 188, 1750-1761 (2006).
- Liu, X., Noll, D. M., Lieb, J. D., Clarke, N. D. DIP-chip: rapid and accurate determination of DNA-binding specificity. Genome Res. 15, 421-427 (2005).
- Gossett, A. J., Lieb, J. D. DNA Immunoprecipitation (DIP) for the Determination of DNA-Binding Specificity. CSH Protoc. 2008, (2008).
- Mascher, T., et al. The Streptococcus pneumoniae cia regulon: CiaR target sites and transcription profile analysis. J Bacteriol. 185, 60-70 (2003).
- Park, P. J. ChIP-seq: advantages and challenges of a maturing technology. Nat Rev Genet. 10, 669-680 (2009).
- Lefrancois, P., Zheng, W., Snyder, M. ChIP-Seq using high-throughput DNA sequencing for genome-wide identification of transcription factor binding sites. Methods Enzymol. 470, 77-104 (2010).
- Ho, J. W., et al. ChIP-chip versus ChIP-seq: lessons for experimental design and data analysis. BMC Genomics. 12, 134 (2011).
- Liu, X., Lee, C. K., Granek, J. A., Clarke, N. D., Lieb, J. D. Whole-genome comparison of Leu3 binding in vitro and in vivo reveals the importance of nucleosome occupancy in target site selection. Genome Res. 16, 1517-1528 (2006).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır