Un abonnement à JoVE est nécessaire pour voir ce contenu. Connectez-vous ou commencez votre essai gratuit.
Method Article
ADN purifié par affinité Chip (DAP-puce) Méthode pour déterminer les cibles génétiques pour bactérienne Deux systèmes de réglementation composants
Dans cet article
Résumé
Cet article vidéo décrit une méthode de puces à ADN sur la base in vitro afin de déterminer les gènes cibles et des sites de liaison pour deux régulateurs de réponse du système de composants.
Résumé
Les méthodes in vivo tels que ChIP-chip sont des techniques bien établies utilisées pour déterminer les cibles mondiales de gènes pour des facteurs de transcription. Cependant, ils sont d'une utilité limitée dans l'exploration de deux systèmes de réglementation composants bactériens avec des conditions d'activation non caractérisés. De tels systèmes régulent la transcription seulement quand elle est activée en présence de signaux uniques. Etant donné que ces signaux sont souvent inconnus, le procédé in vitro de puces à ADN située à décrit dans cet article vidéo peut être utilisée pour déterminer des cibles de gènes et des sites de liaison pour les régulateurs de réponse. Cette méthode puce ADN purifié par affinité peut être utilisée pour n'importe quel régulateur purifiée dans un organisme avec un génome séquencé. Le protocole consiste à permettre la protéine marquée purifiée à se lier à l'ADN génomique cisaillée et ensuite la purification par affinité de l'ADN lié à une protéine, suivie par le marquage fluorescent de l'ADN et l'hybridation à un réseau de carrelage personnalisé. Précédentes étapes qui peuvent être utilisés pour optimiser le dosage de spécificationc régulateurs sont également décrits. Les pics générés par l'analyse des données du tableau sont utilisés pour prédire motifs de sites de liaison, qui sont ensuite validés expérimentalement. Les prédictions de motifs peuvent être utilisés en outre pour déterminer les gènes cibles de régulateurs de réponse orthologues d'espèces étroitement apparentées. Nous démontrons l'applicabilité de ce procédé en déterminant les gènes cibles et de motifs de site de liaison et la prédiction ainsi la fonction d'un régulateur de réponse DVU3023 de sigma54-dépendante de l'environnement dans la bactérie Desulfovibrio vulgaris Hildenborough.
Introduction
La capacité des bactéries à survivre et à prospérer dépend de façon critique sur la façon dont ils sont capables de percevoir et de répondre aux perturbations de leur environnement, et ce, à son tour dépend de leurs systèmes de transduction du signal. Le nombre de systèmes de signalisation une bactérie de encode a été appelé son "QI microbienne" et peut être une indication de la variabilité de son environnement et de sa capacité à détecter des signaux multiples et d'affiner sa réponse 1. Deux systèmes de transduction de signaux composants (TCS) sont des systèmes de signalisation les plus répandues utilisées par les bactéries, et ils sont constitués d'une histidine kinase (HK) qui détecte le signal externe et le transmet par l'intermédiaire de la phosphorylation d'un régulateur de réponse effectrice (RR) 2. RR peuvent avoir une variété de domaines de la production et donc différents modes effectrices, mais la réponse la plus fréquente est la régulation transcriptionnelle via un domaine 1 liaison à l'ADN. Les signaux détectés et les fonctions correspondantes du canal déférentt majorité des TCS restent inconnus.
Bien que des procédés in vivo tels que ChIP-chip sont couramment utilisés pour la détermination des sites de liaison de facteurs de transcription génomiques 3, ils ne peuvent être utilisés pour les deux RR bactériennes du système composant si les conditions ou les signaux d'activation sont connus. Souvent, les signaux environnementaux qui activent un TCS sont plus difficiles à déterminer que leurs gènes cibles. La puce à ADN in vitro dosage à base décrit ici peut être utilisé pour déterminer rapidement et efficacement les gènes cibles et de prévoir des fonctions de TCS. Cet essai tire parti du fait que les RR peuvent être phosphorylés et donc activés in vitro à l'aide de petites molécules telles que des donneurs de phosphate d'acétyle 4.
Dans ce procédé, appelé DAP-puce pour l'ADN-affinité-puce purifié (Figure 1), le gène de la RR d'intérêt est clone avec un His-tag dans E. coli, et une protéine marquée par la suite purifié est autorisé à bie à la tonte de l'ADN génomique. L'ADN lié à une protéine est ensuite enrichi par affinité purification, l'ADN enrichi et entrée sont amplifiés, marqué par fluorescence, mis en commun et hybride à une gamme de carrelage qui est faite sur mesure pour l'organisme d'intérêt (figure 1). expériences de puces à ADN sont soumis à des artefacts et donc des mesures supplémentaires sont utilisés pour optimiser le dosage. Une telle démarche est de tenter de déterminer une cible pour le RR à l'étude en utilisant des tests électrophorétique de décalage de mobilité (EMSA) (voir flux de travail dans la figure 2). Puis, après liaison à l'ADN génomique et les étapes de la DAP, l'ADN lié à une protéine et d'entrée sont examinés par qPCR pour déterminer si la cible positif est enrichi dans la fraction liée aux protéines par rapport à la fraction d'entrée, confirmant ainsi les conditions optimales de liaison pour l' RR (figure 2). Après tableau hybridation, les données sont analysées pour trouver des pics de signal d'intensité plus élevée indiquant loci génomiques où la protéine hannonce lié. Les fonctions peuvent être prévus pour la RR en fonction des objectifs de gènes obtenus. Les loci génomiques cibles sont utilisés pour prédire motifs de sites de liaison, qui sont ensuite validés expérimentalement à l'aide EMSA (Figure 2). Les prédictions fonctionnelles et cibles génétiques pour la RR peuvent ensuite être étendues aux espèces qui codent RR orthologues en scannant les génomes pour des motifs de liaison similaires (figure 2) étroitement liés. La méthode DAP-puce peut fournir une mine d'informations pour un TCS où il n'y avait auparavant aucune. Le procédé peut également être utilisé pour n'importe quel régulateur transcriptionnel si la protéine peut être purifiée et des conditions de liaison d'ADN peut être déterminée, et pour n'importe quel organisme d'intérêt avec une séquence génomique disponible.
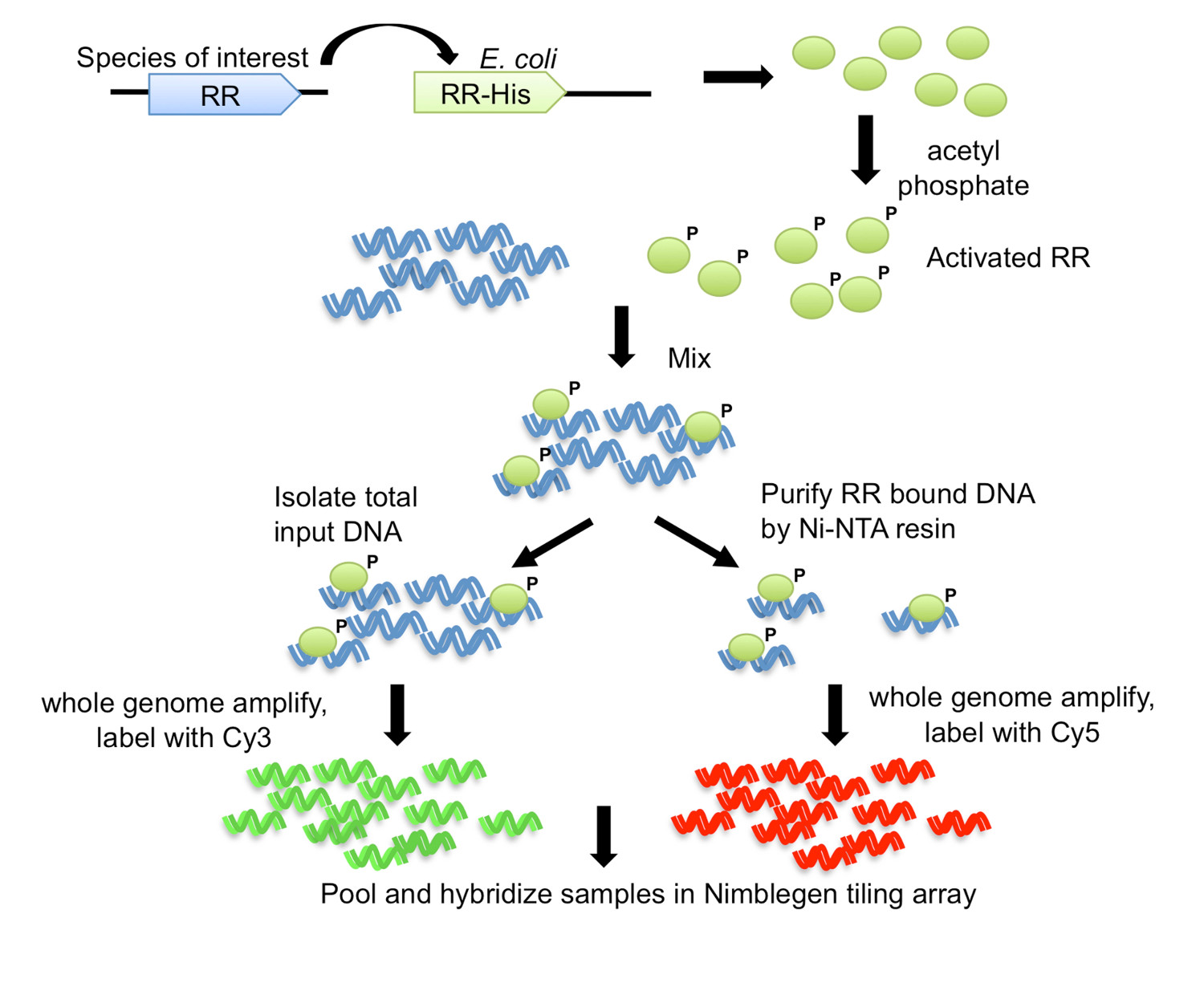
Figure 1. L'-puce ADN purifié par affinité (DAP-puce) stratégie 7. Le gène de la RR de l'organisme d'intérêt est cloné avec un His-tag carboxy-terminale dans un E. coli souche d'expression. Protéine purifiée marquée par His est activée par phosphorylation avec du phosphate d'acétyle, et on le mélange avec de l'ADN génomique cisaillé. Une aliquote de la réaction de liaison est enregistré sous forme d'ADN d'entrée, tandis que le reste est soumis à une purification par affinité en utilisant une résine Ni-NTA. L'entrée et l'ADN de RR lié sont génome amplifié, et marqué avec Cy3 et Cy5, respectivement. L'ADN marqué est mis en commun et hybridée à une matrice de carrelage, qui est ensuite analysé afin de déterminer les gènes cibles. Figure modifiée et réimprimée en utilisant la licence creative commons de 7.
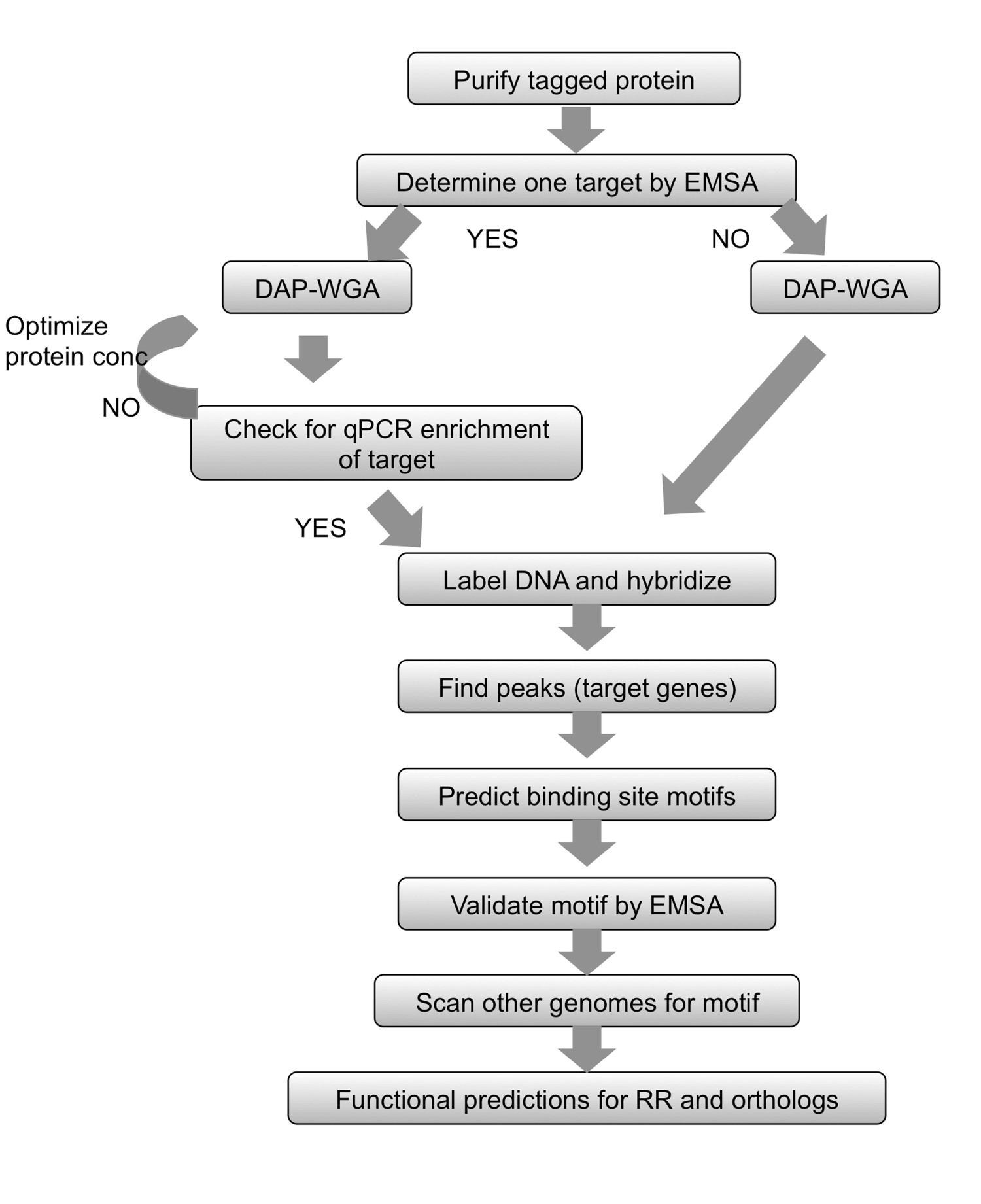
Figure 2. Sommaire des flux de travail. Pour toute protei marqué purifién, commencer par déterminer une cible en utilisant l'EMSA. Autoriser protéine à lier l'ADN génomique et l'ADN purifier par affinité (DAP) et l'ensemble du génome amplifier (WGA), le ADN enrichi et entrée. Si une cible du gène est connue, utiliser qPCR pour s'assurer que la cible connue est enrichi dans la fraction liée aux protéines. Si aucune cible pourrait être déterminée, passez directement à l'étiquetage de l'ADN et l'hybridation tableau. Si l'enrichissement par qPCR pas pu être observée, puis répétez la liaison protéine-ADNg et étapes DAP-WGA utilisant différentes quantités de protéines. Utiliser l'analyse de réseau pour trouver les pics et les faire correspondre à cibler des gènes. Utiliser les régions en amont de gènes cibles pour prédire motifs de site de liaison. Valider les motifs expérimentalement à l'aide EMSA. Utilisez le motif de scanner les génomes d'espèces apparentées codant orthologues de la RR à l'étude, et de prévoir les gènes ciblés dans ces espèces. Sur la base des cibles de gènes obtenus, la fonction physiologique de la RR et ses orthologues peut être prédite. Figure modifié et reproduit à l'aide du c créativeommons licence de 7.
Protocole
Remarque: Le protocole ci-dessous est adaptée pour la détermination des gènes cibles de la DVU3023 RR de la bactérie Desulfovibrio vulgaris Hildenborough. Il peut être adapté à tout autre régulateur transcriptionnel d'intérêt.
1. Clone et Purify RR
- Cloner le gène RR, spécifiquement DVU3023, de D. vulgaris Hildenborough coli dans un vecteur d'expression d'Escherichia telles que le gène est C-terminale His-étiqueté et l'expression est sous le contrôle d'un promoteur T7.
Remarque: Plusieurs méthodes de clonage peuvent être utilisés et sont déterminés par le chercheur. Marqueurs d'affinité alternatifs peuvent également être utilisés. - La transformée de construction d'expression dans E. coli BL21 (DE3) souche d'expression.
- Grow up 1 L de la souche d'expression de BL21 à 37 ° C. Au milieu de la phase log, ajouter de l'IPTG à 0,5 mM pour induire l'expression de la protéine. Continuer la croissance à la température ambiante pendant 24 heures.
- Centrifuger les cellules à 5000 g pendant 10 kmn à 4 ° C. Resuspendre les cellules dans un tampon de lyse (20 mM de phosphate de sodium, pH 7,4, 500 mM de NaCl, 40 mM imidazole, 1 mg / ml de lysozyme, 1x benzonase nuclease). Lyse des cellules en utilisant une presse française à 4 ° C.
- Centrifuger le lysat à 15 000 x g pendant 30 min à 4 ° C. Filtrer à l'aide d'un filtre seringue de 0,45 um.
- Laver une colonne de 1 ml de Ni Sepharose sur un instrument FPLC en utilisant 10 ml de tampon de lavage (phosphate de sodium 20 mM, pH 7,4, 500 mM de NaCl, 40 mM imidazole).
- Charger lysat sur la colonne. Laver la colonne avec 20 ml de tampon de lavage.
- Eluer DVU3023 en utilisant un gradient de tampon d'élution de 0 à 100% (phosphate 20 mM de sodium, pH 7,4, NaCl 500 mM, imidazole 500 mM).
- Charger les fractions éluées sur une colonne de dessalage, et laver avec un tampon de dessalement (20 mM de phosphate de sodium pH 7,4, 100 mM de NaCl).
- Centrifuger l'échantillon de protéine dans un filtre de centrifugation à haute masse moléculaire de coupure de concentrer la protéine. Ajouter TNT à 0,1 mM et de glycérol à 50% et la protéine de conserver à -20 ° C.
Remarque: Les méthodes de purification devront être optimisés individuellement pour chaque protéine étudiée.
2. Déterminer Gene cible pour RR Utilisation de mobilité électrophorétique Maj Assay (EMSA)
- Amplifier par PCR la région de 400 pb en amont du gène de DVU3025 cible candidate, à l'aide D. vulgaris Hildenborough ADN génomique comme matrice et une amorce non marquée vers l'avant et une marche arrière 5'-amorce marquée à la biotine.
Note: Conseils pour choisir un gène cible candidat: Souvent RR lient les régions en amont de leur propre gène / opéron, ou ils peuvent réguler les gènes codés proximale. Si le RR a orthologues chez d'autres espèces, rechercher des gènes qui sont conservés dans le quartier. D'autres méthodes incluent le choix des gènes candidats sur la base de prévisions de régulon (par exemple, RegPrecise 5), ou prédire sigma54 dépendant promoteurs 6 pour RR qui sont eux-mêmes sigma54-dépendante. - Exécutez le produit de PCR sur un gel d'agarose à 1%, découper le 400 bp produit de taille, et purifier l'ADN en utilisant un gel extraction kit nettoyage.
- Mélanger protéine DVU3023 (0,5 pmol) avec 100 fmoles de substrat d'ADN biotinylé dans du HCl 10 mM Tris, pH 7,5, KCl 50 mM, MgCl2 5 mM, DTT 1 mM, 25% de glycerol et 1 ug / ml de poly dI.dC (non -spécifique de l'ADN compétiteur) dans un volume total de 20 ul. Également mis en place une réaction sans protéine de contrôle. Incuber les réactions à la température ambiante sur le banc pendant 20 minutes.
- Note: Ce sont des conditions standard répertoriés et d'autres composants de la réaction peuvent être ajoutés en fonction de la RR d'intérêt. Si l'activation est souhaitée, ajouter 50 mM de phosphate acétyle à la réaction (souvent RR aura lier à l'ADN in vitro sans activation).
- Pré-exécuter un mini 6% de polyacrylamide-0.5x gel de TBE préfabriqué dans un tampon TBE 0,5 x à 100 V pendant 30 min. Ajouter 5 ul de tampon 5x de chargement (0,1% de bleu de bromophénol, 0,1% de xylène cyanol, 30% de glycérol en 1x TBE) pour les réactions de liaison et de la charge de 18 pi des réactions sur la gel. Exécutez à 100 V pendant 2 heures.
Remarque: Afin d'éviter une surchauffe, ce qui peut conduire à une dissociation des complexes protéine-ADN, remplir la chambre tampon externe dans le système d'électrophorèse avec un tampon en cours d'exécution de telle sorte que la majeure partie du gel est isolée par un tampon. En variante, le gel peut être effectuée à 4 ° C. - Couper une membrane de nylon chargée à la taille du gel et le faire tremper dans 0.5x TBE pendant au moins dix minutes. Retirer le gel de la cassette. Coupez les crêtes hors gel et en sandwich le gel et la membrane entre deux papiers-filtres épais imbibés de 0,5 x TBE, et placer à l'intérieur d'un appareil de transfert semi-sec et fonctionner à 20 V pendant 30 min.
- Placez la membrane à l'intérieur d'un instrument lumière UV de réticulation commerciale et régler l'heure à 3 min.
Remarque: La membrane peut alors être stocké à sec à la température ambiante pendant plusieurs jours avant de procéder à l'étape suivante. - Utilisez un kit de détection de chimioluminescence disponibles dans le commerce qui emploie un radis peroxydation streptavidine-chevalsoi conjugué à développer le transfert selon les instructions du fabricant.
- Le transfert de l'image à l'aide d'un ordinateur relié à une caméra CCD équipé et chercher un décalage de la mobilité du substrat d'ADN en présence de la RR, ce qui indique que le RR lie l'ADN à tester.
Remarque: La spécificité de la protéine-ADN décalage peut être testée en incluant dans la réaction un excès d'ADN compétiteur non marqué, ce qui devrait éliminer ou de diminuer le décalage connu.
3. Vérifiez cible enrichissement après-protéines et l'ADN génomique Reliure
- Réaction de liaison protéine-ADN génomique
- ADN cisaillement génomique à une taille moyenne de 500 bp par sonication de l'ADN génomique de 100 ul (à des concentrations de 100 à 200 ng / ul) dans un tube à centrifuger de 1,5 ml en utilisant une micro-pointe avec 9 faibles impulsions d'amplitude de 1 sec, avec deux écart s entre les deux chacune.
Remarque: Si les éclaboussures ADN sur les côtés du tube, ralentissent le contenu après 3 impulsions. Les conditions exactes utiliséesvarie en fonction de l'instrument de traitement ultrasonique utilisé. Les fragments d'ADN peuvent varier de cisaillées 100-1000 pb, mais la taille moyenne doit être à l'intérieur de 400 à 600 pb. Trop de cisaillement peut se traduire par moins de sites de liaison intacts, et soit trop ou trop peu de cisaillement aura une incidence sur la préparation de bibliothèque pendant les étapes d'amplification du génome entier en aval. - Mélanger 2-3 pg d'ADN génomique cisaillé avec une protéine de RR (0,5 pmol de DVU3023) dans 10 mM Tris-HCl pH 7,5, DTT 1 mM, KCl 50 mM, MgCl2 5 mM, 25% de glycerol, et 50 mM de phosphate d'acétyle. Incuber les réactions à 25 ° C pendant 30 min. Transférer 10 ul de cette réaction dans un tube de 1,5 ml et en tant que marqueur d'ADN d'entrée.
Remarque: le phosphate d'acétyle est ajouté à activer la phosphorylation par la protéine in vitro. Phosphorylation stimule liaison à l'ADN, mais de nombreux RR lie également de l'ADN in vitro sans activation 7. La quantité de protéine ajoutée à la réaction dépend de l'activité de la préparation de protéine. L'EMSA peut être utilisé pour choisirimize ce montant.
- ADN cisaillement génomique à une taille moyenne de 500 bp par sonication de l'ADN génomique de 100 ul (à des concentrations de 100 à 200 ng / ul) dans un tube à centrifuger de 1,5 ml en utilisant une micro-pointe avec 9 faibles impulsions d'amplitude de 1 sec, avec deux écart s entre les deux chacune.
- Affinity purification de l'ADN lié à une protéine
- Ajouter 30 ul de résine d'agarose Ni-NTA dans un tube à centrifuger de 0,6 ml. Centrifuger à 100 g pendant 1 min pour recueillir la résine au fond, et retirer le surnageant. Ajouter 100 ul de tampon de lavage (10 mM Tris-HCl, pH 7,5, 5 mM de MgCl2, 50 mM de KCl, 25% de glycérol), film le tube pour mélanger et centrifuger à 100 g pendant 2 min. Retirer le surnageant.
- Ajouter 90 ul restants de la réaction de liaison à la résine Ni-NTA lavé et incuber dans un agitateur rotatif pendant 30 min.
- Centrifuger à 100 g pendant 2 min, et retirer le surnageant (de l'ADN non lié). Ajouter 100 ul de tampon de lavage, faites glisser le tube pour mélanger le contenu, et centrifuger à 100 g pendant 2 min. Retirer le surnageant. Répéter deux fois de plus l'étape de lavage.
- Ajouter 35 ul de tampon d'élution (tampon phosphate 20 mM de sodium pH 8, NaCl 500 mM, imidazole 500 mM) à la résine et mélanger au vortex. Incuber sur le banc à température ambiante pendant 5 min. Centrifuger à 100 g pendant 2 min. Transférer le surnageant dans un nouveau tube de 1,5 ml et de l'étiquette en tant que fraction de l'ADN lié à une protéine.
- Également ajouter 35 ul de tampon d'élution de l'ADN d'entrée.
- Purifier l'entrée et les fractions d'ADN lié à une protéine en utilisant un kit de purification PCR.
- Génome entier amplifier l'entrée et des échantillons d'ADN liés aux protéines.
- Ajouter 10 ul de l'entrée et de l'ADN lié à une protéine pour séparer les tubes de PCR. Ajouter 1 pl de tampon 10x de fragmentation, 2 pi de tampon Préparation Bibliothèque, et 1 pl de solution Bibliothèque de stabilisation à chaque échantillon. Mélangez bien au vortex. La chaleur dans un thermocycleur à 95 ° C pendant 2 minutes, et le froid sur la glace.
Remarque: Le montant de départ de l'ADN devrait être d'au moins 10 ng afin d'éviter d'introduire un biais d'amplification. - Ajouter 1 pl de préparation Bibliothèque Enzyme, mélanger par pipetage, et incuber dans cycleur thermique à 16 ° C/20 min, 24 ° C/20 min, 37 ° C pendant 20 min, 75 ° C / 5 minEt maintien à 4 ° C.
- Pour chaque tube, ajouter 47,5 pi d'eau, 7,5 pi de mélange maître d'amplification 10x, et 5 ul de polymerase. Bien mélanger et chauffer à 95 ° C / 3 min, suivie de 20 cycles de 94 ° C/15 sec, 65 ° C / 5 min. Tenez réactions à 4 ° C.
- Purifier les échantillons d'ADN amplifiés en utilisant un kit de purification de PCR et de mesurer la concentration d'ADN par spectrophotométrie.
- Ajouter 10 ul de l'entrée et de l'ADN lié à une protéine pour séparer les tubes de PCR. Ajouter 1 pl de tampon 10x de fragmentation, 2 pi de tampon Préparation Bibliothèque, et 1 pl de solution Bibliothèque de stabilisation à chaque échantillon. Mélangez bien au vortex. La chaleur dans un thermocycleur à 95 ° C pendant 2 minutes, et le froid sur la glace.
- Vérifier l'enrichissement de la cible dans l'ADN lié à une protéine en utilisant qPCR
- Amorces conception qPCR pour amplifier 200 pb de la région en amont du gène cible EMSA-garantie (DVU3025) utilisant n'importe quel logiciel de conception d'amorce disponible gratuitement.
- Mise en place des réactions de qPCR en triple pour chaque matrice d'ADN avec chaque jeu d'amorces. Préparer un mélange maître pour chaque jeu d'amorces. 1x mélange maître contient 10 ul de 2x SYBR Green qPCR mélange, 0,5 uM de chaque amorce et de l'eau pour un total de 18 pi. Aliquotes de 18 pl du mélange maître par puits d'une plaque PCR de 96 puits.
- DILUTe l'entrée amplifiés et purifiés et des échantillons d'ADN lié à une protéine à 5 ng / ul avec de l'eau et l'utiliser comme matrice d'ADN. Ajouter 2 ul de matrice d'ADN dans les puits.
- Sceller la plaque avec un film ultra clair d'étanchéité qPCR, centrifuger la plaque dans une centrifugeuse à 200 xg / 1 min. Placer la plaque dans une qPCR en temps réel machine. Cycle de la façon suivante en utilisant le logiciel associé qPCR: 95 ° C / 1 min, et 40 cycles de 95 ° C/10 sec, 59 ° C/15 sec, et 70 ° C/35 sec.
- Également mis en place des réactions de qPCR triple avec des amorces pour amplifier les régions en amont d'un gène non lié (contrôle négatif).
- Calculer Ac T en soustrayant la valeur de T en C de l'ADN lié à une protéine à partir de celle de l'ADN d'entrée. Calculer un facteur d'enrichissement de gène cible dans l'ADN lié à une protéine comme Ac 2 T.
Remarque: si la région en amont de la cible a été enrichi dans l'ADN lié à une protéine par rapport à l'ADN d'entrée, cela indique que les réactions de liaison et de purification par affinité étaient successful. Passez à l'étape 4. Si l'enrichissement de la région en amont de la cible n'a pas été observée, répéter les réactions de liaison (étape 3.1) avec une quantité différente de la protéine.
4. Marquage de l'ADN et Array hybridation
- ADN d'entrée d'étiquettes avec l'ADN Cy3 et Cy5 Enrichi
ote: Cy3 et Cy5 colorants sont sensible à la lumière et les soins devraient être prises pour maintenir l'exposition de lumière au minimum.- Mélanger 1 pg d'ADN avec 40 pi Cy3/Cy5-labeled 9-mères et ajuster le volume à 80 pi avec de l'eau.
- La chaleur dénature à 98 ° C pendant 10 min dans l'obscurité (dans un thermocycleur). Refroidissement rapide sur la glace pendant 2 min.
- Ajouter 2 ul Klenow polymérase (3'-5'-exo -, 50 000 U / ml), 5 mM dNTPs, et 8 pi d'eau à chaque réaction, bien mélanger et incuber à 37 ° C pendant 2 heures dans l'obscurité (dans un thermocycleur).
- Ajouter de l'EDTA à 50 mM pour arrêter la réaction et une solution de NaCl à 0,5 M.
- échantillons de transfert aux tubes de 1,5 ml containing 0,9 volume d'isopropanol, incuber dans l'obscurité pendant 10 min et centrifugation à 12 000 xg pendant 10 min. Le culot doit être rose pour l'ADN marqué au Cy3 et Cy5 bleu pour l'ADN marqué.
- Laver culot avec 80% d'éthanol (500 pi) et centrifuger à 12 000 g pendant 2 min. Pastilles air sec pour 5-10 minutes dans l'obscurité.
Remarque: Les granulés peuvent être stockés à -20 ° C. - Remettre en suspension le culot dans 25 pi d'eau. Mesurer la concentration d'ADN par spectrophotométrie.
- Piscine ensemble 6 pg de chacun de l'ADN Cy3 et Cy5 marqué dans un tube de 1,5 ml et vide sec dans une centrifugeuse à feu doux dans l'obscurité (couvrir le couvercle de la centrifugeuse si il est transparent).
Remarque: Les granulés peuvent être stockés à -20 ° C jusqu'au moment de l'hybridation.
- Biopuces hybridation
- Mettez le système d'hybridation sur 3-4 heures avant de l'utiliser et régler la température à 42 ° C.
- Préparer une solution mélange maître d'hybridation telle que la solution contient 1x 11,8 pi 2x hybridationtion tampon, 4,7 pi hybridation de composants A et 0,5 ul alignement oligo.
- Reprendre les culots dans 5 pi d'eau. Ajouter 13 ul de ce mélange à l'échantillon. Vortex pendant 15 secondes, incuber à 95 ° C dans un bain sec pendant 5 min. Conserver les échantillons à 42 ° C dans le système d'hybridation jusqu'à ce que prêt à charger.
- Préparer l'ensemble coulisseau-mélangeur microréseau, selon le protocole du fabricant.
- Placez l'ensemble mélangeur-diapositive dans le système d'hybridation. Charge: 16 ul d'échantillon dans l'orifice de remplissage, l'étanchéité des orifices avec un film adhésif, mettre le mélange dans le système, et pour s'hybrider 16 à 20 heures à 42 ° C.
- Préparer 1x tampons de lavage I (250 ml), II (50 ml) et III (50 ml) par dilution de 10x les tampons disponibles dans le commerce dans de l'eau, et ajouter à chaque DTT à 1 mM. Tampon chaud je à 42 ° C.
- Faites glisser le mélangeur-glisser dans un outil de démontage, et place à l'intérieur d'un plat chaud contenant tampon I. Peel la table de mixage, tout vigoureusement shompte l'outil de démontage à la main.
- Placer la lame dans un récipient avec 50 ml de tampon de lavage I et agiter vigoureusement pendant 2 min à la main.
- glissière de transfert dans un second récipient avec un tampon 50 ml Wash II et agiter vigoureusement pendant 1 min à la main.
- glissière de transfert dans un troisième récipient avec 50 ml de tampon de lavage III, et agiter vigoureusement pendant 15 secondes à la main.
- Effacer rapidement les bords de la lame sur une serviette en papier, et placer dans un rack coulissant. Centrifuger à 200 g pendant 2 min pour sécher la diapositive. Placez dans le cas de glissière, l'envelopper de papier d'aluminium, et de les stocker dans un dessiccateur.
- Numérisation Array
- Placer la lame à l'intérieur du scanner de microréseau selon les instructions de l'instrument.
- Utilisez un logiciel de numérisation pour définir les longueurs d'onde de 532 nm comme = Cy3 et 635 nm = Cy5, et les gains de photomultiplicateurs initiales entre 350 et 400.
- Aperçu de la diapo pour localiser le tableau sur la diapositive. Sélectionnez la région de réseau pour la numérisation.
- Balayez l'ensemble et régler les paramètres de photomultiplicateurs tels que les caractéristiques du tableau sont principalement jaune. L'histogramme doit montrer les courbes rouge et verte superposées ou aussi près de l'autre que possible. Les courbes doivent se terminer au-dessus des 10 -5 chiffres normalisés à saturation.
- Enregistrez les deux 532 et 635 nm images séparément.
- Analyse des données de matrice
- Importer les images dans un logiciel d'analyse de réseau. En utilisant le logiciel, créer deux rapports paire (. Paire) pour chaque réseau (pour Cy3 et Cy5 images). Créer redimensionnées journal 2 fichiers de rapport à l'aide des fichiers de pair. Utilisez log 2 fichiers de rapport à la recherche de pics en utilisant une fenêtre glissante de 500 pb. Mapper le locus de crête à des régions en amont des gènes cibles.
- Vérifiez si la cible positive (déterminée à l'aide de l'EMSA et confirmé par qPCR, DVU3025 dans cet exemple) apparaît dans les meilleurs pics.
Remarque: Si la cible n'est pas positif parmi les meilleurs résultats, il est possible que le RR sous considération a plusieurs gènes cibles et de reproduire DAP-copeaux peut être effectué et les pics communs à toutes les répétitions peut être utilisée pour générer une liste de cibles.
5. Binding Site prévision Motif et Validation
- Récupérer des séquences pour les régions en amont (400 pb) pour les gènes cibles meilleurs que générée par l'analyse DAP-puce. Appliquer MEME sur ces séquences par Microbes en ligne (meme.nbcr.net) pour prédire motifs.
Remarque: les protéines de liaison telles que des régulateurs Enhancer sigma54-dépendantes peuvent se lier à plusieurs centaines de paires de bases en amont du site d'initiation. Pour d'autres régulateurs de la transcription, une région plus courte telle que 200 pb en amont sera suffisante. - Conception supérieure et oligomères d'ADN de brin du bas qui contiennent le motif de site de liaison prédite flanqué de 10 bases à chaque extrémité. Commandez le brin supérieur 5 'biotinylé.
- Mélanger les oligos brins supérieur et inférieur dans le rapport de 1:1,5 à 10 mM Tris HCl, pH 8,0, EDTA 1 mM, NaCl 50 mM et enun volume réactionnel total de 20 ul dans des tubes de PCR. Chauffer à 95 ° C pendant 5 minutes dans un cycleur thermique, suivi d'un refroidissement lent à 25 ° C. Diluer dix fois et l'utiliser comme type sauvage substrat ADN double brin pour l'EMSA.
- Préparer substrats modifiés en utilisant les mêmes étapes que ci-dessus, mais oligomères de conception pour mener 4-6 substitutions dans les bases conservées du motif de liaison.
- Mettre en place des réactions de liaison avec le RR et le type sauvage ou substrats modifiés et examiner à l'aide de l'EMSA comme décrit à l'étape 2.
- Remarque: Le motif prévu est validé si la RR lie le substrat de type sauvage mais pas celui modifié.
6. Conservation des motifs dans d'autres espèces bactériennes associées
- Sélectionnez génomes d'intérêt qui contiennent orthologues de DVU3023. Obtenir des fichiers de séquence et d'annotation pour les génomes du site NCBI.
- Utilisez un langage de programmation comme Perl pour écrire des scripts qui vont utiliser les séquences de motifs des objectifs DAP-puce pour construire un position matrice pondérée et utiliser la matrice de marquer motifs similaires présentes dans d'autres génomes séquencés.
Résultats
La méthode ci-dessus a été appliquée pour déterminer les gènes cibles mondiales des RR dans le sulfate de modèle réduisant bactérie Desulfovibrio vulgaris Hildenborough 7. Ce micro-organisme a un grand nombre de TCS représenté par plus de 70 RI, ce qui indique la grande variété de signaux possibles qui détecte et répond à. Analyses in vivo sur les fonctions de ces systèmes de signalisation sont difficiles à réaliser étant donné que leurs signaux, et donc les conditions d...
Discussion
La méthode DAP-puce décrit ici a été utilisé avec succès pour déterminer les cibles génétiques pour plusieurs RI dans Desulfovibrio vulgaris Hildenborough 7 dont un est représenté ici comme un résultat représentatif. Pour RR DVU3023, le choix d'une cible de gène candidat était simple. DVU3025 est située immédiatement en aval du gène de la RR, et les gènes de la RR et cible sont conservées dans plusieurs espèces Desulfovibrio, et en outre DVU3025 a un promoteur de sig...
Déclarations de divulgation
Les auteurs n'ont pas de conflit d'intérêt à divulguer.
Remerciements
Nous remercions Amy Chen pour son aide dans la préparation pour le tournage de la vidéo et pour démontrer la technique. Ce travail mené par ENIGMA: écosystèmes intégrés et des réseaux avec des gènes et des assemblages moléculaires (http://enigma.lbl.gov), un programme scientifique Secteur d'intérêt au Lawrence Berkeley National Laboratory, a été pris en charge par le Bureau de la science, Bureau du biologique et recherche sur l'environnement, du Département américain de l'Énergie sous contrat DE-AC02-05CH11231.
matériels
| Name | Company | Catalog Number | Comments |
| Name of Material/Equipment | Company | Catalog number | Comments |
| HisTrapFF column (Ni-Sepharose column) | GE Lfe Sciences, Pittsburgh, PA, USA | 17-5255-01 | |
| Akta explorer (FPLC instrument) | GE Lfe Sciences, Pittsburgh, PA, USA | ||
| HiPrep 26/10 Desalting column | GE Lfe Sciences, Pittsburgh, PA, USA | 17-5087-01 | |
| Qiaquick Gel extraction kit | Qiagen Inc, Valencia, CA, USA | 28704 | |
| Biotin-labeled oligonucleotides | Integrated DNA Technologies | N/A | |
| 6% polyacrylamide-0.5X TBE precast mini DNA retardation gel | Life Technologies, Grand Island, NY, USA | EC63652BOX | Alternately, you can pour your own gel. |
| Nylon membrane | EMD Millipore, Billerica, MA, USA | INYC00010 | |
| Trans-Blot SD Semi-dry electrophoretic transfer cell | Biorad, Hercules, CA, USA | 170-3940 | |
| Extra thick blot paper, 8 x 13.5 cm | Biorad, Hercules, CA, USA | 170-3967 | |
| UV crosslinker Model XL-1000 | Fisher Scientific | 11-992-89 | |
| Nucleic Acid chemiluminescent detection kit (Pierce) | Thermo fisher Scientific, Rockford, IL, USA | 89880 | |
| Ni-NTA agarose resin | Qiagen Inc, Valencia, CA, USA | 30210 | |
| GenomePlex Whole genome amplification kit (Fragmentation buffer, library preparation buffer, library stabilization solution, library preparation enzyme, 10X amplification master mix, WGA polymerase ) | Sigma-Aldrich, St. Louis, MO, USA | WGA2-50RXN | |
| Nanodrop ND-1000 | Thermo Scientific, Wilmington, DE, USA | For quantitation of DNA | |
| Perfecta Sybr Green SuperMix, with ROX | Quanta biosciences | 95055-500 | Any Sybr Green PCR mix may be used |
| PlateMax Ultra clear heat sealing film for qPCR | Axygen | ||
| 96 well clear low profile PCR microplate | Life Technologies, Grand Island, NY, USA | PCR-96-LP-AB-C | |
| Applied Biosystems StepOne Plus Real time PCR system | Life Technologies, Grand Island, NY, USA | 4376600 | Any real time PCR system may be used |
| Qiaquick PCR purification kit | Qiagen Inc, Valencia, CA, USA | 28104 | Any PCR clean up kit may be used |
| Cy3/Cy5-labeled nonamers | Trilink biotechnologies, San Diego, CA, USA | N46-0001, N46-0002 | |
| Klenow polymerase 50,000U/ml, 3'-5' exo- | New England Biolabs, Ipswich, MA | M0212M | |
| Hybridization system | Roche-Nimblegen, Madison, WI, USA | N/A | This company no longer makes arrays or related items, so alternate sources such as Agilent or Affymetrix will need to be used, |
| Custom printed microarrays and mixers | Roche-Nimblegen, Madison, WI, USA | N/A | |
| Hybridization kit (2X Hybridization buffer, Hybridization component A, Alignment oligo) | Roche-Nimblegen, Madison, WI, USA | N/A | |
| Wash buffer kit (10X Wash buffer I, II, III, 1 M DTT) | Roche-Nimblegen, Madison, WI, USA | N/A | |
| GenePix 4200A microarray scanner | Molecular Devices, Sunnyvale CA, USA | This model has been replaced by superior ones | |
| GenePix Pro microarray software | Molecular Devices, Sunnyvale CA, USA | ||
| Nimblescan v.2.4, ChIP-chip analysis software | Roche-Nimblegen, Madison, WI, USA | N/A | |
Références
- Galperin, M. Y. Diversity of structure and function of response regulator output domains. Curr Opin Microbiol. 13, 150-159 (2010).
- Casino, P., Rubio, V., Marina, A. The mechanism of signal transduction by two-component systems. Curr Opin Struct Biol. 20, 763-771 (2010).
- Aparicio, O., Geisberg, J. V., Struhl, K. Chromatin immunoprecipitation for determining the association of proteins with specific genomic sequences in vivo. Curr Protoc Cell Biol. 17 (17), (2004).
- McCleary, W. R., Stock, J. B. Acetyl phosphate and the activation of two-component response regulators. J Biol Chem. 269, 31567-31572 (1994).
- Novichkov, P. S., et al. RegPrecise web services interface: programmatic access to the transcriptional regulatory interactions in bacteria reconstructed by comparative genomics. Nucleic Acids Res. 40, 604-608 (2012).
- Studholme, D. J., Buck, M., Nixon, T. Identification of potential sigma(N)-dependent promoters in bacterial genomes. Microbiology. 146 (12), 3021-3023 (2000).
- Rajeev, L., et al. Systematic mapping of two component response regulators to gene targets in a model sulfate reducing bacterium. Genome Biol. 12, 99 (2011).
- Crooks, G. E., Hon, G., Chandonia, J. M., Brenner, S. E. WebLogo: a sequence logo generator. Genome Res. 14, 1188-1190 (2004).
- Barbieri, C. M., Mack, T. R., Robinson, V. L., Miller, M. T., Stock, A. M. Regulation of response regulator autophosphorylation through interdomain contacts. J Biol Chem. 285, 32325-32335 (2010).
- Bourret, R. B. Receiver domain structure and function in response regulator proteins. Curr Opin Microbiol. 13, 142-149 (2010).
- Gao, R., Stock, A. M. Molecular strategies for phosphorylation-mediated regulation of response regulator activity. Curr Opin Microbiol. 13, 160-167 (2010).
- Hung, D. C., et al. Oligomerization of the response regulator ComE from Streptococcus mutans is affected by phosphorylation. J Bacteriol. 194, 1127-1135 (2012).
- Ladds, J. C., et al. The response regulator Spo0A from Bacillus subtilis is efficiently phosphorylated in Escherichia coli. FEMS Microbiol Lett. 223, 153-157 (2003).
- Wen, Y., Feng, J., Scott, D. R., Marcus, E. A., Sachs, G. Involvement of the HP0165-HP0166 two-component system in expression of some acidic-pH-upregulated genes of Helicobacter pylori. J Bacteriol. 188, 1750-1761 (2006).
- Liu, X., Noll, D. M., Lieb, J. D., Clarke, N. D. DIP-chip: rapid and accurate determination of DNA-binding specificity. Genome Res. 15, 421-427 (2005).
- Gossett, A. J., Lieb, J. D. DNA Immunoprecipitation (DIP) for the Determination of DNA-Binding Specificity. CSH Protoc. 2008, (2008).
- Mascher, T., et al. The Streptococcus pneumoniae cia regulon: CiaR target sites and transcription profile analysis. J Bacteriol. 185, 60-70 (2003).
- Park, P. J. ChIP-seq: advantages and challenges of a maturing technology. Nat Rev Genet. 10, 669-680 (2009).
- Lefrancois, P., Zheng, W., Snyder, M. ChIP-Seq using high-throughput DNA sequencing for genome-wide identification of transcription factor binding sites. Methods Enzymol. 470, 77-104 (2010).
- Ho, J. W., et al. ChIP-chip versus ChIP-seq: lessons for experimental design and data analysis. BMC Genomics. 12, 134 (2011).
- Liu, X., Lee, C. K., Granek, J. A., Clarke, N. D., Lieb, J. D. Whole-genome comparison of Leu3 binding in vitro and in vivo reveals the importance of nucleosome occupancy in target site selection. Genome Res. 16, 1517-1528 (2006).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon