Bu içeriği görüntülemek için JoVE aboneliği gereklidir. Oturum açın veya ücretsiz deneme sürümünü başlatın.
Method Article
Floresan protein füzyonları üretilmesi
Bu Makalede
Özet
PCR aracılı gen modifikasyonu görselleştirme ve maya hücreleri ve proteinleri kantitatif kolaylaştırır Candida türleri, floresan protein füzyonları oluşturmak için de kullanılabilir. Bu yazıda, Candida parapsilosis bir floresan protein füzyon (Eno1-FP) oluşturmak için bir strateji sunmak.
Özet
Candida türleri, bağırsak ve genitoüriner yolun yaygın sömürgeciler, insanlarda invaziv fungal enfeksiyonların çoğunun nedenidir. Böylece, moleküler ve genetik araçlar Patogenezleri mekanizmalarının çalışmasını kolaylaştırmak için ihtiyaç vardır. PCR aracılı gen modifikasyonu da tespit edilmesi için epitop etiketli proteinlerin üretilmesi için basit ve hızlı bir yöntemdir. Özellikle, floresan proteini (FP) füzyonlar sırasıyla floresan mikroskopi ve immunoblotting, hem maya hücreleri ve protein görselleştirme ve kantitatif sağlayan güçlü araçlardır. Candida türleri dönüşümünü kolaylaştırır beslenme marker genleri ile birlikte, AP kodlama dizileri ihtiva eden plasmidler, Candida AP yapı ve ifade amacıyla oluşturulmuştur. Bu yazıda, bir Candida türlerinin bir AP füzyon oluşturmak için bir strateji sunmak. nourseothricin dayanıklı iş içeren plazmidlerya da yeşil, sarı, veya kiraz FP (GFP, YFP, MCherry) bir polimeraz zincir reaksiyonu (PCR) 'de gene özel sekansları içerir primerler ile birlikte kullanıldığı bir AP kaseti oluşturmak için dizilerin birlikte ım transformasyon işaretleyici gen (NAT1) . Bu gen spesifik kaseti, homolog rekombinasyon yoluyla, ilgili gen mahalinin 3'-ucuna entegre yeteneğine sahiptir. ilgi konusu gen lokusu içerisine AP dizisinin başarıyla çerçeve füzyonu mikroskopi ve / veya immüno-saptama yöntemleri ile füzyon proteini ifade analizi, ardından genetik doğrulanır. Buna ek olarak, yüksek ölçüde sentezlenen proteinlerin durum için başarılı füzyonlar flüoresan görüntüleme teknikleri ile öncelikli olarak taranabilir.
Giriş
Candida türleri bütün insanların bağırsak ve genitoüriner yolları kolonize ortakçı mantarlardır. Öyle ki erken doğum ya da kanser tedavilerinden immünsupresif etkileri ile ortaya gibi immün yetmezlik koşulları altında, Candida türleri fırsatçı patojenler olabilir. Candida türlerinin, Candida albicans en yaygın mantar kolonize olup invaziv mantar enfeksiyonlarının çoğunluğu neden olur. Böyle C. glabrata, C. parapsilosis, C. tropicalis, ve C. gibi diğer Candida türleri, bazı sergileyen içsel direnç, bağışıklık sistemi baskılanmış hastalarda ciddi enfeksiyonlara neden kruseii yaygın Dolayısıyla böyle flukonazol ve amfoterisin B gibi anti-mantar kullanılan antibiyotiklere bu türlerin bazı enfeksiyonları özellikle de anti-mantar maddeleri ile profilaktik olarak tedavi edilen hastalarda daha sık rastlanmaktadır. Hatta uygun ve zamanında a ilenti-mantar tedavisi, invaziv Candida enfeksiyonları önemli morbidite ve mortalite 1 ile ilişkili olmaya devam etmektedir. Çünkü İnsan sağlığı Candida türleri önemi, bunların patogenezi düzenekleri ve iyi açıklanması izin hazır moleküler araçlar için bir ihtiyaç vardır.
Araştırmacılar görselleştirmek ve mikrobiyal hücrelerin ve ifade proteinlerin ölçmek için olanak sağlayan bir önemli bir araçtır FP füzyon teknolojisidir. Polimeraz zincir reaksiyonu (PCR) aracılık ettiği gen modifikasyonu, bu yazıda tarif edildiği gibi AP dizileri ve genomik ilgilenilen sekansını kodlayan bir Candida proteini arasındaki füzyonlar yapımına izin verir. Yapının istikrarlı entegrasyon protein ifade analizinin yanı sıra protein yerelleştirme dinamikleri kolaylaştırır. AP dizilerini içeren plazmidler, Candida albicans içinde ekspresyon için optimize edilmiş ve PCR aracılı g kullanılabilenen modifikasyonu strateji, daha önce 2, 3, 4, 5, inşa edilmiştir. C. albicans, C. parapsilosis, 2, 3, 4, 5, 6, 7 tarafından tutulan bir besin marker genine bağlanmış bir AP sekansı: plazmidler AP dönüşüm "kaset" içerir. Şu anda mevcut plazmidler seçilebilir beslenme oksotrofik suşlarının transformasyonu için marker genleri (URA3, HIS1, ARG4) yanı sıra oksotrofilerinin yoksun klinik suşların dönüşmesini kolaylaştırmaktadır baskın bir ilâç rezistans markeri (NAT1), çeşitli içerir. Buna ek olarak, plazmidler yello dört farklı FP dizilerinin (yeşil [GFP], seçenekler içeriyor[YFP] W, mavi [CFP] ve kiraz [MCherry]) ve karboksi-termini, proteinin füzyonlarının inşa, veya amino-terminal protein füzyonları yapımı için bir promotör sekansı için bir ADH1 sonlandırma dizisi ya da. Primerler, AP kaseti çevreleyen plasmid DNA'sına homoloji ile tasarlanmıştır. Buna ek olarak, primerler ayrıca, homolog rekombinasyon (Şekil 1) aracılığı ile genomik lokusuna kaset tümlemeyi kolaylaştırır etiketlenecek olan maya geninin homoloji taşıyan 5'-uzantısı dizilerini ihtiva etmektedir. Gen spesifik AP kasetleri, PCR ile üretilen ve daha sonra, lityum asetat ile işlenmesi suretiyle DNA alımı için, yetkin hale getirilmiştir Candida hücrelerine transforme edilmiştir.

Şekil 1: FP dizisi füzyonları Candida türlerinin oluşturulur nasıl diyagramı. (A) plazmid DNA dahil olmakes bir AP dizisi ve direnç (NAT1) nourseothricin bir dizi kodlama. İleri (FWD) ve ters (REV) primerleri rölatif konumları plazmid dizisinin homoloji bölgesini gösteren primerler ve gene-özel homoloji bölgesini ya da primer uzaması gösteren mor kısımların siyah bölümleri ile gösterilir. (B) AP kasetleri Candida dönüştü ve homolog rekombinasyon (noktalı çizgiler) üzerinden ENO1 genomik içinde entegre edilmiştir. ENO1 3 'ucunda AP füzyon sekansı Elde edilen (C). Bu rakamın büyük halini görmek için lütfen buraya tıklayınız.
Bu yazıda, Candida türlerinin protein füzyon (Eno1-FP) yapıların bir örnek sunuyoruz. Biz GFP, YFP kodlayan diziler ile birlikte NAT1 dönüşüm işaretleyici geni içeren plazmidler etiketleme, ya da kullanmakMCherry (Şekil 2). Bu plazmidler, karboksi-terminalinde FPS kaynaşık Eno1 ekspresyonu ile sonuçlanan ENO1 3'-ucuna FP kaynaşmasını kolaylaştırmak gene özel kasetleri oluşturmak için PCR primerler ile birlikte kullanılmıştır.
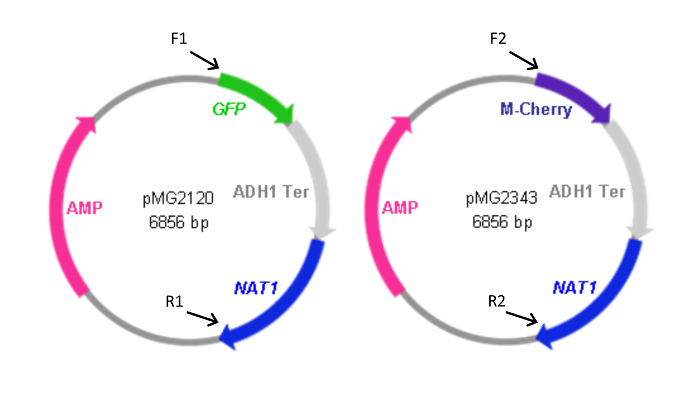
Şekil 2: FP kaset içeren plazmid Haritalar. İleri (F) ve plazmidlerden kasetleri oluşturmak için kullanılan geri (R) primerleri plazmidler kendi homoloji göreli konumu ile birlikte gösterilir. Tablo 1 'de gösterildiği gibi olan primer sekanslarıdır. F1 ve R1 de pYFP- NAT1 kasetini oluşturmak için kullanıldı. YFP- NAT1 kaseti (pMG2263) içeren plazmid, GFP dizisinin yerine YFP dışında pMG2120 aynıdır. Kaset boyutları: GFP-NAT1, 3.7 kbp; mCherry- NAT1, 3.2 kbp'lik; YFP- NAT1, 3.7 kbp. Bu rakam, Gerami-Nejad, ve ark modifiye edilmiştir. 4 Bu rakamın büyük halini görmek için lütfen buraya tıklayınız.
Protokol
E. coli 1. İzole Şablon Plazmidler
- Çalkalanarak 37 ° C'de 10 mi lizojeni etsuyu (LB) + 200 mg / l ampisilin (amp) 'de bir gece boyunca şablon plazmiti içeren E. coli büyütün.
- 2 dakika boyunca 6000 x g'de santrifüj Hasat hücreleri.
- , Sıvı boşaltacaktır izole etmek ve Ausubel ve diğerleri daha önce tarif edildiği gibi E. standart bir yöntemle coli hücreleri DNA saflaştırılması. 8.
- 50-100 ng / ml çalışma konsantrasyonunda Tris-EDTA (10 mM Tris, pH 8.0, 1 mM EDTA, pH 8.0 TE) içinde yeniden süspanse DNA.
2. Tasarım Astarlar
| astar boya | primer sekans |
| F1 | 5 ' GAGAATTGAAGAAGAGTTGGGAGACAATGCTATCTATGCTGGTAAGGACTTCCACAATGCTCAAACTTTG GGTGGTTCTAAAGGTGAAGAATTATT 3 ' |
| R1 | 5 'GAGCGTTTGCACCAACAGGCCATCATTTGTGACGAGAGAAGACCTGACGTCATTAGATTGGCACCTTTGC GTAAAACGACGGCCAGTGAATTC 3 ' |
| F2 | 5 'GAGAATTGAAGAAGAGTTGGGAGACAATGCTATCTATGCTGGTAAGGACTTCCACAATGCTCAAACTTTG GGTGGTGTTTCAAAAGGTGAAGAAGATAAT 3 ' |
| R2 | 5 'GAGCGTTTGCACCAACAGGCCATCATTTGTGACGAGAGAAGACCTGACGTCATTAGATTGGCACCTTTGC ACTGGATGGCGGCGTTAGTATC 3 ' |
Tablo 1: Bu çalışmada kullanılan astar dizilerini sıralamaktadır. Kalın, italik yazı ENO1 genomik homoloji gösterir, normal yazı tipi bölgeler DNA plazmid homologdur.
- Tasarım primerleri kaseti çevreleyen sekansları genin genomik rekombinasyonu kolaylaştıran ilgi konusu hedef gen (örn ENO1) 3'-ucuna ve amplifiye edilecek olan plazmid homolog olduğu (Şekil 2 ve Tablo 1) .
- İleri primer sekansları, son 70 baz çifti, ilgi konusu genin (bp), 5'-3 ', eksi durdurma kodonu eşleşen kodlama çerçevesini korumak için, ayrıca plazma dizinin ilk yaklaşık 30 bp olması emin olun yükseltilir. Not olarak, her bir primer olarak GGTGGTGGTT Resim AP homolojiye sahip bir poli-glisin bağlayıcıdır. Dikkat çekici bir şekilde, bir bağlayıcının yokluğunda, teorik olarak, protein yanlış katlanması, protein üretimi düşük verimle veya bozulmuş biyo yol fonksiyonel alan, doğrudan füzyonu olabilir.
- Ters primer diziler, genin 70 bp hemen alt emin olun 3'-5 ', herhangi bir gen sekansı, ayrıca, son bir yaklaşımı dahilximately plazmid kullanılan beslenme ya da ilaç direnci marker 30 bp.
- Kullanım F1 ve R1 pMG2343 ile mCherry- NAT1 oluşturmak için pMG2120 ve pMG2263 sırasıyla ve F2 ve R2 ile GFP- NAT1 ve YFP- NAT1 kasetleri üretir.
3. PCR ile FP kasetler oluşturun (Gün 1)
- PCR için reaktifler hazırlayın. 1.5 ml tüp aşağıdaki miktarlar ve konsantrasyonlarda eklenmesi ile ana karışımı (500 ul son hacim) sağlayın: 50 ul PCR tampon maddesi (500 mM potasyum klorür, su içinde 100 mM Tris pH 8.0), 20 ul deoksinükleotidler (dNTP, hazır karışımı, 10 mm), 40 ul 25 mM magnezyum klorür nükleotidlerin, 20 ul), 10 ul her ileri ve 10 mM stok çözeltilerinden primer (ters), 30 ul Taq ~ 50-100 ng / ul stok çözeltisinden plazmid (saflaştırılmıştır polimeraz (genel, 5000 birim / ml) ve 320 ul su.
- 10 PCR compatib her birine ana karışımı Kısım 50 ulle 0.5 ml tüpler.
- aşağıdaki adımları PCR PCR tüpleri yerleştirin ve çalıştırın: 1 devir dk 5 94 ° C'de dsDNA denatüre etmek; 94 ° C'de 45 saniye 40 döngü, ardışık olarak 55 ° C'de 30 saniye primerler plasmid şablonu DNA tavlanmasına izin verecek ve DNA ürünleri uzatılması için 68 ° C'de 4 dak; ve 72 ° C'de 15 dakika için 1 son uzatma döngüsü.
NOT: PCR master mix ve bisiklet parametreleri kullanılan özel Taq polimeraz dayalı modifiye edilmesi gerekebilir. - Havuz 1.5 ml tüp içinde 10 PCR reaksiyonları tüm ürünler.
- agaroz jel elektroforezine toplanmış PCR ürünü konusu 5 ul bir DNA merdiveni mukayesesine dayalı bir amplikon boyutunu doğrulamak ve ürün konsantrasyonunun tahmin elde edildi. Genel olarak, takip eden her bir dönüşüm karışımı kaseti DNA ~ 250 ug kullanımı.
- ürün 750 ul% 95 etanol ile, ardından 50 ul 3 M sodyum asetat eklenerek DNA hızlandırabilir ve en az 30 dakika süreyle inkübe-20 ° C'de
- 10 dakika boyunca 16.000 xg tüp santrifüj edilerek PCR ürünleri hasat. Dikkatle çıkarın ve süpernatantı atmak ve bir gecede pelet kurulayın. 40 ul TE pH 8.0 içinde kurutulmuştur DNA kasetinin pelletini ve kullanılana kadar oda sıcaklığında saklayın.
4. FP DNA kasetleri ile Candida Hücreler Transform
- 1. Günde, maya suşu geri adenin (İpad) agar ile maya Pepton Dekstroz üzerine bir kaç kazınmış kristaller çizgiler ile 30 ° C'de inkübe ile (-80 ° C), hazır dondurulmuş% 15 gliserol transforme edilecek. Koloni büyüme çıktıktan sonra, hava alabilir bir kap ile camdan yapılmış bir kültür tüp içinde 2 ml sıvı İpad ortam içine tek bir koloni inoküle ve ajitasyon ile 30 ° C 'de bir gece boyunca inkübe edilir.
- 2. günde, hava alabilir bir kapaklı 125 ml'lik bir Erlenmeyer şişesi içinde 50 ml (son OD 600 ~ 0.2), taze İpad gece boyunca maya kültürü 300 ul seyreltilir. 30 ° C 'de çalkalanır(nihai OD ~ 0.6-0.8 600) ~ 3 saat.
- 50 ml'lik konik tüp içine gecede kültür dökün ve bir masa üstü santrifüj 1 500 xg'de 5 dakika boyunca iplik pelet hücreleri.
- dökün ve düzgün süpernatant atın. 5 ml su içinde hücre pelletini. bir masa üstü santrifüjü içinde 1,500 xg'de 5 dakika boyunca yeniden santrifüjlenerek hücreler yeniden pelet.
- dökün ve düzgün süpernatant atın. 1.5 ml tüp aktarma sırasında 500 ul TELiAc (10 mM Tris, pH 8.0, 1 mM EDTA, pH 8.0, 0.1 M lityum asetat TE lityum asetat) 'de tekrar süspansiyon hücreleri. bir mikrosantrifüj içinde 3000 x g'de 2 dakika süre ile boru santrifüjleyin.
- 250 ul TELiAc yeniden süspanse hücreleri. pelet dahil toplam hacim ~ 300 ul olmalıdır.
- Temiz (4.2.4'te farklı mikrofüj tüpüne) için, 5 ul bir taşıyıcı DNA (10 mg / ml) ve (4.2.4 den) hazırlandı Candida hücrelerinin 150 ul ekle. Bu t negatif kontrolütransformasyonu.
- ikinci temiz bir mikrofüj tüpüne, denatüre bir taşıyıcı DNA 5 ul (yani, 10 dakika boyunca 90 ° C'de kaynatıldı ve 4 ° C'ye soğutulmuş), (3.3.1 arasında) hazırlanan PCR ürününün 40 ul ve 150 ekleme (4.2.4 den) hazırlandı Candida hücrelerinin ul.
- Oda sıcaklığında 30 dakika için iki transformasyon karışımları inkübe edin.
- Her bir dönüşüm karışımı tüp, 700 ul LEVHA karışımı (10 mM Tris, pH 8.0, 1 mM EDTA, pH 8.0,% 50 polietilen glikol 3350 içinde 0.1 M lityum asetat) ekleyin. karıştırın ve oda sıcaklığında gece boyunca inkübe Tüpler haricindekileri.
- Gün 3, dönüşüm 1 saat 42 ° C (ısı şoku) de karışımları kuluçkaya yatmaktadır.
- Santrifüj dönüşümü bir mikrosantrifüj 16.000 xg'de 30 sn karıştırır. Çıkarın ve düzgün süpernatant atın. hücrelere zarar vermemek üzere yavaşça pipetleme 150 ul su içinde hücre peletlerinin her yeniden süspanse edin ve.
- dönüşümler ut içinauxotrophic marker genleri (örneğin URA3) ilizing, uygun seçici ortam agara çözüm pipetle (örneğin eksik üridin) tarafından her bütün karışımı plaka ve eşit steril cam boncuklar kullanarak karışımı yayıldı.
- Burada tarif edildiği gibi nourseothricin direnç marker genini (NAT1) kullanılarak dönüşümleri için, levha dönüşümü seçici olmayan İpad agar üzerine ilk karışımları ve 6-12 saat boyunca 30 ° C'de inkübe edin. stres nourseothricin önce hücre kurtarma sonrası ısı şok Bu adım yardımcıları, uygulanır.
- Kısmi büyüme İyileştikten sonra, İpad üzerine kopya plaka Candida hücreleri, 400 ug / ml nourseothricin içeren. Beslenme marker genleri (örneğin, URA3) kullanılarak dönüşümler için, bu ara kaplama adımı gerekli değildir ve hücreler, 4.4.2 tarif edildiği gibi seçici bir maya ortamı (örneğin İpad yoksun üridin) üzerine kaplanabilir.
NOT: dönüşüm başarılı olursa, colonies bir ila üç gün içinde ortaya çıkar (potansiyel olarak nourseothricin içeren agar üzerinde seçim için büyümesinin beş gün kadar) gerekir. Hiçbir koloniler tek başına (negatif kontrol) taşıyıcı DNA içeren dönüşüm karışımları ile yayılan plakalar üzerinde görünmelidir.
- okzotrofik ve nourseothricin işaretçi seçimi, taze seçici ortam agar plakalarına tek koloniler olarak çizgi Putatif transformantlar ve FP füzyonlar kurulmasında taranabilir maya hücreleri yaymak için 30 ° C'de inkübe edin.
- Ekran transformantlar etiketleme kasetinin doğru entegrasyon (ayrıntılı örneğin Örnek sonuçlar). ilgi konusu genin yeterli miktarda ifade edilirse, bütün koloni floresans floresans saptama yeteneğine sahip bir plaka görüntüleme sistemi kullanılarak potansiyel aday entegranlarm tespit etmek mümkün olduğu gibi meydana gelebilir.
- PCR outsid dizileri ile homolog primerler kullanılarak varsayımsal entegranlarm Girişentegrasyon bölgesinin e hedef gen füzyonu teyit etmek için.
- Buna ek olarak, Batı füzyon proteininin ekspresyonu ve boyutunu belirlemek için benek analizi, hem de bilinen durumunda, protein lokalizasyonu görsel doğrulama için, tek hücre floresan mikroskobu düşünün.
Sonuçlar
Bir örnek olarak, bir C parapsilosis laboratuar suşunda Eno1 GFP ve MCherry füzyonları oluşturmak için yukarıda tarif edilen protokol kullanılmıştır. Her varsayımsal dönüştürücü ilk büyüme için tekrar boyandı edildi. Elde edilen füzyon proteini, yüksek (enolaz) olarak ifade edilir ve Çerçeve parlak olduğundan, bu örnekte, (Şekil 3) daha önceki tanı PCR gerçekleştirmeden floresan mikroskobu ile transformantların taranması mümk?...
Tartışmalar
Epitopa inşası, yukarıda tarif edilen PCR aracılı gen modifikasyonu stratejisi kullanılarak Candida türleri dizilerin üç aşamalı bir süreç olarak özetlenebilir etiketli. İlk olarak, kaset iki maya genomu içine sokulması lokusuna homolog bütünleşme ve bölgeler için istenen dizisini kodlayan PCR ile yapılır. İkinci olarak, transforme edilecek maya hücreleri lityum asetat ve kaset ile birlikte kuluçkaya kimyasal olarak yetkin yapılır. Üçüncü olarak, hücreler, transformantların ku...
Açıklamalar
Yazarlar ifşa hiçbir şey yok.
Teşekkürler
Biz orijinal MCherry FP dizisi sağlamak için N. Dean teşekkür M. Gerami-Nejad plasmidlerin yapımı için, bu projenin geliştirilmesi sırasında yararlı tavsiyeler için teknik yardım B. Larson ve T. Heisel. JB Avrupa Araştırma Konseyi İleri Ödülü 340.087 (RAPLODAPT) tarafından desteklenmiştir. Mikroskopi ve görüntüleme sistemleri Minnesota Pediatri Vakfı Üniversitesi ve Minnesota Görüntüleme Merkezi Üniversitesi tarafından sağlanmıştır.
Malzemeler
| Name | Company | Catalog Number | Comments |
| 100W mercury lamp | CHIU Technical Corporation | M-100T | |
| 95% Ethanol | Any | NA | |
| Adenine | Any | NA | |
| Ampicillin | Any | NA | |
| Carrier DNA | Ambion | AM9680 | Sheared Salmon Sperm DNA 10 mg/ml |
| CCD Camera | Photometrics | CoolSNAP HQ | |
| Conical Tube | Corning | 430828 | 50ml |
| Culture Tube Rotator | New Brunswick | 2013923 | TC-8, or Any Culture Tube Rotator |
| Deoxynucleotides (dNTP) PCR Grade | Any | NA | |
| Eppendorf Tubes | Eppendorf | 022363719, 022363212 | 0.5ml, 1.5ml |
| Erlenmeyer Flask | Fisher Scientific | 7250089 | 125ml |
| Ethylenediaminetetraacetic Acid (EDTA) | Any | NA | |
| Freezer (-80 °C ) | Thermo Electron Corporation | ULT-1386-9-V | Revco Ultima II |
| GFP, YFP and Texas Red Filter Sets | Chroma Technology Corporation | 49002, 86004v2, 49008 | |
| Glass culture tubes | Fisher Scientific | 1496126 | 75mm |
| HRP goat anti-mouse antibody | Santa Cruz Biotechnology | SC-2005 | |
| HRP goat anti-rabbit antibody | Santa Cruz Biotechnology | SC-2301 | |
| Incubator (30 °C ) | Any | NA | |
| Lithium Acetate | Any | NA | |
| Lysogeny Broth (LB) Media | Any | NA | |
| Magnesium Chloride | Any | NA | |
| Microcentrifuge | Eppendorf | 5415 D | |
| Microscope | Nikon | E600 | Nikon Eclipse E600 |
| Microscope Image Analysis Software | Universal Imaging Corporation | 6.3r7 | MetaMorph Software Series 6.3r7 |
| Mouse anti-GFP antibody | Roche | 11814460001 | |
| Nourseothricin | Fisher Scientific | 50997939 | |
| PCR Thermocycler | Applied Biosystems | 9700 | GeneAmp PCR System |
| PCR tubes | BioExpress, GeneMate | T-3035-1 | 0.2ml |
| Polyethylene Glycol 3350 | Any | NA | |
| Potassium Chloride | Any | NA | |
| Rabbit anti-mCherry antibody | BioVision | 5993-100 | |
| Refrigerator (4°C) | Any | NA | |
| Sodium Acetate | Any | NA | |
| Stereomicroscope | Nikon | SMZ1500 | |
| Table Top Centrifuge | Labnet | Z 400 | Hermle Z 400 |
| Taq DNA Polymerase | Any | NA | |
| Tris(hydroxymethyl)aminomethane (Tris) | Any | NA | |
| Vortex Mixer | Scientific Industries | SI-0236 | Vortex Genie 2 |
| Yeast Extract Peptone Dextrose (YPD) Media | Any | NA |
Referanslar
- Bendel, C. M. Colonization and epithelial adhesion in the pathogenesis of neonatal candidiasis. Semin. Perinatol. 27 (5), 357-364 (2003).
- Gerami-Nejad, M., Berman, J., Gale, C. A. Cassettes for PCR-mediated construction of green, yellow, and cyan fluorescent protein fusions in Candida albicans. Yeast. 18 (9), 859-864 (2001).
- Gerami-Nejad, M., Dulmage, K., Berman, J. Additional cassettes for epitope and fluorescent fusion proteins in Candida albicans. Yeast. 26 (7), 399-406 (2009).
- Gerami-Nejad, M., Forche, A., McClellan, M., Berman, J. Analysis of protein function in clinical C. albicans isolates. Yeast. 29 (8), 303-309 (2012).
- Gerami-Nejad, M., Hausauer, D., McClellan, M., Berman, J., Gale, C. Cassettes for the PCR-mediated construction of regulatable alleles in Candida albicans. Yeast. 21 (5), 429-436 (2004).
- Gonia, S., Larson, B., Gale, C. A. PCR-mediated gene modification strategy for construction of fluorescent protein fusions in Candida parapsilosis. Yeast. 33 (2), 63-69 (2016).
- Milne, S. W., Cheetham, J., Lloyd, D., Aves, S., Bates, S. Cassettes for PCR- mediated gene tagging in Candida albicans utilizing nourseothricin resistance. Yeast. 28 (12), 833-841 (2011).
- Ausubel, F. M., et al. . Current Protocols in Molecular Biology. , (1995).
- Wilson, R. B., Davis, D., Mitchell, A. P. Rapid hypothesis testing with Candida albicans through gene disruption with short homology regions. J. Bacteriol. 181 (6), 1868-1874 (1999).
- Pulver, R., et al. Rsr1 focuses Cdc42 activity at hyphal tips and promotes maintenance of hyphal development in Candida albicans. Eukaryotic Cell. 12 (4), 482-495 (2013).
- Falgier, C., et al. Candida species differ in their interactions with immature human gastrointestinal epithelial cells. Pediatr. Res. 69 (5), 384-389 (2011).
- Nosek, J., et al. Genetic manipulation of the pathogenic yeast Candida parapsilosis. Curr. Genet. 42 (1), 27-35 (2002).
- Zemanova, J., Nosek, J., Tomaska, L. High-efficiency transformation of the pathogenic yeast Candida parapsilosis. Curr. Genet. 45 (3), 183-186 (2004).
- Benjamin, D. K., et al. Neonatal candidiasis among extremely low birth weight infants: risk factors, mortality rates, and neurodevelopmental outcomes at 18 to 22 months. Pediatrics. 117 (1), 84-92 (2006).
- Kullberg, B. J., Arendrup, M. C. Invasive Candidiasis. N Engl J Med. 373 (15), 1445-1456 (2015).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır