Bu içeriği görüntülemek için JoVE aboneliği gereklidir. Oturum açın veya ücretsiz deneme sürümünü başlatın.
Method Article
Vitro Zigot polarizasyon, Live-hücre görüntüleme ve Arabidopsis thaliana embriyo desenlendirme için ovule ekimi
Bu Makalede
Özet
Bu el yazması Arabidopsis zigotları ve embriyo canlı hücre görüntüleme sağlar bir vitro ovule yetiştirme yöntemini açıklar. Bu yöntem sırasında zigot polarizasyon hücre içi dinamikleri ve gelişmekte olan embriyo hücre kader belirtimi görselleştirmek için kullanılmaktadır.
Özet
Çoğu çiçekli bitkiler, zigot ve embriyo anne dokuda derin gizlenir ve böylece uzun nasıl dinamik olarak geliştirmek bir gizem olmuştur; Örneğin, nasıl vücut eksen kurmak için zigot polarizes ve nasıl embriyo organ oluşumu sırasında çeşitli hücre kaderi belirtir. Bu el yazması bir vitro ovule kültür yöntemi zigotları ve embriyoların Arabidopsis thalianageliştirme canlı hücre görüntüleme gerçekleştirmek için açıklar. En iyi duruma getirilmiş ekimi orta zigotları veya erken embriyo bereketli bitkiler büyümek için izin verir. Poly(dimethylsiloxane) (PDMS) micropillar dizi aygıtı ile birleştirerek, ovule aynı konumda sıvı ortamda tutulur. Bu fiksasyon bir mikroskop altında aynı ovule geç embriyo aşamasına zygotic bölümden birkaç gün gözlemlemek çok önemlidir. Elde edilen canlı hücre görüntüleme zigot polarizasyon, nükleer geçiş ve sitoiskeleti düzenlenmesi ve aynı zamanda hücre bölünmesi zamanlama ve hücre kader belirtimi embriyo desenlendirme sırasında gibi gerçek zamanlı dinamikleri izlemek için kullanılabilir. Ayrıca, bu ovule yetiştirme sistemi çeşitli faktörlerin etkilerini embriyo gelişimini incelemek için önleyici tedaviler ile ve hücre-hücre iletişim rolü incelemek için lazer bozulma gibi optik manipülasyonlar ile birleştirilebilir.
Giriş
Bir organizmanın temel vücut planı tek hücreli bir zigot geliştirir. Çoğu çiçekli bitkilerde bir apikal ve ateş ve kök, sırasıyla1geliştirmek bir Bazal Hücre zygotic bölümü oluşturur. Bu nedenle, bitki vücut embriyogenez sırasında nasıl oluştuğunu anlamak önemlidir, ancak değil onlar derin çiçek geliştirmek çünkü doğrudan oturma zigotları ve embriyo dinamiklerini gözlemlemek için etkili bir araç olmuştur. Mısır ve pirinç, gibi birçok monocot türü bir vitro fertilizasyon yöntemi kurulan2,3olmuştur. Bu yöntemde, izole sperm ve yumurta hücreleri elektriksel olarak veya kimyasal olarak erimiş ve oluşturulan hücre bereketli bir bitki gelişebilir. Ancak, dicot bitkiler, uygun embriyolar, muhtemelen kadın ve erkek gamet4,5senkronize olmayan hücre döngüsü durumu nedeniyle üretebilir yok vitro fertilizasyon yöntemi yoktur. Buna ek olarak, embriyo çevreleyen doku (endosperm) embriyo gelişimi6' önemli rol oynar.
Bir modeli dicot tür, A. thaliana, vitro ekimi yöntemi embriyo ve endosperm7içeren tüm ovule üzerinde odaklanarak tarafından geliştirilmiştir. Bu sistem başarıyla embriyogenez çeşitli kimyasal reaktifler etkilerini çözümlemek için kullanılan, ancak düşük sağkalım oranı olduğundan zaman hata görüntüleme için uygun değildir. Bu nedenle, bir roman vitro ovule yetiştirme sistemi zigot sahne olarak erken başlamak ve yüksek oranı8bereketli bitkiler üretmek amacıyla geliştirilmiştir. Çeşitli denemeler sonra o Nitsch orta bulundu ve trehalose ovules8survival oranı önemli ölçüde geliştirilmiş. Buna ek olarak, bu büyür ve bu nedenle sık sık mikroskop gözlem alanı uzak taşır ovule genişletir çünkü PDMS aygıt ovule orta9' düzeltmek için geliştirilmiştir. PDMS aygıt bir zigot geliştirmeden kalp-sahne embriyo için izlemek yeterli için 3-4 gün, uzun vadeli görüntüleme etkin. Bu yöntemi kullanarak, zigot polarizasyon ve biçimlenme, sadece normal koşullar altında ama aynı zamanda kimyasal inhibitörleri varlığında veya çeşitli mutant arka planlar8,10 embriyo dinamiklerini görselleştirmek mümkün olur ,11.
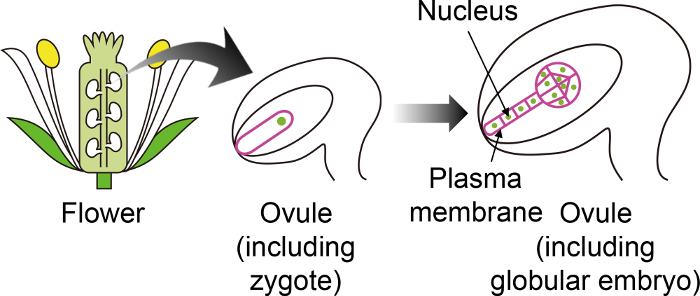
Resim 1: Belirli floresan zigotları görselleştirmek ve Ovule aracılığıyla embriyolar için kullanılan veri işaretleyicilerini şematik diyagramı.
Derin çiçek içinde oluşturulan ovule bir embriyo içine Arabidopsis zigot geliştirir. Bu vitro yetiştirme sisteminde zigot ve embriyo ile ovule gözlenir ve böylece diğer ovule dokularda ifade değil belirli floresan işaretçileri kullanmak önemlidir. Bu rakam daha büyük bir versiyonunu görüntülemek için buraya tıklayınız.
Protokol
1. hazırlık In Vitro Ovule kültür orta
- yapmak sıvı ortamı içinde vitro ovule kültür için (" N5T orta ") 1 x Nitsch Bazal tuz karışımı, %5 (w/v) trehalose dihydrate, 0,05 içeren % (w/v) 2-(N-morpholino) ethanesulfonic asit (MES)-KOH (pH 5,8) ve 1 x Gamborg ' s vitamini çözüm.
- KOH ile 5.8 için pH ayarlama.
- Orta (121 ° C, 20 dk) veya bir 0,22-µm filtresi filtre tarafından ısıyla sterilize.
Not: Steril orta için 2-3 ay 4 ° C'de saklanabilir.
2. PDMS Micropillar dizi aygıtı hazırlanması
- kesme bıçağı, jilet veya cam parçası bir 35 mm cam alt çanak (14 mm φ) sığacak şekilde makas PDMS micropillar aygıt.
Not: PDMS aygıt inşaat tam prosedürü önceki kağıtları 8 , 9 ' anlatılan ve böylece detayları burada göz ardı edilir. Cam-alt yemekleri, 4-şey veya 96-şey tabak gibi daha küçük birimler ile-ebilmek var olmak kullanılmış için aygıtı olmayan kısa vadeli düşsel. - Sterilize PDMS cihaz 15 dakika süreyle UV ışık altında üst tarafında
- Kare uç cımbız kullanarak tarafından PDMS aygıtı ve UV altında alt sterilize etmek 15 dk hafif devam.
- Steril PDMS aygıt bir 35 mm kültür kabına aktarmak ve cihazın tamamen orta (yaklaşık 5-7 mL) batırılmış kadar N5T orta ekleyin.
- Çanak vakum bir odaya koyun ve degas basıncı azaltmak. Cihazın havada medyum tarafından değiştirilene kadar gece 3 h için vakumlama devam.
Not: Cihaz hava kabarcıkları güçlü vakum altında tarafından müstakil. - Kare uç cımbız ile tutarak yemek aygıtı almak ve ekstra orta alt ve yan üzerinde kaldırmak için kağıt havlu koyarsın.
Not: Bu ovule ekimi için kullanılır çünkü micropillar dizi (üst yüzey) medyada tamamen kaldırılmaması gerekir. - Micropillar parçası olarak üst tarafı tutmak için sağlanması bir 76 mm x 26 mm slayt cam üzerine bu aygıtı ve 35 mm kültür çanak kapağı aşağıdaki ovule ayıklama sırasında kurumasını üzerinden orta önlemek için aygıtla kapak.
3. Silique diseksiyon ve Ovule çıkarma
- Sterilize iğne (0.40 mm G) ve iyi cımbız % 70 etanol ile silerek. İğne kolayca bir şırınga veya ahşap sopa ekleyerek ele.
- Bitki önümüzdeki kontrol ve deney için uygun siliques seçin. Yaklaşık 5 mm siliques zigotları içeren ve 8-10 mm siliques genç küresel embriyo içerir.
- Cımbız kullanarak siliques tüketim ve onları çift taraflı bant 76 x 26 mm slayt camına yerleştirin. Bir silique içeren hakkında 40-60 ovules ve 3-4 siliques (Yani, 120-240 ovules) bir aygıt için yeterlidir.
- Steril iğne ve bir stereomicroscope altında cımbız kullanarak içinde ovules görmek için silique (yumurtalık duvar) açın. Ovules hasar görmemiş sadece Over duvar kesti.
- (2,7 adımda hazırlanan) PDMS aygıtta N5T orta açılan silique transfer ve ovules orta iğne veya cımbız ile serbest.
- Ovules micropillar dizideki alanlarda içine itmek için PDMS cihazın üzerine küçük bir kapak bardak (18 x 18 mm) koymak.
- Cam yatay olarak ekstra orta kaldırmak için cımbız veya parmak kullanarak çekerek çıkar.
- PDMS aygıt ters çevirin, bir 35 mm cam alt çanak yerleştirin ve biraz cam sopa kare uç cımbız kullanarak basarak cihazın basın.
- Cam alt içine yavaşça dökün N5T orta çanağı PDMS cihazın tamamen ortamda batırılmış kadar orta şişe decanting ve parafin film ile çanak mühür.
Not: PDMS aygıtı geri dönüştürülmüş olabilir, ama çok eski aygıtları kolayca cam alttan ayrılır. Ayrıca, cihazın tamamen adım 2.5 degassed değil veya orta çok çabuk dökülür savrulabilir.
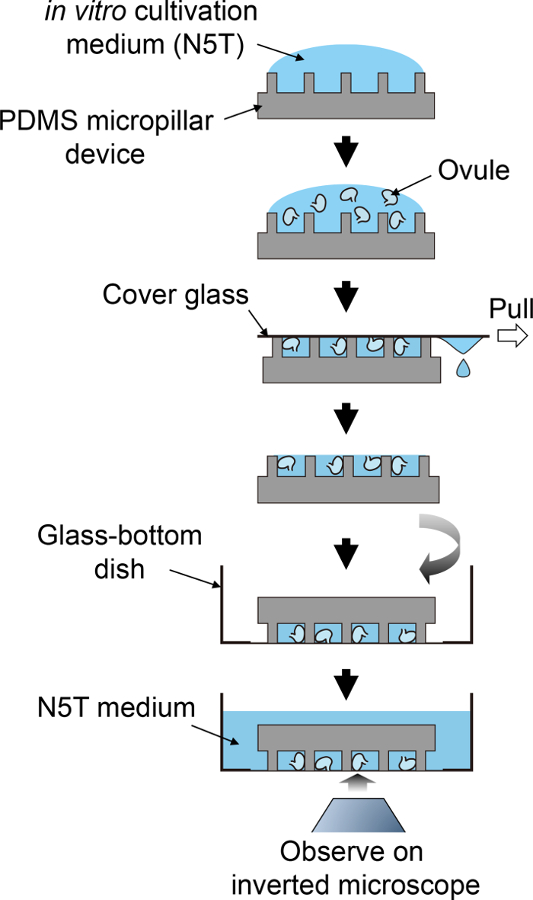
Resim 2: için numune hazırlama şematik yordam.
Bu şematik akış adımları 3.5 4.1 karşılık gelir. Bu rakam daha büyük bir versiyonunu görüntülemek için buraya tıklayınız.
4. time-lapse Imaging
- ters bir mikroskop 3.9 adımda hazırlanan cam alt çanak yerleştirin ve odaklanmak için uygun ovules seçin.
Not: sahne, pozisyon ve yönde ovules farklı olduğundan, uygun ovules onların işaret Floresans kontrol ederek bulunabilir. - Başlamak canlı görüntüleme üreticiye göre ' s yönergeleri mikroskop sistemi.
Not: Mikroskop ekipman ve parametreleri çeşitlidir ve böylece kullanıcılar için deneme amaçlı uygun uygun ayarları seçmeniz gerekir. Örneğin, Tablo 1 ' de bu el yazması kullanılan ayarları listelenir.
| ekipman/koyma | şekil 3 (A) ve tamamlayıcı Videolar 1 ve 4 | Şekil 3 (B) ve tamamlayıcı Video 2 | tamamlayıcı Video 3 |
| mikroskop | lazer tarama mikroskop (A1R MP) ters | dönen disk confocal ters mikroskop (CSU-W1) | Kutu-tip ters confocal mikroskop sistem istikrarlı kuluçka Odası (CV1000) ile |
| lazer | Ti:sapphire femtosecond pulse lazer | 488-nm ve 561-nm LD lazerler | 488-nm ve 561-nm LD lazer |
| O bjective lens | 40 X su-daldırma objektif lens (NA = 1,15) daldırma orta ile | 60 X silikon yağı daldırma objektif lens (NA 1,30 =), bir Piezo odak sürücüde takılı | 40 X objektif lens (NA = 0,95) |
| Algıla veya | dış descanned sigara GaAsP Devresel_ödeme dedektörü | EMCCD kamera | EMCCD kamera |
| Dichroic ayna | DM495 ve DM560 | DM488/561 | DM400-410/488/561 |
| filtre | bant geçiren Filtre; 520/35 nm ve 593/46 nm | bant geçiren Filtre; 520/50 nm ve 617/73 nm | |
| z ekseni boyunca dilim | 31 z-Baca'ya 1 µm aralıkları | 17 z-Baca'ya 3 µm Inter vals | 7 z-Baca'ya 5-µm aralıkları |
| zaman aralığı | 20 dk | 5 dk | 10 min |
Tablo 1: Mikroskop sistemleri ve bu el yazması kullanılan ayarları.
Parametreleri ve mikroskoplar çeşitlidir ve böylece her kullanıcı deney için uygun sistemi seçmelisiniz.
- elde edilen görüntü sırası kontrol ve .avi ya da .mov sunu için gibi genel film biçime dönüştürmek.
Not: belgili tanımlık mikroskop bilgisayar yazılımı görüntüleri bir film biçimi olarak çıktı olamaz eğer mümkün .tif görüntüleri kaydetmek ve sonra onları ImageJ, açık kaynaklı bir program tarafından NIH görüntü dosya türünü değiştirmek için ilham açın. ImageJ adlı sağlanır: https://imagej.nih.gov/ij/. ImageJ bir Z-s yapmak için de kullanılabilir.Film, maksimum yoğunluk projeksiyon gibi açıklandığı gibi tuck: https://imagej.net/Z-functions.
Sonuçlar
Bu ovule yetiştirme sistemi kullanarak, bu yöntem zigot polarizasyon ve embriyo desenlendirme yaşam dinamikleri izleyebilirsiniz. Daha önce yoktu çünkü gerçek zamanlı davranışı anne dokuda derin gizli olan zigot ve embriyo, görselleştirmek için hiçbir teknik bir başarı 's. Şekil 3A ve tamamlayıcı Video 1 genç zigot içinde mikrotübüller (MTs) subapical bölge10enine bir halka olarak birikir gös...
Tartışmalar
Bu el yazması zigotları ve embriyo geliştirme canlı hücre görüntülemede etkilidir bir basit vitro ovule ekimi protokol tanıttı.
PDMS aygıt tasarım optimizasyonu embriyo sahne göre gerekebilir. Bir microcage dizi yönlendirmesini ayarlamak için ve ovules9konumunu düzeltmek için ilk geliştirilen cihaz olduğunu ve o zaman micropillar aygıt ovules daha verimli bir şekilde yakalamak için inşa edilmiş8. Ayrıca, micropil...
Açıklamalar
Yazarlar ifşa gerek yok.
Teşekkürler
Bu çalışmada mikroskobu Enstitüsü, dönüştürücü biyo-molekülleri, (TEFE-ITbM) Nagoya Üniversitesi yapıldı ve Japonya gelişmiş bitki bilim şebeke tarafından desteklenmesi. Bu eser bilim promosyon için hibe Japonya bilim ve teknoloji Ajansı (ERATO T.H. ve M.U. projeye) ve Japonya toplum tarafından desteklenmiştir: yenilikçi alanlar ('ları üzerinde bilimsel araştırma için bir Grant-in-Aid JP24113514, JP26113710, JP15H05962 ve JP15H05955 M.U. ve Nos için. JP16H06465, JP16H06464 ve JP16K21727-T.H için), bir Grant-in-Aid genç bilim adamları (B, Nos. JP24770045 ve JP26840093 M.U. için) ve bir Grant-in-Aid zorlu araştırmacı araştırma (No. M.U. için JP16K14753).
Malzemeler
| Name | Company | Catalog Number | Comments |
| Nitsch basal salt mixture | Duchefa | N0223 | |
| trehalose dihydrate | Wako Pure Chemical | 206-18455 | |
| MES | Dojindo | 345-01625 | |
| Gamborg’s vitamin solution | Sigma-Aldrich | G1019 | |
| 35-mm glass-bottom dish | Matsunami Glass | D111300 | |
| 35 mm culture dish | Corning | 430588 | |
| PDMS | Dow Corning Co. | Sylgard184 | |
| 76 × 26 mm slide glass | Matsunami Glass | S1225 | |
| 18 × 18 mm slide glass | Matsunami Glass | C018181 | |
| needle (gauge 0.40 mm) | Terumo | NN-2719S | |
| Immersion medium Immersol W 2010 | Zeiss | 444969-0000-000 | |
| A1R MP | Nikon | A1RsiMP(1080) Ti-E-TIRF | |
| CSU-W1 | Yokogawa Electric | It is a customized equipment, and thus Catalog Number is not avairable. | |
| CV1000 | Yokogawa Electric | CV1000-SP84 |
Referanslar
- Natesh, S., Rau, M. A., Johri, B. M. . Embryology of Angiosperms. , 377-443 (1984).
- Kranz, E., Lorz, H. In vitro fertilisation of maize by single egg and sperm cell protoplast fusion mediated by high calcium and high pH. Zygote. 2 (2), 125-128 (1994).
- Uchiumi, T., Uemura, I., Okamoto, T. Establishment of an in vitro fertilization system in rice (Oryza sativa L.). Planta. 226 (3), 581-589 (2007).
- Sun, M. X., Moscatelli, A., Yang, H. Y., Cresti, M. In vitro double fertilization in Nicotiana tabacum (L.): the role of cell volume in cell fusion. Sex Plant Rep. 13 (4), 225-229 (2001).
- Tian, H. Q., Yuan, T., Russell, S. D. Relationship between double fertilization and the cell cycle in male and female gametes of tobacco. Sex Plant Rep. 17 (5), 243-252 (2004).
- Costa, L. M., et al. Central cell-derived peptides regulate early embryo patterning in flowering plants. Science. 344 (6180), 168-172 (2014).
- Sauer, M., Friml, J. In vitro culture of Arabidopsis embryos within their ovules. Plant J. 40 (5), 835-843 (2004).
- Gooh, K., et al. Live-cell imaging and optical manipulation of Arabidopsis early embryogenesis. Dev Cell. 34 (2), 242-251 (2015).
- Park, J., Kurihara, D., Higashiyama, T., Arata, H. Fabrication of microcage arrays to fix plant ovules for long-term live imaging and observation. Sens Act B-Chem. 191, 178-185 (2014).
- Kimata, Y., et al. Cytoskeleton dynamics control the first asymmetric cell division in Arabidopsis zygote. Proc Natl Acad Sci U S A. 113 (49), 14157-14162 (2016).
- Nambo, M., et al. Combination of Synthetic Chemistry and Live-Cell Imaging Identified a Rapid Cell Division Inhibitor in Tobacco and Arabidopsis thaliana. Plant Cell Physiol. 57 (11), 2255-2268 (2016).
- Mizuta, Y., Kurihara, D., Higashiyama, T. Two-photon imaging with longer wavelength excitation in intact Arabidopsis tissues. Protoplasma. 252 (5), 1231-1240 (2015).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiDaha Fazla Makale Keşfet
This article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır