Zum Anzeigen dieser Inhalte ist ein JoVE-Abonnement erforderlich. Melden Sie sich an oder starten Sie Ihre kostenlose Testversion.
Method Article
In-vitro- Ovulum Anbau für Live Cell Imaging der Zygote Polarisation und Embryo Musterung in Arabidopsis thaliana
In diesem Artikel
Zusammenfassung
Dieses Manuskript beschreibt eine in-vitro- Ovulum Anbaumethode, die live Cell Imaging von Arabidopsis Zygoten und Embryonen ermöglicht. Diese Methode wird genutzt, um die intrazellulären Dynamik während der Zygote Polarisation und die Zelle Schicksal Spezifikation bei der Entwicklung von Embryonen zu visualisieren.
Zusammenfassung
In den meisten Blütenpflanzen die Zygote und Embryo sind tief in das Gewebe der Mutter versteckt, und so es ist seit langem ein Rätsel wie sie dynamisch entwickeln; z. B. polarisiert wie die Zygote um Körperachse und wie der Embryo gibt verschiedene Zelle Schicksale während Orgel Bildung zu schaffen. Dieses Manuskript beschreibt eine in-vitro- Ovulum Kultur-Methode ausführen live Cell Imaging Zygoten und Embryonen von Arabidopsis Thalianazu entwickeln. Das optimierte Anbau Medium ermöglicht Zygoten oder frühen Embryonen bis zu fruchtbaren Pflanzen heranwachsen. Durch die Kombination mit einem poly(dimethylsiloxane) (PDMS) Micropillar Array Gerät, wird das Ovulum in das flüssige Medium in der gleichen Position gehalten. Diese Fixierung ist entscheidend für die gleichen Eizelle unter dem Mikroskop für mehrere Tage aus der zygotic Division Spätstadium Embryo zu beobachten. Das resultierende live-Cell Imaging kann verwendet werden, um die Echtzeit-Dynamik der Zygote Polarisation, wie nukleare Migration und Cytoskelett Neuordnung, und auch das Timing der Zellteilung und Zelle Schicksal Spezifikation beim Embryo Musterung zu überwachen. Darüber hinaus sind diese Ovulum Anbausystem mit Inhibitor Behandlungen, die Auswirkungen verschiedener Faktoren auf die Entwicklung des Embryos zu analysieren und mit optischen Manipulationen wie z. B. Laser-Unterbrechung, die Rolle der Zell-Zell-Kommunikation zu untersuchen kombinierbar.
Einleitung
Der Grundkörper Plan eines Organismus entwickelt sich aus einem einzelligen Zygote. Bei den meisten Blütenpflanzen erzeugt zygotic Division eine apikale und eine basale Zelle, die zu dem Shooting und Wurzel, bzw.1zu entwickeln. Daher ist es wichtig zu verstehen, wie der Pflanzenkörper in der Embryogenese gebildet wird, aber es wurde kein wirksames Instrument, um die Dynamik des lebendigen Zygoten und Embryonen direkt zu beobachten, weil sie tief in der Blüte entwickeln. Eine in-vitro- Befruchtung-Methode wurde in mehreren Monocot Arten, wie Mais und Reis etablierten2,3. Bei dieser Methode isolierten Spermien und Eizellen sind verschmolzen, elektrisch oder chemisch, und die generierten Zelle in eine fruchtbare Pflanze entwickeln kann. In Dicot Pflanzen ist jedoch keine in-vitro- Befruchtung Methode, die richtige Embryonen, vermutlich aufgrund der nicht synchronisierten Zellzyklus von männlichen und weiblichen Gameten4,5produzieren kann. Darüber hinaus spielt das Embryo umgebenden Gewebe (Endosperm) eine wichtige Rolle im Embryo Entwicklung6.
In einem Modell Dicot Arten, A. Thaliana, wurde eine in-vitro- Kultivierung Methode entwickelt, durch die Konzentration auf das ganze Ovulum, das den Embryo und Endosperm7enthält. Dieses System wurde erfolgreich verwendet, um die Auswirkungen der verschiedenen chemischen Reagenzien auf Embryogenese analysieren, aber es ist nicht geeignet für Zeitraffer-imaging, weil es eine geringe Überlebensrate hat. Daher wurde eine neuartige in-vitro- Ovulum Anbausystem entwickelt, um so früh wie die Zygote Bühne und fruchtbaren Pflanzen in einem hohen Verhältnis8zu produzieren. Nach verschiedenen Studien wurde festgestellt, dass Nitsch-Medium und Trehalose erheblich verbessert die Überlebensrate der Eizellen8. Da das Ovulum erweitert wird, wie es wächst und so häufig bewegt sich weg vom Feld der Beobachtung des Mikroskops, wurde darüber hinaus ein PDMS Gerät entwickelt, um das Ovulum im mittleren9zu beheben. Das PDMS-Gerät aktiviert die langfristige Imaging für 3-4 Tage, die ausreicht, um die Entwicklung von einer Zygote zu einem Herz-Bühne Embryo zu verfolgen. Mit dieser Methode wird es möglich, die Dynamik der Zygote Polarisation und Embryo-Strukturierung, nicht nur unter normalen Bedingungen, aber auch in Anwesenheit von chemische Inhibitoren oder in verschiedenen mutierten Hintergründe8,10 visualisieren ,11.
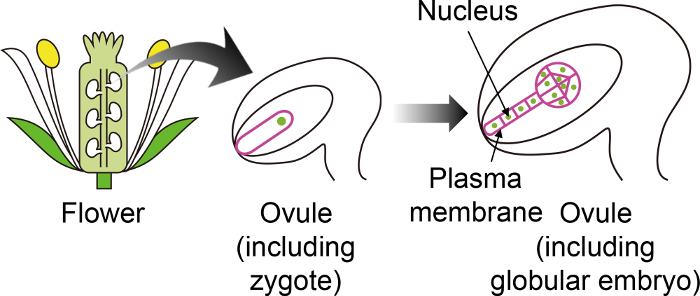
Abbildung 1: Schematische Darstellung der spezifischen fluoreszierenden Marker verwendet, um zu visualisieren Zygoten und Embryonen durch das Ovulum.
Die Arabidopsis Zygote entwickelt sich ein Embryo in das Ovulum, die tief im Inneren der Blume erzeugt wird. In dieser in-Vitro -Anbausystem der Zygote und Embryo durch das Ovulum eingehalten werden, und so ist es wichtig, bestimmte fluoreszierende Marker zu verwenden, die nicht in anderen Ovulum Geweben ausgedrückt werden. Klicken Sie bitte hier, um eine größere Version dieser Figur.
Protokoll
1. Vorbereitung des Kulturmediums In vitro- Ovulum
- machen das flüssige Medium für die in-vitro- Kultur von Ovulum (" N5T Medium ") mit 1 X Nitsch basale Salzgemisch, 5 % (w/V) Trehalose Dihydrat, 0,05 % (w/V) 2-(N-Morpholino) Ethanesulfonic Säure (MES)-KOH (pH-Wert 5,8), und 1 X Gamborg ' s Vitamin Lösung.
- Einstellen den pH-Wert 5,8 mit KOH.
- Sterilisieren dem Medium durch Autoklavieren (121 ° C, 20 min) oder durch einen 0,22-µm-Filter filtern.
Hinweis: Das sterilisierte Medium kann bei 4 ° C für ca. 2-3 Monate gespeichert werden.
2. Vorbereitung des Geräts PDMS Micropillar Array
- schneiden die PDMS Micropillar Gerät durch ein Messer, Schere, passen in das Glasteil (14 mm φ) ein 35 mm Glasboden Teller oder Rasierklinge.
Hinweis: Das gesamte Verfahren der PDMS-Gerätekonstruktion ist in früheren Papiere 8 , 9 beschrieben und somit die Details sind hier weggelassen. Glasboden Gerichte mit kleineren Stückzahlen, z. B. 4-Brunnen oder 96-Well-Platten, können für kurzfristige Bildgebung ohne das Gerät verwendet werden. - Sterilisation der Oberseite des Geräts PDMS unter UV-Licht für 15 min.
- PDMS Gerät durch quadratische Spitze Pinzette, und halten Sie es unter UV-Licht für 15 min auf die Unterseite zu sterilisieren.
- Übertragen die sterilisierte PDMS-Gerät in einer Kulturschale 35 mm und das N5T Medium hinzufügen, bis das Gerät vollständig in das Medium (ca. 5-7 mL) getränkt ist.
- Setzen Sie die Schale in eine Vakuumkammer und reduzieren Sie den Druck zu entgasen. Halten Sie für 3 h über Nacht, bis die Luft in das Gerät durch Medium ersetzt wird Staubsaugen.
Hinweis: Das Gerät kann durch Luftblasen unter einen starken Unterdruck abgenommen werden. - Bringen Sie das Gerät aus der Schale, indem Sie es mit einer Pinzette quadratische Spitze halten und legte es auf ein Papiertuch, das zusätzliche Medium auf der Seite und unten entfernen.
Hinweis: das Medium im Micropillar-Array (Oberseite) sollte nicht entfernt werden, da dies für das Ovulum Anbau verwendet werden. - Übertragen Sie das Gerät auf eine 76 mm x 26 mm Folie Glas, Gewährleistung den Micropillar Teil als die Oberseite zu halten und decken Sie das Gerät mit 35 mm Kultur Schale Deckel um das Medium vor dem Austrocknen während der folgenden Ovulum Extraktion zu verhindern.
3. Schote Dissektion und Ovulum Extraktion
- sterilisieren eine Nadel (0,40 mm G) und feinen Pinzette durch Abwischen mit 70 % Ethanol. Die Nadel ist leicht durch Anhängen an eine Spritze oder Holz-Stick behandelt.
- Der Blütenstand der Pflanze zu überprüfen, und wählen Sie die richtige Siliques für das Experiment. Die ca. 5 mm Siliques enthalten Zygoten, und 8-10 mm Siliques junge Kugelsternhaufen Embryonen.
- Verbrauchsteuern des Siliques mit Hilfe einer Pinzette und legen Sie sie auf doppelseitigem Klebeband auf das Glas der Folie 76 x 26 mm. Eine Schote enthält etwa 40-60 Samenanlagen und 3-4 Siliques (d. h. 120-240 Eizellen) sind ausreichend für ein Gerät.
- Öffnen Sie die Schote (Eierstock Wand) um zu sehen, die Eizellen im Inneren mit den sterilisierten Nadel und Pinzette unter einem Stereomikroskop. Nur die Eierstock Wand geschnitten, so dass die Eizellen nicht beschädigt werden.
- Übertragen die geöffneten Schote in das N5T Medium auf dem PDMS-Gerät (in Schritt 2.7 vorbereitet), und lassen Sie Ovula in das Medium mit der Nadel oder Pinzette.
- Setzen ein kleines Cover-Glas (18 x 18 mm) auf das PDMS-Gerät, drücken Sie die Eizellen in die Räume im Micropillar-Array.
- Das Deckglas abzunehmen, ziehen sie horizontal mit Fingern oder Pinzette, um zusätzliche Mittel zu entfernen.
- Der PDMS-Gerät umdrehen, legen Sie sie in eine 35 mm Glasboden Schale und leicht drücken Sie das Gerät durch Drücken der quadratische Spitze Pinzette, um es auf das Glas kleben.
- Pour N5T Medium sanft in den Glasboden Schale durch die mittlere Flasche umfüllen, bis das PDMS-Gerät komplett in das Medium eingeweicht wird, und versiegeln Sie die Schale mit Paraffin Film.
Hinweis: Das PDMS-Gerät kann recycelt werden, aber Geräte, die zu alt sind werden einfach losgelöst von den Glasboden. Darüber hinaus kann das Gerät schweben wenn es nicht völlig im Schritt 2.5 entgast ist oder das Medium ist zu schnell gegossen.
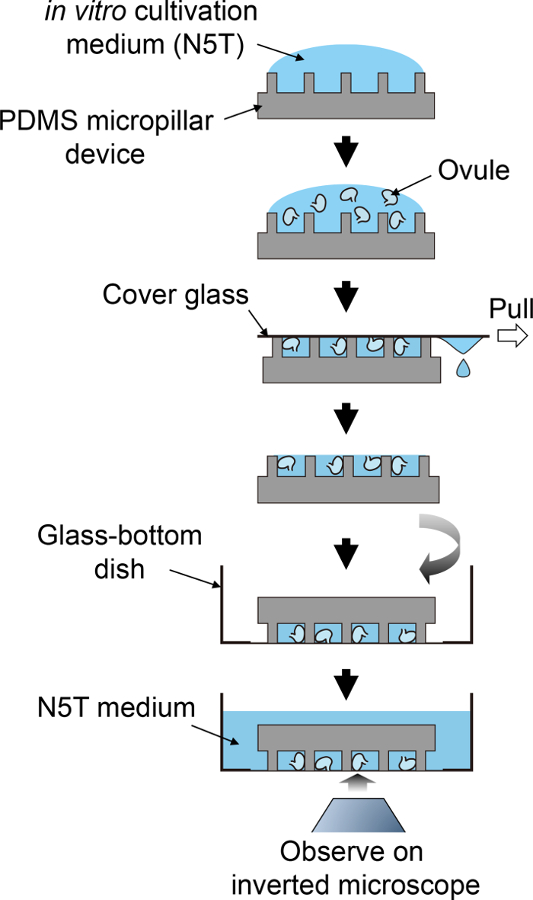
Abbildung 2: Schematische Vorgehensweise zur Probenaufbereitung.
Diese schematische Strömung entspricht Schritte 3,5 bis 4,1. Bitte klicken Sie hier für eine größere Version dieser Figur.
4. Time-Lapse Imaging
- die Glasboden Gericht, das vorbereitet wurde in Schritt 3,9 auf einem inversen Mikroskop, und wählen Sie geeignete Eizellen zu konzentrieren auf.
Hinweis: Da die Eizellen im Stadium, Position und Richtung variieren, geeignete Eizellen gefunden werden sollte durch die Überprüfung ihrer Marker Fluoreszenz. - Starten Sie den live-Imaging nach Angaben des Herstellers ' s Anweisungen des Mikroskops Systems.
Hinweis: Die Mikroskop-Ausrüstung und Parameter sind vielfältig, und so sollten die Benutzer wählen die richtigen Einstellungen, die dem Experiment Zweck passen. Als Beispiel, die Einstellungen in dieser Handschrift sind in Tabelle 1 aufgeführten.
| Ausstattung/Einstellung | Abbildung 3 (A) und ergänzende Videos 1 und 4 | Abbildung 3 (B) und ergänzende Video 2 | zusätzliche Video-3 |
| Mikroskop | Laserscanning - Mikroskop (A1R MP) invertiert | rotierende Festplatten konfokale inversen Mikroskop (CSU-W1) | kastenförmigen invertiert confocal Mikroskop-System mit einer stabilen Inkubation Kammer (CV1000) |
| Laser | Femtosekundenlaser Puls Exklusivrepräsentation | 488 nm und 561 nm LD Laser | 488 nm und 561 nm LD Laser |
| O Bjective Objektiv | 40 X Objektiv eintauchen in Wasser (NA = 1,15) mit Immersion Medium | 60 X Silikon-Öl-Immersion-Objektiv (NA = 1,30), montiert auf einem Piezo Fokustrieb | 40 X Objektiv (NA = 0,95) |
| erkennen oder | externen nicht descanned GaAsP PMT Detektor | EMCCD Kamera | EMCCD Kamera |
| dichroitischen spiegeln | DM495 und DM560 | DM488/561 | DM400-410/488/561 |
| Filter | Bandpass-Filter; 520/35 nm und 593/46 nm | Bandpass-Filter; 520/50 nm und 617/73 nm | |
| Scheibe Achse | 31 Z-Stapel mit Abständen von 1 µm | inter 17 Z-Stapel mit 3 µm Vals | 7 Z-Stapel mit Intervallen von 5 µm |
| Zeitintervall | 20 min | 5 min | 10 min |
Tabelle 1: die Mikroskopsysteme und Einstellungen in diesem Manuskript verwendet.
Die Mikroskope und Parameter sind vielfältig, und so sollte jeder Benutzer wählen das passende System für das Experiment.
- die erworbenen Bildsequenz zu überprüfen, und wandelt es in die allgemeine Film-Format wie AVI oder MOV für Präsentation.
Hinweis: Wenn die Mikroskop-Software die Bilder als Filmformat ausgeben kann, ist es möglich, die Bilder als TIF speichern und öffnen Sie sie dann in ImageJ, ein open Source Programm inspiriert von NIH Image, um den Dateityp zu ändern. ImageJ versehen ist: https://imagej.nih.gov/ij/. ImageJ kann auch verwendet werden, um ein Z-s zu machenFilm, wie die maximale Intensität Projektion, verstauen, wie beschrieben: https://imagej.net/Z-functions.
Ergebnisse
Durch die Verwendung dieser Ovulum Anbausystem, kann diese Methode die lebendige Dynamik der Zygote Polarisation und Embryo Musterung zurückverfolgen. Dies ist eine Leistung, denn bisher gab es keine Technik zu visualisieren das Echtzeitverhalten der Zygote und Embryo, die tief in das Gewebe der Mutter versteckt sind. Abbildung 3A und ergänzenden Video 1 zeigen, dass die Mikrotubuli (MTs) in die junge Zygote als transversale Ring in der sub...
Diskussion
Dieses Manuskript stellt eine einfachen in Vitro Ovulum Anbau-Protokoll, die effizient für den Einsatz in live Cell Imaging Zygoten und Embryonen zu entwickeln ist.
Das Design des Geräts PDMS ggf. Optimierung nach dem Embryonalstadium. Das erste entwickelte Gerät war ein Microcage Array die Ausrichtung anpassen und die Position der Eizellen9zu fixieren, und dann ein Micropillar Gerät wurde gebaut, um Eizellen effizienter trap8. Darü...
Offenlegungen
Die Autoren haben nichts preisgeben.
Danksagungen
Mikroskopie in dieser Arbeit wurde durchgeführt an das Institut der transformativen Biomoleküle (WPI-ITbM) der Universität Nagoya und von Japan Advanced Plant Science Network unterstützt. Diese Arbeit wurde unterstützt durch Zuschüsse von der Japan Science and Technology Agency (ERATO Projekt, t.h. und M.U.) und der Japan Society zur Förderung der Wissenschaften: eine Beihilfe für die wissenschaftliche Forschung an innovativen Bereichen (Nos. JP24113514, JP26113710, JP15H05962 und JP15H05955 für M.U. und Nos. JP16H06465, JP16H06464 und JP16K21727 für T.H), eine Beihilfe für den wissenschaftlichen Nachwuchs (B, Nos. JP24770045 und JP26840093 für M.U.), und eine Beihilfe für anspruchsvolle Pionierforschung (No. JP16K14753 für M.U.).
Materialien
| Name | Company | Catalog Number | Comments |
| Nitsch basal salt mixture | Duchefa | N0223 | |
| trehalose dihydrate | Wako Pure Chemical | 206-18455 | |
| MES | Dojindo | 345-01625 | |
| Gamborg’s vitamin solution | Sigma-Aldrich | G1019 | |
| 35-mm glass-bottom dish | Matsunami Glass | D111300 | |
| 35 mm culture dish | Corning | 430588 | |
| PDMS | Dow Corning Co. | Sylgard184 | |
| 76 × 26 mm slide glass | Matsunami Glass | S1225 | |
| 18 × 18 mm slide glass | Matsunami Glass | C018181 | |
| needle (gauge 0.40 mm) | Terumo | NN-2719S | |
| Immersion medium Immersol W 2010 | Zeiss | 444969-0000-000 | |
| A1R MP | Nikon | A1RsiMP(1080) Ti-E-TIRF | |
| CSU-W1 | Yokogawa Electric | It is a customized equipment, and thus Catalog Number is not avairable. | |
| CV1000 | Yokogawa Electric | CV1000-SP84 |
Referenzen
- Natesh, S., Rau, M. A., Johri, B. M. . Embryology of Angiosperms. , 377-443 (1984).
- Kranz, E., Lorz, H. In vitro fertilisation of maize by single egg and sperm cell protoplast fusion mediated by high calcium and high pH. Zygote. 2 (2), 125-128 (1994).
- Uchiumi, T., Uemura, I., Okamoto, T. Establishment of an in vitro fertilization system in rice (Oryza sativa L.). Planta. 226 (3), 581-589 (2007).
- Sun, M. X., Moscatelli, A., Yang, H. Y., Cresti, M. In vitro double fertilization in Nicotiana tabacum (L.): the role of cell volume in cell fusion. Sex Plant Rep. 13 (4), 225-229 (2001).
- Tian, H. Q., Yuan, T., Russell, S. D. Relationship between double fertilization and the cell cycle in male and female gametes of tobacco. Sex Plant Rep. 17 (5), 243-252 (2004).
- Costa, L. M., et al. Central cell-derived peptides regulate early embryo patterning in flowering plants. Science. 344 (6180), 168-172 (2014).
- Sauer, M., Friml, J. In vitro culture of Arabidopsis embryos within their ovules. Plant J. 40 (5), 835-843 (2004).
- Gooh, K., et al. Live-cell imaging and optical manipulation of Arabidopsis early embryogenesis. Dev Cell. 34 (2), 242-251 (2015).
- Park, J., Kurihara, D., Higashiyama, T., Arata, H. Fabrication of microcage arrays to fix plant ovules for long-term live imaging and observation. Sens Act B-Chem. 191, 178-185 (2014).
- Kimata, Y., et al. Cytoskeleton dynamics control the first asymmetric cell division in Arabidopsis zygote. Proc Natl Acad Sci U S A. 113 (49), 14157-14162 (2016).
- Nambo, M., et al. Combination of Synthetic Chemistry and Live-Cell Imaging Identified a Rapid Cell Division Inhibitor in Tobacco and Arabidopsis thaliana. Plant Cell Physiol. 57 (11), 2255-2268 (2016).
- Mizuta, Y., Kurihara, D., Higashiyama, T. Two-photon imaging with longer wavelength excitation in intact Arabidopsis tissues. Protoplasma. 252 (5), 1231-1240 (2015).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenWeitere Artikel entdecken
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten