Для просмотра этого контента требуется подписка на Jove Войдите в систему или начните бесплатную пробную версию.
Method Article
В пробирке Выращивания яйцеклетку для Live клеточной Imaging зигота поляризации и кучность эмбриона в проростках Arabidopsis thaliana
В этой статье
Резюме
Эта рукопись описывает в vitro яйцеклетку культивирования метод, который позволяет жить клеточной изображений Arabidopsis зигот и эмбрионов. Этот метод используется для визуализации внутриклеточных динамика во время зигота поляризации и спецификации судьбу клеток в развитии эмбрионов.
Аннотация
В большинстве цветковых растений зиготы и эмбриона скрыты глубоко в ткани мать, и таким образом уже давно тайна как они развиваются динамически; к примеру как зиготы поляризовывает установить оси тела и как зародыш указывает различные клетки судьбы во время формирования органа. Эта рукопись описывает в vitro яйцеклетку культуры метод для выполнения клеток изображений развивающихся зигот и эмбрионы Arabidopsis thaliana. Оптимизированный культивирования среднего позволяет зигот или ранних эмбрионов расти в плодородной растения. Объединив его с устройством массив micropillar анонсированный (PDMS), яйцеклетку проводится в жидкой среде в той же позиции. Это закрепление важно соблюдать же яйцеклетку под микроскопом на несколько дней для поздней стадии эмбриона в отделе zygotic. Результирующего изображения клеток может использоваться для мониторинга в реальном времени динамику зигота поляризации, например ядерных миграции и перегруппировки цитоскелета и также сроки деление клеток и спецификации судьбу клеток во время структурирования эмбриона. Кроме того эта система выращивания яйцеклетку может сочетаться с ингибитором лечения для анализа воздействия различных факторов на развитие эмбриона и оптических манипуляции как лазерная срыв для изучения роли связи ячеек.
Введение
Основной план организм развивается из одноклеточная зигота. В большинстве цветковых растений zygotic Отдел создает апикальной и базально-клеточный, развиться в корень, соответственно1и стрелять. Таким образом важно понять, как завод тела образуется во время эмбриогенеза, но не было эффективным инструментом непосредственно наблюдать динамику жизни зигот и эмбрионов, потому, что они развиваются в глубине цветка. В нескольких видов растения, например кукурузы и риса метод оплодотворение в пробирке был установленным2,3. В этом методе изолированные сперматозоиды и яйцеклетки сплавлены электрически или химически, и созданный клетки могут развиться в плодородной завод. Однако в нелигнифицированного растений, существует не в пробирке оплодотворение метод, который может производить надлежащее эмбрионов, предположительно из-за состояния синхронизированных клеточного цикла мужские и женские гаметы4,5. Кроме того эмбриона окружающих тканей (эндосперм) играет важную роль в развитии эмбриона6.
В модели нелигнифицированного видов, A. thaliana, был разработан метод культивирования в пробирке , сосредоточив внимание на весь яйцеклетку, которая содержит как зародыш, так и эндосперма7. Эта система успешно использовалась для анализа воздействия различных химических реагентов на эмбриогенеза, но это не подходит для покадровой изображений, потому что она имеет низкой выживаемости. Таким образом система выращивания яйцеклетку Роман в vitro была разработана для того, чтобы начать уже в стадии зиготы и производят плодородные растений на высокий коэффициент8. После различных испытаний было установлено, что средний Нитша и Трегалоза значительно улучшить выживаемость семяпочек8. Кроме того потому что яйцеклетку расширяется, как он растет и таким образом часто движется от области наблюдения микроскопа, устройство PDMS был разработан чтобы исправить яйцеклетку в средних9. PDMS устройство включено долгосрочное изображений для 3-4 дня, который является достаточно проследить развитие от зиготы до сердца стадии эмбриона. С помощью этого метода, он становится возможным для визуализации динамики зигота поляризации и эмбриона, кучность, не только при нормальных условиях, но также при наличии химических ингибиторов или в различных мутант стола8,10 ,11.
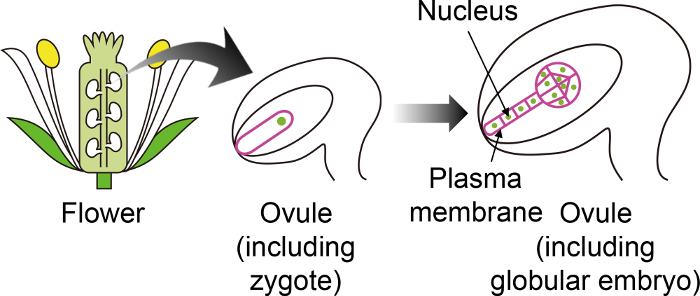
Рисунок 1: Схема конкретных флуоресцентных маркеров, используются для визуализации зигот и эмбрионы через яйцеклетку.
Arabidopsis зиготы развивается эмбрион в яйцеклетку, который генерируется глубоко внутри цветка. В выращивании этой в пробирке системе зиготы и эмбриона наблюдаются через яйцеклетку, и таким образом важно использовать конкретные флуоресцентные маркеры, которые не выражаются в других тканях яйцеклетку. Пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.
протокол
1. Подготовка In Vitro яйцеклетку культуры среднего
- сделать жидкой среды в лабораторных условиях культуры яйцеклетку (" N5T среднего ") содержащий 1 x Nitsch базальной соляной смеси, 5% (w/v) Трегалоза дигидрат, 0,05 % (w/v) 2-(N-Морфолино) ethanesulfonic кислота (МЧС)-Кох (рH 5,8) и 1 x Gamborg ' раствор витамина s.
- Настроить pH 5,8 с Кох.
- Стерилизации среды путем автоклавирования (121 ° C, 20 мин) или фильтрации через фильтр 0,22 мкм.
Примечание: Стерилизовать среды может храниться при температуре 4 ° C на 2-3 месяца.
2. Подготовка устройства массива PDMS Micropillar
- Вырезать PDMS устройство micropillar нож, лезвие или ножницы, чтобы вписаться в части стекла (14 mm φ) стекло дно тарелки 35 мм.
Примечание: Полное конструкции устройства PDMS описан в предыдущих документах 8 , 9, и таким образом детали опущены здесь. Стекло дно блюда с небольших объемах, например 4-ну или 96-луночных пластины, могут использоваться для краткосрочных изображений без устройства. - Стерилизируй-отпусти на верхней стороне PDMS устройства под УФ светом на 15 мин
- Устройство PDMS себя с помощью пинцета квадратный наконечник и держать его под УФ света на 15 минут, чтобы стерилизовать в нижней.
- Передача стерилизованные PDMS устройство в 35 мм культуры блюдо и добавить средне N5T до тех пор, пока устройство полностью замачивают в среде (примерно 5-7 мл).
- Блюдо в вакуумной камере и уменьшить давление Дега. Держать очистки для 3 h для ночевки до тех пор, пока воздух в устройство заменяется среднего.
Примечание: Устройство может быть отделен от пузырьков воздуха под сильный вакуум. - Взять устройство от блюдо, удерживая его с помощью пинцета, квадратный наконечник и положил его на бумажное полотенце, чтобы удалить дополнительное средство на боковой и нижней.
Примечание: средство на micropillar массиве (верхняя поверхность) не должны быть удалены, потому что это будет использоваться для выращивания яйцеклетку. - Передачи устройства на 76 мм x 26 мм слайд стакан, обеспечение держать часть micropillar как верхней части и охватывают устройство с 35 мм культуры блюдо крышкой для предотвращения среднего от пересыхания во время следующих извлечения яйцеклетку.
3. Стручок диссекции и яйцеклетку добыча
- стерилизовать иглы (0,40 мм G) и тонкой пинцет, вытирая с 70% этиловом спирте. Иглы легко обрабатывается путем присоединения его к шприц или дерева палкой.
- Соцветие растений и выберите надлежащий siliques для эксперимента. Примерно 5 мм siliques содержат зигот, и 8-10 мм siliques включают в себя молодых шаровидных эмбрионов.
- Акциз siliques с помощью пинцета и разместить их на двухсторонний скотч на стекле слайд 76 x 26 мм. Один стручок содержит около 40-60 яйцеклеток и 3-4 siliques (то есть, 120-240 яйцеклеток) достаточно для одного устройства.
- Открыть стручок (стенки завязи) чтобы увидеть семяпочек внутри с использованием стерилизованные иглы и пинцет под стереомикроскопом. Вырезать только стенки завязи, так что яйцеклетки не повреждены.
- Передача открыл стручок в средних N5T на устройстве PDMS (подготовленных на шаге 2.7) и выпустить семяпочек в среду с иглой или пинцет.
- Положить маленький стакан крышкой (18 x 18 мм) на устройство PDMS толкать семяпочек в пробелы в массиве micropillar.
- Снять крышку стекла, потянув ее по горизонтали с помощью пинцета или пальцев для удаления дополнительных среднего.
- Переверните устройство PDMS, поместите его в блюдо 35 мм стекло дно и слегка прижмите устройство нажатием с помощью пинцета квадратный наконечник придерживаться стекла.
- Среднего N5T залить мягко в стекло дно блюдо, переливание средних бутылку до тех пор, пока устройство PDMS полностью замачивают в среде и печатью блюдо пленкой парафин.
Примечание: Устройство PDMS могут быть переработаны, но устройства, которые являются слишком стар легко отсоединяются от стекла дно. Кроме того, устройство может плавать, если он не является полностью дегазации в шаг 2,5 или средство заливается слишком быстро.
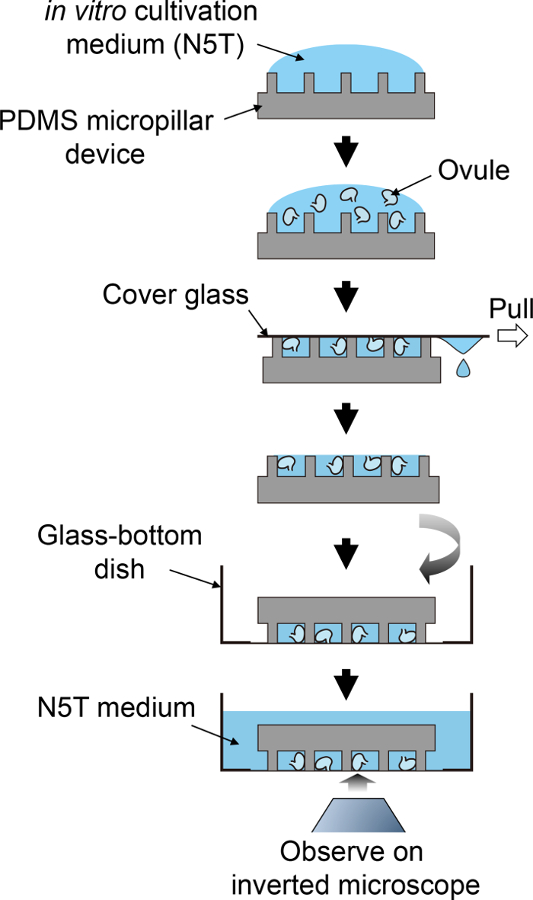
Рисунок 2: схема процедура пробоподготовки.
Эта схема потока соответствует шаги 3.5 до 4.1. пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.
4. time-lapse Imaging
- стекло дно блюдо, который был подготовлен в шаге 3,9 на инвертированным микроскопом и выбрать подходящих яйцеклеток сосредоточиться на.
Примечание: Поскольку семяпочек различаются в стадии, положение и направление, подходящих яйцеклеток должны найти путем проверки их маркер флуоресценции. - Начать жить изображений по заявлению производителя ' s инструкции системы микроскопа.
Примечание: Оборудование микроскопа и параметры разнообразны, и таким образом пользователи должны выбрать правильные настройки, которые подходят для этого эксперимента. Например, параметры, используемые в этой рукописи, перечислены в таблице 1.
| Рисунок 3 (A) и дополнительные видео 1 и 4 | Рисунок 3 (B) и дополнительные 2 видео | дополнительное видео 3 | |
| Микроскоп | лазерное сканирование инвертированным микроскопом (A1R МП) | спиннинг диск конфокальный инвертированным микроскопом (CSU-W1) | Тип коробки Перевернутый Конфокальный микроскоп система с камерой стабильной инкубации (CV1000) |
| лазер | титан-сапфировый лазер фемтосекундных импульсов | 488 нм и 561 Нм лазеры LD | 488 нм и 561 Нм лазер LD |
| O объектив bjective | 40 X объектив погружения в воду (NA = 1,15) с погружение средний | 60 X силиконовое масло погружения объектива (NA = 1.30), смонтированные на диске фокус пьезо | 40 X объектив (NA = 0,95) |
| обнаружить или | Внешние - descanned PMT Хаасп детектор | EMCCD камеры | камеры EMCCD |
| Дихроичные зеркало | DM495 и DM560 | DM488/561 | DM400-410/488/561 |
| Фильтр | полосовые фильтры; 520/35 Нм и 593/46 Нм | полосовые фильтры; 520/50 Нм и 617/73 Нм | |
| срез вдоль z | 31 z стеки с интервалами 1-мкм | Интер 17 z стеки с 3-мкм Вальс | 7 z стеки с интервалом 5-мкм |
| интервал | 20 мин | 5 мин | 10 мин |
в таблице 1: Микроскоп системы и параметры, используемые в этой рукописи.
Микроскопы и параметры разнообразны, и таким образом каждый пользователь должен выбрать подходящую систему для эксперимента,.
- проверить последовательность полученное изображение и преобразовать его в формат общего кино, такие как AVI или .mov для презентации.
Примечание: Если микроскоп программное обеспечение не может выводить изображения как формат фильма, его можно сохранить изображения как .tif и затем открыть их в ImageJ, открытым исходным кодом программы Вдохновленный NIH Image, чтобы изменить тип файла. ImageJ предоставляется на: https://imagej.nih.gov/ij/. ImageJ может также использоваться для Z-sукол фильмов, таких как проекция максимальной интенсивности, как описано в: https://imagej.net/Z-functions.
Результаты
С помощью этой системы выращивания яйцеклетку, этот метод можно проследить динамику жизни зигота поляризации и кучность эмбриона. Это достижение, потому что ранее было не технику для визуализации в реальном времени поведение зиготы и эмбрионов, которые скрыты глубок?...
Обсуждение
Эта рукопись представляет простой в vitro яйцеклетку культивирования протокол, который является эффективным для использования в живой клетки изображений развивающихся зигот и эмбрионов.
Дизайн PDMS устройства может потребоваться оптимизация согласно на стадии эмбри?...
Раскрытие информации
Авторы не имеют ничего сообщать.
Благодарности
Микроскопии в этой работе была проведена в Институт трансформативных био-молекул (WPI-ITbM) из Университета Нагоя и поддерживается сеть науки Японии расширенный завод. Эта работа была поддержана грантов от Японии науки и техники Агентство (ERATO проект т.г. и м.ю.) и от японского общества для содействия развитию науки: целевые субсидии для проведения научных исследований в инновационных областях (Nos. JP24113514, JP26113710, JP15H05962 и JP15H05955 м.ю., и Nos. JP16H06465, JP16H06464 и JP16K21727 для T.H), субсидий для молодых ученых (B, Н.у.к. JP24770045 и JP26840093 для м.ю.) и субсидий для сложных поисковых исследований (No. JP16K14753 для м.ю.).
Материалы
| Name | Company | Catalog Number | Comments |
| Nitsch basal salt mixture | Duchefa | N0223 | |
| trehalose dihydrate | Wako Pure Chemical | 206-18455 | |
| MES | Dojindo | 345-01625 | |
| Gamborg’s vitamin solution | Sigma-Aldrich | G1019 | |
| 35-mm glass-bottom dish | Matsunami Glass | D111300 | |
| 35 mm culture dish | Corning | 430588 | |
| PDMS | Dow Corning Co. | Sylgard184 | |
| 76 × 26 mm slide glass | Matsunami Glass | S1225 | |
| 18 × 18 mm slide glass | Matsunami Glass | C018181 | |
| needle (gauge 0.40 mm) | Terumo | NN-2719S | |
| Immersion medium Immersol W 2010 | Zeiss | 444969-0000-000 | |
| A1R MP | Nikon | A1RsiMP(1080) Ti-E-TIRF | |
| CSU-W1 | Yokogawa Electric | It is a customized equipment, and thus Catalog Number is not avairable. | |
| CV1000 | Yokogawa Electric | CV1000-SP84 |
Ссылки
- Natesh, S., Rau, M. A., Johri, B. M. . Embryology of Angiosperms. , 377-443 (1984).
- Kranz, E., Lorz, H. In vitro fertilisation of maize by single egg and sperm cell protoplast fusion mediated by high calcium and high pH. Zygote. 2 (2), 125-128 (1994).
- Uchiumi, T., Uemura, I., Okamoto, T. Establishment of an in vitro fertilization system in rice (Oryza sativa L.). Planta. 226 (3), 581-589 (2007).
- Sun, M. X., Moscatelli, A., Yang, H. Y., Cresti, M. In vitro double fertilization in Nicotiana tabacum (L.): the role of cell volume in cell fusion. Sex Plant Rep. 13 (4), 225-229 (2001).
- Tian, H. Q., Yuan, T., Russell, S. D. Relationship between double fertilization and the cell cycle in male and female gametes of tobacco. Sex Plant Rep. 17 (5), 243-252 (2004).
- Costa, L. M., et al. Central cell-derived peptides regulate early embryo patterning in flowering plants. Science. 344 (6180), 168-172 (2014).
- Sauer, M., Friml, J. In vitro culture of Arabidopsis embryos within their ovules. Plant J. 40 (5), 835-843 (2004).
- Gooh, K., et al. Live-cell imaging and optical manipulation of Arabidopsis early embryogenesis. Dev Cell. 34 (2), 242-251 (2015).
- Park, J., Kurihara, D., Higashiyama, T., Arata, H. Fabrication of microcage arrays to fix plant ovules for long-term live imaging and observation. Sens Act B-Chem. 191, 178-185 (2014).
- Kimata, Y., et al. Cytoskeleton dynamics control the first asymmetric cell division in Arabidopsis zygote. Proc Natl Acad Sci U S A. 113 (49), 14157-14162 (2016).
- Nambo, M., et al. Combination of Synthetic Chemistry and Live-Cell Imaging Identified a Rapid Cell Division Inhibitor in Tobacco and Arabidopsis thaliana. Plant Cell Physiol. 57 (11), 2255-2268 (2016).
- Mizuta, Y., Kurihara, D., Higashiyama, T. Two-photon imaging with longer wavelength excitation in intact Arabidopsis tissues. Protoplasma. 252 (5), 1231-1240 (2015).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены