Bu içeriği görüntülemek için JoVE aboneliği gereklidir. Oturum açın veya ücretsiz deneme sürümünü başlatın.
Method Article
Mikroorganizmaların düşük konsantrasyonlarda dijital holografik mikroskobu (DHM) kullanarak miktarının
Bu Makalede
Özet
Dijital holografik mikroskobu (DHM) görüntüleme örnekleri 50-100 X daha aydınlık alan mikroskobu karşılaştırılabilir çözünürlükte odaklanarak daha kalın gerçekleştirilen son işlem sağlar hacimsel bir tekniktir. Burada DHM tanımlamak için sayma, kullanılır ve mikroorganizmalar, çok izleme yoğunluğu düşük ve optik yoğunluk ölçümleri, plaka sayısı ve doğrudan sayısı ile karşılaştırıldığında.
Özet
Doğru tespit ve seyrek bakteriyel örnekleri sayma yiyecek, içecek ve ilaç işleme sanayi, birçok uygulamada tıbbi teşhis ve diğer gezegen ve uyduları güneş sisteminin robot görev tarafından hayatı algılama için vardır. Şu anda, seyrek bakteriyel örnekleri kültür kaplama veya epifluorescence mikroskobu tarafından dikkate alınır. Kültür plakaları gerektiren uzun kuluçka çarpı (gün hafta) ve epifluorescence mikroskobu geniş boyama ve örnek konsantrasyon gerektirir. Burada, eksen dışı dijital holografik mikroskobu (DHM) çok seyreltik kültürler (100-104 hücre/mL) bakterilerde numaralandırmak için nasıl kullanılacağını göstermektedir. İlk olarak, özel DHM inşası, bir düşük maliyetli araç oluşturma hakkında ayrıntılı yönergeler ile birlikte ele alınmıştır. Holografi prensipleri ele alınmıştır ve istatistiksel bir modelini ne kadar videoları gerekir tahmin etmek için kullanılan araç optik performans özellikleri ve bakteriyel çözüm (Tablo 2) konsantrasyonu dayalı hücreleri, algılamak için olmak . Hücreleri video algılama 10,5, 104, 103ve 100 hücre/mL un restore edilmiş hologram kullanarak gerçek zamanlı olarak gösterdi. Genlik ve faz görüntüleri yeniden inşası bir açık kaynak yazılım paketi kullanarak gösterilmiştir.
Giriş
Birçok uygulamada doğru bakteri sayıları çok seyreltik örneklerinde belirlenmesi önemlidir: birkaç örnektir: su ve gıda kalite analiz1,2,3; Kan, beyin omurilik sıvısı veya balgam4,5patojenler tespiti; eczacılık ürünleri, steril su6dahil olmak üzere üretim; ve çevre toplum analiz açık okyanus ve çökeller7,8,gibi9oligotrofik ortamlarda. Orada da mümkün kaybolmamış mikrobiyal yaşam Jüpiter ve Satürn, özellikle Europa10,11 ve Enceladus12,13, buzlu aylar tespiti ilgi artmaktadır 14, hangi yeraltı Sıvı okyanuslar var bilinmektedir. 1978 yılında Viking beri görev başka bir gezegende kaybolmamış hayat bulmaya çalıştı çünkü teknolojileri ve bakteriyel kimlik ve alan misyonlar15sırasında sayım için aygıtlar sınırlı gelişme oldu.
Plaka sayısı geleneksel yöntemlerle bulmak bir azınlık çevre suşları, türlerin bazen temsil edebilir yalnızca culturable hücreleri < %116. Plakalar zorlanma bağlı olarak en fazla başarı için günlerce ya da haftalarca, kuluçka gerektirir. Epifluorescence mikroskobu büyük ölçüde hızlı ve doğru mikrobiyal numaralandırma için altın standart olarak plaka sayar yerini aldı. Nükleik asitler için bağlama nükleik asit etiketleme floresan boyalar ' 4, 6-diamidino-2-phenylindole dihydrochloride (DAPI), SYBR yeşil veya akridin turuncu gibi kullanılan tipik boyalar17,18,19 vardır , birçok çalışma kullanın rağmen20,21,22,23,24Gram floresan göstergeleri imzalamak. Bu yöntemleri öncesi konsantrasyonu adımları olmadan kullanarak algılama (LoDs) sınırlarını ~ 105 hücre mL başına yol açar. LoD gelişmeler filtrasyon kullanarak mümkündür. Vakum filtre-bir membran, genellikle polikarbonat ve siyah arka plan azaltmak için ideal bir sıvı örneğidir. Yukarıda belirtilen DNA lekeleri doğrudan filtre25için uygulanabilir gibi düşük-arka plan boya. Doğru göz tarafından saymak, ~ 105 hücre başına örnekleri ~ 10 mL başına5 hücre daha seyreltik Yani filtresi, gerekli olan, önemli örnek birimleri toplanan ve filtre. Lazer tarama aygıtları sistematik filtresi bütün bölgeleri keşfetmek ve böylece hücre sayım için ~ 10 mL26başına2 hücre aşağı algılama sınırlarını zorlayan gerekli sayısını azaltmak için geliştirilmiştir. Ancak, bunlar çoğu laboratuvarlarda kullanılamaz ve bakteri ve enkaz değil gelişmiş donanım hem de yazılım parçacıklar gözlenen uzman onayı izin vardır gerektirir.
Başvuru için kan zehirlenmesi olan yetişkinler genellikle belirtiler, gösterilen başlar < 100 hücre/mL kan ve bebekler de < 10 hücre/mL. Bir yetişkin gelen kan alımı 10 mL, alır ve bir bebek, 1 mL. PCR temelli yöntemleri varlığı ile insan ve patojenik olmayan flora DNA ve kan27,28PCR inhibe bileşenlerinde tarafından inhibe. Ortaya çıkan teknikleri çeşitli rağmen kültürler kan dolaşımına enfeksiyonlar, özellikle içinde daha kırsal alanlarda ya da gelişmekte olan ülkelerden tanısında altın standart kalır. Diğer gezegenlerde hayat tespiti için termodinamik hesaplamalar hayat ve böylece beklenen olası Biyokütle enerji bütçesini tahmin edebilirsiniz. 1 - 100 hücre/mL Europa29tarihinde thermodynamically makul olması bekleniyor. O kolayca bu sayılardaki miktarda sulu çözüm hücrelerin çok küçük sayılar tespiti önemli bir çözülmemiş sorun olduğunu görülebilir.
Bu yazıda, biz 10 konsantrasyonlarda Serratia marcescens ve Shewanella Corynebacterium (vahşi tipi ve hareketli mutant) algılama göstermek5, 104, 103ve bir eksen dışı kullanarak 100 hücre/mL Dijital holografik mikroskop (DHM). Anahtar DHM geleneksel ışık mikroskobu üzerinde kalın numune hacmi yüksek çözünürlükte eşzamanlı görüntüleme avantajdır — bu uygulamasında örnek odası 0.8 mm kalınlığında oldu. Bu örnek odaları tolerans ± 50 µm ile yumuşak litografi, polydimethylsiloxane (PDMS) bir hassas işlenmiş alüminyum kalıp üzerinden tarafından inşa edildi. Bu yüksek güçlü ışık mikroskobu alan derinliği yaklaşık 100-fold bir iyileşme gösterir. DHM optik yol uzunluğu (Ürün kalınlığı ve Kırılma indisi) ölçülerini izin nicel faz bilgi de sağlar. DHM ve benzer teknikler bakteri ve Maya hücre döngüsü ve bakteriyel kuru kitle30,31,32hesaplanması izlemek için kullanılmıştır; saçılma farklılıklar bile bakteri suşları33ayırt etmek için kullanılır.
Kullandığımız enstrüman özel olarak daha önce yayımlanmış34,35, mikroorganizmalar ile kullanmak için özel olarak oluşturulmuş ve onun tasarım ve inşaat gösterdi ve tartışıldı. Sulu çözümler sürekli bir 0,25 µL birim örnek odasına şırınga pompa ile sağlanır; akış hızı tüm numune hacmi görüntüleme sağlamak için kamera kare hızı tarafından belirlenir. İstatistiksel bir hesaplama hücreleri belirli bir konsantrasyon, önemli sayıda algılamak için yansıma gerekir örnek birim sayısı öngörür.
Hücre algılama uygulamaları için hologram yeniden inşası genlik ve faz görüntüler içine gerekli değildi; analiz ham hologram üzerinde gerçekleştirildi. Bu önemli miktarda Hesaplamalı kaynak ve disk alanı kazandırır: 500 Mb hologram video 1-2 ne zaman yeniden Tb olacak. Ancak, biz yeniden inşası ile derinlik hologram istenen tür temsil onaylamak için örnek tartışıyorlar. Bir önemli DHM yoğunluğu ve faz görüntüleri izlemek için onun yetenek özelliğidir. Yoğunluk (gibi birçok biyolojik hücreleri) neredeyse şeffaf organizmalar açıkça aşamasında görünür. Etiket içermeyen bir teknik olduğu gibi hiçbir boyalar kullanılır. Bu bir birdvantage boyalar bir görev şartları sağ çıkamayız beri mümkün uzay uçuşu uygulamalar için ve — daha da önemlisi — DNA veya RNA kodlamak için kullanamazsınız dünya dışı canlılar ile çalışmak için kabul edilemez. Da Arktik ve Antarktika, nerede boyalar uzak konuma getirmek zor olabilir ve depolama düşebilir gibi aşırı ortamlarda çalışmak için bir avantajdır. Görüntüleri yeniden inşası aşamasında ve genlik üzerinde GitHub (şampuan) kullanılabilmesini sağladığınız bir açık kaynak yazılım paketi veya ImageJ kullanılarak gerçekleştirilir.
Protokol
1. büyüme ve bakteri numaralandırma
Not: Bu içinde uygun orta 36 büyüdü neredeyse herhangi bir bakteriyel zorlanma için geçerlidir. Bizim örneğimizde, biz üç suş kullanın: Serratia marcescens olarak bir ortak, kolay tanımlanabilir laboratuvar yük; ve daha küçük, son derece hareketli çevre zorlanma, Shewanella Corynebacterium Bay-1. Hafiye-in karşılaştırmak için hareketli hareketli olmayan hücreleri, hareketli Shewanella mutant, Δ vs. FlgM, ayrıca kullanılan karşılaştırma 37 için. Tüm suşların lysogeny suyu (LB) yetiştirilmektedir.
- Hazırla steril LB orta (distile su litre başına: 10 g bacto tryptone, 5 gr bacto Maya, 10 g NaCl; filtre veya basınçlı kap). Standart 100 mm çap LB-Ağar kaplamalar (aynı tarifi orta artı 15 g agar litre başına olarak; otoklav (121 ° C, 20 dk) sterilize ve soğuyunca yeterince işlemek için dökmek) hazırlayın. Buzdolabında saklamak orta ve plakalar.
- Bir gün önce deney tohum 5-6 mL " Master " doğru steril ve Biyogüvenlik tekniği kullanarak bir taze bakteriyel koloni kültür ortamından. ~ 12 h. kuluçka süresi zorlanma ve büyüme oranına bağlı olacaktır için bir shaker (120 rpm) 30 ° c üzerinde kuluçkaya. Bizim deneylerde Shewanella suşları için 12 saat inkübe; Ancak, Serratia kültür orta-Logaritmik büyüme sergileyen emin olmak için 8 saat sonra hasat edilir.
- Deneme, gün al bakteriyel spektrofotometrik okuma (OD 600) ana kültür, 0,6-0,7 aralığında olacağı tahmin edilmektedir. (Önceden belirlendiği gibi) Logaritmik büyüme aşamasında olması gerektiği. Değil, alt kültür 100 µL Eğer içine 5 mL orta ve orta log fazı hücre büyümesine izin.
- Ustanın bir örnek almak kültür ve doğrudan bir Petroff-Hausser sayma kullanarak Oda hücreleri saymak. Bu canlı ve ölü hücreleri Numaralandırılacak.
- Bir micropipette ve transfer odası içine su katılmamış kültür 10 µL örneği ayıklamak.
- Görüntü mikroskopla yüksek kuru objektif (40 X ya da 63 X, NA 0,7 - 0,8) faz kontrast kullanarak.
- Saymak en az 20 kareler ve ortalama bakteri.
Not: tamamen bir kare ve yalnızca çaprazlanarak üst ve sol sınırları (veya alt ve eğer sen tercih etmek değil, içinde) olan bakteri say. Kareler birkaç çizgilerle ayrılır, bir sınır olarak seçin.
Seyreltme faktörü x - Hesapla konsantrasyon ortalama olarak 20 kareler. Sayıları de konsantrasyonları için işe yaramazsa doğrudan Not < 10 7 / mL.
- Seri dilutions koloni oluşturan sayımı için kültür yapmak birimleri (CFU). Bu yalnızca canlı hücreleri Numaralandırılacak.
- Yapmak bir seri seyreltme her seçili bakteriyel örnekleri steril % 0,9 serum fizyolojik ile çözüm. Bakteriyel çözüm 20 µL aktarmak ve 180 µL serum sulandırmak. En düşük konsantrasyon ~ 10 3 hücre/mL gelene kadar bunu tekrarlayın.
- Al 100 µL en az iki dilutions önerilen 10 vardır 3 ve 10 4 /mL — ve plaka bir uygun sağlam medya plaka üzerinde. Steril bir ayırıcı ile yayıldı. Her seyreltme en az 3 çoğaltır gerçekleştirmek.
- , Bakteriler için uygun bir sıcaklıkta gecede veya koloniler büyümek kadar kuluçkaya.
- Saymak kolonileri ve birimleri (CFU) (# kolonileri seyreltme faktörü x) göre oluşturan colony hesaplamak / birim kaplama CFU/mL =. Ortalama CFU çoğaltır.
2. Son derece seyreltik örnekleri hazırlanması DHM için
- olun seri dilutions ustanın kültür DHM ve post-DHM saymak için koloni oluşturan birimler LB medya plakaları (bakınız 1.4.1 - 1.4.4). Kayıtları yapan kişinin konsantrasyon ölçülen her örnek habersiz olması bu çift-kör gerçekleştirmek.
- Seyreltik bakteri 10-15 mL (hangisi uygunsa) hareketliliği teşvik ama hücre bölünmesi, inhibe bir en az orta böylece hücre konsantrasyonu kayda değer deneme sırasında değişmez. Bu % 0,9 serum ya da daha özel bir hareketliliği ortam olabilir. Örneğin, Escherichia coli kullanıyorsanız, motilite orta EDTA 38 içermesi gerekir. Bu örnekler için % 0,9 serum fizyolojik kullanıyoruz.
3. DHM videoları kayıt
- steril bir Ģırınga kullanarak, Çek faiz seyreltme yaklaşık 10 mL.
- Bağlanmak şırınga steril bağlantı parçaları kullanarak ve boru DHM örnek odası için.
Not: Örnek enstrümanın optik yolundan tutarlı akışının izin için ısmarlama mikrosıvısal odası inşa edilmiştir. Daha fazla ayrıntı için sonuçlar bölümüne bakın. Deney öncesinde örnek odasının tüm bileşenleri tarafından ısıyla sterilize. - Akışı sürekli olarak bir şırınga pompa kullanarak örnek odası aracılığıyla şırıngadan örnek.
Not: Uygun akış oranları sıvı kanal boyutları, istenen işlem hacmi gibi veri alma sınırlamaları bağlı olarak değişir.
Örnek örnek odası akan gibi - hologram bir uygun kare hızında arka arkaya alın. Bir zaman damgası dosya daha sonra veri analizi (iletişim kuralı Bölüm 4) sırasında kullanılacak zaman her görüntünün hangi günlükleri yakalama oluşturulur. Ortam sıcaklığı (23 ° C), tüm hologramlar edinin. Kayıt hologramlar kamera üreticisi tarafından sağlanan önceden yazılı C++ yürütülebilir dosyayı yürüterek.
Not: Seçilen akış hızı bağlı olarak uygun kare hızları değişir. Bu deneme için bu bir bakteri görüntüsü şekilde bir kare hızı kullanmak için tavsiye edilir > 2 kez alet seyahat gibi ' s alan bakış. - Yeterli zaman tanımak için örnek DHM akan tüm 10 mL.
- Bakteri değil büyüyor veya deneyler sırasında ölen aşılamak sağlamak için medya plakaları 100 µL harcanan medya mesaj-DHM görüntü yakalama ile zenginleştirilmiş. Steril bir ayırıcı ile yayıldı ve uygun sıcaklığında 24 saat boyunca kuluçkaya; saymak kolonileri hediyesi.
4. Hücre yoğunluğu ve algılama sınırları hesaplanması
- ile alınan hologram videoları, bakteri varlığı için veri analiz.
- Zaman Serisi hologram olarak medyan piksel değeri hesaplamak sonra sabit hologram aktarımında ortadan kaldırmak için ilgili her pikseli medyan bu değerden çıkarmak. Bu ImageJ içinde aşağıdaki adımları uygulayarak yapılabilir:
- (resim-türü-32 bit) 32-gem-e dönüştürmek
- Calculate medyan (resim-yığın-Zproject-medyan)
- yığını (geri kalan orta çıkarma Process-ImageCalculator-Subtract)
- görünür havadar halkalar ve odaktaki hücreleri sayar el ile. ImageJ içinde bu noktaya aracıyla nesne gelerek yapılır.
- Hologramlar her dizi (hologram edinme anda kayıtlı) bir zaman damgası dosyası tarafından eşlik edecek. Kullanım örnek toplam miktarı pompalanır zaman görüntü hesaplamak için zaman damgası dosya yakalandı.
- Zaman Serisi hologram olarak medyan piksel değeri hesaplamak sonra sabit hologram aktarımında ortadan kaldırmak için ilgili her pikseli medyan bu değerden çıkarmak. Bu ImageJ içinde aşağıdaki adımları uygulayarak yapılabilir:
- Hücre hacmi yansıma örnek tarafından algılanan toplam sayısı bölünmesi ile hücre yoğunluğu hesaplamak. Doğru istatistikler için 5-10 kare ortalama.
5. Görüntü yeniden yapılmasına genlik ve faz
- Seç temsilcisi video çerçeve başına 10-200 hücreleri ile. Ham hologramlar (değil medyan düşülen) imar yazılım yük (örnekler: ImageJ sayısal yayma 39; ŞAMPUAN [GitHub]).
- Kullanarak ImageJ, OD sayısal yayma sayısal kırınım gidin.
- İsteminde gerçek veya sanal görüntü seçin ve herhangi bir sinüsoidal gürültü özellikleri ortadan kaldırmak bir Fourier maske çizim yapın.
- Yeniden genlik ve uygun z-adımları aşamasında yeniden yapılanma mesafe girerek.
- Ortanca 4.1.1 olduğu gibi gürültüyü azaltmak için genlik veri çıkarma.
- Çizim verisini bir 3D olarak küp veya yansıtıcı. Eklentileri gidin — Volume Viewer.
Sonuçlar
Sonuçları canlı ve ölü bakteriler DHM tarafından çok düşük seviyelerde algılama yeteneğini gösterir. Sayılan bakteri sayısı Petroff-Hauser sayım odası ve plaka sayıları kullanarak elde edilen sonuçlar ile tutarlı olması gerekir. Standart istatistiksel yöntemler farklı algılama yöntemleri çeşitli bakteri konsantrasyonlarda doğruluğu hakkında bilgi sağlar.
Şekil 1 Pet...
Tartışmalar
Hologram sayısal yeniden inşası: hologram sayısal yeniden inşası için açısal spektrum yöntemi (ASM) kullanılır. Bu hologram DHM için Green fonksiyonu ile evrişim içerir. Belgili tanımlık imge vasıl belirli bir odak düzlem karmaşık wavefront Fourier evrişim teoremi istihdam ederek aşağıdaki gibi hesaplanabilir:
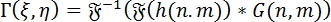 (1)
(1)
Nerede
Açıklamalar
Yazarlar ifşa gerek yok.
Teşekkürler
Yazarlar Gordon ve Betty Moore Vakfı Hibe 4037 ve bu eser finansmanı için California Institute of Technology için 4038 kabul edersiniz.
Malzemeler
| Name | Company | Catalog Number | Comments |
| Bacto Yeast | BD Biosciences | 212750 | |
| Bacto Tryptone | BD Biosciences | 211705 | |
| Sodium chloride | Sigma-Aldrich | 7710 | Many options for purchase |
| Bacto Agar | BD Biosciences | 214010 | |
| 10 cm Petri dishes | VWR | 10053-704 | |
| 15 mL culture tubes | Falcon (Corning Life Sciences) | 352002 | Loose-capped |
| Petroff-Hauser chamber | Electron Microscopy Sciences | 3920 | |
| 10 mL syringes | BD Biosciences | 309604 | Luer-Lok tip not necessary |
| Male Luer to 1/16” barbed fitting | McMaster-Carr | 51525K291 | |
| Autoclavable 1/16” ID PVC tubing for flow | Nalgene | 8000-0004 | Sold by length, purchase accordingly |
| Syringe pump | Harvard Apparatus | PHD 2000 | |
| Sample Chamber | Custom | n/a | See Materials Section |
| Holographic Microscope | Custom | n/a | See Wallace et al. |
| Open-source software | Custom | https://github.com/bmorris3/shampoo |
Referanslar
- Akineden, O., Weirich, S., Abdulmawjood, A., Failing, K., Buelte, M. Application of a Fluorescence Microscopy Technique for Detecting Viable Mycobacterium avium ssp. paratuberculosis Cells in Milk. Food Anal. Methods. 8, 499-506 (2015).
- Deibl, J., Paulsen, P., Bauer, F. Rapid enumeration of total aerobic microbial counts on meat and in meat products by means of the direct epifluorescence filter technique. Wien Tierarztl Monat. 85, 327-333 (1998).
- Huang, J., Li, Y., Slavik, M. F., Tao, Y., Huff, G. R. Identification and enumeration of Salmonella on sample slides of poultry carcass wash water using image analysis with fluorescent microscopy. Transactions of the Asae. 42, 267-273 (1999).
- Durtschi, J. D., et al. Increased sensitivity of bacterial detection in cerebrospinal fluid by fluorescent staining on low-fluorescence membrane filters. J Med Microbiol. 54, 843-850 (2005).
- Panicker, R. O., Soman, B., Saini, G., Rajan, J. A Review of Automatic Methods Based on Image Processing Techniques for Tuberculosis Detection from Microscopic Sputum Smear Images. J Med Syst. 40, (2016).
- Riepl, M., et al. Applicability of solid-phase cytometry and epifluorescence microscopy for rapid assessment of the microbiological quality of dialysis water. Nephrol Dial Transplant. 26, 3640-3645 (2011).
- Hwang, C. Y., Cho, B. C. Virus-infected bacteria in oligotrophic open waters of the East Sea, Korea. Aquat Microb Ecol. 30, 1-9 (2002).
- Kepner, R. L., Pratt, J. R. Use of Fluorochromes for Direct Enumeration of Total Bacteria in Environmental-Samples - Past and Present. Microbiol Rev. 58, 603-615 (1994).
- Queric, N. V., Soltwedel, T., Arntz, W. E. Application of a rapid direct viable count method to deep-sea sediment bacteria. J Microbiol Meth. 57, 351-367 (2004).
- Prieto-Ballesteros, O., Vorobyova, E., Parro, V., Rodriguez Manfredi, J. A., Gomez, F. Strategies for detection of putative life on Europa. Adv Space Res. 48, 678-688 (2011).
- Gleeson, D. F., et al. Biosignature Detection at an Arctic Analog to Europa. Astrobiology. 12, 135-150 (2012).
- Carr, C. E., Zuber, M. T., Ruvkun, G., Ieee, . 2013 Ieee Aerospace Conference IEEE Aerospace Conference Proceedings. , (2013).
- Konstantinidis, K., et al. A lander mission to probe subglacial water on Saturn's moon Enceladus for life. Acta Astronautica. 106, 63-89 (2015).
- McKay, C. P., Anbar, A. D., Porco, C., Tsou, P. Follow the Plume: The Habitability of Enceladus. Astrobiology. 14, 352-355 (2014).
- Hoover, R. B., Hoover, R. B., Levin, G. V., Rozanov, A. Y., Wickramasinghe, N. C. . Instruments, Methods, and Missions for Astrobiology Xvii. , (2015).
- Handelsman, J. Metagenomics: application of genomics to uncultured microorganisms. Microbiol Mol Biol Rev: MMBR. 68, 669-685 (2004).
- Lebaron, P., Parthuisot, N., Catala, P. Comparison of blue nucleic acid dyes for flow cytometric enumeration of bacteria in aquatic systems. Appl Environ Microbiol. 64, 1725-1730 (1998).
- Marie, D., Partensky, F., Jacquet, S., Vaulot, D. Enumeration and cell cycle analysis of natural populations of marine picoplankton by flow cytometry using the nucleic acid stain SYBR Green I. Appl Environ Microbiol. 63, 186-193 (1997).
- Noble, R. T., Fuhrman, J. A. Use of SYBR Green I for rapid epifluorescence counts of marine viruses and bacteria. Aquat Microb Ecol. 14, 113-118 (1998).
- Forster, S., Snape, J. R., Lappin-Scott, H. M., Porter, J. Simultaneous fluorescent gram staining and activity assessment of activated sludge bacteria. Appl Environ Microbiol. 68, 4772-4779 (2002).
- Lauer, B. A., Reller, L. B., Mirrett, S. Comparison Of Acridine-Orange And Gram Stains For Detection Of Microorganisms In Cerebrospinal-Fluid And Other Clinical Specimens. J Clin Microbiol. 14, 201-205 (1981).
- Mason, D. J., Shanmuganathan, S., Mortimer, F. C., Gant, V. A. A fluorescent gram stain for flow cytometry and epifluorescence microscopy. Appl Environ Microbiol. 64, 2681-2685 (1998).
- Saida, H., Ytow, N., Seki, H. Photometric application of the Gram stain method to characterize natural bacterial populations in aquatic environments. Appl Environ Microbiol. 64, 742-747 (1998).
- Sizemore, R. K., Caldwell, J. J., Kendrick, A. S. Alternate Gram Staining Technique Using A Fluorescent Lectin. Appl Environ Microbiol. 56, 2245-2247 (1990).
- Bitton, G., Dutton, R. J., Foran, J. A. New Rapid Technique For Counting Microorganisms Directly On Membrane Filters. Stain Technology. 58, 343-346 (1983).
- Broadaway, S. C., Barton, S. A., Pyle, B. H. Rapid staining and enumeration of small numbers of total bacteria in water by solid-phase laser cytometry. Appl Environ Microbiol. 69, 4272-4273 (2003).
- Yagupsky, P., Nolte, F. S. Quantitative aspects of septicemia. Clin Microbiol Rev. 3, 269-279 (1990).
- Kang, D. K., et al. Rapid detection of single bacteria in unprocessed blood using Integrated Comprehensive Droplet Digital Detection. Nat Commun. 5, 5427 (2014).
- Hand, K. P. . Report of the Europa Lander Science Definition Team. , (2017).
- Popescu, G., et al. Optical imaging of cell mass and growth dynamics. Am J Physiol-Cell Physiol. 295, C538-C544 (2008).
- Mir, M., et al. Optical measurement of cycle-dependent cell growth. Proc Natl Acad Sci U S A. 108, 13124-13129 (2011).
- Rappaz, B., et al. Noninvasive characterization of the fission yeast cell cycle by monitoring dry mass with digital holographic microscopy. J.Biomed Opt. 14, 034049 (2009).
- Jo, Y., et al. Label-free identification of individual bacteria using Fourier transform light scattering. Opt. Express. 23, 15792-15805 (2015).
- Wallace, J. K., et al. Robust, compact implementation of an off-axis digital holographic microscope. Opt. Express. 23, 17367-17378 (2015).
- Lindensmith, C. A., et al. A Submersible, Off-Axis Holographic Microscope for Detection of Microbial Motility and Morphology in Aqueous and Icy Environments. Plos One. 11, e0147700 (2016).
- Dumas, E. M., Ozenne, V., Mielke, R. E., Nadeau, J. L. Toxicity of CdTe Quantum Dots in Bacterial Strains. IEEE Trans. NanoBiosci. 8, 58-64 (2009).
- Frisk, A., Jyot, J., Arora, S. K., Ramphal, R. Identification and functional characterization of flgM, a gene encoding the anti-sigma 28 factor in Pseudomonas aeruginosa. J Bacteriol. 184, 1514-1521 (2002).
- Adler, J., Templeton, B. The effect of environmental conditions on the motility of Escherichia coli. Journal Gen Microbiol. 46, 175-184 (1967).
- Piedrahita-Quintero, P., Castaneda, R., Garcia-Sucerquia, J. Numerical wave propagation in Image J. Appl Opt. 54, 6410-6415 (2015).
- Schnars, U., Jüptner, W. P. Digital recording and numerical reconstruction of holograms. Meas. Sci. Technol. 13, R85 (2002).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır