Method Article
Ring Tipi E3 Ubiquitin Ligases In Vitro ve Planta Fonksiyonel Karakterizasyonu
Bu Makalede
Özet
Bu makalenin amacı, RING tipi E3 ubikitin ligaseskapsamlı biyokimyasal ve fonksiyonel çalışmalar için bir anahat sunmaktır. Ayrıntılı protokollere sahip bu çok aşamalı boru hattı, test edilen proteinin enzimatik aktivitesini doğrular ve aktivitenin işlevine nasıl bağdaştırılabildiğini gösterir.
Özet
Proteinlerin çeviri sonrası modifikasyonu olarak ubikitinasyon ökaryotik hücrelerin homeostazisinde önemli bir düzenleyici rol oynar. Poliubiquitin zincirinin uzunluğu na ve topolojisine bağlı olarak, 76 amino asit ubiquitin değiştiricinin hedef proteine kovalent bağlanması, protein yıkımından modifiye proteinin lokalizasyonundaki değişikliklere ve/veya aktivitesine kadar farklı sonuçlara yol açabilir. Üç enzim sırayla her yerde alevlenme sürecini katalizler: E1 ubikitin aktive edici enzim, E2 ubikitin konjuge enzim, ve E3 ubikitin ligaz. E3 ubiquitin ligaz substrat özgüllüğünü belirler ve bu nedenle çok ilginç bir çalışma konusunu temsil eder. Burada RING tipi E3 ubiquitin ligazEnzimatik aktivitesi ve fonksiyonu arasındaki ilişkiyi incelemek için kapsamlı bir yaklaşım salıyoruz. Bu dört adımlı protokol 1) korunan RING etki alanını hedefleyen site yönelimli mutagenez aracılığıyla bir E3 ligase eksik mutant oluşturmak için nasıl açıklar; 2-3) hem in vitro hem de planta'da ubikitinasyon aktivitesinin nasıl incelenir; 4) nasıl test edilen proteinin biyolojik önemi için bu biyokimyasal analiz bağlamak için. Hala substrat ı ile etkileşime girebilen ama bozulma için artık her yerde bulunan bir E3 ligaz-eksik mutantın üretimi, in vivo enzim-substrat etkileşimlerinin testini kolaylaştırır. Ayrıca, korunmuş RING etki alanında mutasyon genellikle bir RNA-girişim yaklaşımına alternatif bir yaklaşım olarak fonksiyonel nakavt çalışmalarda kullanılabilir baskın bir negatif fenotip confers. Yöntemlerimiz parazitizmi teşvik etmek için bitki hücrelerinde konak her yerde bulunan sistemi kaçıran bitki parazitik nematod efektörü RHA1B'nin biyolojik rolünü araştırmak için optimize edilmiştir. In vivo ekspresyon sisteminin hafif modifikasyonu ile bu protokol, kökenine bakılmaksızın herhangi bir HALKA tipi E3 ligase analizine uygulanabilir.
Giriş
E3 ubiquitin ligaseslerinin büyük çoğunluğu RING 'e aittir (Really Interesting New Gene)tipi proteinler. RING-finger etki alanı başlangıçta Freemont ve arktarafından tanımlanmıştır. 1 ve fonksiyonel protein-protein etkileşimi aracılık bir etki alanı olarak tanımlanan2. Kanonik HALKA parmağı, özellikle diğer amino asit kalıntıları (X), C-X2-C-X9–39 -C-X1-3-H-X2-3-C-H-X2-C-X4–48-C-X2-C -C -C-C ile özel olarak tanımlanan çinko koordinasyon alanının özel bir türüdür. İki Zn2+ iyonları c1/C2 ve C/H5/C6 ile benzersiz "çapraz ayraç" topolojisi ile çekirdek C ve H artıkları ile stabilize edilirken, C3/H4 ve C7/C8 ikinciyi bağlarken(Şekil 1A)3,4. Beşinci Zn2+-koordinasyon bölgesinde C veya H varlığına bağlı olarak, RING-parmak proteinlerinin iki kanonik alt sınıfı tanımlanmıştır: C3HC4 ve C3H2C3 (sırasıyla RING-HC ve RING-H2). E3 ubiquitin ligazın RING etki alanı E2 konjuge enzimler ve substratlar arasındaki etkileşime aracılık ettiği için, bu temel C ve H kalıntılarının mutasyonunun ligaz aktivitesini bozduğu gösterilmiştir5. RING E3 ligazlarının daha az beş daha az yaygın alt sınıfı tanımlanmıştır (RING-v, RING-C2, RING-D, RING-S/T ve RING-G)6. RING tipi E3 ubikitin ligases daha basit ve karmaşık E3 enzimleri ayrılabilir. Basit tek alt birim RING E3 ligases hem substrat tanıma sitesi ve E2 bağlayıcı RING etki alanı içerir. Buna karşılık, multisubunit RING tipi E3 kompleksi ya acemi substrat veya E2-ubikitin orta E3 kompleksine bağlama aracılık. Kendi kendine ubikitinasyon için birincil ubiquitin eki site (ler) olarak hizmet veren RING etki Alanı Lys kalıntı(lar) da E3 ligaz aktivitesi için önemli olabilir.
Tüm HALKA içeren proteinler E3 ligaz olarak işlev almaz. Bu nedenle, RING-parmak etki alanının biyoinformatik tahmini ve E2'ye bağımlı protein ubiquitination kapasitesi biyokimyasal olarak doğrulanmalı ve test edilen proteinin biyolojik rolüne bağlanmalıdır. Burada, ring tipi E3 ubiquitin ligaseslerinin enzimatik aktivitesinin hem in vitro hem de planta olarak, site yönelimli mutagenez yaklaşımı yla nasıl saptanacağını ve işlevsel olarak karakterize edeceğini zindan eden bir adım adım protokolü açıklıyoruz. Bu boru hattının temsilsonuçları RING tipi E3 ligase RHA1B için gösterilmiştir. RHA1B bitki bağışıklığını bastırmak ve bitki kök hücrelerinin morfolojisini manipüle etmek için parazitik kist nematod Globodera pallida tarafından üretilen bir efektör proteindir. Patojen/parazit istilasından korunmak için bitkiler, bir patojen veya parazitin varlığını tespit eden nükleotid bağlayıcı etki alanı ve lösin bakımından zengin tekrar (NB-LRR) tipi bağışıklık reseptörleri geliştirmiş ve bunun sonucu olarak, patojenlerin kolonizasyonunu tutuklamak için enfeksiyon bölgesinde meydana gelen hızlı ve lokalize hücre ölümünün bir formu olan aşırı duyarlı yanıtı (HR) geliştirmektedirler. Böyle bir bağışıklık reseptörü G. pallida bazı izole direnç confers patates Gpa2 proteinidir (alan popülasyonları D383 ve D372)7.
Sunulan protokolleri kullanarak, son zamanlarda RHA1B her yerde ve bozulma için bitki Gpa2 immünreseptör hedefleyerek bir E3 bağımlı bir şekilde bitki bağışıklık sinyali müdahale bulunmuştur8.
Protokol
1. Site yönelimli mutagenezi (Şekil 1)
- RING etki alanında korunmuş Cys ve Amino asitleri tanımlayın(Şekil 1A) ve mutasyon bölgesinin her iki tarafında 15 baz çifti ile çevrili ilgi ikame kodonu taşıyan tasarım astarları(Şekil 1B).
- Üreticiprotokolüne göre Tablo 1 ve Tablo 2'de gösterildiği gibi toplam PCR reaksiyon hacminin 50 μL'sinde Pfu içeren mutajenik astarlar ve yüksek sadakatli DNA polimeraz kullanılarak ilgi genini barındıran plazmidin PCR tabanlı amplifikasyonu ile istenilen mutasyonu tanıyın.
- Escherichia colitüretilmiş ebeveyn metillenmiş ve yarı metillenmiş DNA'yı doğrudan PCR reaksiyonuna 3 μL DpnI restriksiyon enzimi ekleyerek (adım 1.2) ve 37 °C'de 2 saat kuluçkaya yatırın.
NOT: Metilasyon, bakterilerden üretilen ve izole edilen plazmide eklenen posttranskripsiyonel protein modifikasyonudur. PCR tarafından oluşturulan plazmidin yeni kopyaları metilasyondan yoksun, bu nedenle DpnI tedavisi sırasında yeni kopyalar bozulmadan kalacaktır. - Spin kolon teknolojisine dayalı ticari bir DNA ekstraksiyon kiti kullanarak mutajenize plazmidleri arındırın ve 50°L su ile DNA'yı aşındırın.
- Dh5α E. coli kimyasal olarak yetkin hücreleri, kurtarılan mutajenize edilmiş plazmid DNA'sının 0,5 μL'si üreticinin protokolüne göre dönüştürün. Kısacası, 30 dakika boyunca buz üzerinde DNA ile yetkili hücreleri inkübate, sonra 42 °C'de 20 s ısı şok, ve 2 dakika boyunca buz üzerinde tekrar tüpler yerleştirin.
- E. coli'denizole edilen DNA plazmidlerini sıralamak için Sanger tarafından istenilen mutasyonu doğrulayın.
2. Rekombinant protein saflaştırma ve in vitro ubiquitination tsay
- PMAL-c2 vektörü içine ilgi vahşi tip RING ve mutasyona uğramış RING genleri klonlamak (üreticinin protokolü izleyin; Tablo 3) amilose rezorin kullanarak tek adımar saflaştırma yada mbp epitop etiketi ile bu genleri birleştirmek için. Adım 1.5'te açıklandığı gibi, ortaya çıkan yapıları E. coli BL21 suşuna tanıtın.
- Loariritmik faza (0.4-0.6'nın OD600'ü) ulaşana kadar 37 °C'de 50 mL LB sıvı ortamda istenilen yapıyı barındıran E. coli suşu BL21'i büyütün.
- MBP etiketli rekombinant proteinin infeksiyonu yapmak için 0.1-1 mM'lik son konsantrasyona IPTG ekleyin ve E. coli kültürünü 28 °C'de 2-3 saat kuluçkaya yatırın. Kuluçkadan sonra kültürü buza yerleştirin.
NOT: Proteinleri bozulmadan korumak için buz üzerinde 2.4-2.13 adımlarını gerçekleştirin. - İndüksiyon verimliliğini kontrol etmek için, 1,5 mL indüklenen hücre toplamak, 2 dakika için 13.000 x g onları aşağı spin, supernatant kaldırmak ve 2x SDS-PAGE yükleme tampon (24 mM Tris-HCl pH 6.8, 0.8% SDS, 10% SDS, 4 mM DTT, 0.04% (w /v) bromol mavisi) 20 μL hücreleri yeniden askıya.
- 5 dakika için örnekleri kaynatın ve% 10 SDS-PAGE jel üzerinde çalıştırın. MBP-füzyon proteininin (proteinin moleküler ağırlığı + 42,5 kDa MBP) birikmesini görsel olarak değerlendirmek için, Coomassie boyama tamponu (%50 metanol, %10 asetik asit, %0,1 Coomassie mavisi) ile ajitasyon yaparak jeli 20 dk ile lekelemek ve bir gecede destaining destaining tampon (%20 metanol, %10 asetik asit).
- Kalan E. coli hücrelerini 6 dk için 1.350 x g'de santrifüj le hasat edin, süpernatantı atın ve 5 mL kolon arabelleği (20 mM Tris HCl, 200 mM NaCl, 1 mM EDTA, bakteriyel proteeaseor) ile hücre peletini yeniden askıya alın.
NOT: Bu gece protokolü durdurmak için iyi bir yerdir. Dondurulmuş hücreler -20 °C'de 1 haftaya kadar saklanabilir. - Bir buz-su banyosunda bakteri içeren tüp yerleştirerek ve 10 sonication döngüleri uygulayarak E. coli hücreleri yıkmak: 10 s sonication% 30 amper ve 20 s tatili takip.
- 10 dk için 4 °C'de 13.000 x g centrifuge numunesi ve supernatant (ham ekstresi) kaydedin.
- 15 mL'lik bir tüpte 500 μL amilose reis hazırlayın. Reçineyi 10 mL soğuk kolon tamponu ekleyerek yıkayın ve 5 dk için 1.800 x g,4 °C'de santrifüj edin. Bunu 2x yap.
- Amylose reşin ile tüpe 5 mL ham ekstresi ekleyin ve gece boyunca 4 °C'de kuluçkaya yatırın.
- 4 °C'de 1800 x g'de 5 dk santrifüj edin ve süpernatantı atın.
- Reçine peletine 10 mL sütun arabelleği ekleyin ve 20 dakika kuluçkaya yatırın. Daha sonra 4 °C'de 1800 x g'da 5 dk. Bu adımı 2x tekrarlayın.
- 4 °C'de 2 saat bir numuneyi kuluçkaya yatırarak 10 mM maltoz içeren 0,5 mL kolon tamponu içeren füzyon proteinini ezle. Santrifüj 1.800 x g 4 °C için 5 dakika ve eluted protein toplamak. Bu adımı 2x tekrarlayın.
- Soğuk PBS'ye karşı protein fraksiyonunun 1 mL'sini diyalize sürün. Aliquot proteini tek kullanımlık tüplere (10-20 μL) donmayı önlemek için ve -80 °C'de ihtiyaç duyulana kadar saklayın.
- Bradford tsay9kullanarak protein konsantrasyonu ölçün.
- Toplam 30 μL'lik bir hacimde in vitro ubiquitination reaksiyonunu 40 ng E1 (örneğin, AtUBA1), 100 ng E2 (örneğin, AtUBC8, SlUBC1/4/6/7/12/13/17/20/22/27/32), 1 μg MBP-RING-ring tipi, protein tipi, 1 00 ng'yi karıştırarak ayarlayın ve ubikitinasyon tamponunda 2 μg FLAG-Ub (veya HA-Ub) (50 mM Tris-HCl pH 7.5, 2 mM ATP, 5 mM MgCl2, 30 mM kreatin fosfat, 50 g/mL kreatinin fosfokinaz). Karışımı 30 °C'de 2 saat kuluçkaya yatırın.
NOT: Premake 20x ubiquitination tampon ve tek bir kullanım için küçük aliquots -20 °C'de 6 aya kadar saklayın. Kreatin fosfokisinaz tampon çözülür ve tekrar tekrar dondurulmuş zaman kolayca enzimatik aktivitesini kaybeder. - 30 μL numuneyi 7,5 μL 5x SDS-PAGE yükleme tamponu (60 m Tris-HCl pH 6,8, %2 SDS, %25 (v/v) gliserol, 10 mM DTT, %0,1 (w/v) bromofenol mavisi) ile karıştırarak ve 5 dakika kaynatılarak reaksiyonu sonlandırın.
- Proteinleri %7.5 SDS-poliakrilamid jel elektroforezi (SDS-PAGE) ile ayırın, daha sonra PDVF membranına aktarın ve anti-FLAG (veya anti-HA) kullanarak Batı lekeleme ile her yerde bulunur.
- Test edilmiş MBP-RING tipi proteinin eşit yüklendiğini doğrulamak için PVDF membranını Coomassie mavisi ile lekelayın.
3. Nicotiana benthamiana yapraklarında ve planta ubiquitination analizinde agrobacteriumaracılı geçici protein ekspresyonu
- Çizgi uygun Agrobacterium tumefaciens suşları ilgi epitop etiketli gen taşıyan (örneğin, HA-RHA1B, HA-RHA1BC135S, HA-RHA1BK146R, HA-Ub) uygun antibiyotik seçimi içeren LB orta üzerinde bir kontrol olarak.
- 28 °C'de 2 günlük büyümeden sonra, tek kolonileri toplayın ve lb sıvı ortamda 28 °C/250 rpm'de 24 saat daha yetiştirin.
- Uygun antibiyotiklerle 100 μL agrobakteriyel kültürü 3 mL taze LB'ye aktarın ve 28 °C'de (250 rpm) ek bir 4-6 saat ek bir kültür için geç üstel büyüme aşamasına kuluçkaya yatırın.
- 6 dakika boyunca 1.800 x g agrobakteriyel hücreleri aşağı spin, supernatant atın ve yıkama tampon (50 mM MES pH 5.6, 28 mM glikoz, 2 mM NaH2PO4)3 mL ile hücreleri resuspend. Bu adımı 2x tekrarlayın.
- İkinci yıkamadan sonra, indüksiyon tamponundaki hücreleri yeniden askıya alın (50 mM MES pH 5.6, 28 mM glikoz, 2 mM NaH2PO4, 200 μM acetosyringone, 37 mM NH4Cl, 5 mM MgSO4.7H2O, 4 mM KCl, 18 μM FeSO4.7H2O, 2 mM CaCl2). Hücreleri 28 °C'de 10-12 saat ek bir indüksiyon tamponu ile kuluçkaya yatırın.
NOT: Aseton, T-DNA transferine neden olur. - Hücreleri 1.800 x g 6 dakika için santrifüj edin, süpernatant atın ve 2 mL infiltrasyon tamponu (10 mM MES pH 5.5, 200 μM asetonringone) ile hücreleri yeniden askıya alın.
NOT: Agrobacteria indüksiyon tamponu ile kuluçka dan sonra biraraya, birleştirilmiş hücrelerin birkaç dakika tezgah üzerinde bırakarak tüpün altına lavabo izin ve adım 3.6 ile devam etmeden önce yeni bir tüp için açık Agrobacterium süspansiyon aktarın. - OD600 değerini kullanarak bakterilerin konsantrasyonu ölçün (600 nm emici optik yoğunluğu). OD600 değerlerini istenilen değerlere ayarlayın.
NOT: Genellikle 0.2-0.4 arasındaki OD600 değeri tek bir agrobakteriyel leke ekspresyonu için en iyi sonucu ver. Farklı agrobakteriyel suşların bir kombinasyonu uygulanırsa, Agrobakteriyel suşların toplam OD600 değerleri 1'i geçmemelidir. - Agroinfiltrate 4 haftalık N. bethamiana yavaşça bir iğne ile onları dikerek bırakır, iğne olmadan bir şırınga ile el enjekte Agrobacterium izledi. Sızmış yaprak alanını işaretleyiciyle (genellikle 1-2 cm çapında) daire içine çekin.
- Sızmış yaprak dokuları toplamak 36 saat sonrası infiltrasyon. Sıvı azot ile ince bir toz için doku grind.
- 300 μL protein ekstraksiyon tamponu (50 mM Tris-HCl pH 7.5, 150 mM NaCl, 5 mM EDTA, 2 mM DTT, %10 gliserol, %1 polivinilpolipiridone, 1 mM PMSF, bitki proteazör inhibitörü kokteyli) ve 15.000 x g 15 °C'de santrifüj.
- Supernatant'ı yeni bir tüpe aktarın. 1x son konsantrasyonuna 5x SDS-PAGE yükleme tamponu ekleyin ve 5 dakika kaynatın.
- % 10 SDS-PAGE jelleri üzerinde ayrı ham proteinler, PVDF membranlar üzerine transfer, ve planta ubiquitination tespit etmek için anti-HA ile prob.
4. Planta'da enzimatik aktivite ve fonksiyon arasındaki bağlantının kurulması
NOT: Örneğin, RHA1B İk hücre ölümünü bastırmak için dirençli protein Gpa2 bozulmasını teşvik. Bu adım, RHA1B'nin bu öldürücü faaliyetlerinin E3'e bağlı olduğunu nasıl doğrulayışgösterilir.
- Streak uygun Agrobacterium tumefaciens suşları ilgi etiketli genleri taşıyan (Bu örnekte HA-RHA1B, HA-RHA1BC135S, HA-RHA1BK146R, myc-Gpa2, RBP1) ve boş vektör bir kontrol olarak. Agrobacterium hazırlık ve N. bethamiana yaprakları üzerinde enjeksiyon için adımları 3.1-3.8 izleyin.
- E3 bağımlı substrat protein yıkımı için, 3.9-3.12 adımlarını takip edin ve bitki hücrelerindeki protein birikimini tespit etmek için uygun antikorları kullanarak Batı lekelemesini gerçekleştirin (örn. anti-HA ve anti-MYC).
- E3 bağımlı aşırı duyarlı yanıt (HR) aracılı hücre ölümü inhibisyonu için, İk hücre ölümü belirtileri için tarımsal sızmış yaprakları izlemek 2-4 gün sonrası infiltrasyon.
Sonuçlar
Bu bölümde, PROSITE tarafından öngörülen RING-H2 tipi etki alanına (132-176 aminoasit)sahip tek bir e3 ubiquitin ligaz RHA1B alt ünitesinin incelenmesinde kullanılan protokol için temsili sonuçlar verilmektedir . Şekil 1'degösterildiği gibi, E3 eksikliği olan bir mutant protein elde etmek için, RING etki alanında korunmuş sekiz C'den veya Hs'den en az birinin(Şekil 1A)mutajenize edilmesi gerekir (Şekil 1B). Böylece, ilk adım olarak, RHA1B, RHA1BC135S (RING etki alanının korunmuş C3'te Ser tarafından Cys'in ikamesi) ve RHA1BK146R'ın (RHA1B'de bulunan tek Lys'de Lys'nin Lys'nin ikamesi) iki mutant versiyonu üretildi. Tek alt birim E3 ligases ubiquitin transferi için e2 barındıran substrat yerine doğrudan ubiquitin ile etkileşim arabuluculuk rağmen, Lys de E3 kendi kendine her yerde kendi kendine her yerde onun maksimal enzimatik aktivite için gerekli olabilir.
Şekil 2A'daki Batı lekeleme sonuçları, test edilen proteinin moleküler ağırlığından (örn. MPB-erimiş RHA1B ~100 kDa) başlayıp yukarı doğru ilerleyen çok bantlı bir yayma ile tipik bir in vitro ubiquitination tahlili sonucu göstermektedir. Anti-HA antikor ha-etiketli Ub farklı uzunluklarda poli-ubiquitination zincirine dahil tanınan, bu tipik ubiquitin ilişkili merdiven benzeri yayma oluşturma. Olumlu sonuçları doğrulamak için, Şekil 2A aynı zamanda tüm önemli negatif kontrolleri tek tek bileşenleri (E1, E2, Ub veya MBP-RHA1B) eksik veya MBP'yi kontrol olarak kullanarak ve lekeli her savar sinyalinden yoksun olarak sunar. Ayrıca, PVDF membran Coomassie mavi boyama tüm kontrollerde MBP-RHA1B veya MBP eşit yükleme gösterdi.
Şekil 2B, in vitro ubiquitination sonuçlarının spesifik E2/E3 kombinasyonuna bağlı olarak nasıl değiştiğini göstermektedir. Bu örnekte, 10 farklı E2 ailesi temsil eden 11 farklı E2 test edildi. Tespit edilen ubikitinasyon aktivitesi sinyal sizden (yayma yok) farklı molekül ağırlıklarda başlayan çok bantlı yaymaya kadar değişmektedir ve bu da farklı hersitüre desenleri gösterirdi.
Şekil 3, test edilen proteinin RING ve K-mutant versiyonları için her yerde bulunan test sonuçlarını göstermektedir. RHA1BC135S için enzimatik aktivite eksikliği, in vitro(Şekil 3A)veya planta poli-ubikitinasyon sinyalini nisbeten çok bantlama yayma üretememesi ile desteklenir (Şekil 3B). Bu ha-tagged Ub'un planta'da kendi başına aşırı ekspresyonunun, rha1B tipi vahşi tip enzimatik aktivitenin sağladığı güçlü ubiquitination sinyalinin aksine, vektör kontrolü de dahil olmak üzere tüm test edilen numunelerde bazal düzeyde her yerde yer vermesi dikkat çekicidir. Ayrıca, RHA1BK146R mutant üzerinde yapılan analiz, K146 kalıntısının DA RHA1B'nin E3 aktivitesi için de gerekli olduğunu göstermektedir. Marjinal bir öz-ubikitinasyon sinyali in vitro(Şekil 3A)saptamasına rağmen, planta sataşmada mutantın E3-eksikliği olduğu saptanır(Şekil 3B, sadece arka plan da her yerde tespit edilmiştir).
E3 eksikliği mutantı üredikten ve biyokimyasal olarak doğruladıktan sonra, fonksiyonel çalışmalar test edilmiş RING E3 ubiquitin ligazın E3 ile ilişkili biyolojik rolünü belirlemek için tasarlanabilir. RHA1B durumunda, Bu nematod efektörü bitki bağışıklık sinyali bastırır, Gpa2 tetiklenen İk hücre ölümü bastırılması ile tezahür. Şekil 4A'dasunulduğu gibi, yabani tip RHA1B'nin aksine, E3 ligaz aktivitesi nden yoksun RHA1BC135S mutantı İk hücre ölümünü engellemedi. Protein ubikitinasyonunun en yaygın sonucunun proteozom aracılı bozulması olduğu göz önüne alındığında, RING etki alanında bulunan mutasyonlar, doğrudan ve/veya dolaylı substratlarının bozulmasını tetiklemek için E3'e bağımlı bir yeteneği doğrulamak için de kullanılabilir. Bu nedenle, şekil 4B'deki Batı lekeleme sonuçları Gpa2'nin yabani tip RHA1B varlığında birikmediğini ancak RHA1BC135S'nin Gpa2 protein stabilitesi üzerinde hiçbir etkisi olmadığını doğrulamaktadır.
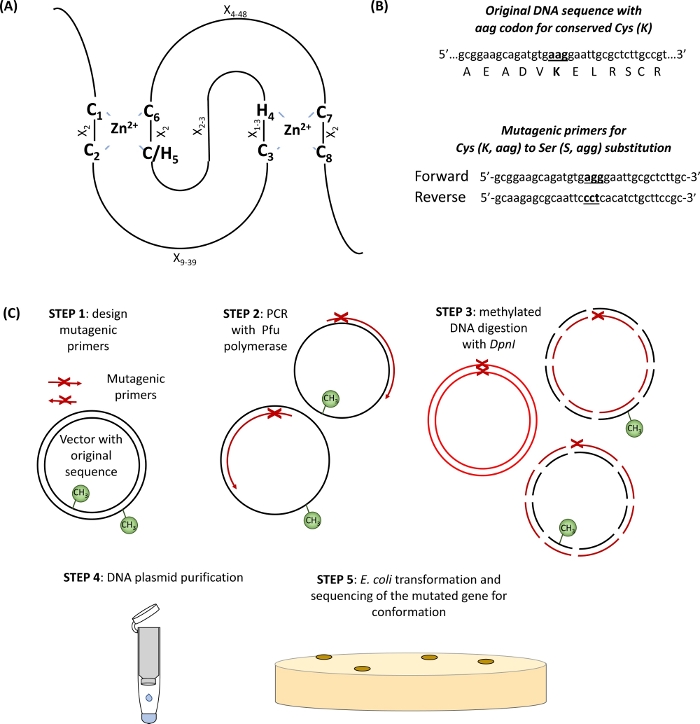
Şekil 1: Site yönelimli mutagenezde yer alan ilke ve adımların şematik gösterimi. (A) korunmuş Kis ve Onun amino asitleri ile RING-CH/H2 etki alanı vurgulanır. (B) Mutajenik astar tasarımının bir örneği. (C) Site yönelimli mutagenez adımları. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
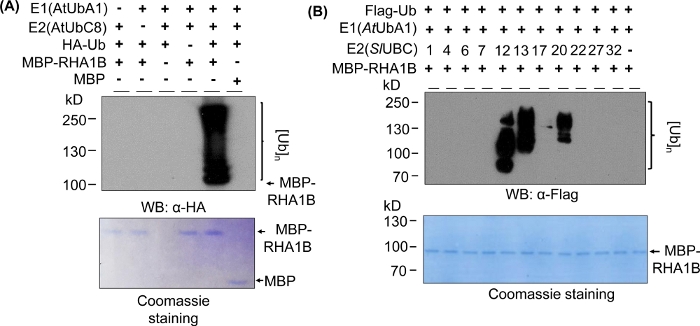
Şekil 2: Temsilci in vitro ubiquitination tsay. (A) Üst jel tüm negatif kontrolleri de dahil olmak üzere her yerde her yerde teşbimi gösterir, ve alt jel eşit yükleme gösterir. (B) E2 enzimlerine bağlı olarak beklenen sonuçların aralığı. Bu rakam Kud ve ark8'dendeğiştirilmiştir. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
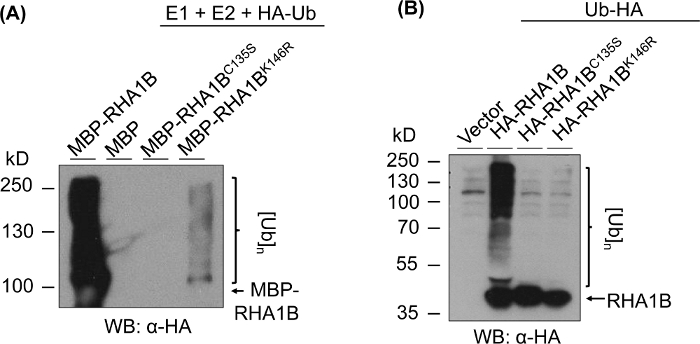
Şekil 3: RING ve K- mutantları (RHA1BC135S ve RHA1BK146R)için ubiquitinasyon taht sonuçları. RHA1BC135S ve RHA1BK146Riçin in vitro ubiquitination sonuçları . (B) RHA1BC135S ve RHA1BK146Riçin planta ubiquitination taht sonuçları . Bu rakam Kud ve ark8'dendeğiştirilmiştir. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
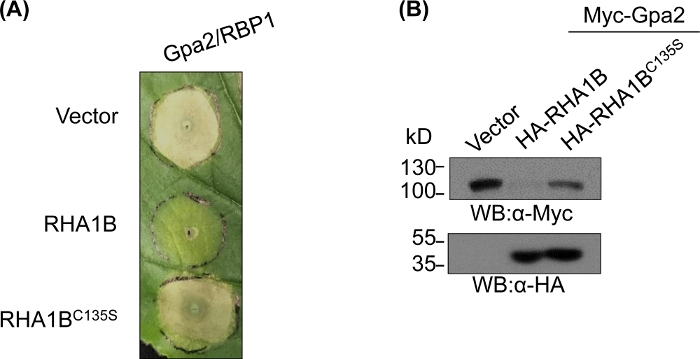
Şekil 4: E3'e bağımlı biyolojik fonksiyonlar için temsili fonksiyonel çalışma. E3 bağımlı biyolojik işlevi gösteren fonksiyonel çalışmalara bir örnek. (A) E3 bağımlı İk hücre ölümü bastırma ve (B) bir bitki immünreseptör Gpa2 bozulması. Bu rakam Kud ve ark8'dendeğiştirilmiştir. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
| PCR kurulumu | |
| 1 μL | plazmid (~100 ng) |
| 1,5 μL | F mutajenik astar (10 μM) |
| 1,5 μL | R mutajenik astar (10 μM) |
| 1 μL | dNTPs (10 mM) |
| 5 μL | arabellek (10x) |
| 1 μL | Ultra Pfu polimeraz (2,5 U/μl) |
| 39 μL | ddH2O |
| 50 μL | TOPLAM HACIM |
Tablo 1: PCR reaksiyonu kurulumu
| termocycler programı | |||
| 1 | 95 °C | 30 s | |
| 2 | 95 °C | 30 s | |
| 3 | 60 °C | 30 s | |
| 4 | 72 °C | 5 dk | tekrar 2-4 30 kez |
| 5 | 72 °C | 5 dk | |
Tablo 2: PCR termocycler programı
| RHA1B örneği için kurulan ligasyon reaksiyonu | ||
| 1,5 μL | pMAL-c2::MBP doğrusallaştırılmış vektör BamHI ve SalI ile sindirimi ile (60 ng) | |
| 7 μL | RHA1B/RHA1BC135S veya RHA1BK146R ucu BamHI ve SalI ile sindirilmiş (25 ng) | |
| 1 μL | T4 ligaz tampon (10x) | |
| 0,5 μL | T4 ligase (400 U/μL) | |
| 10 μL | TOPLAM HACIM | |
Tablo 3: RHA1B örneği için ligasyon reaksiyonu ayarlanır.
Tartışmalar
RING tipi E3 ubikitin ligasesbiyokimyasal ve mekanistik temeli açıklığa kavuşturulması, gelişim, stres sinyalizasyonu ve homeostazın bakımındaki biyolojik önemini anlamamıza büyük katkıda bulunabilir. Protokol burada çiftlerin in vitro ve planta fonksiyonel çalışmalarda mutagenez yaklaşımını tanımlamıştır. Site-doğrudan mutagenez yoluyla RING etki alanının korunmuş artıkları tek bir amino asit ikamesi tanıtarak, ortaya çıkan E3-eksik mutant işlevsellik ile enzimatik aktivite bağlamak için yabani tip protein ile paralel olarak test edilebilir.
Ring etki alanını, özellikle de korunmuş Cys ve His artıklarını düzgün bir şekilde tanımlamak çok önemlidir. PROSITE gibi çevrimiçi araçlar bunu yapmak için kullanılabilir10. E2 enziminin işe alınmasından sorumlu RING etki alanını istikrarsızlaştırmak için, Cys normalde çinko koordinasyonu için kullanılan bir disülfür bağı oluşturma yeteneğinden yoksun en yakın yapısal replasmanı olan Ser ile değiştirilir. Lorick ve ark. bu kritik Cys kalıntılarının herhangi birinde mutasyonun tek alt birim RING tipi E3 ligases5'inher yerde ki reisinasyon aktivitesini ortadan kaldıracağını gösterdi. Bazı Kis kalıntıları ring tipi proteinler içeren çok üniteli E3 ligaz kompleksleri için de önemli olsa da, bu ubiquitination komplekslerinin çok yönlü ve dinamik üç boyutlu yapısı ve RING tipi proteinlerin farklı rolü nedeniyle, çok birimli E3 ligase'de RING etki alanında korunmuş kalıntıların tek ikameleri bir ligaz eksikliği fenotip11'iüretmede başarılı olmamıştır.
Site yönelimli mutagenez için, biz daha küçük plazmid vektörler ve daha düşük amplifikasyon döngüleri kullanarak genellikle mutagenez için daha yüksek verimlilik verdi bulundu. Pfu enzimi diğer yüksek sadakat ve yüksek prosesIVite DNA polimeraz ile değiştirilebilir. Ayrıca, ilgi geni nadir kodon içeriyorsa, başka bir E. coli leke, Rosetta, rekombinant protein in daha yüksek verim elde etmek için kullanılabilir. Ayrıca, IPTG indüksiyonu için hem kuluçka süresi hem de sıcaklık daha da optimize edilebilir. Daha düşük sıcaklıklar Bazı proteinlerin ekspresyonu için uygun olabilir E. coli bölünme oranını azaltmak. IPTG yüksek konsantrasyonprotein ekspresyonu artırabilir rağmen, aynı zamanda E. coli bölünme süreçleri inhibe ve tavsiye edilmez.
Tek alt birim RING tip E3 ligases sadece substrat yakın E2-Ub orta pozisyonları moleküler bir iskele olarak işlev değil, aynı zamanda onların cognate E2s ubiquitin transfer aktivitesini uyarır. Ayrıca, bir E2/E3 kombinasyonu nun modifiye edilmiş bir substrat ın kaderini belirleyen poliubiquitin zincirinin uzunluğu ve bağlantıları için önemli olduğu göz önüne alındığında, RING tipi E3'lerin herhangi bir dikkate enzimatik ortakları, E2s12içermelidir. Şekil 3B'degösterildiği gibi, test edilen Tüm E2'ler RHA1B ligaz ile uyumlu değildir. Bu nedenle, in vitro ubiquitination tahlilleri yanlış negatif sonuçları önlemek için farklı E2 sınıflarını temsil eden birden fazla E2 enzimleri ile paralel olarak yapılmalıdır.
Burada sunulan test RING-tipi proteinlerin kendi kendine her yerde yeteneğini algılar in vitro enzimatik testtir. Ancak, küçük değişiklikler ile, bu protokol kolayca substratların in vitro ubiquitination tespit etmek için uyarlanabilir. Bu amaçla, adım 2.15 gelen in vitro ubiquitination karışımı potansiyel E3 ligase substrat rekombinant protein ile takviye edilmelidir (500 ng). 30 °C'de 2 saatlik bir kuluçkadan sonra, her yerde bulunan protein 15 μL anti-HA afiity matris (HA-Ub kullanılıyorsa veya FLAG-Ub kullanılıyorsa ANTI-FLAG afiity matrisi) kullanılarak 4 °C'de 2 saat ajitasyon ile ele geçirilmelidir. Soğuk Ub yıkama tamponu (20 mM Tris pH 7.5, 100 mM NaCl, 0.1 mM EDTA, 0.05% Tween 20, 1x PMSF) ile boncukları 4x kez yıkadıktan sonra, tamponun 40 μL'si hariç tümünü atın ve adım 2.16'ya geçin. Epitop etiketli Ub ve substrata özgü antikorlar tarafından saptanan ubikitinasyon sinyali, sırasıyla, substrat proteininin moleküler ağırlığından ortaya çıkan, substrat/enzim özgüllüğünü doğrular.
Ayrıca, in vivo'da E3 ligase substratlarının tanımlanması genellikle geçici enzim-substrat etkileşimi ve her yerde bulunan hedef proteinin hızlı bozulması nedeniyle birden fazla zorlukla ilişkilidir. Bir E3 ligase eksik mutant kullanarak, hala hedefi ile etkileşime ama artık13ubiquitinates , proteasomal inhibitörü MG132 eklenmesi için çok yararlı bir alternatiftir, hangi her zaman yeterince 26S proteozom fonksiyonu ile müdahale etmez.
RING tipi E3 ligaseslerinin ortak bir özelliği homo- ve/veya heterodimer olarak biçim ve işlev verme eğilimidir. İlginçtir, RING etki alanının korunmuş kalıntılar ikame genellikle bir yerli yabani tip protein enzimatik aktivite mutasyona uğramış HALKA tipi E3 ligaz blokları bir baskın negatif fenotip ile ilişkilidir13. Bu nedenle, planta RING mutantların aşırı ekspresyonu E3 ligaz geni nakavt için alternatif bir yaklaşım olabilir.
Açıklamalar
Yazarların açıklayacak bir şeyi yok.
Teşekkürler
Çalışmalarımız, USDA Ulusal Gıda ve Tarım Enstitüsü, USDA-NIFA Farm Bill, Northwest Potato'ın Tarım ve Gıda Araştırma Girişimi'nin (2017-67014-26197; 2017-67014-26591) finansal desteği ile mümkün oldu. Konsorsiyum ve ISDA Özel Ürün.
Malzemeler
| Name | Company | Catalog Number | Comments |
| Acetic acid | Sigma-Aldrich | A6283 | |
| Acetosyringone | Sigma-Aldrich | D134406 | |
| Amylose resin | NEB | E8021S | |
| ATP | Sigma-Aldrich | A1852 | |
| Bacterial protease inhibitor | Sigma-Aldrich | P8465 | |
| Bromphenol Blue | VWR | 97061-690 | |
| CaCl2 | Sigma-Aldrich | C1016 | |
| Centrifuge | Beckman Coulter | model: Avanti J-25 | |
| Commassie Blue | VWR | 97061-738 | |
| Creatine phosphate | Sigma-Aldrich | P7936 | |
| Creatine phosphokinase | Sigma-Aldrich | C3755 | |
| DNA clean & concentrator Kit | ZYMO RESEARCH | D4029 | |
| DpnI | NEB | R0176S | |
| DTT | Sigma-Aldrich | D0632 | |
| E. coli BL21 | Thermo Fisher Scientific | C600003 | |
| E. coli DH5α competent cells | Thermo Fisher Scientific | 18265017 | |
| EDTA | Sigma-Aldrich | 324504 | |
| FeSO4 7H2O | Sigma-Aldrich | F7002 | |
| FLAG-Ub | BostonBiochem | U-120 | |
| Glucose | VWR | 188 | |
| Glycerol | Sigma-Aldrich | G5516 | |
| HA-Ub | BostonBiochem | U-110 | |
| Heat block | VWR | model: 10153-318 | |
| Incubator | VWR | model: 1525 Digital Incubator | |
| Incubator shaker | Thermo Fisher Scientific | model: MaxQ 4000 | |
| IPTG | Roche | 10724815001 | |
| KCl | Sigma-Aldrich | P9333 | |
| LB Broth | Sigma-Aldrich | L3022 | |
| Liquide nitrogen | university chemistore | ||
| Maltose | Sigma-Aldrich | 63418 | |
| MES | Sigma-Aldrich | M3671 | |
| Methanol | Sigma-Aldrich | 34860 | |
| MgCl2 | Sigma-Aldrich | 63138 | |
| MgSO4 7H2O | Sigma-Aldrich | 63138 | |
| Microcentrifuge | Eppendorf | model: 5424 | |
| Miniprep plasmid purification kit | ZYMO RESEARCH | D4015 | |
| monoclonal anti-FLAG antibody | Sigma-Aldrich | F3165 | |
| monoclonal anti-HA antibody | Sigma-Aldrich | H9658 | |
| monoclonal anti-MYC antibody | Sigma-Aldrich | WH0004609M2 | |
| Mortar | VWR | 89038-144 | |
| NaCl | Sigma-Aldrich | S7653 | |
| NaH2PO4 | Sigma-Aldrich | S8282 | |
| NanoDrop | Thermo Fisher Scientific | model: 2000 Spectrophotometer | |
| Needle | Thermo Fisher Scientific | 14-826-5C | |
| NH4Cl | Sigma-Aldrich | A9434 | |
| PCR machine | Bio-Rad | model: C1000 | |
| Pestle | VWR | 89038-160 | |
| Pfu Ultra | Agilent Technologies | 600380 | |
| Plant protease inhibitor coctail | Sigma-Aldrich | P9599 | |
| pMAL-c2 | NEB | N8076S | |
| PMSF | Sigma-Aldrich | P7626 | |
| Polyvinylpolypyrrolidone | Sigma-Aldrich | P6755 | |
| SDS | Sigma-Aldrich | 1614363 | |
| Sonicator | Qsonica Sonicators | model: Q125 | |
| Syringe | Thermo Fisher Scientific | 22-253-260 | |
| Tris | Sigma-Aldrich | T1503 | |
| T4 ligase | NEB | M0202S |
Referanslar
- Freemont, P. S., Hanson, I. M., Trowsdale, J. A novel gysteine-rich sequence motif. Cell. 64, 483-484 (1991).
- Borden, K. L. B. RING fingers and B-boxes: Zinc-binding protein-protein interaction domains. Biochemistry and Cell Biology. 76, 351-358 (1998).
- Barlow, P. N., Luisi, B., Milner, A., Elliott, M., Everett, R. Structure of the C3HC4 Domain by 1H-nuclear Magnetic Resonance Spectroscopy: A New Structural Class of Zinc-finger. Journal of Molecular Biology. 237, 201-211 (1994).
- Borden, K. L. B., et al. The solution structure of the RING finger domain from the acute promyelocytic leukaemia proto-oncoprotein PML. The EMBO Journal. 14, 1532-1541 (1995).
- Lorick, K. L., et al. RING fingers mediate ubiquitin-conjugating enzyme (E2)-dependent ubiquitination. Proceedings of the National Academy of Sciences. 96, 11364-11369 (1999).
- Jiménez-López, D., Muñóz-Belman, F., González-Prieto, J. M., Aguilar-Hernández, V., Guzmán, P. Repertoire of plant RING E3 ubiquitin ligases revisited: New groups counting gene families and single genes. PLoS ONE. 13, 1-28 (2018).
- Sacco, M. A., et al. The Cyst Nematode SPRYSEC Protein RBP-1 Elicits Gpa2- and RanGAP2-Dependent Plant Cell Death. PLoS Pathogens. 5, 1-14 (2009).
- Kud, J., et al. The potato cyst nematode effector RHA1B is a ubiquitin ligase and uses two distinct mechanisms to suppress plant immune signaling. PLoS Pathogens. 15, 1007720 (2019).
- Bradford, M. M. A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of protein-dye binding. Analytical Biochemistry. 72, 248-254 (1976).
- Sigrist, C. J. A., et al. New and continuing developments at PROSITE. Nucleic Acids Research. 41, 344-347 (2013).
- Dove, K. K., Stieglitz, B., Duncan, E. D., Rittinger, K., Klevit, R. E. Molecular insights into RBR E3 ligase ubiquitin transfer mechanisms. EMBO Reports. 17, 1221-1235 (2016).
- Metzger, M. B., Pruneda, J. N., Klevit, R. E., Weissman, A. M. RING-type E3 ligases: Master manipulators of E2 ubiquitin-conjugating enzymes and ubiquitination. Biochimica et Biophysica Acta - Molecular Cell Research. 1843, 47-60 (2014).
- Xie, Q., et al. SINAT5 promotes ubiquitin-related degradation of NAC1 to attenuate auxin signals. Nature. 419, 167-170 (2002).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır