Method Article
Tek Çekirdekli RNA Dizilimi için Yetişkin Fare Böbreğinden Çekirdek İzolasyonu
* Bu yazarlar eşit katkıda bulunmuştur
Bu Makalede
Özet
Burada, medüller böbrek hücresi tiplerinin temsilini geliştiren ve enzimatik doku ayrışmasından kaynaklanan gen ekspresyon artefaktlarını önleyen donmuş fare böbreklerinden yüksek kaliteli çekirdekleri izole etmek için bir protokol sunuyoruz.
Özet
Böbrekler su, elektrolit ve asit-baz homeostazı gibi çeşitli biyolojik süreçleri düzenler. Böbreğin fizyolojik fonksiyonları, organın kortikomedüller ekseni boyunca karmaşık bir mimaride düzenlenmiş çoklu hücre tipleri tarafından yürütülür. Tek hücreli transkriptomiklerdeki son gelişmeler, böbrek fizyolojisi ve hastalığında hücre tipine özgü gen ekspresyonunun anlaşılmasını hızlandırmıştır. Bununla birlikte, tek hücreli RNA dizilimi (scRNA-seq) için sıklıkla kullanılan enzim bazlı doku ayrışma protokolleri, çoğunlukla taze (arşivlenmemiş) doku gerektirir, transkripsiyonel stres tepkileri verir ve böbrek korteksinin bol hücre tiplerinin seçimini destekler, bu da medulla hücrelerinin yetersiz temsiline neden olur.
Burada, bu sorunları önleyen bir protokol sunuyoruz. Protokol, donmuş böbrek dokusundan 4 ° C'de çekirdek izolasyonuna dayanmaktadır. Çekirdekler, korteks, dış medulla ve iç medulladan oluşan fare böbreğinin merkezi bir parçasından izole edilir. Bu, medüller hücrelerin yararı için tüm böbrek örnekleri için tipik olan kortikal hücrelerin aşırı temsilini azaltır, böylece veriler tüm kortikomedüller ekseni yeterli miktarda temsil eder. Protokol basit, hızlı ve uyarlanabilir ve böbrek araştırmalarında tek çekirdekli transkriptomiklerin standardizasyonuna yönelik bir adım sağlar.
Giriş
Böbrekler oldukça karmaşık bir doku mimarisi sergiler. Bir kortikomedüller eksen boyunca fonksiyonel ve anatomik olarak farklı segmentlerden oluşurlar ve hücre dışı sıvı hacminin düzenlenmesi, elektrolit dengesi veya asit-baz homeostazı1 gibi biyolojik fonksiyonlara aracılık ederler.
Tek hücreli transkriptomiklerdeki ilerlemeler, kompleks dokuların derinlemesine karakterizasyonunu sağlamış ve renal fizyoloji, gelişim ve hastalıkta segment ve hücre tipine özgü gen ekspresyonunun anlaşılmasını hızlandırmıştır 2,3,4.
Bununla birlikte, scRNA-seq için sıklıkla kullanılan enzim bazlı ayrışma protokolleri çeşitli dezavantajlar ve kısıtlamalar göstermektedir. Protokole bağlı olarak, transkripsiyonel stres yanıtları ve daha kolay ayrışması kolay kortikal hücre tiplerine yönelik doku ayrışma önyargısı üretirler 5,6. Embriyonik böbrekler için soğuk-aktif proteazlar kullanan protokoller strese bağlı transkripsiyonel değişiklikleri hafifletebilse de, kortikal hücrelere yönelik ayrışma yanlılığının üstesinden gelemeyebilir ve farklı hastalıklı böbrek dokularına kolayca adapte olamayabilirler7. Ek olarak, tek hücreli yaklaşımlar dondurulmuş doku örnekleriyle kolayca uyumlu değildir, bu da uygulamalarını çoğunlukla arşivlenmemiş, taze dokularla sınırlandırır, böylece doku toplamayı kısıtlayıcı bir faktör6 haline getirir.
Tek çekirdekli RNA dizilimi (snRNA-seq) bu sınırlamaları aşabilir 8,9. Burada, dondurulmuş yetişkin fare böbrek dokusunun merkezi bir diliminden çekirdek izolasyonu için bir protokol sunuyoruz (Şekil 1)10. Protokolümüz basittir ve güçlü bölgesel doku değişiklikleri içermeyen deneysel modeller için çeşitli böbrek hücresi tiplerinin dengeli bir temsili ile RNA dizileme kütüphaneleri elde etmek için standartlaştırılmış bir yaklaşım sağlar. İkinci durumda, protokolümüz tüm böbreklerle de gerçekleştirilebilir.
Protokol
Tüm hayvan deneyleri, Hayvan Refahı Yasası (TierSchG) ve Hayvan Refahı Deney Hayvanları Yönetmeliği (TierSchVersV) uyarınca yürütülmüş ve yerel makamlar ve kurumumuzdaki Hayvan Refahı Görevlileri (MDC) tarafından yetkilendirilmiştir.
1. Doku hazırlığı
- Elde edilecek her böbrek için kuyucuk başına 2 mL 1x fosfat tamponlu salin (PBS) içeren 6 delikli bir plaka hazırlayın. Kuyu ve böbrek başına 2 mL RNA stabilizasyon çözeltisi içeren 6 delikli bir plaka hazırlayın. Her iki plakayı da buz üzerinde önceden soğutun.
- 3-6 aylık bir erkek C57BL/6 fareyi ötenazileştirin. Fareyi diseksiyon tepsisine yerleştirin, ekstremiteleri sabitleyin ve% 70 etanol ile karnı sterilize edin.
- Forseps ve makas kullanarak karnı göğüs kafesine kadar açın. Bağırsağı ve diğer organları yana doğru kaldırın ve üreteri, böbrek arterini ve damarı bir makasla dikkatlice keserek böbrekleri çıkarın. Böbreği önceden hazırlanmış, buz gibi soğuk 1x PBS'de yıkayın ve tüm beyaz dokular çıkarılana kadar böbrek fasyasını ve kalan yağları böbrekten çıkarın (Şekil 2A).
- Böbreği soğuk bir diseksiyon plakasına yerleştirin ve 1-2 mm'lik bir orta dilim elde etmek için keskin bir neşter veya tıraş bıçağı kullanın. Doku parçasının tüm kortikomedüller ekseni içerdiğinden emin olun (Şekil 2B). Korteksi orta parçanın yanlarından dikkatlice kesmek için mikrodiseksiyon makası ve forseps kullanın. Diseke edilen doku parçası içinde, üç segmentli korteks, dış medulla ve iç medulla açıkça görülebilmelidir (Şekil 2C).
NOT: Etkili doku lizisi için yeterli tampon miktarlarını sağlamak ve cDNA kütüphanelerinde ortam arka plan RNA'sını en aza indirmek için dilim 2 mm kalınlığı veya 20 mg ağırlığı geçmemelidir. Ortam RNA'sı, tek çekirdeklerle ilişkili olmadığı için dizi kapasitesini boşa harcar. - Böbrek parçasını önceden hazırlanmış RNA stabilizasyon çözeltisine aktarın ve RNA bozulmasını önlemek için 4 ° C'de 24 saat boyunca inkübe edin. 24 saat sonra, RNA stabilizasyon çözeltisini çıkarın ve dokuyu daha fazla kullanana kadar -80 ° C'de saklayın. Fazla çözeltiyi kağıt mendille dikkatlice çıkarın.
2. Çekirdek izolasyonu
- Temizlik ve hazırlık adımları
- Masaüstü ve pipetleri %70 etanol ve RNase dekontaminasyon çözeltisi ile temizleyin.
- Yuvarlak tabanlı, 2 mL doku öğütücü tüpünü ve eşleşen havane A ve B'yi RNaz dekontaminasyon çözeltisi ile temizleyin, ardından %70 etanol ve RNaz içermeyen su (numune başına 1 öğütücü tüp ve havane seti) ile temizleyin. Tamamen kurumasını bekleyin.
- Santrifüjü 4 °C'ye kadar önceden soğutun.
- Üç adet 15 mL toplama tüpünü, 1,5 mL'lik toplama tüpünü, 5 mL'lik floresan aktif hücre ayıklama (FACS) toplama tüpünü ve buz üzerindeki her numune için bir kuru öğütücü tüpünü etiketleyin ve önceden soğutun.
- Tampon hazırlama
- Ribonükleozid-vanadil kompleks stok çözeltisini, üreticinin talimatlarına göre yeşil-siyah berrak bir çözeltiye yeniden oluşturulana kadar 65 ° C'ye ısıtın. 11 adet
- Tablo 1A'da açıklandığı gibi %4 sığır serum albümini ( BSA) içeren 1x PBS hazırlayın. Ek olarak, %0,04 BSA ile 1x PBS hazırlayın (Tablo 1B). Her iki çözeltiyi de 0,2 μm yüzey aktif madde içermeyen selüloz asetat (SFCA) membran şırınga filtresi kullanarak filtreleyin ve daha fazla kullanıma kadar buzda tutun.
- Çekirdek Lizis Tamponu 1'i hazırlayın (NLB1, Tablo 1C). Çekirdek Lizis Tamponu 2 (NLB2, Tablo 1D) için 4 mL EZ lizis tamponu ve 15 mL tüplere Çekirdek Süspansiyon Tamponu (NSB, Tablo 1E) için 2 mL % 0,04 BSA / PBS ekleyin. RNase inhibitörü solüsyonunu protokolde aşağıda belirtildiği gibi kullanmadan önce NLB2 ve NSB'ye doğrudan ekleyin. Daha fazla kullanana kadar buz üzerinde tutun.
- EZ lizis tamponunu %10 sakkaroz ile hazırlayın (Sakkaroz Degrade Tamponu, Tablo 1F). İyice karıştırın ve 0,2 μm SFCA membran şırınga filtresi kullanarak tamponu taze bir 15 mL tüpe süzün. Daha fazla kullanana kadar buz üzerinde tutun.
- Doku homojenizasyonu ve hücre lizisi
NOT: RNA bozunmasını en aza indirmek için, tüm adımlar buz üzerinde gerçekleştirilir. Öğütücü borusu, Petri kabı ve tüm tamponların önceden soğutulması gerekir. Tüm yeniden süspansiyon adımları, çekirdek süspansiyonunu dikkatlice pipetleyerek yapılır. Kesme kuvvetlerini ve çekirdeklere zarar vermemek için numuneyi vortekse etmeyin.- Dondurulmuş böbrek parçasını alın ve 1 mL NLB1 içeren buz üzerinde 60 mm'lik bir polistiren Petri kabına aktarın.
- Bir tıraş bıçağı veya neşter kullanarak dokuyu iyice kesin (Şekil 3A).
- 1 mL'lik pipet ucunun ucunu kesin ve kıyılmış doku ve tamponu öğütücü tüpüne aktarın. Tüm doku parçalarını aktardığınızdan emin olun. Petri kabını gerekirse tamponla 5-10 kez yıkayın.
- Öğütücü tüpünde 25 kat yukarı ve aşağı havane A'yı yavaşça hareket ettirerek buz üzerindeki süspansiyonu homojenize edin. Hızlı hareketin neden olduğu hava kabarcıklarından kaçının (Şekil 3B).
- Homojenatı önceden soğutulmuş 15 mL'lik bir toplama tüpünde 100 μm'lik bir süzgeçten geçirin ve filtreyi başka bir 1 mL NLB1 ile yıkayın.
- Öğütücü tüpünü soğuk EZ çekirdek lizis tamponu ile yıkayın ve tamponu atın.
- Homojenatı öğütücü tüpüne geri aktarın ve B havanesini yavaşça hareket ettirerek buz üzerindeki süspansiyonu homojenize edin, öğütücü borusunda 15 kat yukarı ve aşağı. Hızlı hareketin neden olduğu hava kabarcıklarından kaçının (Şekil 3C).
- Homojenatı önceden soğutulmuş 15 mL toplama tüpüne aktarın. Öğütücü tüpünü başka bir 2 mL NLB1 ile yıkayın ve tüm doku parçalarını toplama tüpüne aktardığınızdan emin olun. Hücreleri lize etmek için homojenatı (toplam hacim 4 mL) buz üzerinde 5 dakika boyunca inkübe edin.
- Çekirdek saflaştırma
- Homojenatı 40 μm'lik bir süzgeçten önceden soğutulmuş 15 mL'lik bir toplama tüpüne geçirin. Toplama tüpünü, sallanan kova rotorlu bir santrifüjde 4 °C'de 500 x g'de 5 dakika boyunca döndürün. Bu arada, NLB2'ye RNaz inhibitörü çözeltisi ekleyin (Tablo 1D).
- Pelet'i rahatsız etmeden süpernatantı çıkarın. Peleti 4 mL NLB2'de dikkatlice askıya alın.
- Süspansiyonun altına 1 mL'lik bir Sakkaroz Degrade Tamponu yastığı ile dikkatlice yerleştirin. Sallanan kova rotorlu bir santrifüjde 4 °C'de 5 dakika boyunca 500 x g'de santrifüj. Bu arada, NSB'ye RNaz inhibitörü solüsyonu ekleyin (Tablo 1E).
- Santrifüjlemeden sonra, toplama tüpünü santrifüjden yavaşça çıkarın ve toplama tüpünü tutarken iki katmanı rahatsız etmemeye dikkat edin. Hücre kalıntıları iki katman arasında görülebilir. Süpernatantı enkazdan başlayarak dikkatlice çıkarın. Çekirdek peletini rahatsız etmeden kalan süpernatantı çıkarın ve peleti 1 mL NSB'de dikkatlice yeniden askıya alın.
NOT: Resüspansiyon hacmi, izolasyon için kullanılan doku miktarına ve son santrifüjleme adımından sonra kazanılan pelet boyutuna bağlıdır. Hacmin beklenen çekirdek sayısına uyarlanması gerekebilir. - Homojenatı 20 μm'lik bir süzgeçten önceden soğutulmuş 5 mL FACS toplama tüpüne geçirin.
3. Çekirdek sıralama
- FACS toplama tüpündeki homojenata 2 μM'lik son konsantrasyona NSB'nin mL'si başına 20 μL 4′,6-diamidino-2-fenilindol (DAPI) ekleyin ve dikkatlice karıştırın. Buz üzerinde 5 dakika kuluçkaya yatırın.
- Önceden soğutulmuş 1.5 mL toplama tüpünü 20 μL% 4 BSA / 1x PBS ile hazırlayın ve 1 U / μL'lik son konsantrasyona 0.5 μL RNaz inhibitörü çözeltisi ekleyin.
- Bir hücre sıralayıcısı kullanarak çekirdekleri sıralayın.
- FACS toplama tüpünü ayıklayıcıya yerleştirmeden önce çekirdek süspansiyonunu kısa bir süre karıştırın.
- Enkaz ve agregaları hariç tutmak için ileri saçılma (FSC) ve yan saçılmaya (SSC) dayalı bir ilk kapı P1 ayarlayın (Şekil 4A).
- Boş veya hasarlı çekirdekleri ve katları hariç tutmak için, DAPI Alanı ile DAPI-Yüksekliğine (DAPI-A vs DAPI-H) göre sonraki bir kapı ayarlayın (Şekil 4B).
- Tek çekirdekleri, 3.2'de hazırlanan 1 U/μL RNaz inhibitörü çözeltisi ile %4 BSA /1x PBS içeren 1.5 mL toplama tüpüne ayırın.
4. Kalite kontrol
- Son çekirdek konsantrasyonunu bir floresan mikroskobu altında veya otomatik bir sayım odasında en az iki bağımsız sayımda ölçün ve süspansiyon kalitesini değerlendirin (Şekil 5).
NOT: Optimal konsantrasyonlar 700 - 1.200 çekirdek / μL arasındadır. 700 çekirdek / μL gibi daha düşük hücre konsantrasyonları, sonuçta ortaya çıkan cDNA kütüphaneleri daha az ortam arka plan RNA'sı (bireysel çekirdeklerle ilişkili olmayan transkriptler) içerdiğinden tercih edilebilir. - Sıralanmış tek çekirdeklerin istenen geri kazanımı için gerekli çekirdek süspansiyonu hacmini hesaplayın. Çekirdek agregasyonunu ve RNA bozulmasını önlemek için, hemen kütüphane hazırlığına geçin.
Sonuçlar
Protokolümüzün performansını belirlemek için kütüphane hazırlığı için 10x Genomics Chromium Single Cell 3' Gene Expression Kit v3.1'i kullandık ve snRNA-seq verilerini Seurat paketi12,13 ile analiz ettik.
Şekil 6, temsili bir snRNA-seq kütüphanesinden elde edilen sonuçları göstermektedir. Çekirdeklerimizin kalitesini değerlendirmek için, gen sayısını, mitokondriyal okumaların fraksiyonu ile renklendirilen transkriptlerin sayısına (benzersiz moleküler tanımlayıcılar (UMI'ler) tarafından tanımlanan) karşı çizdik (Şekil 6A). İyi kalitede çekirdekler genellikle daha yüksek okuma sayıları, UMI ve gen sayılarını ilişkilendiren ve düşük mitokondriyal okuma fraksiyonları gösterir.
Sonraki analiz için, 500'den az veya 4000'den fazla sayılan gen veya mitokondriyal RNA'nın% 5'inden fazlasına sahip çekirdekler hariç tutuldu (n = 828). Sadece en az üç çekirdekte eksprese edilen genler dahil edildi. Kalan 6.000 çekirdekte toplamda yaklaşık 20.000 gen tespit ettik ve çekirdek başına 1.600 medyan gen ve 2.800 medyan UMI tespit ettik (Şekil 6B).
Kümelenme oldukça değişken genlere dayanıyordu. Toplam 18 küme tespit ettik. Hücre kimlikleri, bilinen belirteç genlerine dayanarak açıklandı (gösterilmedi). Bir hücre tipinin alt kümeleri bir kümeye özetlenerek toplam 11 farklı hücre tipi elde edildi: podositler, proksimal tübül (PT), ince ekstremite (tL), kalın yükselen ekstremite (TAL), distal kıvrımlı tübül (DCT), bağlantı tübülü (CNT), toplama kanalı sorumlusu ve intercalated hücreler (CD-PC, A-IC, B-IC), pelvisin derin medüller epiteli (DMEP) ve endotel. Küme bakımından zenginleştirilmiş belirteçlerin gen ekspresyon paternleri bir nokta grafiğinde (Şekil 6C) ve hücre tipi kümeleri t-dağıtılmış stokastik komşu gömme (t-SNE) grafiğinde (Şekil 6D) görselleştirilmiştir.
Örneğimizdeki hücre tipi dağılımlarını değerlendirmek için, her hücre tipinin yüzdesi hesaplandı (Şekil 6E) ve PT'nin TAL'ye oranını belirlemek için kullanıldı. PT esas olarak böbrek korteksinde bulunur ve PT hücrelerinin ayrışması kolay ve tüm böbrek örneklerinde oldukça bol olduğu için böbrek tek hücreli veri kümelerinde sıklıkla aşırı temsil edilir. Öte yandan TAL, tüm dış medulla14 boyunca uzanır. Bu nedenle, PT ve TAL fraksiyonlarının oranı, böbrek tek hücreli bir veri kümesindeki medüller hücre tiplerinin zenginleştirilmesi için iyi bir ölçüyü temsil eder. Genel olarak, tek hücreli tüm böbrek veri setlerindeki PT / TAL oranı, enzimatik olarak ayrışmış doku10,14,15 için 8 (soğuk proteaz ile tedavi edilen tüm böbrek dokusundan yayınlanmamış veriler) ile 45 arasında değişmiştir. Burada sunulan snRNA-seq veri setinde PT/TAL oranı 2'ye ulaşabildik. Bu sonuç, snRNA-seq ile birlikte doku diseksiyonu sırasında fazla korteksin çıkarılmasının, çarpıcı bir şekilde gelişmiş bir böbrek hücresi tipi temsili ile sonuçlandığını göstermektedir.
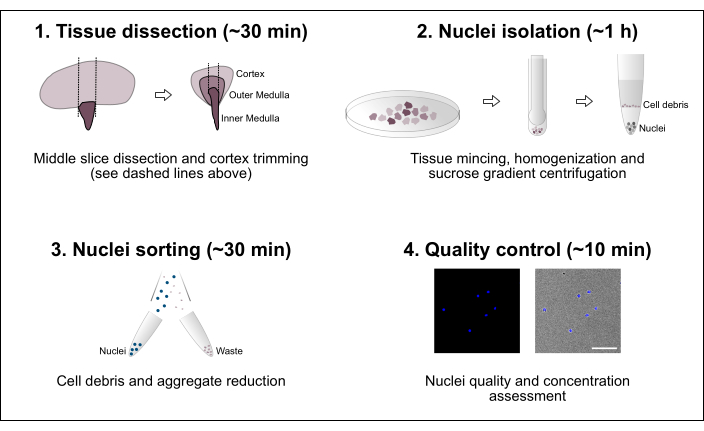
Şekil 1: İş akışına şematik genel bakış. Protokol, doku diseksiyonunu ve ardından çekirdek izolasyonunu, çekirdek sıralamasını ve son saflık ve konsantrasyon değerlendirmesini içeren dört ana adımdan oluşur. Ölçek çubuğu = 100 μm. Bu şeklin daha büyük bir versiyonunu görüntülemek için lütfen buraya tıklayın.
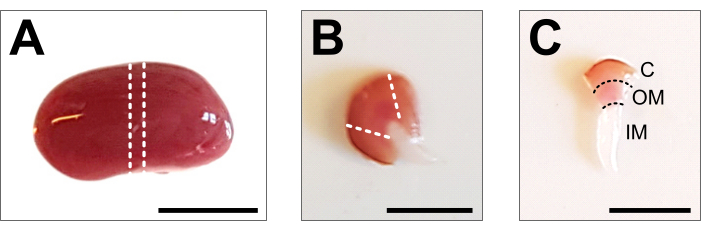
Şekil 2: Böbrek diseksiyonu ve doku hazırlığı . (A) Diseke edilmiş tüm böbreğin temsili görüntüsü. Noktalı çizgiler, tüm renal hücre tiplerinin bir temsili ile 1-2 mm'lik bir orta dilim elde etmek için gereken kesimleri gösterir. (B) Elde edilen orta dilimin temsili görüntüsü. Noktalı çizgiler, yandan korteks kırpma için kesimleri gösterir. (C) Kesilmiş korteks ile merkezi böbrek parçasının temsili görüntüsü. Korteks (C), dış medulla (OM) ve iç medulla (IM) açıkça görülebilir. Ölçek çubuğu = 500 μm. Bu şeklin daha büyük bir versiyonunu görüntülemek için lütfen buraya tıklayın.

Şekil 3: Doku homojenizasyonu ve çekirdek saflaştırması . (A) Yeterince kıyılmış böbrek dokusunu gösteren temsili görüntü. Ölçek çubuğu = 500 μm. (B) İlk homojenizasyon adımından sonra homojenat (havane A ile 25 strok, 2 mL öğütücü borusu). (C) İkinci homojenizasyon adımından sonra homojenat yapın (B havaneli 15 strok, 2 mL öğütücü borusu). Bu şeklin daha büyük bir versiyonunu görüntülemek için lütfen buraya tıklayın.
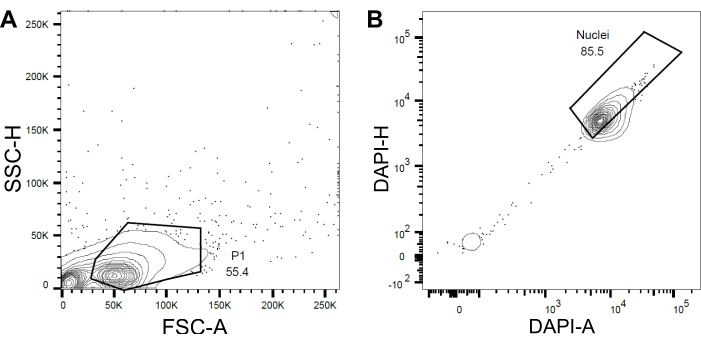
Şekil 4: Çekirdek sıralama için geçit stratejisi. (A ) İlk kapı P1, enkaz ve agregaları hariç tutmak için ileri saçılma (FSC) ve yan saçılma (SSC) temelinde ayarlandı. (B ) DAPI-Alanı (DAPI-A) ve DAPI-Yüksekliğine (DAPI-H) dayanan bir sonraki kapı, boş veya hasarlı çekirdekleri ve katları hariç tuttu. Bu şeklin daha büyük bir versiyonunu görüntülemek için lütfen buraya tıklayın.
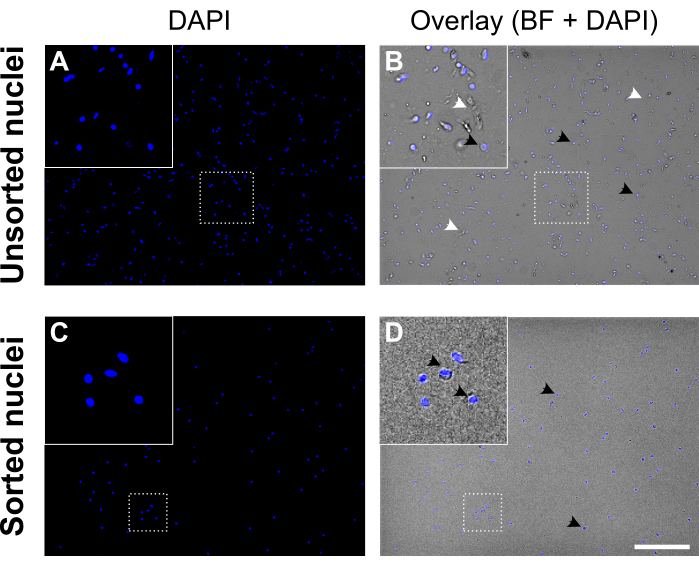
Şekil 5: Çekirdek sıralamadan önce ve sonra çekirdek süspansiyonu. (A, C) DAPI boyalı çekirdekler (mavi). (B, D) DAPI ve parlak alan (BF) kanalının bindirmesi. Sıralamadan önce (üst panel) çekirdek süspansiyonu hücre kalıntıları ve agregalar (beyaz ok uçlarıyla etiketlenmiş) içerir. Sıralamadan sonra (alt panel) çekirdek süspansiyonu çok daha temiz görünür. DAPI lekeli çekirdek örnekleri siyah ok uçlarıyla etiketlenmiştir. Kaliteli çekirdekler sağlam bir zarla yuvarlak ve pürüzsüz görünür ve iyi ayrılırken, düşük kaliteli çekirdekler buruşuk görünür ve nükleer zarın kaybını gösterir. Ölçek çubuğu = 250 μm. Bu şeklin daha büyük bir versiyonunu görüntülemek için lütfen buraya tıklayın.
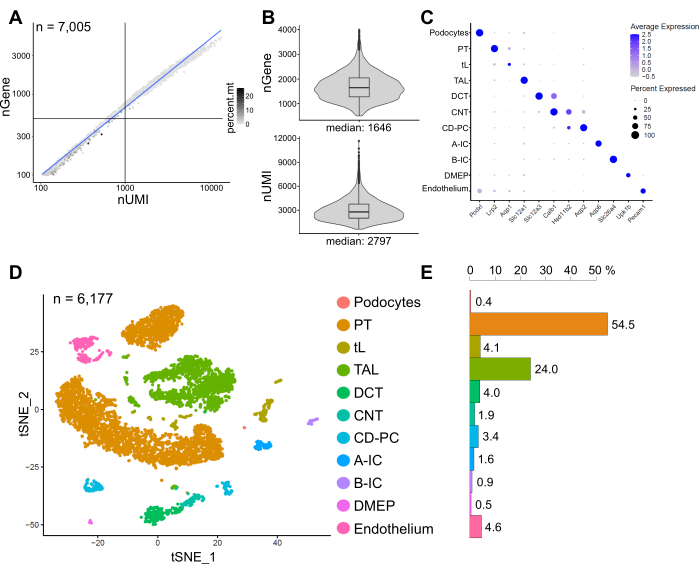
Şekil 6: Temsili bir snRNA-seq veri kümesinin kalite kontrolü ve analizi. (A) Mitokondriyal okumaların fraksiyonu (percent.mt) ile renklendirilen benzersiz moleküler tanımlayıcıların (nUMI) sayısına karşı çizilen gen sayısı (nGene). Düşük kaliteli çekirdekler, grafiğin sol alt çeyreğine karşılık gelir (n = 828) ve sonraki analizlerden hariç tutulmuştur. (B) 6.177 çekirdeği (> 500 geni) temsil eden snRNA-seq veri kümesinde çekirdek başına tespit edilen nGene ve nUMI'nin dağılımı ve medyanı. Kütüphaneler, çekirdek başına ~ 8.200 haritalanmış okuma medyan derinliğine dizilendi. (C) Bireysel hücre tipleri (y ekseni) için küme bakımından zenginleştirilmiş belirteçlerin (x ekseni) gen ekspresyon modellerini gösteren nokta grafiği. Noktanın boyutu, belirtilen geni ifade eden hücrelerin oranına karşılık gelir. Renk ortalama ifadeye karşılık gelir. (D) Tanımlanan hücre tiplerinin T-dağıtılmış stokastik komşu gömme (t-SNE) grafiği. (E) snRNA-seq veri kümesinde hücre tipi dağılımı. PT, proksimal tübül; tL, ince uzuv; TAL, kalın yükselen uzuv, DCT, distal kıvrımlı tübül; CNT, tübül bağlama; CD-PC, kanal ana hücrelerini toplayan; A-IC, tip A intercalated hücreler; B-IC, tip B interkalasyonlu hücreler; DMEP, pelvisin derin medüller epiteli. Bu şeklin daha büyük bir versiyonunu görüntülemek için lütfen buraya tıklayın.
| Reaktif | Son konsantrasyon | Ses seviyesi (mL) | ||
| (A) % 4 BSA / PBS | ||||
| %10 Sığır Albüminli Fosfat Tamponlu Tuzlu Sin (PBS) | 4% | 2 | ||
| PBS (Fosfat Tamponlu Salin) kalsiyum veya magnezyum olmadan 1X | - | 3 | ||
| (B) % 0,04 BSA / PBS | ||||
| % 4 BSA / PBS | 0.04 % | 0.5 | ||
| PBS (Fosfat Tamponlu Salin) kalsiyum veya magnezyum olmadan 1X | - | 49.5 | ||
| (C) Çekirdek Lizis Tamponu 1 (NLB1) | ||||
| Nükleer EZ Lizis Tamponu | - | 4 | ||
| RiboLock RNaz İnhibitörü (40 U/μL) | 1 U/μL | 0.1 | ||
| Ribonükleozit-vanadil kompleksi (200 mM) | 10 mM | 0.2 | ||
| (D) Çekirdek Lizis Tamponu 2 (NLB2) | ||||
| Nükleer EZ Lizis Tamponu | - | 4 | ||
| RiboLock RNaz İnhibitörü (40 U/μL) | 1 U/μL | 0.1 | ||
| (E) Çekirdek Süspansiyon Tamponu (NSB) | ||||
| % 0,04 BSA / PBS | - | 2 | ||
| RiboLock RNaz İnhibitörü (40 U/μL) | 1 U/μL | 0.05 | ||
| (F) Sakkaroz Gradyan Tamponu (%10 Sakkaroz) | ||||
| Ağırlık 1 g Sakkaroz | ||||
| 6 ml Nükleer EZ Lizis Tamponunda çözün | ||||
| Nükleer EZ Lizis Tamponu ile 10 mL'ye kadar dolum yapın | ||||
| 0,2 μm'lik bir şırınga filtresinden taze bir tüpe süzün | ||||
Tablo 1: Çözelti tarifleri: (A) %4 BSA/1x PBS hazırlanması. 0,2 μm SFCA membran şırınga filtresi kullanarak filtreleyin ve kullanana kadar buz üzerinde tutun. (B) %0,04 BSA/1 x PBS hazırlanması. 0,2 μm SFCA membran şırınga filtresi kullanarak filtreleyin ve kullanana kadar buz üzerinde tutun. (C) Çekirdek Lizis Tamponu 1'in (NLB1) Hazırlanması. Belirtilen hacimler numune başına sağlanır. Kullanana kadar buz üzerinde tutun. (D) Çekirdek Lizis Tamponu 2'nin (NLB2) Hazırlanması. Belirtilen hacimler numune başına sağlanır. RiboLock RNase İnhibitörünü protokolde belirtildiği gibi kullanmadan hemen önce NLB2'ye ekleyin. Kullanana kadar buz üzerinde tutun. (E) Çekirdek Süspansiyon Tamponunun (NSB) Hazırlanması. Belirtilen hacimler numune başına sağlanır. RiboLock RNase İnhibitörünü protokolde belirtildiği gibi kullanmadan hemen önce NSB'ye ekleyin. Kullanana kadar buz üzerinde tutun. (F) Sakkaroz gradyan tamponunun hazırlanması. 0,2 μm SFCA membran şırınga filtresi kullanarak filtreleyin ve kullanana kadar buz üzerinde tutun.
Tartışmalar
Tek hücreli transkriptomikler, böbrek fizyolojisi ve hastalığında hücre tipine özgü gen ekspresyonunun anlaşılmasını ilerletir. Burada, snRNA-seq için yüksek kaliteli tek çekirdekleri dondurulmuş fare böbrek dokusundan standart bir şekilde izole etmek için basit ve tekrarlanabilir bir yöntem sağladık.
snRNA-seq için, kütüphane üretimi için girdi olarak yüksek kaliteli çekirdeklerin kullanılması ve doku işleme sırasında RNA bozulmasının önlenmesi çok önemlidir. Bu nedenle, diseksiyondan hemen sonra RNA stabilizasyon çözeltisinde doku parçalarının inkübasyonu, hücresel RNA'yı korumak ve stabilize etmek için gereklidir ve numunelerin süresiz olarak - 80 ° C'de saklanmasına izin verir. Bu protokolü, arşiv materyali gibi RNA stabilizasyon çözeltisi tedavisi olmadan dondurulmuş dokuya uygularken, bir deneme çalışması gereklidir ve RNA stabilizasyon çözeltisinde önceden inkübasyon yapılmadan dondurulmuş dokuda önemli bir RNA bütünlüğü kaybı gözlemlediğimiz için RNA kalitesinin değerlendirilmesi gerekir.
Genel olarak, uygun numune işleme, bozulmamış, tek çekirdeklerin geri kazanımını en üst düzeye çıkarmak için çok önemlidir. Tüm yeniden süspansiyon adımları, kayma stresini ve fiziksel hasarı önlemek için dikkatlice pipetle pipetlenerek gerçekleştirilmelidir. Son çekirdek ressüspansiyonu ve çekirdek ayıklama için tamponlar, çekirdek kaybını ve kümelenmesini önlemek için BSA içermelidir.
Bu protokoldeki tampon hacimleri çok küçük doku örnekleri (~ 15 mg) için optimize edilmiştir. Yüksek kaliteli süspansiyonlar oluşturmak için tam hücre lizisi ve yeterli yıkama sağlamak çok önemlidir. Daha büyük doku blokları veya tüm böbrek örnekleri, kümelenme ve agregasyona, yüksek miktarda ortam RNA'sına ve genel olarak düşük süspansiyon kalitesine yol açan aşırı çekirdek konsantrasyonlarına neden olacaktır. Daha büyük numuneler veya diğer dokular işlenirse, minimum ortam RNA seviyeleri için en uygun tampon hacimlerini belirlemek için deneme çalışmaları yapılması şiddetle tavsiye edilir. Çekirdek ve RNA kalitesi ve konsantrasyonları, aşırı yüklenmenin genel olarak düşük performansa neden olması nedeniyle dikkatlice incelenmelidir.
Ek olarak, tek çekirdeklerle ilişkili olmayan yüksek seviyelerde ortam RNA'sına neden olan büyük miktarda hücre kalıntısı, dizileme sonuçlarını olumsuz yönde etkiler. Çekirdek süspansiyonunun bir sakkaroz yastığı yoluyla santrifüjleme yoluyla açıklığa kavuşturulması bu sorunu bir dereceye kadar hafifletir, ancak aynı zamanda, örneğin bağışıklık hücrelerinde bulunan yoğun, küçük çekirdeklere karşı karşı seçim yaparak hücre tipi temsilinde önyargıya yol açabilir16. Bu endişe vericiyse, sakkaroz gradyanı ihmal edilmelidir. Buna karşılık, DAPI boyamasına dayalı akış sitometrisinin, yüksek kaliteli bir tek çekirdek süspansiyonu üretmek için hücre kalıntıları miktarını azaltmak için kritik olduğunu bulduk.
Tek çekirdeklerin izolasyonu, tek hücreli yaklaşımlara kıyasla önemli avantajlara sahiptir8. Düzgün dondurulmuş doku ile uyumludur, doku koleksiyonunu daha esnek hale getirir ve transkripsiyonelstres yanıtlarını 6,17 getirebilen enzim bazlı doku ayrışması ihtiyacını ortadan kaldırır. Ayrıca, renal korteksin kolayca ayrışabilen hücre tiplerinin seçimini destekleyen ayrışma yanlılığının üstesinden gelir, bu da bazı enzim bazlı yaklaşımlarda medüller hücre tiplerinin yetersiz temsiline yol açabilir 5,6,10.
Tüm böbrek dokusu yerine merkezi bir böbrek parçası kullanmak, kaynakları daha da korur ve daha önce açıklandığı gibi bol miktarda hücre tipinin aşırı temsilini düzeltir10. Bununla birlikte, araştırılan fare modeline veya fenotipe bağlı olarak, tek bir orta dilim yerine bütün böbrek örneklerinin kullanılması faydalı olabilir. Tüm böbrek örnekleri, gerçek hücre oranlarını veya tüm böbrekte meydana gelen değişiklikleri daha iyi temsil edebilirken, kesilmiş bir orta dilim, medüller fenotipler için veya numune materyali sınırlı olduğunda avantajlı olduğunu kanıtlamıştır. Bu nedenle, bu karar son derece kullanıcıya özgüdür ve dikkatlice düşünülmelidir.
Açıklamalar
Yazarların açıklayacak hiçbir şeyleri yoktur.
Teşekkürler
Teknik destek için Berlin'deki Helmholtz Derneği'ndeki Max Delbrück Moleküler Tıp Merkezi'ndeki Bilimsel Genomik Platformuna teşekkür ederiz.
JL ve KMSO, Alman Araştırma Vakfı (DFG) Araştırma Eğitim Grubu GRK 2318 ve Araştırma Birimi FOR 2841 tarafından desteklenmiştir. KMSO, Collaborative Research Grant 1365 tarafından desteklenmiştir. AB, NR'ye verilen DFG'nin Gottfried Wilhelm Leibniz Ödülü'nün finansmanıyla desteklendi.
Malzemeler
| Name | Company | Catalog Number | Comments |
| Cell sorter | - | - | For fluorescence-activated cell sorting (FACS); e.g. BD FACSAria Cell Sorter. |
| Centrifuge 5810 R | Eppendorf | 5811000015 | |
| Countess Cell Counting Chamber Slides | Invitrogen | C10228 | |
| Countess II FL Automated Cell Counter | Invitrogen | AMQAF1000 | Needs to contain DAPI light cube to count nuclei. Alternatively, nuclei can be counted manually under fluorescence microscope. |
| 4′,6-Diamidino-2-phenyl-indol-dihydrochlorid (DAPI) | Biotrend | 40043/b | Stock solution prepared with a concentration of 100 µM. Used for nuclei staining in a final concentration of 2 µM. |
| D(+)-Sucrose ≥99.9%, ultrapure DNAse-, RNAse-free | VWR | 0335-500G | |
| DNA LoBind Microcentrifuge Tubes (1.5 mL) | Eppendorf | 22431021 | |
| Ethanol, 70 % | - | - | |
| FACS tubes | pluriSelect | 43-10100-46 | |
| KIMBLE Dounce tissue grinder set 2 mL complete | Sigma-Aldrich | D8938-1SET | |
| Minisart Syringe Filters 0.2 µm | Sartorius | 16534-GUK | |
| Nuclease-free Water | Invitrogen | AM9937 | |
| Nuclei EZ Prep Nuclei Isolation Kit | Sigma-Aldrich | NUC-101 | Nuclei EZ Lysis Buffer (Product No. N3408) needed for buffer preparation. |
| PBS (Phosphate-Buffered Saline) 1X without calcium or magnesium | Corning | 21-040-CV | |
| Petri dishes, polystyrene 60 mm | Sigma-Aldrich | P5481 | |
| Phosphate-Buffered Saline (PBS) with 10% Bovine Albumin | Sigma-Aldrich | SRE0036 | |
| pluriStrainer Mini 100 µm | pluriSelect | 43-10100-46 | |
| pluriStrainer Mini 20 µm | pluriSelect | 43-10020-40 | |
| pluriStrainer Mini 40 µm | pluriSelect | 43-10040-40 | |
| Polystyrene Centrifuge Tube (15 mL) | Falcon | 352099 | |
| Razor blades | - | - | |
| RiboLock RNase Inhibitor (40 U/µL) | Thermo Fisher | EO0384 | |
| Ribonucleoside-vanadyl complex | New England Biolabs | S1402S | Follow manufacturer's instructions (https://international.neb.com/products/s1402-ribonucleoside-vanadyl-complex#Product%20Information). Upon use the 200 mM stock solution is reconstituted to a green-black clear solution by incubating at 65 °C. |
| RNAlater Stabilization Solution | Invitrogen | AM7020 | |
| RNase AWAY | Fisher Scientific | 11952385 |
Referanslar
- Thomas, R. S. Kidney modeling and systems physiology. Wiley Interdisciplinary Reviews: Systems Biology and Medicine. 1 (2), 172-190 (2009).
- Potter, S. S. Single-cell RNA sequencing for the study of development, physiology and disease. Nature Reviews Nephrology. 14 (8), 479-492 (2018).
- Park, J., Liu, C. L., Kim, J., Susztak, K. Understanding the kidney one cell at a time. Kidney International. 96 (4), 862-870 (2019).
- Clark, A. R., Greka, A. The power of one: advances in single-cell genomics in the kidney. Nature Reviews Nephrology. 16 (2), 73-74 (2020).
- Lake, B. B., et al. A single-nucleus RNA-sequencing pipeline to decipher the molecular anatomy and pathophysiology of human kidneys. Nature Communications. 10 (1), 2832(2019).
- Wu, H., Kirita, Y., Donnelly, E. L., Humphreys, B. D. Advantages of single-nucleus over single-cell RNA sequencing of adult kidney: Rare cell types and novel cell states revealed in fibrosis. Journal of the American Society of Nephrology. 30 (1), 23-32 (2019).
- Adam, M., Potter, A. S., Potter, S. S. Psychrophilic proteases dramatically reduce single-cell RNA-seq artifacts: a molecular atlas of kidney development. Development. 144 (19), 3625-3632 (2017).
- Habib, N., et al. Massively parallel single-nucleus RNA-seq with DroNc-seq. Nature Methods. 14 (10), 955-958 (2017).
- Muto, Y., et al. Single cell transcriptional and chromatin accessibility profiling redefine cellular heterogeneity in the adult human kidney. Nature Communications. 12 (1), 2190(2021).
- Hinze, C., et al. Kidney single-cell transcriptomes predict spatial corticomedullary gene expression and tissue osmolality gradients. Journal of the American Society of Nephrology. 32 (2), 291(2021).
- Berger, S. L. Isolation of cytoplasmic RNA: ribonucleoside-vanadyl complexes. Methods in Enzymology. 152, 227-234 (1987).
- Butler, A., Hoffman, P., Smibert, P., Papalexi, E., Satija, R. Integrating single-cell transcriptomic data across different conditions, technologies, and species. Nature Biotechnology. 36 (5), 411-420 (2018).
- Stuart, T., et al. Comprehensive Integration of single-cell data. Cell. 177 (7), 1888-1902 (2019).
- Park, J., et al. Single-cell transcriptomics of the mouse kidney reveals potential cellular targets of kidney disease. Science. 360 (6390), 758-763 (2018).
- Kirita, Y., Wu, H., Uchimura, K., Wilson, P. C., Humphreys, B. D. Cell profiling of mouse acute kidney injury reveals conserved cellular responses to injury. Proceedings of the National Academy of Sciences of the United States of America. 117 (27), 15874-15883 (2020).
- Schneeberger, S., et al. The neuroinflammatory interleukin-12 signaling pathway drives Alzheimer's disease-like pathology by perturbing oligodendrocyte survival and neuronal homeostasis. bioRxiv. , 441313(2021).
- Nguyen, Q. H., Pervolarakis, N., Nee, K., Kessenbrock, K. experimental considerations for single-cell RNA sequencing approaches. Frontiers in Cell and Developmental Biology. 6, 108(2018).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır