Method Article
Выделение ядер из почек взрослой мыши для секвенирования одноядерной РНК
* Эти авторы внесли равный вклад
В этой статье
Резюме
Здесь мы представляем протокол выделения высококачественных ядер из замороженных почек мыши, который улучшает представление типов медуллярных клеток почек и позволяет избежать артефактов экспрессии генов от ферментативной диссоциации тканей.
Аннотация
Почки регулируют различные биологические процессы, такие как вода, электролит и кислотно-щелочной гомеостаз. Физиологические функции почек выполняются несколькими типами клеток, расположенных в сложной архитектуре по всей кортикомедуллярной оси органа. Последние достижения в области одноклеточной транскриптомики ускорили понимание экспрессии генов, специфичных для клеточного типа, в физиологии и заболеваниях почек. Однако протоколы диссоциации тканей на основе ферментов, которые часто используются для секвенирования одноклеточной РНК (scRNA-seq), требуют в основном свежей (неархивированной) ткани, вводят транскрипционные стрессовые реакции и способствуют отбору обильных типов клеток коры почек, что приводит к недопредставленности клеток продолговатого мозга.
Здесь мы представляем протокол, который позволяет избежать этих проблем. Протокол основан на выделении ядер при 4 °C из замороженной почечной ткани. Ядра выделены из центральной части почки мыши, состоящей из коры, наружного продолговатого вещества и внутреннего мозгового вещества. Это уменьшает чрезмерную представленность корковых клеток, типичных для образцов цельных почек, в пользу медуллярных клеток, так что данные будут представлять всю кортикомедуллярную ось в достаточном количестве. Протокол прост, быстр и адаптируем и обеспечивает шаг к стандартизации одноядерной транскриптомики в исследованиях почек.
Введение
Почки демонстрируют очень сложную тканевую архитектуру. Они состоят из функционально и анатомически различных сегментов вдоль кортикомедуллярной оси и опосредуют биологические функции, такие как регуляция объема внеклеточной жидкости, электролитного баланса или кислотно-щелочного гомеостаза1.
Достижения в области одноклеточной транскриптомики позволили глубоко охарактеризовать сложные ткани и ускорили понимание экспрессии генов, специфичных для сегментов и типов клеток, в физиологии, развитии и заболеваниях почек 2,3,4.
Однако протоколы диссоциации на основе ферментов, которые часто используются для секвенирования скРНК, имеют ряд недостатков и ограничений. В зависимости от протокола они генерируют транскрипционные стрессовые реакции и смещение диссоциации тканей в сторону легче диссоциирующих типов корковых клеток 5,6. Хотя протоколы с использованием холодно-активных протеаз для эмбриональных почек способны смягчить транскрипционные изменения, связанные со стрессом, они не могут преодолеть смещение диссоциации в сторону корковых клеток и могут быть нелегко адаптированы к различным типам пораженных тканей почек7. Кроме того, одноклеточные подходы нелегко совместимы с замороженными образцами тканей, что ограничивает их применение в основном неархивированными свежими тканями, что делает сбор тканей ограничивающим фактором6.
Секвенирование одноядерной РНК (snRNA-seq) может обойти эти ограничения 8,9. Здесь мы представляем протокол выделения ядер из центрального среза замороженной ткани почек взрослой мыши (рис. 1)10. Наш протокол прост и обеспечивает стандартизированный подход к получению библиотек секвенирования РНК со сбалансированным представлением различных типов клеток почек для экспериментальных моделей, которые не связаны с сильными региональными изменениями ткани. В последнем случае наш протокол также может быть выполнен с целыми почками.
протокол
Все эксперименты на животных проводились в соответствии с Законом о благополучии животных (TierSchG) и Положением о защите животных в экспериментальных условиях (TierSchVersV) и были санкционированы местными властями и сотрудниками по защите животных в нашем учреждении (MDC).
1. Подготовка тканей
- Подготовьте 6-луночную пластину, содержащую 2 мл 1x фосфатно-буферного физиологического раствора (PBS) на лунку для каждой почки, которая будет получена. Подготовьте 6-луночную пластину, содержащую 2 мл стабилизационного раствора РНК на лунку и почку. Предварительно охладите обе тарелки на льду.
- Усыпить 3-6-месячного самца мыши C57BL/6. Поместите мышь на препарирующий лоток, прижмите конечности и стерилизуйте брюшную полость 70% этанолом.
- Вскрывают живот вплоть до грудной клетки с помощью щипцов и ножниц. Поднимите кишечник и другие органы в сторону и удалите почки, аккуратно разрезав ножницами мочеточник, почечную артерию и вену. Промойте почку в предварительно подготовленном ледяном 1x PBS и удалите почечную фасцию и оставшийся жир из почек до тех пор, пока не будет удалена вся белая ткань (рис. 2A).
- Поместите почку на холодную рассекающую пластину и острым лезвием скальпеля или бритвы получите средний срез 1-2 мм. Убедитесь, что кусок ткани содержит всю кортикомедуллярную ось (рис. 2B). Используйте микродиссекционные ножницы и щипцы, чтобы аккуратно обрезать кору по бокам центральной части. Внутри рассеченного куска ткани должны быть хорошо видны три сегмента коры, наружный продолговатый мозг и внутренний мозговый мозг (рис. 2C).
ПРИМЕЧАНИЕ: Толщина среза не должна превышать 2 мм или веса 20 мг, чтобы обеспечить достаточное количество буфера для эффективного лизиса тканей и свести к минимуму фоновую РНК окружающей среды в библиотеках кДНК. Окружающая РНК теряет емкость последовательности, поскольку она не связана с отдельными ядрами. - Переносят кусочек почки в заранее приготовленный раствор для стабилизации РНК и инкубируют в течение 24 ч при 4 °C, чтобы избежать деградации РНК. Через 24 ч удалить стабилизирующий раствор РНК и хранить ткань при -80 °C до дальнейшего использования. Аккуратно удалите излишки раствора папиросной бумагой.
2. Выделение ядер
- Этапы очистки и подготовки
- Очистите столешницы и пипетки 70% раствором для обеззараживания этанола и РНКазы.
- Очистите трубку тканевой шлифовальной машины с круглым дном объемом 2 мл и соответствующий пестик А и В раствором для обеззараживания РНКазы, а затем 70% этанола и воды, не содержащей РНКазы (1 трубка кофемолки и набор пестиков на образец). Дайте ему полностью высохнуть.
- Предварительно охладите центрифугу до 4 °C.
- Промаркируйте и предварительно охладите три пробирки для сбора по 15 мл, пробирку для сбора 1,5 мл, пробирку для сбора 5 мл, активируемую флуоресценцией сортировку клеток (FACS) и пробирку для сухой измельчители для каждого образца на льду.
- Подготовка буфера
- Нагрейте исходный раствор рибонуклеозид-ванадилового комплекса до 65 °C до получения прозрачного раствора зелено-черного цвета в соответствии с инструкциями производителя. 11 См.
- Приготовьте 1x PBS, содержащий 4% бычьего сывороточного альбумина (BSA), как описано в таблице 1A. Дополнительно приготовьте 1x PBS с 0,04% BSA (таблица 1B). Отфильтруйте оба раствора с помощью мембранного шприцевого фильтра из ацетата целлюлозы (SFCA) без поверхностно-активного вещества 0,2 мкм и держите на льду до дальнейшего использования.
- Подготовьте буфер для лизиса ядер 1 (NLB1, таблица 1C). Добавьте 4 мл буфера для лизиса EZ для буфера для лизиса ядер 2 (NLB2, таблица 1D) и 2 мл 0,04% BSA / PBS для буфера суспензии ядер (NSB, таблица 1E) в пробирки объемом 15 мл. Добавьте раствор ингибитора РНКазы к NLB2 и NSB непосредственно перед использованием, как указано ниже в протоколе. Держать на льду до дальнейшего использования.
- Приготовьте буфер лизиса EZ с 10% сахарозой (буфер градиента сахарозы, таблица 1F). Хорошо перемешайте и отфильтруйте буфер в свежую пробирку объемом 15 мл с помощью мембранного шприцевого фильтра SFCA 0,2 мкм. Держать на льду до дальнейшего использования.
- Гомогенизация тканей и лизис клеток
ПРИМЕЧАНИЕ: Чтобы свести к минимуму деградацию РНК, все этапы выполняются на льду. Трубку измельчителя, чашку Петри и все буферы необходимо предварительно охладить. Все этапы ресуспендирования выполняются путем осторожного пипетирования суспензии ядер. Не вихревайте образец, чтобы избежать сдвиговых усилий и повреждения ядер.- Возьмите замороженный кусочек почки и переложите его в 60-миллиметровую полистирольную чашку Петри на льду, содержащую 1 мл NLB1.
- Тщательно измельчите ткань бритвенным лезвием или скальпелем (рис. 3A).
- Отрежьте наконечник наконечника пипетки объемом 1 мл и перенесите измельченную ткань и буфер в трубку кофемолки. Обязательно перенесите все кусочки ткани. При необходимости вымойте чашку Петри 5-10 раз с буфером.
- Гомогенизируйте суспензию на льду, медленно перемещая пестик А, 25 раз вверх и вниз в трубке кофемолки. Избегайте пузырьков воздуха, вызванных быстрым движением (рис. 3B).
- Пропустите гомогенат через сетчатый фильтр 100 мкм в предварительно охлажденной сборной пробирке объемом 15 мл и промойте фильтр еще 1 мл NLB1.
- Промойте трубку измельчителя холодным буфером для лизиса ядер EZ и выбросьте буфер.
- Перенесите гомогенат обратно в трубку измельчителя и гомогенизируйте суспензию на льду, медленно перемещая пестик B, 15x вверх и вниз в трубке измельчителя. Избегайте пузырьков воздуха, вызванных быстрым движением (рис. 3C).
- Перелейте гомогенат в предварительно охлажденную пробирку объемом 15 мл. Промойте пробирку кофемолки еще 2 мл NLB1 и обязательно перенесите все фрагменты ткани в пробирку для сбора. Инкубируйте гомогенат (общий объем 4 мл) в течение 5 мин на льду для лизиса клеток.
- Очистка ядер
- Пропустите гомогенат через сетчатое фильтр размером 40 мкм в предварительно охлажденную сборную пробирку объемом 15 мл. Отжимите сборную трубку в течение 5 мин при 500 x g при 4 °C в центрифуге с ротором с качающимся ковшом. Тем временем добавьте раствор ингибитора РНКазы в NLB2 (таблица 1D).
- Удалите надосадочную жидкость, не нарушая гранулы. Осторожно ресуспендируйте гранулу в 4 мл NLB2.
- Тщательно подложите суспензию подушкой объемом 1 мл буфера градиента сахарозы. Центрифуга при 500 x g в течение 5 мин при 4 °C в центрифуге с ротором с качающимся ковшом. Тем временем добавьте раствор ингибитора РНКазы в NSB (таблица 1E).
- После центрифугирования осторожно извлеките сборную трубку из центрифуги и будьте осторожны, чтобы не повредить два слоя при работе с сборной пробиркой. Между двумя слоями виден клеточный мусор. Удалите надосадочную жидкость осторожно, начиная с мусора. Удалите остатки надосадочной жидкости, не нарушая гранулу ядер, и осторожно ресуспендируйте гранулу в 1 мл NSB.
ПРИМЕЧАНИЕ: Объем ресуспендирования зависит от количества ткани, используемой для выделения, и размера гранул, полученного после последней стадии центрифугирования. Возможно, потребуется адаптировать объем к ожидаемому количеству ядер. - Пропустите гомогенат через сетчатый фильтр 20 мкм в предварительно охлажденную пробирку для сбора FACS объемом 5 мл.
3. Сортировка ядер
- Добавьте 20 мкл 4',6-диамидино-2-фенилиндола (DAPI) на мл NSB до конечной концентрации 2 мкМ к гомогенату в пробирке для сбора FACS и тщательно перемешайте. Инкубировать 5 минут на льду.
- Приготовьте предварительно охлажденную пробирку для сбора объемом 1,5 мл с 20 мкл 4% BSA / 1x PBS и добавьте 0,5 мкл раствора ингибитора РНКазы до конечной концентрации 1 Ед / мкл. Немедленно приступайте к сортировке.
- Отсортируйте ядра с помощью сортировщика клеток.
- Ненадолго перемешайте суспензию ядер, прежде чем вставлять сборную пробирку FACS в сортировщик.
- Установите первый затвор P1 на основе прямого рассеяния (FSC) и бокового рассеяния (SSC), чтобы исключить мусор и агрегаты (рис. 4A).
- Чтобы исключить пустые или поврежденные ядра и кратные ядра, установите последующий вентиль на основе DAPI-площади и DAPI-высоты (DAPI-A против DAPI-H) (рис. 4B).
- Отсортируйте отдельные ядра в пробирку для сбора объемом 1,5 мл, содержащую 4% BSA/1x PBS с 1 ЕД/мкл раствором ингибитора РНКазы, приготовленным в 3,2.
4. Контроль качества
- Измерьте конечную концентрацию ядер под флуоресцентным микроскопом или в автоматизированной счетной камере, по крайней мере, в двух независимых подсчетах и оцените качество суспензии (рис. 5).
ПРИМЕЧАНИЕ: Оптимальные концентрации составляют от 700 до 1,200 ядер / мкл. Более низкие концентрации клеток, такие как 700 ядер / мкл, могут быть предпочтительными, поскольку результирующие библиотеки кДНК содержат меньше фоновой РНК окружающей среды (транскрипты, не связанные с отдельными ядрами). - Рассчитайте необходимый объем суспензии ядер для желаемого восстановления секвенированных одиночных ядер. Чтобы избежать агрегации ядер и деградации РНК, немедленно приступайте к подготовке библиотеки.
Результаты
Чтобы определить производительность нашего протокола, мы использовали 10x Genomics Chromium Single Cell 3' Gene Expression Kit v3.1 для подготовки библиотеки и проанализировали данные snRNA-seq с пакетом Seurat12,13.
На рисунке 6 показаны результаты репрезентативной библиотеки snRNA-seq. Чтобы оценить качество наших ядер, мы построили график зависимости количества генов от количества транскриптов (определяемых уникальными молекулярными идентификаторами (UMI)), окрашенных по доле митохондриальных считываний (рис. 6A). Ядра хорошего качества обычно показывают более высокое количество считываний, коррелирующих UMI и количество генов, а также низкие митохондриальные фракции считывания.
Для последующего анализа были исключены ядра с менее чем 500 или более 4000 подсчитанных генов, или более 5% митохондриальной РНК (n = 828). Были включены только гены, экспрессируемые как минимум в трех ядрах. Мы обнаружили в общей сложности около 20 000 генов в оставшихся 6 000 ядер с 1 600 медианными генами и 2 800 медианными UMI на ядро (рис. 6B).
Кластеризация была основана на сильно вариабельных генах. Всего было выявлено 18 кластеров. Идентичность клеток была аннотирована на основе известных маркерных генов (не показаны). Субкластеры одного типа клеток были объединены в один кластер, в результате чего в общей сложности было выделено 11 различных типов клеток: подоциты, проксимальный каналец (PT), тонкая конечность (tL), толстая восходящая конечность (TAL), дистальный извитый каналец (DCT), соединительный каналец (CNT), основные и интеркалированные клетки собирательного протока (CD-PC, A-IC, B-IC), глубокий медуллярный эпителий таза (DMEP) и эндотелий. Паттерны экспрессии генов маркеров, обогащенных кластерами, визуализировались на точечном графике (рис. 6C), а кластеры клеточного типа — на графике t-распределенного стохастического встраивания соседей (t-SNE) (рис. 6D).
Для оценки распределения типов клеток в нашей выборке был рассчитан процент каждого типа клеток (рис. 6E) и использован для определения отношения PT к TAL. PT в основном расположен в коре почек и часто чрезмерно представлен в одноклеточных наборах данных почек, поскольку клетки PT легко диссоциируют и очень распространены в целых образцах почек. ТАЛ, с другой стороны, простирается через весь наружный продолговатый мозг14. Таким образом, соотношение фракций PT и TAL представляет собой хорошую меру для обогащения типов медуллярных клеток в одноклеточном наборе данных почек. В целом, соотношение PT/TAL в одноклеточных наборах данных по целым почкам варьировалось от 8 (неопубликованные данные из целой ткани почек, обработанной холодовой протеазой) до 45 для ферментативно диссоциированной ткани10,14,15. В представленном здесь наборе данных snRNA-seq мы смогли достичь соотношения PT/TAL, равного 2. Этот результат иллюстрирует, что удаление лишней коры во время рассечения тканей в сочетании с snRNA-seq приводит к поразительно улучшенному представлению типа клеток почек.
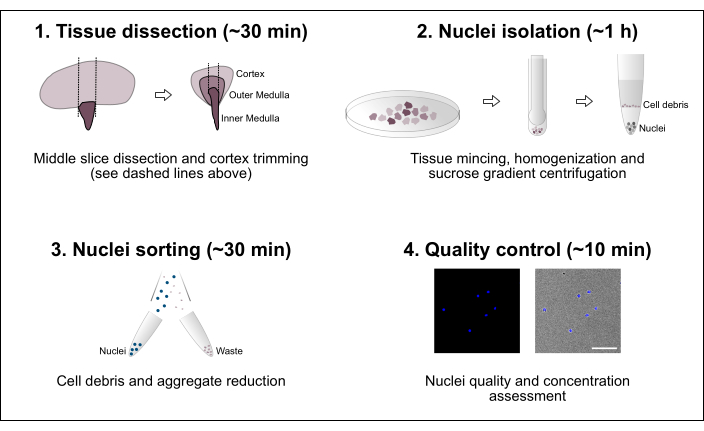
Рисунок 1: Схематический обзор рабочего процесса. Протокол состоит из четырех основных этапов, которые включают вскрытие тканей с последующим выделением ядер, сортировкой ядер и окончательной оценкой чистоты и концентрации. Масштабная линейка = 100 мкм. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
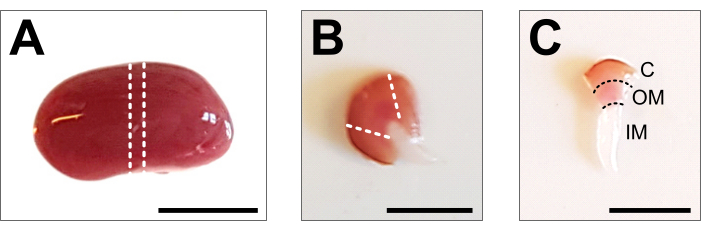
Рисунок 2: Рассечение почки и подготовка тканей . (А) Репрезентативное изображение рассеченной всей почки. Пунктирными линиями обозначены разрезы, необходимые для получения среднего среза размером 1-2 мм с изображением всех типов почечных клеток. (B) Репрезентативное изображение полученного среднего среза. Пунктирными линиями обозначены срезы для обрезки коры сбоку. (C) Репрезентативное изображение центральной части почки с обрезанной корой. Хорошо видны кора (С), наружное мозговое вещество (ОМ) и внутреннее мозговое вещество (ИМ). Масштабная линейка = 500 мкм. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.

Рисунок 3: Гомогенизация тканей и очистка ядер . (A) Репрезентативное изображение, показывающее достаточно измельченную почечную ткань. Масштабная линейка = 500 мкм. (B) Гомогенат после первой стадии гомогенизации (25 ударов пестиком A, трубка измельчителя объемом 2 мл). (C) Гомогенат после второй стадии гомогенизации (15 ударов пестиком B, трубка измельчителя объемом 2 мл). Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
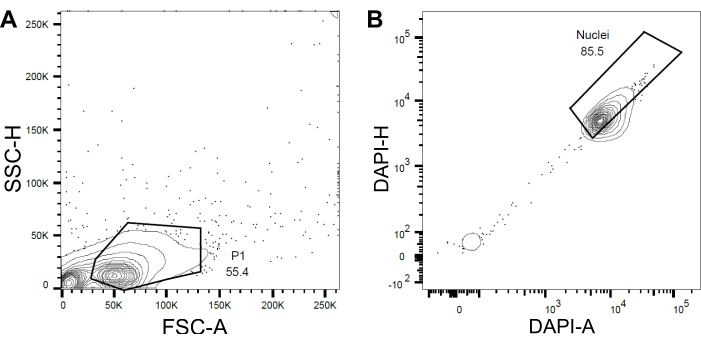
Рисунок 4: Стратегия стробирования для сортировки ядер. (A ) Первый затвор P1 был установлен на основе прямого рассеяния (FSC) и бокового рассеяния (SSC) для исключения мусора и агрегатов. (B ) Последующий вентиль, основанный на DAPI-площади (DAPI-A) и DAPI-высоте (DAPI-H), исключал пустые или поврежденные ядра и кратные ядра. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
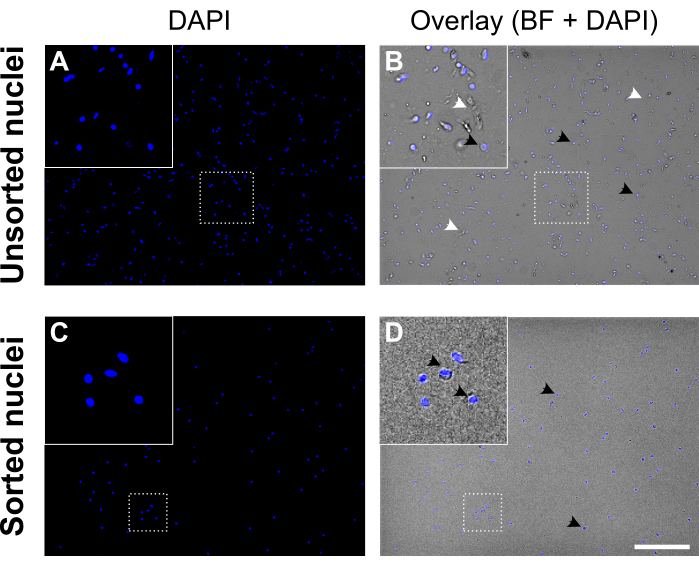
Рисунок 5: Суспензия ядер до и после сортировки ядер. (А, С) Ядра, окрашенные в DAPI (синий). (Б, Г) Наложение канала DAPI и светлого поля (BF). Перед сортировкой (верхняя панель) суспензия ядер содержит клеточный мусор и агрегаты (помеченные белыми наконечниками стрелок). После сортировки (нижняя панель) суспензия ядер выглядит намного чище. Примеры ядер, окрашенных DAPI, помечены черными наконечниками стрелок. Ядра хорошего качества выглядят круглыми и гладкими с неповрежденной мембраной и хорошо разделены, тогда как ядра низкого качества выглядят морщинистыми и демонстрируют потерю ядерной мембраны. Масштабная линейка = 250 мкм. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
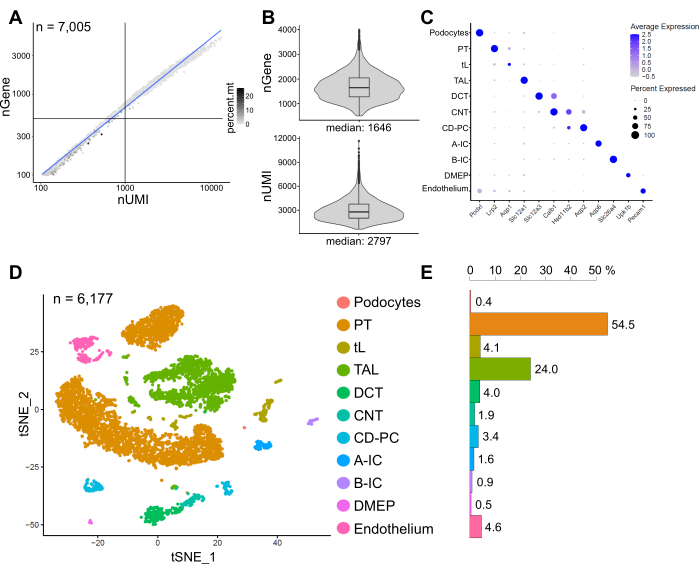
Рисунок 6: Контроль качества и анализ репрезентативного набора данных snRNA-seq. (A) Количество генов (nGene), построенных по отношению к количеству уникальных молекулярных идентификаторов (nUMI), окрашенных фракцией митохондриальных считываний (percent.mt). Ядра низкого качества соответствуют нижнему левому квадранту графика (n = 828) и были исключены из последующего анализа. (B) Распределение и медиана nGene и nUMI, обнаруженных на ядро в наборе данных snRNA-seq, представляющем 6 177 ядер (> 500 генов). Библиотеки были секвенированы на среднюю глубину ~ 8,200 отображенных чтений на ядро. (C) Точечная диаграмма, показывающая паттерны экспрессии генов маркеров, обогащенных кластерами (ось x) для отдельных типов клеток (ось y). Размер точки соответствует доле клеток, экспрессирующих указанный ген. Цвет соответствует среднему выражению. (D) График Т-распределенного стохастического встраивания соседей (t-SNE) идентифицированных типов клеток. (E) Распределение типов клеток в наборе данных snRNA-seq. ПТ, проксимальный каналец; tL, тонкая конечность; TAL, толстая восходящая конечность, DCT, дистальный извитый каналец; УНТ, соединительные канальцы; CD-PC, собирающий главные ячейки протока; A-IC, интеркалированные клетки типа А; B-IC, интеркалированные клетки типа B; DMEP, глубокий медуллярный эпителий малого таза. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
| Реагент | Конечная концентрация | Объем (мл) | ||
| (А) 4 % BSA / PBS | ||||
| Фосфатно-буферный физиологический раствор (PBS) с 10% бычьего альбумина | 4% | 2 | ||
| PBS (фосфатно-буферный физиологический раствор) 1X без кальция и магния | - | 3 | ||
| (B) 0,04 % BSA / PBS | ||||
| 4 % BSA / PBS | 0.04 % | 0.5 | ||
| PBS (фосфатно-буферный физиологический раствор) 1X без кальция и магния | - | 49.5 | ||
| (C) Буфер лизиса ядер 1 (NLB1) | ||||
| Ядерный буфер лизиса EZ | - | 4 | ||
| Ингибитор РНКазы RiboLock (40 ЕД/мкл) | 1 ЕД/мкл | 0.1 | ||
| Рибонуклеозид-ванадильный комплекс (200 мМ) | 10 мМ | 0.2 | ||
| (D) Буфер лизиса ядер 2 (NLB2) | ||||
| Ядерный буфер лизиса EZ | - | 4 | ||
| Ингибитор РНКазы RiboLock (40 ЕД/мкл) | 1 ЕД/мкл | 0.1 | ||
| е) Буфер суспензии ядер (NSB) | ||||
| 0,04 % BSA / PBS | - | 2 | ||
| Ингибитор РНКазы RiboLock (40 ЕД/мкл) | 1 ЕД/мкл | 0.05 | ||
| (F) Градиентный буфер сахарозы (10% сахарозы) | ||||
| Вес 1 г сахарозы | ||||
| Растворить в 6 мл Nuclear EZ Lysis Buffer | ||||
| Заполните до 10 мл буфером для лизиса Nuclear EZ | ||||
| Фильтруйте через шприцевой фильтр 0,2 мкм в свежую пробирку | ||||
Таблица 1: Рецепты растворов: (A) Приготовление 4% BSA/1x PBS. Отфильтруйте с помощью мембранного шприцевого фильтра SFCA 0,2 мкм и держите на льду до использования. (B) Приготовление 0,04% BSA/1 x PBS. Отфильтруйте с помощью мембранного шприцевого фильтра SFCA 0,2 мкм и держите на льду до использования. (C) Приготовление буфера для лизиса ядер 1 (NLB1). Указанные объемы приведены для каждого образца. Держать на льду до использования. d) Приготовление буфера для лизиса ядер 2 (NLB2). Указанные объемы приведены для каждого образца. Добавьте ингибитор РНКазы RiboLock в NLB2 непосредственно перед использованием, как указано в протоколе. Держать на льду до использования. е) Приготовление буфера суспензии ядер (NSB). Указанные объемы приведены для каждого образца. Добавьте ингибитор РНКазы RiboLock в NSB непосредственно перед использованием, как указано в протоколе. Держать на льду до использования. f) приготовление буфера градиента сахарозы. Отфильтруйте с помощью мембранного шприцевого фильтра SFCA 0,2 мкм и держите на льду до использования.
Обсуждение
Одноклеточная транскриптомика способствует пониманию экспрессии генов, специфичных для клеточного типа, в физиологии и заболеваниях почек. Здесь мы предоставили простой и воспроизводимый метод выделения высококачественных одиночных ядер из замороженной ткани почек мыши для snRNA-seq стандартизированным способом.
Для snRNA-seq крайне важно использовать высококачественные ядра в качестве входных данных для генерации библиотек и избегать деградации РНК во время обработки тканей. Таким образом, инкубация кусочков ткани в стабилизационном растворе РНК сразу после рассечения имеет важное значение для защиты и стабилизации клеточной РНК и позволяет хранить образцы при -80 ° C неограниченное время. При применении этого протокола к замороженным тканям без обработки стабилизационным раствором РНК, таким как архивный материал, требуется пробный запуск, и необходимо оценить качество РНК, поскольку мы наблюдали значительную потерю целостности РНК в замороженной ткани без предварительной инкубации в стабилизационном растворе РНК.
В целом, надлежащая обработка образцов имеет решающее значение для максимального извлечения интактных одиночных ядер. Все этапы ресуспендирования следует выполнять путем осторожного пипетирования, чтобы избежать напряжения сдвига и физического повреждения. Буферы для окончательной ресуспендирования ядер и сортировки ядер должны содержать BSA, чтобы избежать потери и агрегации ядер.
Буферные объемы в этом протоколе оптимизированы для очень маленьких образцов тканей (~ 15 мг). Крайне важно обеспечить полный лизис клеток и достаточную промывку для получения высококачественных суспензий. Более крупные тканевые блоки или целые образцы почек приведут к чрезмерным концентрациям ядер, которые приведут к слипанию и агрегации, высокому содержанию окружающей РНК и общему плохому качеству суспензии. Если обрабатываются более крупные образцы или другие ткани, настоятельно рекомендуется выполнить пробные запуски для определения оптимальных буферных объемов для минимальных уровней РНК в окружающей среде. Качество и концентрация ядер и РНК должны быть тщательно изучены, так как перегрузка приводит к общей низкой производительности.
Кроме того, большое количество клеточного мусора, вызывающее высокие уровни окружающей РНК, не связанной с отдельными ядрами, отрицательно влияет на результаты секвенирования. Осветление суспензии ядер центрифугированием через сахарозную подушку в некоторой степени смягчает эту проблему, но также может привести к смещению в представлении типа клеток путем встречного отбора по плотным маленьким ядрам, присутствующим, например, в иммунных клетках16. Если это вызывает беспокойство, градиент сахарозы следует опустить. Напротив, мы обнаружили, что проточная цитометрия, основанная на окрашивании DAPI, имеет решающее значение для уменьшения количества клеточного мусора для получения высококачественной суспензии отдельных ядер.
Выделение одиночных ядер имеет значительные преимущества по сравнению с одноклеточными подходами8. Он совместим с правильно замороженной тканью, что делает сбор тканей более гибким и устраняет необходимость диссоциации тканей на основе ферментов, что может привести к транскрипционным стрессовым реакциям 6,17. Кроме того, он преодолевает смещение диссоциации, которое благоприятствует отбору легко диссоциируемых типов клеток почечной коры, что может привести к недопредставленности типов медуллярных клеток в некоторых подходах, основанных на ферментах 5,6,10.
Использование центрального фрагмента почки вместо цельной почечной ткани дополнительно экономит ресурсы и корректирует чрезмерную представленность обильных типов клеток, как описано ранее10. Однако, в зависимости от модели мыши или исследуемого фенотипа, может быть полезно использовать целые образцы почек вместо одного среднего среза. Образцы целых почек могут быть более репрезентативными для истинных пропорций клеток или изменений, происходящих во всей почке, тогда как обрезанный средний срез оказался выгодным для медуллярных фенотипов или когда материал образца был ограничен. Таким образом, это решение в значительной степени зависит от пользователя и должно быть тщательно продумано.
Раскрытие информации
Авторам раскрывать нечего.
Благодарности
Мы благодарим Платформу научной геномики в Центре молекулярной медицины им. Макса Дельбрюка в Ассоциации им. Гельмгольца в Берлине за техническую поддержку.
JL и KMSO были поддержаны исследовательской учебной группой GRK 2318 Немецкого научно-исследовательского общества (DFG) и исследовательским подразделением FOR 2841. KMSO был поддержан совместным исследовательским грантом 1365. AB был поддержан финансированием премии Готфрида Вильгельма Лейбница DFG, присужденной NR.
Материалы
| Name | Company | Catalog Number | Comments |
| Cell sorter | - | - | For fluorescence-activated cell sorting (FACS); e.g. BD FACSAria Cell Sorter. |
| Centrifuge 5810 R | Eppendorf | 5811000015 | |
| Countess Cell Counting Chamber Slides | Invitrogen | C10228 | |
| Countess II FL Automated Cell Counter | Invitrogen | AMQAF1000 | Needs to contain DAPI light cube to count nuclei. Alternatively, nuclei can be counted manually under fluorescence microscope. |
| 4′,6-Diamidino-2-phenyl-indol-dihydrochlorid (DAPI) | Biotrend | 40043/b | Stock solution prepared with a concentration of 100 µM. Used for nuclei staining in a final concentration of 2 µM. |
| D(+)-Sucrose ≥99.9%, ultrapure DNAse-, RNAse-free | VWR | 0335-500G | |
| DNA LoBind Microcentrifuge Tubes (1.5 mL) | Eppendorf | 22431021 | |
| Ethanol, 70 % | - | - | |
| FACS tubes | pluriSelect | 43-10100-46 | |
| KIMBLE Dounce tissue grinder set 2 mL complete | Sigma-Aldrich | D8938-1SET | |
| Minisart Syringe Filters 0.2 µm | Sartorius | 16534-GUK | |
| Nuclease-free Water | Invitrogen | AM9937 | |
| Nuclei EZ Prep Nuclei Isolation Kit | Sigma-Aldrich | NUC-101 | Nuclei EZ Lysis Buffer (Product No. N3408) needed for buffer preparation. |
| PBS (Phosphate-Buffered Saline) 1X without calcium or magnesium | Corning | 21-040-CV | |
| Petri dishes, polystyrene 60 mm | Sigma-Aldrich | P5481 | |
| Phosphate-Buffered Saline (PBS) with 10% Bovine Albumin | Sigma-Aldrich | SRE0036 | |
| pluriStrainer Mini 100 µm | pluriSelect | 43-10100-46 | |
| pluriStrainer Mini 20 µm | pluriSelect | 43-10020-40 | |
| pluriStrainer Mini 40 µm | pluriSelect | 43-10040-40 | |
| Polystyrene Centrifuge Tube (15 mL) | Falcon | 352099 | |
| Razor blades | - | - | |
| RiboLock RNase Inhibitor (40 U/µL) | Thermo Fisher | EO0384 | |
| Ribonucleoside-vanadyl complex | New England Biolabs | S1402S | Follow manufacturer's instructions (https://international.neb.com/products/s1402-ribonucleoside-vanadyl-complex#Product%20Information). Upon use the 200 mM stock solution is reconstituted to a green-black clear solution by incubating at 65 °C. |
| RNAlater Stabilization Solution | Invitrogen | AM7020 | |
| RNase AWAY | Fisher Scientific | 11952385 |
Ссылки
- Thomas, R. S. Kidney modeling and systems physiology. Wiley Interdisciplinary Reviews: Systems Biology and Medicine. 1 (2), 172-190 (2009).
- Potter, S. S. Single-cell RNA sequencing for the study of development, physiology and disease. Nature Reviews Nephrology. 14 (8), 479-492 (2018).
- Park, J., Liu, C. L., Kim, J., Susztak, K. Understanding the kidney one cell at a time. Kidney International. 96 (4), 862-870 (2019).
- Clark, A. R., Greka, A. The power of one: advances in single-cell genomics in the kidney. Nature Reviews Nephrology. 16 (2), 73-74 (2020).
- Lake, B. B., et al. A single-nucleus RNA-sequencing pipeline to decipher the molecular anatomy and pathophysiology of human kidneys. Nature Communications. 10 (1), 2832(2019).
- Wu, H., Kirita, Y., Donnelly, E. L., Humphreys, B. D. Advantages of single-nucleus over single-cell RNA sequencing of adult kidney: Rare cell types and novel cell states revealed in fibrosis. Journal of the American Society of Nephrology. 30 (1), 23-32 (2019).
- Adam, M., Potter, A. S., Potter, S. S. Psychrophilic proteases dramatically reduce single-cell RNA-seq artifacts: a molecular atlas of kidney development. Development. 144 (19), 3625-3632 (2017).
- Habib, N., et al. Massively parallel single-nucleus RNA-seq with DroNc-seq. Nature Methods. 14 (10), 955-958 (2017).
- Muto, Y., et al. Single cell transcriptional and chromatin accessibility profiling redefine cellular heterogeneity in the adult human kidney. Nature Communications. 12 (1), 2190(2021).
- Hinze, C., et al. Kidney single-cell transcriptomes predict spatial corticomedullary gene expression and tissue osmolality gradients. Journal of the American Society of Nephrology. 32 (2), 291(2021).
- Berger, S. L. Isolation of cytoplasmic RNA: ribonucleoside-vanadyl complexes. Methods in Enzymology. 152, 227-234 (1987).
- Butler, A., Hoffman, P., Smibert, P., Papalexi, E., Satija, R. Integrating single-cell transcriptomic data across different conditions, technologies, and species. Nature Biotechnology. 36 (5), 411-420 (2018).
- Stuart, T., et al. Comprehensive Integration of single-cell data. Cell. 177 (7), 1888-1902 (2019).
- Park, J., et al. Single-cell transcriptomics of the mouse kidney reveals potential cellular targets of kidney disease. Science. 360 (6390), 758-763 (2018).
- Kirita, Y., Wu, H., Uchimura, K., Wilson, P. C., Humphreys, B. D. Cell profiling of mouse acute kidney injury reveals conserved cellular responses to injury. Proceedings of the National Academy of Sciences of the United States of America. 117 (27), 15874-15883 (2020).
- Schneeberger, S., et al. The neuroinflammatory interleukin-12 signaling pathway drives Alzheimer's disease-like pathology by perturbing oligodendrocyte survival and neuronal homeostasis. bioRxiv. , 441313(2021).
- Nguyen, Q. H., Pervolarakis, N., Nee, K., Kessenbrock, K. experimental considerations for single-cell RNA sequencing approaches. Frontiers in Cell and Developmental Biology. 6, 108(2018).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеThis article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены