Method Article
从成年小鼠肾脏中分离细胞核以进行单核RNA测序
* 这些作者具有相同的贡献
摘要
在这里,我们提出了一种从冷冻小鼠肾脏中分离高质量细胞核的方案,该方案改善了髓质肾细胞类型的表征,并避免了酶组织解离引起的基因表达伪像。
摘要
肾脏调节不同的生物过程,如水、电解质和酸碱稳态。肾脏的生理功能由多种细胞类型执行,这些细胞类型排列在器官皮质髓质轴上的复杂结构中。单细胞转录组学的最新进展加速了对肾脏生理和疾病中细胞类型特异性基因表达的理解。然而,经常用于单细胞RNA测序(scRNA-seq)的基于酶的组织解离方案主要需要新鲜(非存档)组织,引入转录应激反应,并且有利于选择肾脏皮层的丰富细胞类型,导致髓质细胞代表性不足。
在这里,我们提出了一个避免这些问题的协议。该方案基于从冷冻肾组织中分离4°C的细胞核。细胞核是从小鼠肾脏的中央部分分离出来的,该中心部分由皮质、外髓质和内髓质组成。这减少了全肾样本中典型的皮质细胞的过度代表性,有利于髓质细胞,使得数据将以足够的丰度代表整个皮质髓质轴。该方案简单、快速且适应性强,为肾脏研究中单核转录组学的标准化迈出了一步。
引言
肾脏显示出高度复杂的组织结构。它们由沿皮髓质轴的功能和解剖学上不同的片段组成,并介导生物学功能,例如调节细胞外液量、电解质平衡或酸碱稳态1。
单细胞转录组学的进步使复杂组织的深入表征成为可能,并加速了对肾脏生理学、发育和疾病中段和细胞类型特异性基因表达的理解2,3,4。
然而,经常用于scRNA-seq的基于酶的解离方案显示出一些缺点和限制。根据协议的不同,它们产生转录应激反应和组织解离偏向于更容易解离的皮质细胞类型5,6。尽管使用冷活性蛋白酶治疗胚胎肾脏的方案能够减轻与应激相关的转录改变,但它们无法克服对皮质细胞的解离偏差,并且可能不容易适应不同种类的患病肾组织7。此外,单细胞方法不容易与冷冻组织样品兼容,将其应用主要限制在非存档的新鲜组织,从而使组织收集成为限制因素6。
单核RNA测序(snRNA-seq)可以规避这些限制8,9。在这里,我们提出了从冷冻成年小鼠肾脏组织的中心切片中分离细胞核的方案(图1)10。我们的方案很简单,为不涉及强烈区域组织变化的实验模型提供了一种标准化的方法来获得RNA测序文库,该文库具有不同肾细胞类型的平衡表示。在后一种情况下,我们的方案也可以对整个肾脏进行。
研究方案
所有动物实验均按照《动物福利法》(TierSchG)和《动物福利实验动物条例》(TierSchVersV)进行,并得到地方当局和我们机构(MDC)动物福利官员的授权。
1. 组织准备
- 为将要获得的每个肾脏准备一个 6 孔板,每孔含有 2 mL 的 1x 磷酸盐缓冲盐水 (PBS)。准备一个 6 孔板,每孔和肾脏含有 2 mL 的 RNA 稳定溶液。在冰上预冷两个盘子。
- 对 3 至 6 个月大的雄性 C57BL/6 小鼠实施安乐死。将鼠标放在解剖托盘上,固定四肢并用70%乙醇对腹部进行消毒。
- 用镊子和剪刀打开腹部到胸腔。将肠道和其他器官抬到一边,用剪刀小心地切割输尿管、肾动脉和静脉来切除肾脏。在先前准备好的冰冷1x PBS中清洗肾脏,并从肾脏中去除肾筋膜和任何剩余的脂肪,直到去除所有白色组织(图2A)。
- 将肾脏放在冷解剖板上,并使用锋利的手术刀或剃须刀片获得1-2毫米的中间切片。确保组织片包含整个皮质髓质轴(图2B)。使用显微解剖剪刀和镊子小心地从中心部分的侧面修剪皮层。在解剖的组织片内,皮质,外髓质和内髓质的三段应清晰可见(图2C)。
注意:切片的厚度不应超过2毫米或重量20毫克,以确保有足够的缓冲液量进行有效的组织裂解,并尽量减少cDNA文库中的环境背景RNA。环境RNA会浪费序列容量,因为它与单个细胞核无关。 - 将肾脏片段转移到先前制备的RNA稳定溶液中,并在4°C下孵育24小时以避免RNA降解。24小时后,除去RNA稳定溶液并将组织储存在-80°C直至进一步使用。用薄纸小心地去除多余的溶液。
2. 细胞核分离
- 清洁和准备步骤
- 用70%乙醇和RNase净化溶液清洁台面和移液器。
- 用RNase去污溶液清洁圆底2 mL组织研磨管和匹配的研杵A和B,然后用70%乙醇和无RNA酶的水(每个样品1个研磨管和研杵组)。让它完全干燥。
- 将离心机预冷至4°C。
- 标记并预冷三个 15 mL 收集管、一个 1.5 mL 收集管、一个 5 mL 荧光激活细胞分选 (FACS) 收集管和一个干式研磨管,用于冰上每个样品。
- 缓冲液制备
- 将核糖核苷 - 钒基复合物储备溶液加热至65°C,直到根据制造商的说明重新复溶为绿黑色透明溶液。11
- 如表1A所述制备含有4%牛血清白蛋白( BSA)的1x PBS。此外,制备含有0.04%BSA的1x PBS(表1B)。使用0.2μm不含表面活性剂的醋酸纤维素(SFCA)膜注射器过滤器过滤两种溶液,并保持在冰上直至进一步使用。
- 制备细胞核裂解缓冲液1(NLB1, 表1C)。向15 mL管中加入用于细胞核裂解缓冲液2(NLB2,表 1D)的4 mL EZ裂解缓冲液和用于细胞核悬浮缓冲液(NSB, 表1E)的2 mL 0.04% BSA / PBS。如方案下文所示,使用前直接将RNase抑制剂溶液添加到NLB2和NSB中。在冰上保存,直到进一步使用。
- 用10%蔗糖制备EZ裂解缓冲液(蔗糖梯度缓冲液, 表1F)。充分混合并使用 0.2 μm SFCA 膜注射器过滤器将缓冲液过滤到新鲜的 15 mL 管中。在冰上保存,直到进一步使用。
- 组织匀浆和细胞裂解
注意:为了尽量减少RNA降解,所有步骤都在冰上进行。研磨管、培养皿和所有缓冲液都需要预冷。所有重悬步骤都是通过仔细移液细胞核悬浮液来完成的。不要涡旋样品,以免剪切力和损坏细胞核。- 取冷冻的肾脏片并将其转移到含有 1 mL NLB1 的冰上的 60 mm 聚苯乙烯培养皿中。
- 使用剃须刀片或手术刀彻底切碎组织(图3A)。
- 切断 1 mL 移液器吸头的尖端,并将切碎的组织和缓冲液转移到研磨管中。确保转移所有纸巾。如有必要,用缓冲液清洗培养皿5-10次。
- 通过在研磨管中缓慢移动杵A,上下移动25倍,使悬浮液在冰上均匀化。避免快速运动引起的气泡(图3B)。
- 将匀浆通过预冷的 15 mL 收集管中的 100 μm 过滤器,并用另外 1 mL NLB1 清洗过滤器。
- 用冷EZ细胞核裂解缓冲液清洗研磨管并丢弃缓冲液。
- 将匀浆转移回研磨管中,并通过在研磨管中缓慢移动杵B在冰上均匀化悬浮液15倍。避免快速运动引起的气泡(图3C)。
- 将匀浆转移到预冷的 15 mL 收集管中。用另外 2 mL NLB1 清洗研磨管,并确保将所有组织碎片转移到收集管中。将匀浆(总体积为4mL)在冰上孵育5分钟以裂解细胞。
- 细胞核纯化
- 将匀浆通过 40 μm 过滤器进入预冷的 15 mL 收集管中。在带有水平吊篮转子的离心机中以500× g 在4°C下旋转收集管5分钟。同时,将RNase抑制剂溶液添加到NLB2中(表1D)。
- 在不干扰沉淀的情况下除去上清液。小心地将沉淀重悬于 4 mL NLB2 中。
- 用 1 mL 蔗糖梯度缓冲液垫小心地在悬浮液下面。在带有水平吊篮转子的离心机中以500× g 离心5分钟,在4°C下离心。同时,将RNase抑制剂溶液加入NSB中(表1E)。
- 离心后,轻轻地从离心机中取出收集管,并在处理收集管时注意不要干扰两层。两层之间可见细胞碎片。从碎片开始小心地除去上清液。在不干扰细胞核沉淀的情况下除去剩余的上清液,并小心地将沉淀重悬于 1 mL NSB 中。
注意:重悬体积取决于用于分离的组织量和最后一个离心步骤后获得的颗粒尺寸。体积可能需要适应预期的细胞核数量。 - 将匀浆通过 20 μm 过滤器进入预冷的 5 mL FACS 收集管中。
3. 细胞核分选
- 每毫升 NSB 加入 20 μL 4′,6-二脒基-2-苯基吲哚 (DAPI),至终浓度为 2 μM 到FACS 收集管中的匀浆中,并仔细混合。在冰上孵育5分钟。
- 用 20 μL 4% BSA / 1x PBS 制备预冷的 1.5 mL 收集管,并加入 0.5 μL RNase 抑制剂溶液至终浓度为 1 U/μL。 立即进行分拣。
- 使用细胞分选仪对细胞核进行分选。
- 在将FACS收集管插入分选机之前,短暂混合细胞核悬浮液。
- 根据前向散射 (FSC) 和侧向散射 (SSC) 设置第一门 P1,以排除碎屑和聚集体(图 4A)。
- 要排除空的或损坏的细胞核和多重核,请根据DAPI面积与DAPI高度(DAPI-A与DAPI-H)设置后续门(图4B)。
- 将单个细胞核分选到含有 4% BSA /1x PBS 的 1.5 mL 收集管中,其中 1 U/μL RNase 抑制剂溶液在 3.2 中制备。
4. 质量控制
- 在荧光显微镜下或在自动计数室中以至少两个独立计数测量最终细胞核浓度并评估悬浮液质量(图5)。
注意:最佳浓度在 700 - 1,200 个细胞核/μL 之间。 较低的细胞浓度(例如 700 个细胞核/μL)可能更可取,因为生成的 cDNA 文库含有较少的环境背景 RNA(与单个细胞核无关的转录本)。 - 计算所需的细胞核悬浮液体积,以期望回收测序的单个细胞核。为了避免细胞核聚集和RNA降解,请立即进行文库制备。
结果
为了确定我们实验方案的性能,我们使用10x Genomics Chromium Single Cell 3'基因表达试剂盒v3.1进行文库制备,并使用修拉包12,13分析了snRNA-seq数据。
图6显示了代表性snRNA-seq文库的结果。为了评估我们细胞核的质量,我们将基因数量与线粒体读数分数着色的转录本数量(由唯一分子标识符(UMIs)定义)绘制成图(图6A)。高质量的细胞核通常显示较高的读段数,将UMI和基因数相关联,以及较低的线粒体读段。
对于随后的分析,排除了少于500个或超过4000个计数基因或超过5%线粒体RNA的细胞核(n = 828)。仅包括在至少三个细胞核中表达的基因。我们在剩余的 6,000 个细胞核中总共检测到约 20,000 个基因,每个细胞核有 1,600 个中位数基因和 2,800 个中位 UMI(图 6B)。
聚类基于高度可变的基因。我们总共确定了18个集群。根据已知的标记基因(未显示)对细胞身份进行注释。将一种细胞类型的亚簇汇总为一个簇,总共产生11种不同的细胞类型:足细胞,近端小管(PT),细肢(tL),厚升肢(TAL),远端回旋小管(DCT),连接小管(CNT),集合管主细胞和插层细胞(CD-PC,A-IC,B-IC),骨盆深髓质上皮(DMEP)和内皮。在点图中可视化簇富集标记的基因表达模式(图 6C),在 t 分布随机邻域嵌入 (t-SNE) 图中可视化细胞类型簇(图 6D)。
为了评估我们样品中的细胞类型分布,计算了每种细胞类型的百分比(图6E)并用于确定PT与TAL的比率。PT主要位于肾皮层中,在肾脏单细胞数据集中经常被过度代表,因为PT的细胞易于解离并且在全肾样本中含量高。另一方面,TAL延伸到整个外髓质14。因此,PT和TAL分数的比率代表了肾脏单细胞数据集中髓质细胞类型富集的良好衡量标准。一般来说,单细胞全肾数据集中的PT / TAL比率范围从8(来自冷蛋白酶处理的全肾组织的未发表数据)到酶解离组织的4510,14,15。在这里介绍的snRNA-seq数据集中,我们能够达到2的PT / TAL比率。这一结果表明,在组织解剖过程中去除多余的皮层与snRNA-seq相结合,导致肾细胞类型表征显着改善。
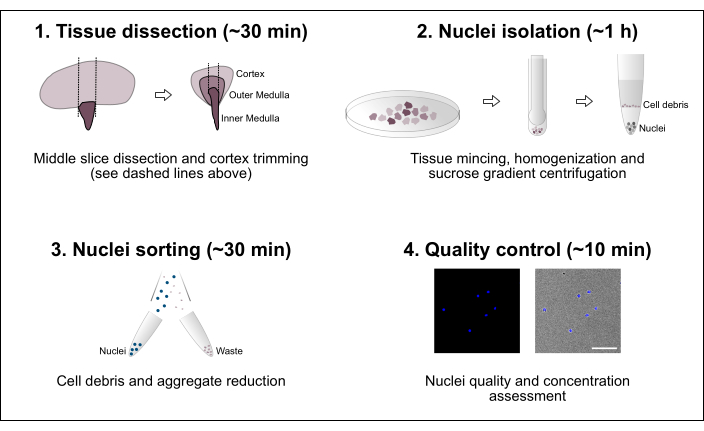
图 1:工作流程的示意图。 该方案包括四个主要步骤,包括组织解剖,然后是细胞核分离,细胞核分类以及最终的纯度和浓度评估。比例尺 = 100 μm。 请点击此处查看此图的大图。
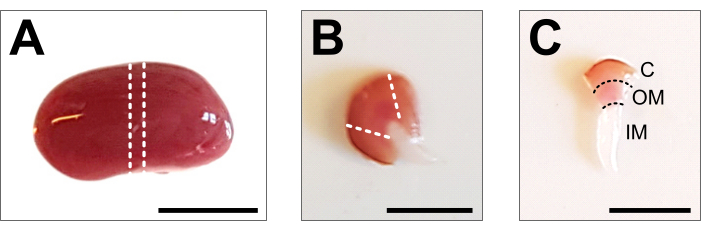
图2:肾脏解剖和组织制备 。 (A)解剖整个肾脏的代表性图像。虚线表示获得1-2毫米的中间切片所需的切口,代表所有肾细胞类型。(B)获得的中间切片的代表性图像。虚线表示从侧面修剪皮层的切口。(C)具有修剪皮层的中央肾脏片的代表性图像。皮质 (C)、外髓质 (OM) 和内髓质 (IM) 清晰可见。比例尺 = 500 μm。 请点击此处查看此图的大图。

图3:组织匀浆和细胞核纯化 。 (A)显示充分切碎的肾组织的代表性图像。比例尺 = 500 μm。 (B) 在第一个均质步骤后均质化(用杵 A 和 2 mL 研磨管进行 25 次冲程)。(C)第二均质步骤后匀浆(用研杵B,2mL研磨管15冲程)。 请点击此处查看此图的大图。
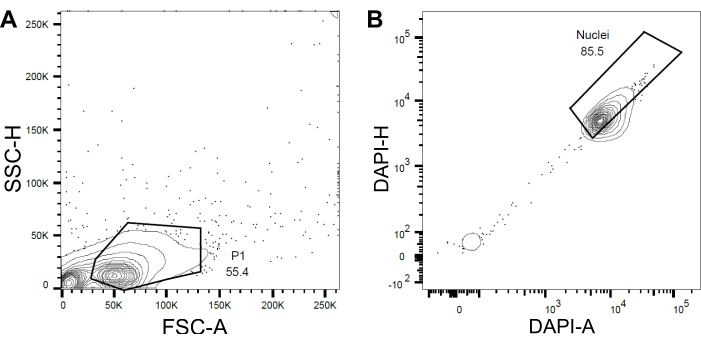
图 4:用于细胞核分选的门控策略。(A )基于前向散射(FSC)与侧向散射(SSC)设置第一个门P1,以排除碎片和聚集体。(B)基于DAPI面积(DAPI-A)与DAPI高度 ( DAPI-H)的后续门排除了空的或损坏的细胞核和多重。 请点击此处查看此图的大图。
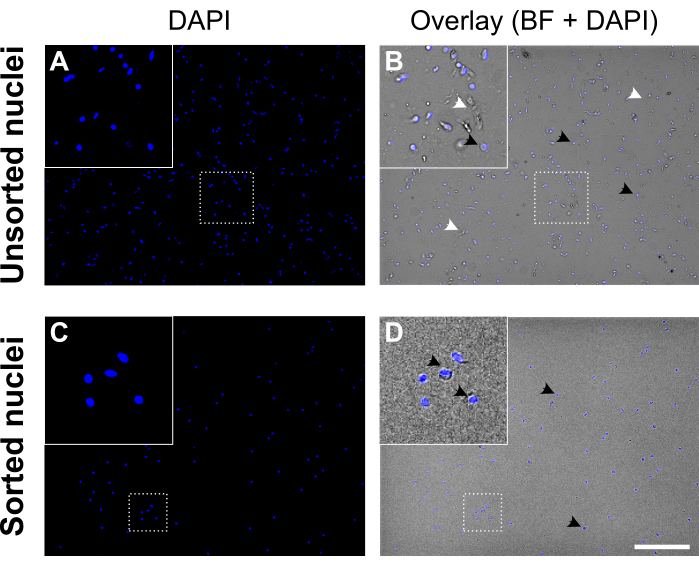
图 5:细胞核分选前后的细胞核悬浮液。 (一、三)DAPI染色的细胞核(蓝色)。(乙、丁)DAPI 和明场 (BF) 通道的叠加。在分选之前(上图),细胞核悬浮液包含细胞碎片和聚集体(用白色箭头标记)。分选后(下图),细胞核悬浮液看起来更干净。DAPI染色细胞核的例子用黑色箭头标记。质量好的细胞核看起来圆形光滑,膜完整,分离良好,而质量差的细胞核出现皱纹并显示核膜丢失。比例尺 = 250 μm。 请点击此处查看此图的大图。
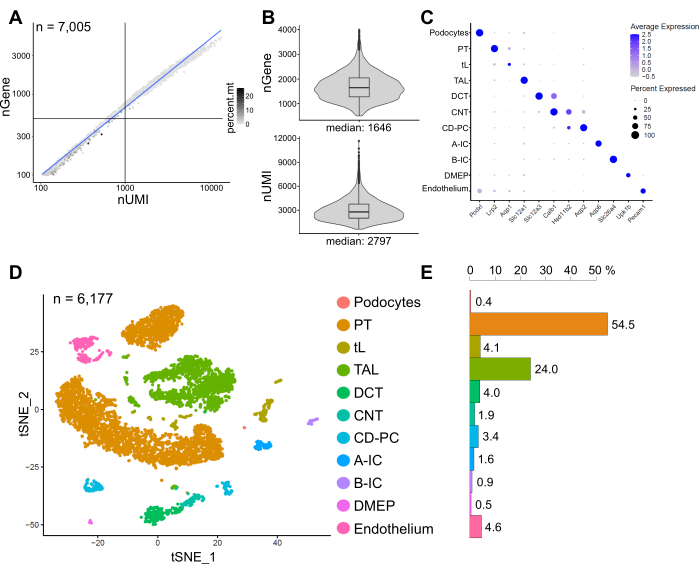
图 6:代表性 snRNA-seq 数据集的质量控制和分析。 (A)基因数量(nGene)与线粒体读数分数(percent.mt)所着色的唯一分子标识符(nUMI)的数量作图。低质量的细胞核对应于图的左下象限(n = 828),并被排除在后续分析之外。(B)snRNA-seq数据集中每个细胞核检测到的nGene和nUMI的分布和中位数,代表6,177个细胞核(>500个基因)。文库测序的中位深度为每个细胞核~8,200个映射读段。(C) 点图显示单个细胞类型(y 轴)的富集簇标记(x 轴)的基因表达模式。点的大小对应于表达指示基因的细胞比例。颜色对应于平均表达式。(D)已识别细胞类型的T分布随机邻域嵌入(t-SNE)图。(E)snRNA-seq数据集中的细胞类型分布。PT,近端小管;tL,细肢;TAL,粗升肢,DCT,远端回旋小管;CNT,连接小管;CD-PC,收集管道主电池;A-IC,A型插层电池;B-IC,B型插层电池;DMEP,骨盆深髓质上皮。 请点击此处查看此图的大图。
| 试剂 | 最终浓度 | 体积(毫升) | ||
| (A) 4 % BSA / PBS | ||||
| 含 10% 牛白蛋白的磷酸盐缓冲盐水 (PBS) | 4% | 2 | ||
| PBS(磷酸盐缓冲盐水)1X不含钙或镁 | - | 3 | ||
| (B) 0.04 % BSA / PBS | ||||
| 4 % BSA / PBS | 0.04 % | 0.5 | ||
| PBS(磷酸盐缓冲盐水)1X不含钙或镁 | - | 49.5 | ||
| (C) 细胞核裂解缓冲液 1 (NLB1) | ||||
| 核 EZ 裂解缓冲液 | - | 4 | ||
| 核锁核糖核酸酶抑制剂 (40 U/μL) | 1 U/μL | 0.1 | ||
| 核糖核苷 - 钒基复合物(200 mM) | 10 毫米 | 0.2 | ||
| (D) 细胞核裂解缓冲液 2 (NLB2) | ||||
| 核 EZ 裂解缓冲液 | - | 4 | ||
| 核锁核糖核酸酶抑制剂 (40 U/μL) | 1 U/μL | 0.1 | ||
| (e) 细胞核悬浮缓冲液 | ||||
| 0.04 % BSA / PBS | - | 2 | ||
| 核锁核糖核酸酶抑制剂 (40 U/μL) | 1 U/μL | 0.05 | ||
| (F) 蔗糖梯度缓冲液(10%蔗糖) | ||||
| 重量 1 克蔗糖 | ||||
| 溶于6毫升核EZ裂解缓冲液中 | ||||
| 用核 EZ 裂解缓冲液填充多达 10 mL | ||||
| 通过0.2μm注射器过滤器过滤到新管中 | ||||
表1:溶液配方: (A)制备4%BSA/1x PBS。使用0.2μmSFCA膜注射器过滤器过滤并保持在冰上直至使用。(B) 制备0.04%BSA/1 x PBS。使用0.2μmSFCA膜注射器过滤器过滤并保持在冰上直至使用。(C)细胞核裂解缓冲液1(NLB1)的制备。每个样品提供指示体积。在冰上保持使用。(D)细胞核裂解缓冲液2(NLB2)的制备。每个样品提供指示体积。如协议中所述,在使用前直接将核糖锁RNase抑制剂添加到NLB2中。在冰上保持使用。(e) 核悬浮缓冲液(NSB)的制备。每个样品提供指示体积。如协议中所述,在使用前直接将核糖锁RNase抑制剂添加到NSB中。在冰上保持使用。(f)蔗糖梯度缓冲液的制备。使用0.2μmSFCA膜注射器过滤器过滤并保持在冰上直至使用。
讨论
单细胞转录组学促进了对肾脏生理学和疾病中细胞类型特异性基因表达的理解。在这里,我们提供了一种简单且可重复的方法,以标准化的方式从冷冻小鼠肾组织中分离高质量的单核以获取snRNA-seq。
对于snRNA-seq,使用高质量细胞核作为文库生成的输入并避免RNA在组织处理过程中降解至关重要。因此,解剖后立即在RNA稳定溶液中孵育组织碎片对于保护和稳定细胞RNA至关重要,并允许无限期地将样品储存在-80°C。当将此协议应用于未经RNA稳定溶液处理的冷冻组织(例如档案材料)时,需要进行试运行,并且需要评估RNA质量,因为我们观察到在没有事先孵育的情况下在RNA稳定溶液中快速冷冻组织中RNA完整性显着丧失。
通常,适当的样品处理对于最大限度地提高完整单核的回收率至关重要。所有重悬步骤都应小心移液,以避免剪切应力和物理损坏。用于最终细胞核重悬和细胞核分选的缓冲液应含有BSA,以避免细胞核损失和聚集。
该方案中的缓冲液体积针对非常小的组织样品(~15 mg)进行了优化。确保完全细胞裂解和充分洗涤以产生高质量悬浮液至关重要。较大的组织块或整个肾脏样本将导致细胞核浓度过高,从而导致聚集和聚集、环境 RNA 丰度高以及整体悬浮质量差。如果处理较大的样品或其他组织,强烈建议进行试运行,以确定最低环境RNA水平的最佳缓冲液体积。需要仔细检查细胞核和RNA的质量和浓度,因为过载会导致整体性能不佳。
此外,大量的细胞碎片导致高水平的环境RNA与单个细胞核无关,对测序结果产生负面影响。通过蔗糖垫离心澄清细胞核悬浮液在一定程度上缓解了这个问题,但它也可能通过计数器选择针对例如免疫细胞中存在的致密小细胞核而导致细胞类型表征的偏差16。如果这值得关注,则应省略蔗糖梯度。相比之下,我们发现基于DAPI染色的流式细胞术对于减少细胞碎片量以产生高质量的单核悬液至关重要。
与单细胞方法相比,单核分离具有相当大的优势8。它与适当冷冻的组织兼容,使组织收集更加灵活,并且避免了基于酶的组织解离的需要,这可以引入转录应激反应6,17。此外,它克服了有利于选择肾皮层易于解离的细胞类型的解离偏差,这可能导致在某些基于酶的方法中髓质细胞类型的代表性不足5,6,10。
使用中央肾脏碎片而不是整个肾脏组织进一步节省了资源,并纠正了前面描述的丰富细胞类型的过度代表10。然而,根据所研究的小鼠模型或表型,使用整个肾脏样本而不是单个中间切片可能是有益的。全肾样本可能更能代表真实细胞比例或整个肾脏发生的变化,而修剪的中间切片被证明对髓质表型或样本材料有限时有利。因此,此决定是高度特定于用户的,应仔细考虑。
披露声明
作者没有什么可透露的。
致谢
我们感谢柏林亥姆霍兹协会马克斯·德尔布吕克分子医学中心的科学基因组学平台提供的技术支持。
JL和KMSO得到了德国研究基金会(DFG)研究培训小组GRK 2318和研究单位FOR 2841的支持。KMSO得到了合作研究基金1365的支持。AB得到了DFG授予NR的Gottfried Wilhelm Leibniz奖的资助。
材料
| Name | Company | Catalog Number | Comments |
| Cell sorter | - | - | For fluorescence-activated cell sorting (FACS); e.g. BD FACSAria Cell Sorter. |
| Centrifuge 5810 R | Eppendorf | 5811000015 | |
| Countess Cell Counting Chamber Slides | Invitrogen | C10228 | |
| Countess II FL Automated Cell Counter | Invitrogen | AMQAF1000 | Needs to contain DAPI light cube to count nuclei. Alternatively, nuclei can be counted manually under fluorescence microscope. |
| 4′,6-Diamidino-2-phenyl-indol-dihydrochlorid (DAPI) | Biotrend | 40043/b | Stock solution prepared with a concentration of 100 µM. Used for nuclei staining in a final concentration of 2 µM. |
| D(+)-Sucrose ≥99.9%, ultrapure DNAse-, RNAse-free | VWR | 0335-500G | |
| DNA LoBind Microcentrifuge Tubes (1.5 mL) | Eppendorf | 22431021 | |
| Ethanol, 70 % | - | - | |
| FACS tubes | pluriSelect | 43-10100-46 | |
| KIMBLE Dounce tissue grinder set 2 mL complete | Sigma-Aldrich | D8938-1SET | |
| Minisart Syringe Filters 0.2 µm | Sartorius | 16534-GUK | |
| Nuclease-free Water | Invitrogen | AM9937 | |
| Nuclei EZ Prep Nuclei Isolation Kit | Sigma-Aldrich | NUC-101 | Nuclei EZ Lysis Buffer (Product No. N3408) needed for buffer preparation. |
| PBS (Phosphate-Buffered Saline) 1X without calcium or magnesium | Corning | 21-040-CV | |
| Petri dishes, polystyrene 60 mm | Sigma-Aldrich | P5481 | |
| Phosphate-Buffered Saline (PBS) with 10% Bovine Albumin | Sigma-Aldrich | SRE0036 | |
| pluriStrainer Mini 100 µm | pluriSelect | 43-10100-46 | |
| pluriStrainer Mini 20 µm | pluriSelect | 43-10020-40 | |
| pluriStrainer Mini 40 µm | pluriSelect | 43-10040-40 | |
| Polystyrene Centrifuge Tube (15 mL) | Falcon | 352099 | |
| Razor blades | - | - | |
| RiboLock RNase Inhibitor (40 U/µL) | Thermo Fisher | EO0384 | |
| Ribonucleoside-vanadyl complex | New England Biolabs | S1402S | Follow manufacturer's instructions (https://international.neb.com/products/s1402-ribonucleoside-vanadyl-complex#Product%20Information). Upon use the 200 mM stock solution is reconstituted to a green-black clear solution by incubating at 65 °C. |
| RNAlater Stabilization Solution | Invitrogen | AM7020 | |
| RNase AWAY | Fisher Scientific | 11952385 |
参考文献
- Thomas, R. S. Kidney modeling and systems physiology. Wiley Interdisciplinary Reviews: Systems Biology and Medicine. 1 (2), 172-190 (2009).
- Potter, S. S. Single-cell RNA sequencing for the study of development, physiology and disease. Nature Reviews Nephrology. 14 (8), 479-492 (2018).
- Park, J., Liu, C. L., Kim, J., Susztak, K. Understanding the kidney one cell at a time. Kidney International. 96 (4), 862-870 (2019).
- Clark, A. R., Greka, A. The power of one: advances in single-cell genomics in the kidney. Nature Reviews Nephrology. 16 (2), 73-74 (2020).
- Lake, B. B., et al. A single-nucleus RNA-sequencing pipeline to decipher the molecular anatomy and pathophysiology of human kidneys. Nature Communications. 10 (1), 2832(2019).
- Wu, H., Kirita, Y., Donnelly, E. L., Humphreys, B. D. Advantages of single-nucleus over single-cell RNA sequencing of adult kidney: Rare cell types and novel cell states revealed in fibrosis. Journal of the American Society of Nephrology. 30 (1), 23-32 (2019).
- Adam, M., Potter, A. S., Potter, S. S. Psychrophilic proteases dramatically reduce single-cell RNA-seq artifacts: a molecular atlas of kidney development. Development. 144 (19), 3625-3632 (2017).
- Habib, N., et al. Massively parallel single-nucleus RNA-seq with DroNc-seq. Nature Methods. 14 (10), 955-958 (2017).
- Muto, Y., et al. Single cell transcriptional and chromatin accessibility profiling redefine cellular heterogeneity in the adult human kidney. Nature Communications. 12 (1), 2190(2021).
- Hinze, C., et al. Kidney single-cell transcriptomes predict spatial corticomedullary gene expression and tissue osmolality gradients. Journal of the American Society of Nephrology. 32 (2), 291(2021).
- Berger, S. L. Isolation of cytoplasmic RNA: ribonucleoside-vanadyl complexes. Methods in Enzymology. 152, 227-234 (1987).
- Butler, A., Hoffman, P., Smibert, P., Papalexi, E., Satija, R. Integrating single-cell transcriptomic data across different conditions, technologies, and species. Nature Biotechnology. 36 (5), 411-420 (2018).
- Stuart, T., et al. Comprehensive Integration of single-cell data. Cell. 177 (7), 1888-1902 (2019).
- Park, J., et al. Single-cell transcriptomics of the mouse kidney reveals potential cellular targets of kidney disease. Science. 360 (6390), 758-763 (2018).
- Kirita, Y., Wu, H., Uchimura, K., Wilson, P. C., Humphreys, B. D. Cell profiling of mouse acute kidney injury reveals conserved cellular responses to injury. Proceedings of the National Academy of Sciences of the United States of America. 117 (27), 15874-15883 (2020).
- Schneeberger, S., et al. The neuroinflammatory interleukin-12 signaling pathway drives Alzheimer's disease-like pathology by perturbing oligodendrocyte survival and neuronal homeostasis. bioRxiv. , 441313(2021).
- Nguyen, Q. H., Pervolarakis, N., Nee, K., Kessenbrock, K. experimental considerations for single-cell RNA sequencing approaches. Frontiers in Cell and Developmental Biology. 6, 108(2018).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。