Bu içeriği görüntülemek için JoVE aboneliği gereklidir. Oturum açın veya ücretsiz deneme sürümünü başlatın.
Method Article
Memeli Hücre Lisatlarında E3 Ubikitin-ligaz ile Substrat Ubikitilasyonunun Değerlendirilmesi
Bu Makalede
Özet
Memeli hücrelerinde belirli bir substratın ubikitilasyon testi ve bir E3 ubikitin-ligazının ubikitilasyon testi için ayrıntılı bir protokol sunuyoruz. HEK293T hücre hatları protein aşırı ekspresyonu için kullanıldı, poliubikitillenmiş substrat immünopresipitasyon ile hücre lizatlarından arındırıldı ve SDS-PAGE'de çözüldü. Bu post-translasyonel modifikasyonu görselleştirmek için immünoblotlama kullanıldı.
Özet
Ubikitilasyon, ökaryotik hücrelerde meydana gelen ve hücre sağkalımı, proliferasyonu ve farklılaşması dahil olmak üzere çeşitli biyolojik yolakların düzenlenmesi için kritik olan translasyonel bir modifikasyondur. E1 (Ubikitin aktivasyon enzimi), E2 (Ubikitin-konjuge enzim) ve E3'ten (Ubikitin-ligaz enzimi) oluşan en az üç farklı enzimin kaskad reaksiyonu yoluyla ubikitinin substrata kovalent bir şekilde bağlanmasından oluşan geri dönüşümlü bir işlemdir. E3 kompleksi substrat tanıma ve ubikitilasyonda önemli bir rol oynar. Burada, seçilen substratı, bir E3 ubikitin ligazını ve etiketli bir ubikitini kodlayan bir plazmidin geçici ko-transfeksiyonunu kullanarak memeli hücrelerinde substrat ubikitilasyonunu değerlendirmek için bir protokol tanımlanmıştır. Lizisten önce, transfekte hücreler, substrat proteazomal bozulmasını önlemek için proteazom inhibitörü MG132 (karbobenzoksi-lö-lö-lösinal) ile muamele edilir. Ayrıca, hücre ekstresi, ubikitin etiketi için spesifik antikorlar kullanılarak batı lekelenmesi (WB) ile daha sonra tespit edilmek üzere poliubikitillenmiş substratı saflaştırmak için küçük ölçekli immünopresipitasyona (IP) gönderilir. Bu nedenle, memeli hücrelerinde ubikitilasyon testi için tutarlı ve karmaşık olmayan bir protokol, bilim adamlarına spesifik substratların ve E3 ubikitin ligazlarının ubikitilasyonunu ele almada yardımcı olmak için tanımlanmıştır.
Giriş
Post-translasyonel modifikasyonlar (PTM'ler), hücre homeostazı için gerekli olan protein regülasyonu ile ilgili önemli bir mekanizmadır. Protein ubikitilasyonu, ökaryotik organizmalarda çeşitli hücresel sonuçlarla sonuçlanan farklı sinyallerin bir çeşitliliğini yaratan dinamik ve karmaşık bir modifikasyondur. Ubikitilasyon, 76 amino asit içeren bir ubikitin proteininin substrata bağlanmasından oluşan, üç farklı reaksiyondan oluşan enzimatik bir kaskadda meydana gelen geri dönüşümlü bir süreçtir1. İlk adım, ubikitin C-terminus ile E1 enziminin aktif bölgesinde bulunan sistein kalıntısı arasında yüksek enerjili bir tiyoestere bağlı ubikitin oluşturmak için bir ATP hidrolizine bağlı ubikitin aktivasyonu ile karakterizedir. Daha sonra, ubikitin, ubikitin ile tiyoester benzeri bir kompleks oluşturan E2 enzimine aktarılır. Daha sonra, ubikitin, substrat 2,3'ü tanıyan ve etkileşime giren E2 veya daha sık olarak, E3 enzimi tarafından kovalent olarak substratabağlanır. Bazen, multiubikitin zincir düzeneğini teşvik etmek için E4 enzimleri (Ubikitin zinciri uzama faktörleri)gereklidir 3.
Ubikitin yedi lizin kalıntısına sahiptir (K6, K11, K27, K29, K33, K48 ve K63), birkaç efektör protein tarafından tanınacak farklı üç boyutlu yapılar üretmek için farklı bağlantılar üreten poliubikitin zincirlerinin oluşumuna izin verir 4,5. Bu nedenle, substratta tanıtılan poliubikitin zincirinin türü,hücre kaderine 6,7,8 karar vermek için gereklidir. Dahası, substrat, N-degrons adı verilen N-terminal kalıntıları yoluyla da ubikitine edilebilir. Spesifik E3 ubikitin-ligazları, N-degron tanımadan sorumludur ve yakındaki lizin kalıntısı9'un poliubikitilasyonuna izin verir.
Günümüzde, karakterize edilen 40'tan fazla farklı SCF'ye özgü substrat vardır. Bunlar arasında, hücre farklılaşması ve gelişiminin yanı sıra hücre sağkalımı ve ölümü de dahil olmak üzere çeşitli biyolojik yolakların anahtar düzenleyicileribulunabilir 10,11,12,13. Bu nedenle, her bir E3 ubikitin-ligazın spesifik substratlarının tanımlanması, çeşitli biyolojik olayların kapsamlı bir haritasını tasarlamak için gereklidir. Gerçek substratların tanımlanması biyokimyasal olarak zor olsa da, biyokimya tabanlı yöntemlerin kullanımı, zincir özgüllüğünü ve mono- ve poliubikitilasyon arasındaki ayrımı değerlendirmek için çok uygundur14. Bu çalışma, E3 ubikitin-ligaz kompleksi SCF (Fbxo7) ile substrat UXT-V2'yi (Her yerde eksprese edilen prefoldin benzeri şaperon izoform 2) aşırı eksprese eden memeli hücre hattı HEK293T kullanılarak ubikitilasyon testi için tam bir protokolü açıklamaktadır. UXT-V2, NF-κB sinyallemesi için önemli bir ko-faktördür ve bu protein hücrelerde parçalandıktan sonra, TNF-α indüklenen NF-κB aktivasyonunu inhibe eder11. Bu nedenle, poliubikitillenmiş UXT-V2'yi tespit etmek için, proteazom inhibitörü MG132, proteazom kompleksi15'in 26S alt biriminin proteolitik aktivitesini bloke etme yeteneğine sahip olduğu için kullanılır. Ayrıca, hücre ekstresi, substratı saflaştırmak için küçük ölçekli bir IP'ye gönderilir ve seçilen antikorlar kullanılarak WB tarafından daha sonra tespit edilmek üzere agaroz reçinesine hareketsiz hale getirilmiş spesifik bir antikor kullanılır. Bu protokol, hücresel ortamda substrat ubikitilasyonunu doğrulamak için çok yararlıdır ve ayrıca farklı memeli hücreleri ve diğer E3 ubikitin-ligaz kompleksleri için uyarlanabilir. Bununla birlikte, in vitro ubikitilasyon testi ile test edilen substratın doğrulanması da gereklidir, çünkü her iki protokol de gerçek substratların tanımlanması konusunda birbirini tamamlar.
Protokol
NOT: Memeli hücrelerinde ubikitilasyon tahlil protokolüne genel bir bakış Şekil 1'de gösterilmiştir.
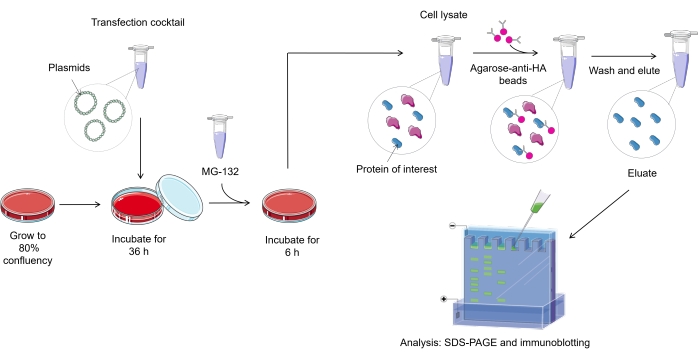
Şekil 1. Ubiquitilasyon testi prosedürüne genel bakış. Bu şeklin daha büyük bir versiyonunu görüntülemek için lütfen buraya tıklayın.
1. Hücre kültürü
- HEK293T hücre hattını 100 mm TC ile muamele edilmiş bir kültür kabında büyüme ortamında% 80-90 oranında birleşime (Dulbecco'nun Modifiye Kartal Ortamı (DMEM) yüksek glikozu,% 10 fetal sığır serumu (FBS) ve penisilin (100 ünite), streptomisin (100 μg) ve L-glutamin (0.292 mg / mL) ile desteklenmiştir) ile güçlendirin. Kültürü nemlendirilmiş bir hücre kültürü inkübatöründe 37 ° C'de% 5 CO2'de inkübe edin.
- Hücreleri geçmek için, serolojik bir pipet kullanarak medyayı kültür kabından aspire edin. Hücreleri bir kez 1 mL sterilize edilmiş 1x fosfat tamponlu salin (PBS 1x) ile yıkayın.
- 1 mL tripsin / EDTA (etilendiamintetraasetik asit) çözeltisi ekleyerek hücreleri ayırın. Çanağı 5 dakika boyunca 37 ° C'de inkübe edin. 2 mL büyüme ortamında serolojik bir pipet kullanarak hücreleri yeniden askıya alın.
- Hücre süspansiyonunu taze ve temiz bir 15 mL tüpe aktarın ve oda sıcaklığında (RT) 5 dakika boyunca 500 x g'de santrifüj yapın. Süpernatantı dikkatlice dökerek çıkarın. Homojen bir hücre süspansiyonu elde etmek için hücre peletini yukarı ve aşağı pipetleyerek hücre peletini 3 mL büyüme ortamında nazikçe yeniden askıya alın.
- Hücre süspansiyonunun 1 mL'sini, 9 mL büyüme ortamı içeren 100 mm TC ile işlenmiş bir kültür kabına aktarın.
NOT: Hücreler iyi durumdaysa, birleşmenin% 80 -% 90 olduğu HEK293T'nin her kültür kabı, geçişten 2 gün sonra% 80 birleşimli üç kültür kabı üretebilir.
2. Hücre transfeksiyonu
NOT: Ulaşılan birleşim %80'den azsa hücre kültürünün transfekte edilmesi önerilmez.
- Transfeksiyondan önce, hücrelerin kontaminasyondan arındırılmış olup olmadığını ve geçici transfeksiyonlar için yeterli bir birleşimde olup olmadığını onaylayın.
- Her transfeksiyon numunesi için, DNA-Polietilenimin (pH 7.2'de PEI 1 μg / μL) komplekslerini aşağıdaki gibi hazırlayın:
- Her plazmidin 3 μg'ını 100 μL opti-MEM içinde seyreltin Takviye olmadan serum ortamını azaltın ve çözeltiyi yukarı ve aşağı pipetleyerek hafifçe karıştırın.
NOT: Burada, hücreler her plazmidin 4 μg ile transfekte edildi: Boş vektör (pcDNA3) veya FLAG-Fbxo7 yapıları ve UXT-V2-HA, 6xHis-myc-ubiquitin ile veya olmadan. Toplam DNA içeriği 12 μg idi. - PEI'yi RT'de çözün ve 1 μg DNA başına 3 μL PEI oranını takiben çözeltiye ekleyin. Çözeltiyi yukarı ve aşağı pipetleyerek homojenize edin. Daha sonra DNA-PEI komplekslerinin oluşumuna izin vermek için RT'de 15 dakika boyunca inkübe edin.
NOT: DNA miktarı başına PEI hacminin optimal oranı, seçilen hücre hattına göre farklılık gösterir.
- Her plazmidin 3 μg'ını 100 μL opti-MEM içinde seyreltin Takviye olmadan serum ortamını azaltın ve çözeltiyi yukarı ve aşağı pipetleyerek hafifçe karıştırın.
- DNA-PEI komplekslerinin toplam hacmini hücre kültürünü içeren her kaba ekleyin ve tabağı ileri geri sallayarak hafifçe karıştırın. Hücreleri nemlendirilmiş bir hücre kültürü inkübatöründe 37 ° C'de% 5 CO2'de inkübe edin.
- Büyüme ortamını 5 saat sonra değiştirin, çünkü uzun süreli PEI maruziyeti HEK293T hücreleri için toksik olabilir. Hücreleri nemlendirilmiş bir hücre kültürü inkübatöründe 36 saat boyunca% 5 CO2'de 37 ° C'de inkübe edin.
3. Hücre lizisi ve immünopresipitasyon
- Kuluçka döneminden sonra ve hücre lizisinden 6 saat önce, transfekte edilen hücrelere proteazom inhibitörü MG-132'nin 10 μM'si ile muamele edin. Bir kez daha, hücreleri nemlendirilmiş bir hücre kültürü inkübatöründe 37 ° C'de% 5 CO2'de inkübe edin.
- Serolojik bir pipet kullanarak her kültür kabındaki ortamı aspire edin ve 1 mL 1x PBS ile bir kez yıkayın. 1 mL tripsin ekleyerek ve kabı 5 dakika boyunca 37 ° C'de inkübe ederek hücreleri ayırın. Hücreleri 1 mL büyüme ortamında yeniden askıya alın.
- Hücre süspansiyonunu taze ve temiz bir 15 mL tüpe aktarın ve RT'de 5 dakika boyunca 500 x g'de santrifüj yapın.
- Süpernatantı dikkatlice dökerek çıkarın. Hücre peletini 200 μL buz gibi soğuk NP-40 lizis tamponunda (50 mM Tris-HCl pH 7.2, 225 mM KCl ve% 1 NP-40), proteaz ve fosfataz inhibitörleri kokteyli (10 mM NaF ve 1 mM Na3VO4) ile desteklenmiş olarak nazikçe askıya alın ve çözeltiyi temiz bir 1.5 mL mikrotüpe aktarın.
- Hücre lizatını buz üzerinde 30 dakika boyunca inkübe edin. Kuluçkadan sonra, hücreyi 4 ° C'de 20 dakika boyunca 16.900 x g'da lizatları santrifüj edin.
- Bu arada, agaroz-anti-HA boncuklarını buz gibi soğuk NP-40 lizis tamponu ile dengeleyin. Her numune için 15 μL agaroz-anti-HA boncuk kullanın. Boncukları 200 μL NP-40 lizis tamponu ile 4 ° C'de 1 dakika boyunca 3.000 x g'de bir mikrosantrifüj tüpünde atımlayarak yıkayın. Bir pipetle, süpernatantı çok dikkatli bir şekilde aspire edin ve atın; Bu işlemi üç kez tekrarlayın. Daha sonra, boncukları kullanana kadar buz üzerinde dengede tutun.
- Hücre lizatlarını santrifüj ettikten sonra, süpernatanı kurtarın. Bradford yöntemi16'yı kullanarak toplam lizattaki protein içeriğini ölçün.
- İmmün çökeltmeye maruz kalan her numunenin eşit miktarda protein gösterdiğinden emin olun. Gerekli hücre lizat hacmini 4 saat boyunca dengelenmiş agaroz-anti-HA boncukları ile inkübe edin, 4 ° C'de dönen bir inkübatörde hafifçe döndürün, bu da UXT-V2-HA'nın agaroz-anti-HA boncuklarına bağlanmasını sağlar.
- Agaroz-anti-HA boncuklarını, 4 ° C'de 1 dakika boyunca 3.000 x g'de bir mikrosantrifüj tüpünde atımlayarak toplayın. Süper natantı dikkatlice aspire edin ve atın. Boncukları üç kez buz gibi soğuk NP-40 hücre lizis tamponu ve iki kez buz gibi soğuk FLAG/HA tamponu ile yıkayın (10 mM Hepes pH 7.9, 15 mM MgCl2, 225 mM KCl ve %0.1 NP-40).
- Son yıkamadan sonra, bir pipet kullanarak tüm süpernatantı dikkatlice çıkarın ve poliubikitillenmiş proteini FLAG / HA tamponu üzerinde seyreltilmiş HA peptidi (300 μg / mL) ile elden çıkarın. Agaroz-anti-HA boncuklarını, sallanan bir çalkalayıcı platformunda 4 ° C'de 1 saat boyunca HA peptidi ile inkübe edin.
- Boncukları 4 ° C'de 2 dakika boyunca 3.000 x g'de döndürün ve poliubikitinlenmiş proteinleri içeren süpernatantı dikkatlice pipetleyin. Gerekirse, elüatı -20 ° C'de taze ve temiz bir mikrotüp içinde saklayın.
- Elüatları ve hücre lizatlarını% 10 SDS-PAGE (sodyum dodesil sülfat-poliakrilamid jel elektroforezi)17 ve immünoblotlamada çözün.
- Bu çalışmada ıslak transfer WB uygulanmıştır. Bu tür bir transfer için, jeli filtre kağıdı-jel-membran-filtre kağıdından oluşan bir transfer sandviçinin içine yerleştirin, pedlerle yastıklayın ve bir destek ızgarasıyla birlikte bastırın. Bu sistemi dikey olarak transfer tamponu ile dolu bir tanka ve paslanmaz çelik / platin tel elektrotların arasına yerleştirin. Transfer, ıslak transfer tamponunda (glisin 192 mM, tris-baz 25 mM,% 0.025 SDS,% 20 Metanol) 150 V'ta 90 dakika boyunca gerçekleşir.
NOT: Hücre ekstraktları nicelleştirildiğinden (adım 3.7), her örnek için eşit miktarda protein içeren bir SDS-PAGE çalıştırın. Ayrıca, ayrıştırmayı çözümlemek için, her numunenin eşit hacimlerini çalıştırın. - Seçilen antikorları kullanarak immünoblot membranını araştırın 11. Vahşi tip E3 ligaz, substrat ve myc-ub içeren örneklerde anti-myc antikoru kullanarak, IP işleminde çekilen poliubikitile substrattan elde edilen elüatta bir smear sinyalinin tespit edildiğinden emin olun. Hücre lizatında (giriş), seçilen substrattan, Fbxo7 proteininden, ubikitile proteinlerden ve bir temizlik proteininden (örneğin, GAPDH ve β-aktin) gelen sinyalin, her şeritte aynı miktarda proteini garanti etmek için tespit edildiğinden emin olun.
NOT: Kullanılan her antikor için seyreltme, üreticinin talimatlarına göre hazırlanmıştır.
Sonuçlar
UXT (her yerde ifade edilen transkript), kalp, beyin, iskelet kası, plasenta, pankreas, böbrek ve karaciğer gibi fare ve insan dokularında her yerde eksprese edilen protein katlama komplekslerini oluşturan prefoldin benzeri bir proteindir18. UXT-V1 ve UXT-V2 olarak adlandırılan iki ekleme izoformu, farklı fonksiyonlar ve hücre altı konumlar gerçekleştirerek tanımlanmıştır. UXT-V1 ağırlıklı olarak sitoplazmada ve mitokondri içinde lokalize olur ve TNF-α indüklenen apoptoz ve ...
Tartışmalar
Ubikitilasyon, birkaç proteinin seviyelerini düzenleyen ve birçok sinyal yolunda ve biyolojik süreçte önemli bir rol oynayan ve sağlıklı bir hücre içi ortam sağlayan önemli bir post-translasyonel modifikasyondur. Ubikitin-proteazom sistemi (UPS), tümör baskılayıcılarını stabilize etme veya onkojenik ürünlerin bozulmasını indükleme imkanı sağlayan son farmasötik araştırmaların ana odaklarından biridir22. Örneğin, multipl miyelomda (MM) monoklonal immünoglobulin se...
Açıklamalar
Yazarlar çıkar çatışması olmadığını beyan ederler.
Teşekkürler
F.R.T, FAPESP hibe numarası 2020/15771-6 ve CNPq Universal 405836/2018-0 tarafından desteklenmektedir. P.M.S.P ve V.S, CAPES tarafından desteklenmektedir. C.R.S.T.B.C, 2019/23466-1 sayılı FAPESP burs numarası ile desteklenmiştir. Sandra R. C. Maruyama'ya (FAPESP 2016/20258-0) maddi destek için teşekkür ederiz.
Malzemeler
| Name | Company | Catalog Number | Comments |
| 1.5 mL microtube | Axygen | PMI110-06A | |
| 100 mm TC-treated culture dish | Corning | 430167 | |
| 15 mL tube | Corning | 430766 | |
| 96-well plate | Cralplast | 655111 | |
| Agarose-anti-HA beads | Sigma-Aldrich | E6779 | |
| Anti Mouse antibody | Seracare | 5220-0341 | Goat anti-Mouse IgG |
| Anti Rabbit antibody | Seracare | 5220-0337 | Goat anti-Rabbit IgG |
| Anti-Actin antibody | Sigma-Aldrich | A3853 | Dilution used: 1:2000 |
| Anti-Fbxo7 antibody | Sigma-Aldrich | SAB1407251 | Dilution used: 1:1000 |
| Anti-HA antibody | Sigma-Aldrich | H3663 | Dilution used: 1:1000 |
| Anti-Myc antibody | Cell Signalling | 2272 | Dilution used: 1:1000 |
| Bradford reagent | Sigma-Aldrich | B6916-500ML | |
| BSA | Sigma-Aldrich | A9647-100G | Bovine Serum Albumin |
| Cell incubator | Nuaire | NU-4850 | |
| Centrifuge | Eppendorf | 5804R | 500 x g for 5 min |
| ChemiDoc | BioRad | ||
| Digital pH meter | Kasvi | K39-2014B | |
| Dulbecco’s Modified Eagle’s Medium | Corning | 10-017-CRV | High glucose |
| Fetal bovine serum | Gibco | F4135 | Filtrate prior use |
| HA peptide | Sigma-Aldrich | I2149 | |
| HEK293T cells | ATCC | CRL-3216 | |
| Hepes | Gibco | 15630080 | |
| KCl | VWR Life Science | 0365-500G | |
| Kline rotator | Global Trade Technology | GT-2OIBD | |
| MG-132 | Boston Biochem | I-130 | |
| Microcentrifuge | Eppendorf | 5418R | |
| Na3VO4 (Ortovanadato) | |||
| NaF | |||
| Nitrocellulose blotting membrane | GE Healthcare | 10600016 | |
| NP40 (IGEPAL CA-630) | Sigma-Aldrich | I8896-100ML | |
| Optical microscope | OPTIKA microscopes | SN510768 | |
| Opti-MEM | Gibco | 31985-070 | |
| pcDNA3 | Invitrogen | V79020 | For mammalian expression |
| pcDNA3-2xFlag-Fbxo7 | Kindly donated by Dr. Marcelo Damário | Tag 2xFlag (N-terminal). Restriction enzymes: EcoRI and XhoI | |
| pcDNA3-2xFlag-Fbxo7-ΔF-box | Kindly donated by Dr. Marcelo Damário | Tag 2xFlag (N-terminal). Restriction enzymes: EcoRI and XhoI. Δ335-367 | |
| pcDNA3-UXTV2-HA | Kindly donated by Dr. Marcelo Damário | Tag HA (C-terminal). Restriction enzymes: EcoRI and XhoI | |
| pCMV-6xHis-Myc-Ubiquitin | Kindly donated by Dr. Marcelo Damário | Tag 6x-His-Myc (N-terminal). Restriction enzymes: EcoRI and KpnI | |
| Pen Strep Glutamine 100x | Gibco | 10378-016 | |
| Phosphate buffered saline 10x | AccuGENE | 51226 | To obtain a 1x PBS, dilute the 10x PBS into ultrapure water |
| Polyethylenimine (PEI) | Sigma-Aldrich | 9002-98-6 | |
| Ponceau S | VWR Life Science | 0860-50G | |
| Protease inhibitor cocktail SIGMAFAST | Sigma-Aldrich | S8820 | |
| Rocking Shaker | Kasvi | 19010005 | |
| SDS-PAGE system | BioRad | 165-8004 | |
| Solution Homogenizer | Phoenix Luferco | AP-22 | |
| Trizma base | Sigma-Aldrich | T6066-500G | |
| Trypsine (TrypLe Express) | Gibco | 12605-028 | |
| Western Blotting Luminol Reagent | Santa Cruz Biotechnology | SC-2048 |
Referanslar
- Popovic, D., Vucic, D., Dikic, I. Ubiquitination in disease pathogenesis and treatment. Nature Medicine. 20 (11), 1242-1253 (2014).
- Callis, J. The ubiquitination machinery of the ubiquitin system. The Arabidopsis Book. 12, 0174 (2014).
- Koegl, M., et al. A novel ubiquitination factor, E4, is involved in multiubiquitin chain assembly. Cell. 96 (5), 635-644 (1999).
- French, M. E., Koehler, C. F., Hunter, T. Emerging functions of branched ubiquitin chains. Cell Discovery. 7 (1), 6 (2021).
- Komander, D., et al. Molecular discrimination of structurally equivalent Lys 63-linked and linear polyubiquitin chains. EMBO Reports. 10 (5), 466-473 (2009).
- Clague, M. J., Urbé, S. Ubiquitin: Same molecule, different degradation pathways. Cell. 143 (5), 682-685 (2010).
- Davies, B. A., et al. Vps9p CUE domain ubiquitin binding is required for efficient endocytic protein traffic. Journal of Biological Chemistry. 278 (22), 19826-19833 (2003).
- Raasi, S., Wolf, D. H. Ubiquitin receptors and ERAD: A network of pathways to the proteasome. Seminars in Cell and Developmental Biology. 18 (6), 780-791 (2007).
- Pan, M., et al. Structural insights into Ubr1-mediated N-degron polyubiquitination. Nature. 600 (7888), 334-338 (2021).
- Raducu, M., et al. SCF (Fbxl17) ubiquitylation of Sufu regulates Hedgehog signaling and medulloblastoma development. The EMBO Journal. 35 (13), 1400-1416 (2016).
- Spagnol, V., et al. The E3 ubiquitin ligase SCF(Fbxo7) mediates proteasomal degradation of UXT isoform 2 (UXT-V2) to inhibit the NF-κB signaling pathway. Biochimica et Biophysica Acta - General Subjects. 1865 (1), 129754 (2021).
- Teixeira, F. R., et al. Gsk3β and Tomm20 are substrates of the SCFFbxo7/PARK15 ubiquitin ligase associated with Parkinson's disease. Biochemical Journal. 473 (20), 3563-3580 (2016).
- Tan, M. K. M., Lim, H. J., Bennett, E. J., Shi, Y., Harper, J. W. Parallel SCF adaptor capture proteomics reveals a role for SCFFBXL17 in NRF2 activation via BACH1 repressor turnover. Molecular Cell. 52 (1), 9-24 (2013).
- van Wijk, S. J., Fulda, S., Dikic, I., Heilemann, M. Visualizing ubiquitination in mammalian cells. EMBO Reports. 20 (2), 1-18 (2019).
- Kisselev, A. F., Goldberg, A. L. Proteasome inhibitors: From research tools to drug candidates. Chemistry and Biology. 8 (8), 739-758 (2001).
- Bradford, M. A. Rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of protein-dye binding. Analytical Biochemistry. 72 (1-2), 248-254 (1976).
- Laemmli, U. K. Cleavage of structural proteins during the assembly of the head of bacteriophage T4. Nature. 228, 726-734 (1970).
- Schröer, A., Schneider, S., Ropers, H. -. H., Nothwang, H. G. Cloning and characterization of UXT, a novel gene in human Xp11, which is widely and abundantly expressed in tumor tissue. Genomics. 56 (3), 340-343 (1999).
- Huang, Y., et al. UXT-V1 facilitates the formation of MAVS antiviral signalosome on mitochondria. The Journal of Immunology. 188 (1), 358-366 (2012).
- Huang, Y., et al. UXT-V1 protects cells against TNF-induced apoptosis through modulating complex II formation. Molecular Biology of the Cell. 22 (8), 1389-1397 (2011).
- Sun, S., et al. UXT is a novel and essential co-factor in the NF-κB transcriptional enhanceosome. The Journal of Cell Biology. 178 (2), 231-244 (2007).
- Huang, X., Dixit, V. M. Drugging the undruggables: Exploring the ubiquitin system for drug development. Cell Research. 26 (4), 484-498 (2016).
- Rajkumar, S. V. Multiple myeloma: 2020 update on diagnosis, risk-stratification and management. American Journal of Hematology. 95 (5), 548-567 (2020).
- Hideshima, T., et al. The proteasome inhibitor PS-341 inhibits growth, induces apoptosis, and overcomes drug resistance in human multiple myeloma cells. Cancer Research. 61 (7), 3071-3076 (2001).
- Tietsche, V., et al. New proteasome inhibitors in the treatment of multiple myeloma. Hematology, Transfusion and Cell Therapy. 41 (1), 76-83 (2018).
- Vassilev, L. T., et al. In vivo activation of the p53 pathway by small-molecule antagonists of MDM2. Science. 303 (5659), 844-848 (2004).
- Kuiken, H. J., et al. Identification of F-box only protein 7 as a negative regulator of NF-kappaB signalling. Journal of Cellular and Molecular Medicine. 16 (9), 2140-2149 (2012).
- Yuan, N., et al. Bafilomycin A1 targets both autophagy and apoptosis pathways in pediatric B-cell acute lymphoblastic leukemia. Haematologica. 100 (3), 345-356 (2015).
- Iconomou, M., Saunders, D. N. Systematic approaches to identify E3 ligase Substrates. Biochemical Journal. 473 (22), 4083-4101 (2016).
- Zhang, Z. R., Bonifacino, J. S., Hegde, R. S. Deubiquitinases sharpen substrate discrimination during membrane protein degradation from the ER. Cell. 154 (3), 609-622 (2013).
- Hunter, T. The age of crosstalk: Phosphorylation, ubiquitination, and beyond. Molecular Cell. 28 (5), 730-738 (2007).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır