Bu içeriği görüntülemek için JoVE aboneliği gereklidir. Oturum açın veya ücretsiz deneme sürümünü başlatın.
Method Article
Kemirgen kalplerinde kalp yapısını ortaya çıkarmak için ışıklı tabaka görüntüleme
Bu Makalede
Özet
Protokol, kemirgen kalplerindeki karmaşık kardiyak yapıları araştırmak için uyarlanmış doku temizleme yöntemleriyle birlikte gelişmiş ışık tabakası mikroskobunu kullanır ve kardiyak morfogenezin anlaşılması ve yeniden şekillenmesi için büyük bir potansiyele sahiptir.
Özet
Işık tabakası mikroskobu (LSM), kalbin karmaşık üç boyutlu (3D) yapısını anlamada çok önemli bir rol oynar ve temel kardiyak fizyoloji ve patolojik yanıtlar hakkında önemli bilgiler sağlar. Bu vesileyle, fare modellerinde kalbin mikro mimarisini aydınlatmak için LSM tekniğinin geliştirilmesini ve uygulanmasını inceliyoruz. Metodoloji, özelleştirilmiş bir LSM sistemini doku temizleme teknikleriyle bütünleştirerek hacimsel görüntüleme için kardiyak dokulardaki ışık saçılımını azaltır. Konvansiyonel LSM'nin görüntü birleştirme ve çoklu görüntüleme evrişim giderme yaklaşımlarıyla kombinasyonu, tüm kalbin yakalanmasına olanak tanır. Eksenel çözünürlük ve görüş alanı (FOV) arasındaki doğal dengeyi ele almak için, odak dışı ışığı en aza indirmek ve kalbi yayılma yönü boyunca eşit şekilde aydınlatmak için eksenel olarak süpürülmüş bir ışık tabakası mikroskobu (ASLM) yöntemini daha da tanıtıyoruz. Bu arada, iDISCO gibi doku temizleme yöntemleri, ışık penetrasyonunu artırarak derin yapıların görselleştirilmesini kolaylaştırır ve tüm kalp boyunca miyokardın kapsamlı bir şekilde incelenmesini sağlar. Önerilen LSM ve doku temizleme yöntemlerinin kombinasyonu, araştırmacılar için kemirgen kalplerindeki kardiyak yapıların çözülmesinde umut verici bir platform sunmakta ve kardiyak morfogenezin anlaşılması ve yeniden şekillenmesinin anlaşılması için büyük bir potansiyele sahiptir.
Giriş
Kalp yetmezliği, esas olarak olgun kardiyomiyositlerin rejeneratif kapasitesinin olmaması nedeniyle dünya çapında önde gelen mortalite nedeni olmaya devam etmektedir1. Kalbin karmaşık mimarisi, işlevinde çok önemli bir rol oynar ve gelişimsel süreçler hakkında bilgi sağlar. Kardiyak yapının derinlemesine anlaşılması, miyokard enfarktüsüne yanıt olarak kardiyak morfogenezin temel süreçlerini ve yeniden şekillenmeyi aydınlatmak için gereklidir. Son gelişmeler, yenidoğan farelerin yaralanma sonrası kardiyak fonksiyonu eski haline getirebildiğini, yetişkin farelerin ise bu tür rejeneratif kapasiteden yoksun olduğunu göstermiştir2. Bu, fare modellerinde yapısal ve işlevsel anormalliklerle ilişkili ipuçlarını araştırmak için bir temel oluşturur. Konfokal mikroskopi gibi geleneksel görüntüleme yöntemlerinin, kısıtlı penetrasyon derinliği, yavaş nokta tarama şeması ve lazer ışığına uzun süre maruz kalmaktan kaynaklanan foto hasar gibi teknik sınırlamaları vardır. Bunlar, sağlam kalbin kapsamlı üç boyutlu (3D) görüntülenmesini engeller. Bu bağlamda, ışık tabakası mikroskobu (LSM), yüksek hızlı görüntüleme, azaltılmış foto hasarı ve olağanüstü optik kesit alma yeteneklerinin avantajlarını sunan güçlü bir çözüm olarak ortaya çıkmaktadır 3,4,5. LSM'nin benzersiz özellikleri, onu geleneksel tekniklerin sınırlamalarının üstesinden gelmek için umut verici bir yöntem olarak konumlandırmakta ve kardiyak gelişim ve yeniden modelleme süreçlerine benzeri görülmemiş bir bakış açısı sağlamaktadır 6,7,8.
Bu protokolde, gelişmiş LSM'yi uyarlanmış doku temizleme yaklaşımları9 ile birleştiren, spesifik etiketleme ve mekanik kesitlere ihtiyaç duymadan tüm fare kalplerinin görüntülenmesine olanak tanıyan bir görüntüleme stratejisi sunuyoruz. Ayrıca, eksenel çözünürlüğü iyileştirmek için geleneksel LSM görüntülemenin çoklu görüntü evrişimbozukluğu 10 veya eksenel olarak süpürülmüş ışık tabakası mikroskobu (ASLM) teknikleri 11,12,13,14,15 ile geliştirilebileceğini öneriyoruz. Ek olarak, görüntü birleştirmenin bu yöntemlerden herhangi biriyle entegrasyonu, uzamsal çözünürlük ve görüş alanı (FOV) arasındaki dengenin etkili bir şekilde üstesinden gelebilir ve böylece yetişkin fare kalplerinin görüntülenmesini ilerletebilir. Hidrofobik, hidrofilik ve hidrojel bazlı yöntemler dahil olmak üzere çok sayıda doku temizleme yaklaşımının dahil edilmesi, tüm kalbin morfolojisini yakalamak için daha derin ışık penetrasyonu sağlar 16,17,18,19.
Çoklu temizleme yöntemleri mevcut LSM sistemleriyle uyumlu olsa da, amaç, lipitleri kırılma indisine yakından uyan bir ortamla değiştirerek foton saçılımını en aza indirmek ve kalp gibi dokularda ışık penetrasyonunu artırmaktır. iDISCO, temsilci20,21 olarak seçildi ve hızlı işlemesi ve yüksek şeffaflığı nedeniyle bu protokolde otofloresan görüntüleme için uyarlandı (Şekil 1A). Toplu olarak, gelişmiş LSM yaklaşımının doku temizleme teknikleriyle entegrasyonu, kemirgen kalplerindeki karmaşık kardiyak anatomiyi çözmek için umut verici bir çerçeve sunar ve kardiyak morfogenez ve patogenez anlayışımızı ilerletmek için önemli bir potansiyele sahiptir.
Protokol
Hayvan protokolleri ve deneyleri, Dallas Kurumsal Hayvan Bakımı ve Kullanımı Komitesi'ndeki Texas Üniversitesi'nin gözetimi altında onaylanmış ve yürütülmüştür (IACUC # 21-03). Bu çalışmada, doğum sonrası 1. günde (P1) yenidoğanlar ve 8 haftalık yetişkinler dahil olmak üzere C57BL6 fareleri kullanılmıştır. Erkekler ve kadınlar arasında fark gözlenmedi. Tüm veri toplama ve görüntü işleme, açık kaynaklı yazılım veya araştırma veya eğitim lisanslarına sahip platformlar kullanılarak gerçekleştirildi. Kaynaklar, makul talep üzerine yazarlardan temin edilebilir.
1. Numune hazırlama ve doku temizleme (6 - 10 gün)
- Doku temizleme işlemine başlamadan önce doku temizleme yöntemi için gerekli olan Malzeme Tablosundaki tüm kimyasal çözeltileri hazırlayın.
NOT: Uygun kişisel koruyucu ekipman giyerken, özellikle toksik kimyasallarla çalışırken, tüm prosedürleri çeker ocakta gerçekleştirin. - Tüm kalp toplama için P1 ve 8 hafta gibi istenen zaman noktalarında bir CO2 odasına yerleştirerek hayvanları CO2 ile ötenazi yapın ve yeni izole edilmiş kalbi oda sıcaklığında (RT) 0.2 M KCl'ye daldırın ve diyastol16'da tutuklayın.
- Kardiyak anatomiyi 4 ° C'de korumak için gece boyunca bir külbütör üzerinde hafif çalkalama ile 1x fosfat tamponlu salin (PBS) içinde% 4 paraformaldehit (PFA) içine daldırarak kalbi sabitleyin, Tablo 1'e bakın.
DİKKAT: PFA toksik bir kimyasaldır ve çeker ocak altında yapılmalıdır. - Kalbi RT'de 1x PBS ile 30 dakika, 3x yıkayın.
NOT: İsteğe bağlı: Aşağıda açıklandığı gibi 2. adımda özel yapım LSM sistemi için bir kalp düzeneği oluşturmak üzere kalbi agaroz jele gömün.- Agarozu PBS içinde çözerek% 1'lik agaroz çözeltisini hazırlayın ve karışımı tamamen çözünene kadar mikrodalgada ısıtın. Çözelti 40 °C'ye kadar soğuyana kadar bir alt tabaka oluşturmak için çözeltiyi bir kalıba dökün.
- Kalbi kalıba yerleştirin ve kalıbı katılaşana kadar agaroz jel ile doldurun. Görüntülemedeki artefaktları en aza indirmek için agaroz jeldeki kabarcıkları ortadan kaldırın.
NOT: Numunenin gömülmesi, montaj sırasında kalp anatomisine zarar verme riskini azaltır.
DİKKAT: Düşük erime noktalı agaroz kullanın ve numuneyi yüksek sıcaklıklara maruz bırakma riskini azaltmak için kalbi doğrudan ısıtılmış agarozun içine yerleştirmekten kaçının.
- Deiyonize su ile karıştırılmış metanol gradyanlarını kullanarak kalbi kurutun (Şekil 1B), Tablo 1'de belirtildiği gibi %20, %40, %60, %80 ve %100 sıralı konsantrasyonlarla işleyin. Tam dehidrasyonu sağlamak için taze %100 metanol 1x ile tekrarlayın. Yenidoğan fare kalplerini her metanol karışımında 1 saat çalkalayarak kurutun. 8 haftalık fare kalpleri ve sıçan kalpleri için kuluçka süresini 2 saate ayarlayın.
DİKKAT: Metanol uçucu, tahriş edici ve yanıcı bir kimyasaldır. - Kalbi taze %100 metanol ile değiştirin ve 4 °C'de 10 dakika soğutun.
- Solüsyonu değiştirin ve pigmentleri çıkarmak için gece boyunca 4 ° C'de 1: 5 (% 30 H2O2 ila% 100 metanol) hacim oranı kullanarak metanol içinde% 5 hidrojen peroksit (H2O 2) ile kalbi ağartın.
NOT: Pigmentlerin çıkarılması, foton emiliminin en aza indirilmesine olanak tanıyarak görüntü kalitesinin artmasına ve artefaktların azalmasına olanak tanır. - Çözeltiyi değiştirin ve kalbi RT'de 1 saat boyunca% 100 metanol içinde inkübe edin.
- %66 diklorometan (DCM) ve %33 metanol içeren solüsyon ile kalbi 3 saat çalkalayarak delipide edin. Bu adımın sonunda kalbin şişenin dibine battığından emin olun. Değilse, çözeltiyi yenileyin (% 66 DCM ve% 33 metanol) ve tam delipidasyon elde etmek için inkübasyon süresini uzatın (örn. 1 saat daha). DCM oldukça uçucu olduğu için kurumayı önlemek için kalbi hızlı bir şekilde taze bir çözeltiye aktarın.
DİKKAT: DCM polistiren ile uyumlu olmadığından deney için polipropilen veya cam eşya kullanın. - Kırılma indisi eşleştirmesi için dibenzil eter (DBE) kullanın (RI = 1.56). Yenidoğan fare kalpleri için kırılma indisi eşleştirme işlemi 2 gün sürerken, 8 haftalık fare kalpleri için hafif sallama ile 5 gün sürer. Taze DBE ile değiştirin ve kalp tam şeffaflığa ulaşana kadar kuluçka süresini uzatın.
DİKKAT: DBE tehlikelidir. Cilt ile herhangi bir temastan kaçının.
2. Numune montajı (1 gün)
NOT: Ticari bir LSM sisteminin kullanılması durumunda, kalbi düzeltmek ve 2.1 - 2.9 arasındaki adımları atlamak için şirket tarafından sağlanan özel protokolünü izleyin.
- Bir 3D yazıcı ve Onyx malzemeleri kullanarak kırılma indisi eşleştirme çözümüne (örneğin, uyarlanmış iDISCO yaklaşımında DBE) dirençli bir odayı ve bir tutucuyu özelleştirin (Şekil 2A)16.
- LSM sistemi altında hızlı bağlantıyı ve doğru lokalizasyonu kolaylaştırmak için haznenin altına bir mıknatıs yapıştırın (Şekil 2B).
- Şeffaf silikon yapıştırıcı kullanarak hazneye 25 mm x 50 mm x 0,17 mm kapak camları takın ve hazneyi DBE ile doldurarak ve 1 gün sonra sızıntı olup olmadığını kontrol ederek haznenin su geçirmezlik bütünlüğünü doğrulayın.
- Bir 3D yazıcı kullanarak bir kelepçe tutucuyu özelleştirin ve kalp tertibatını haznenin içine monte etmek için bir mıknatıs takın (Şekil 2C) veya kalp tertibatını monte etmek için agaroz jele bir iğne sokun.
- Daha önce bildirildiği gibi silindirik bir lens ve sürekli dalga diyot pompalı katı hal (DPSS) lazerleri kullanarak şirket içi bir LSM sisteminin geliştirilmesini gerçekleştirin16,22. Miyokarddan otofloresan yakalamak için 532 nm'lik uyarma dalga boyunu kullanın (Şekil 2D).
- Odayı 6 boyutlu bir tablaya monte edin ve haznenin lazer yayılma yönüne dik olduğu en uygun konumu bulun.
- Numuneyi odanın ortasına yerleştirmek için manyetik bir kelepçe tutucu kullanın ve tutucuyu 4 boyutlu motorlu bir aşamaya (X, Y, Z ve Sapma; Şekil 2D).
- Kalp tertibatını motorlu aşamayı kullanarak DBE ile doldurulmuş hazneye daldırın ve algılama ekseni (Z yönü) boyunca tarama aralığını belirleyin.
- Aşağıdaki denklemi kullanarak bir görüntünün adım boyutuna (S) ve yakalama süresine (T) dayalı olarak Z yönü boyunca motorun tarama hızını (V, z) belirleyin:
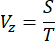
NOT: Görüntüleme sisteminin adım boyutu ve eksenel çözünürlüğü arasındaki ilişki, Nyquist-Shannon örnekleme teoremine bağlıdır. Örneğin, önceki rapor 16'da belirtildiği gibi eksenel çözünürlüğün 2,91 μm olduğu göz önüne alındığında, adım boyutu1 μm olarak ayarlanmıştır. - Uzamsal çözünürlüğü doğrulamak ve farklı derinliklerde olası opaklık sorunlarını en aza indirmek için, 1:1,5 x 10konsantrasyonda %1 düşük erime noktalı agaroz jel içinde seyreltilmiş 0,53 μm çapındaki floresan boncukları görüntüleyerek sistemin nokta yayılma işlevini (PSF) ölçün 5. Tam genişliği yarı maksimumda (FWHM)16 ölçerek tüm numune boyunca PSF'yi hesaplayın.
3. Görüntü birleştirme (4-8 saat)
- Sınırlı FOV'u göz önünde bulundurarak tüm fare kalbini kaplamak için gereken döşeme sayısını hesaplayın. Her döşeme için boyutlar LSM sisteminin FOV'una karşılık gelir. Örneğin, 3 x 3,6 mm2 kesit ölçümüne sahip bir yenidoğan fare kalbi, özelleştirilmiş LSM'de kapsama alanı için 2 x 2 karo gerektirir (Şekil 3A). Buna karşılık, 5 x 8 mm2 ölçülerindeki 8 haftalık bir fare kalbi, tüm kalp yapısını kaplamak için 3 x 4 karo gerektirir (Şekil 3B).
NOT: Konvansiyonel LSM'nin tüm kalbi görüntülemek için sınırlı FOV'u varsa görüntü dikişi gereklidir. - Döşeme 1'den, yani kalbin sol üst köşe döşemesinden başlayarak kalbin resimlerini yakalayın (Şekil 3A-B).
- Şekil 3C'de gösterildiği gibi, tüm kalp kaplanana kadar ardışık karolar arasında %10'luk bir örtüşme ile kalan karoların görüntülerini sırayla yakalayın.
- Fiji23 açık kaynaklı yazılımını indirin ve yükleyin. Fiji eklentisi BigStitcher24'ü indirin ve yükleyin.
- Yardım menüsüne gidin, Güncelle'yi seçin, Güncelleme sitesini yönet'i seçin ve BigStitcher'ı seçin. Ardından, Kapat'ı ve ardından Değişiklikleri uygula'yı tıklayın. Eklenti indirme işlemini tamamladıktan sonra Fiji yazılımını yeniden başlatın.
- BigStitcher eklentisini açın ve gerekli tüm döşemeleri görüntü dosyası dizini aracılığıyla içe aktarın. Veri kümesini bir HDF5 dosyası olarak kaydedin.
- Döşemeyi Normal Izgaraya Göre Taşı'yı seçerek döşemeleri düzenleyin, kalbi hareket ettirmek için kullanılan deseni seçin ve her döşeme arasında %10'luk bir çakışma seçin. Dikiş Sihirbazı seçeneğini kullanarak döşemeleri dikin.
- Bir tiff dosyası oluşturmak için Image Fusion kullanarak dikilmiş verileri dışa aktarın.
4. Çoklu görüntü evrişimi (5 gün)
- Kalp boyunca çoklu görüntü rekonstrüksiyonunun görüntü kaydı için floresan boncuklar kullanın (Şekil 3D).
- Bisfenol-A diglisidil eter (DER332 ), İzoforon diamin, 5-amino-1,3,3-trimetilsikloheksanemelamin (IPDA) ve Polipropilen glikol diglisidil eteri (DER 736) 4:1:1 hacim oranında karıştırarak reçine 25'i hazırlayın.
- 10 μL floresan boncukları 161 x g'da 5 dakika boyunca santrifüjleyin ve boncukların depolama çözeltisini değiştirmek için 20 μL metanol ekleyin. 3 kez tekrarlayın.
- Metanol bazlı boncuk çözeltisini adım 4.1.1'de hazırlanan reçineye karıştırarak 1:1 x 105 boncuk konsantrasyonuna sahip 10 mL'lik bir çözelti hazırlayın.
- Hava ceplerini ve kabarcıkları çıkarmak için çözeltiyi 3 saat boyunca bir vakum odasında gazdan arındırın.
- Solüsyonu bir silikon kalıba veya plastik bir pipete dökün ve katılaşana kadar 2 ila 3 gün bekleyin. Reçine katılaşmadan 1 gün sonra, cam tüpü kalıbın içine koyun ve tüp reçineye yapışana kadar bekleyin. Reçineyi cam tüp ile kalıptan çıkarın (Şekil 3D).
- Kalbi cam tüpe yerleştirin, DBE ile doldurun ve cam tüpü DBE ile dolu hazneye monte edin.
- Kalp aksamını algılama ekseni (Z ekseni; Şekil 3E-F).
NOT: Kalp boyutu FOV'u aşarsa ayrı görüntü yığınları oluşturmak için 3. adımda görüntü birleştirmeyi uygulayın. - Sonraki yığınları birden çok açıdan, yani 60°, 60°, 120°, 180°, 240° ve 300° gibi birden çok açıdan yakalamak için fare kalbini Y ekseni boyunca 60° döndürün (Şekil 3E-F).
- BigStitcher eklentisini açın ve tüm görüntüleri görüntü dosyası dizini aracılığıyla içe aktarın. Veri kümesini bir HDF5 dosyası olarak kaydedin.
- İlgi Alanlarını Tespit Et'i seçin ve kayıt için ilgilenilen boncukları manuel olarak seçin.
- Kayıt için afine dönüşüm modeli'ni seçin. Nokta Yayılma İşlevi'ni seçin ve tüm görünümlere PSF atayın.
- Multiview Deconvolution'a tıklayın ve yineleme türünü Verimli Bayesian olarak seçin. Yineleme sayısını 10 olarak tanımlayın ve26 olarak yürütün.
- Bir tiff dosyasını dışa aktarmak için Image Fusion'a tıklayın.
NOT: Çoklu görüntü evrişimi hakkında daha ayrıntılı bilgi diğer raporlarda veyaprotokollerde bulunabilir 24,27,28.
5. Eksenel süpürülmüş hafif levha sistem donanımı (1 gün)
- Lazer ışınını eksenel olarak taramak için silindirik merceğin (CL)27 (Şekil 2D)Fourier düzlemine bir elektrikli ayarlanabilir mercek (ETL) takın 1 4. Yerçekiminin neden olduğu dalga cephesi bozulmasını önlemek için ETL'deki sıvı arayüzünün yatay olduğundan emin olun. Işın azalmasını ve daha yüksek dereceli optik sapmaları en aza indirmek için ETL'yi hassas bir şekilde hizalayın30.
- İş istasyonuna bir DAQ kartı takın ve kamera pozlamasını ve ETL taramasını senkronize etmek için DAQ kartına bir BNC kablosu bağlayın.
- ETL sürücüsünün muhafazasını açın ve kapağı çıkarın (Şekil 4).
- BNC kablosunun sinyal kablosunu, PCB kartının altında etiketlendiği gibi Analog in B pinine lehimleyin (Şekil 4).
- BNC kablosunun topraklama kablosunu GND pinine lehimleyin; bundan sonra BNC kablosunun diğer ucunu DAQ kartındaki AO'ya (Analog Çıkış) bağlayın (Şekil 4).
- ETL Sürücüsünü iş istasyonunun USB bağlantı noktasına takın, sürücüyü bir hirose kablosu kullanarak ETL'ye bağlayın ve Lens Sürücüsü Denetleyici Yazılımını yükleyin.
- ETL'yi DAQ kartından oluşturulan bir tetikleyici ile kontrol etmek için Lens Sürücüsü Kontrol Yazılımı'ndaki Çalışma modunu Analog olarak değiştirin.
- sCMOS kameranın yazılımında, Çekim modunu Harici (Hafif sayfa) olarak değiştirin. Senkronizasyona yardımcı olmak için aktif piksel tarama yönünün lazer tarama yönüne dik olduğundan emin olun.
- sCMOS kameranın arkasındaki harici tetikleme bağlantı noktasını bir BNC kablosu kullanarak DAQ kartının AO'suna bağlayın (Şekil 4).
6. Eksenel süpürülmüş hafif levha sistemi senkronizasyonu (7 gün)
- Önerilen çalışma için en az 10 olan kabul edilebilir sinyal-arka plan oranına (SBR) dayalı olarak maruz kalma süresini tanımlayın. SBR 10'dan düşükse maruz kalma süresini artırın.
NOT: 10 ila 50 ms arasında değişen maruz kalma süresi, bu projede kabul edilebilir bir SBR sağlar. - Aşağıdaki denklemleri kullanarak kamera için pozlama süresine (E) ve ETL frekansına (f) dayalı olarak bir görüntünün çekim süresini (T) ve çizgi aralığını (L) tanımlayın:
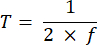
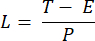
Burada P , kamera sensöründeki piksel sütunlarının sayısını gösterir. Referans için temsili parametreler sırasıyla f = 1 Hz, P = 2048, E = 10 ms ve L = 243 μs'dir. - LabVIEW programında Trigger Generator.vi, senkronizasyon için hem kare hem de üçgen tetikleyiciler oluşturur (Şekil 5).
NOT: Özelleştirilmiş LabVIEW programı, makul bir talep üzerine yazarlardan temin edilebilir. - Görüntüdeki ışın belinin konumunu bulmak için %1 düşük erime noktalı agaroz jel16 içinde 1:1 x 103 konsantrasyonla seyreltilmiş floresan boncukları monte edin (Şekil 6A).
- Programda, tarama yönü boyunca voltajı değiştirerek FOV altındaki lazer ışınının başlangıç ve bitiş noktalarını belirleyin.
- sCMOS kamerayı ve ETL'yi senkronize etmek için, bir 2D görüntü oluşturmak için lazer ışınını X ekseni boyunca ve Y ekseni boyunca aktif pikselleri tarayın (Şekil 6B). Görüntüdeki köşegen boyunca daha parlak ve daha keskin boncuklar, sCMOS ve ETL arasındaki hassas senkronizasyonu gösterir.
NOT: ETL'nin tarama hızının senkronizasyonu ve sCMOS piksel aktivasyonu, görüntü kalitesi için kritik öneme sahiptir. Çeşitli yaygın asenkron hatalar Şekil 6C-F'de özetlenmiştir. - Senkronizasyon için en uygun senkronizasyon parametrelerini belirledikten sonra, aktif piksel yönünü lazer tarama yönüyle hizalamak için sCMOS kamerayı Z ekseni etrafında 90° döndürün.
- Adım 2.10'u tekrarlayın ve PSF'nin FWHM'sini ölçün. ASLM'nin ortalama yanal ve eksenel çözünürlükleri sırasıyla 2.18 μm ve 2.88 μm olacak şekilde önceki rapor16'da belirtilenle aynı yöntemi kullanın (Şekil 7).
NOT: Tüm FOV boyunca tek tip aydınlatma ve çözünürlük, ideal koşullar altında mümkündür (Şekil 7A-B). ETL'nin sCMOS kamera ile eşzamansız çalışmasının yanı sıra aydınlatma ve algılamanın yanlış hizalanması, tekdüze olmayan uzamsal çözünürlüğe neden olabilir (Şekil 7C-D). - Kardiyak görüntüleme için, sistemi hizaladıktan ve sistem senkronizasyonu için en uygun parametreleri belirledikten sonra, 2.6 ila 2.9 adımlarına geçin.
Sonuçlar
LSM'nin, parlak alan ve nokta tarama teknikleri gibi diğer optik görüntüleme yöntemlerinin aksine minimum foto hasar riski, yüksek uzamsal çözünürlük ve optik kesitleme riski nedeniyle31,32,33,34,35,36,37 kardiyak çalışmaları teşvik ettiği gösterilmiştir 6,8,38,39,40<...
Tartışmalar
Görüntüleme, hesaplama ve doku temizleme yöntemlerinin ilerlemesi, kardiyak yapı ve fonksiyonu kapsamlı bir şekilde araştırmak için eşsiz bir fırsat sağlamıştır. Bu, sağlam bir kemirgen kalp modeli kullanarak kardiyak morfogenez ve patogenez anlayışımızı derinleştirmek için büyük bir potansiyele sahiptir. Benzer bir yaklaşım40,41,42,43 kullanan zebra balığı kalbi üzerinde yapılan in vivo çalışmaların aksin...
Açıklamalar
Yazarların ifşa edecek herhangi bir çıkar çatışması yoktur.
Teşekkürler
Dr. Eric Olson'un UT Southwestern Tıp Merkezi'ndeki grubuna hayvan modellerini cömertçe paylaştıkları için minnettarlığımızı ifade ediyoruz. UT Dallas'taki D-incubator üyeleri tarafından sağlanan tüm yapıcı yorumları takdir ediyoruz. Bu çalışma NIH R00HL148493 (YD), R01HL162635 (YD) ve UT Dallas STARS programı (YD) tarafından desteklenmiştir.
Malzemeler
| Name | Company | Catalog Number | Comments |
| 1% Agarose | |||
| Low melting point agarose | Thermo Fisher | 16520050 | |
| Deionized water | - | - | |
| Chemicals for tissue clearing | |||
| 5-Amino-1,3,3-trimethylcyclohexanemethylamine, mixture of cis and trans | Sigma-Aldrich | 118184 | |
| D.E.R.™ 332 | Sigma-Aldrich | 31185 | |
| D.E.R.™ 736 | Sigma-Aldrich | 31191 | |
| Dibenzyl ether (DBE) | Sigma-Aldrich | 33630 | |
| Dichloromethane (DCM) | Sigma-Aldrich | 270997 | |
| Fluorescent beads | Spherotech | FP-0556-2 | |
| Hydrogen peroxide (H2O2) | Sigma-Aldrich | 216736 | |
| Methanol | Sigma-Aldrich | 439193 | |
| Paraformaldehyde (PFA) | Thermo Fisher | 47392 | |
| Phosphate Buffered Saline (PBS) | Sigma-Aldrich | 79383 | |
| Potassium Chloride (KCl) | Sigma-Aldrich | P3911 | |
| Software and algorithms | |||
| Amira | Thermo Fisher Scientific | 2021.2 | |
| BigStitcher | Hörl et al.22 | ||
| Fiji-ImageJ | Schindelin et al.20 | 1.54f | |
| HCImage Live | Hamamatsu Photonics | 4.6.1.2 | |
| LabVIEW | National Instruments Corporation | 2017 SP1 | |
| Key components of the customized light-sheet system | |||
| 0.63 - 6.3X Zoom body | Olympus | MVX-ZB10 | |
| 10X Illumination objective | Nikon | MRH00105 | |
| 1X detection objective | Olympus | MV PLAPO 1X/0.25 | |
| 473nm DPSS Laser | Laserglow Technologies | LRS-0473-PFM-00100-05 | |
| 532nm DPSS laser | Laserglow Technologies | LRS-0532-PFM-00100-05 | |
| 589 nm DPSS laser | Laserglow Technologies | LRS-0589-GFF-00100-05 | |
| BNC connector | National Instrument | BNC-2110 | |
| Cylindrical lens | Thorlabs | ACY254-050-A | |
| DC-Motor Controller, 4 axes | Physik Instrumente | C-884.4DC | |
| ETL | Optotune | EL-16-40-TC-VIS-5D-1-C | |
| ETL Cable | Optotune | CAB-6-300 | |
| ETL Lens Driver | Optotune | EL-E-4i | |
| Filter | Chroma | ET525/30 | |
| Filter | Chroma | ET585-40 | |
| Filter | Chroma | ET645-75 | |
| Filter wheel | Shutter Instrument | LAMBDA 10-B | |
| Motorized translation stage | Physik Instrumente | L-406.20DG10 | |
| Motorized translation stage | Physik Instrumente | L-406.40DG10 | |
| Motorized translation stage | Physik Instrumente | M-403.4PD | |
| NI multifunction I/O | National Instrument | PCIe-6363 | |
| sCMOS camera | Hamamatsu | C13440-20CU | |
| Stepper motor | Pololu | 1474 | |
| Tube lens | Olympus | MVX-TLU |
Referanslar
- Sadek, H., Olson, E. N. Toward the goal of human heart regeneration. Cell Stem Cell. 26, 7-16 (2020).
- Porrello, E. R., et al. Transient regenerative potential of the neonatal mouse heart. Science. 331, 1078-1080 (2011).
- Stelzer, E. H. K. K., et al. Light sheet fluorescence microscopy. Nat Rev Methods Prim. 1, 73 (2021).
- Girkin, J. M., Carvalho, M. T. The light-sheet microscopy revolution. J Opt. 20, 053002 (2018).
- Power, R. M., Huisken, J. A guide to light-sheet fluorescence microscopy for multiscale imaging. Nat Methods. 14, 360-373 (2017).
- Ding, Y., et al. Multiscale light-sheet for rapid imaging of cardiopulmonary system. JCI Insight. 3, e121396 (2018).
- Ding, Y., et al. Light-sheet fluorescence imaging to localize cardiac lineage and protein distribution. Sci Rep. 7, 42209 (2017).
- Fei, P., et al. Cardiac light-sheet fluorescent microscopy for multi-scale and rapid imaging of architecture and function. Sci Rep. 6, 1-12 (2016).
- Richardson, D. S., Lichtman, J. W. Clarifying tissue clearing. Cell. 162, 246-257 (2015).
- Stelzer, E. H. K., Huisken, J., Swoger, J., Greger, K., Verveer, P. Multi-view image fusion improves resolution in three-dimensional microscopy. Opt Express. 15 (13), 8029-8042 (2007).
- Dean, K. M., Roudot, P., Welf, E. S., Danuser, G., Fiolka, R. Deconvolution-free subcellular imaging with axially swept light sheet microscopy. Biophys J. 108, 2807-2815 (2015).
- Dean, K. M., et al. Isotropic imaging across spatial scales with axially swept light-sheet microscopy. Nat Protoc. 17, 2025-2053 (2022).
- Hedde, P. N., Gratton, E. Selective plane illumination microscopy with a light sheet of uniform thickness formed by an electrically tunable lens. Microsc Res Tech. 81, 924 (2018).
- Voigt, F. F., et al. The mesoSPIM initiative: open-source light-sheet microscopes for imaging cleared tissue. Nat Meth. 16, 1105-1108 (2019).
- Giardini, F., et al. Mesoscopic optical imaging of whole mouse heart. J Vis Exp. (176), e62795 (2021).
- Sodimu, O., et al. Light sheet imaging and interactive analysis of the cardiac structure in neonatal mice. J Biophotonics. 16, e202200278 (2023).
- Ariel, P. A beginner's guide to tissue clearing. Int J Biochem Cell Biol. 84, 35-39 (2017).
- Richardson, D. S., et al. Tissue clearing. Nat Rev Methods Prim. 1, 1-24 (2021).
- Ueda, H. R., et al. Tissue clearing and its applications in neuroscience. Nat Rev Neurosci. 21, 61-79 (2020).
- Renier, N., et al. iDISCO: a simple, rapid method to immunolabel large tissue samples for volume imaging. Cell. 159, 896-910 (2014).
- Kirchner, K. N., et al. A hydrophobic tissue clearing method for rat brain tissue. J Vis Exp. (166), e61821 (2020).
- Ding, Y., et al. Light-sheet fluorescence microscopy for the study of the murine heart. J Vis Exp. (139), e57769 (2018).
- Schindelin, J., Rueden, C. T., Hiner, M. C., Eliceiri, K. W. The ImageJ ecosystem: An open platform for biomedical image analysis. Mol Reprod Dev. 82, 518-529 (2015).
- Hörl, D., et al. BigStitcher: reconstructing high-resolution image datasets of cleared and expanded samples. Nat Methods. 16, 870-874 (2019).
- Becker, K., et al. Reduction of Photo Bleaching and Long Term Archiving of Chemically Cleared GFP-Expressing Mouse Brains. PLoS One. 9, e114149 (2014).
- Preibisch, S., et al. Efficient Bayesian-based multiview deconvolution. Nat. Methods. 11, 645-648 (2014).
- Guo, M., et al. Rapid image deconvolution and multiview fusion for optical microscopy. Nat. Biotechnol. 38, 1337-1346 (2020).
- Tomer, R., Khairy, K., Amat, F., Keller, P. J. Quantitative high-speed imaging of entire developing embryos with simultaneous multiview light-sheet microscopy. Nat Methods. 9, 755-763 (2012).
- Fahrbach, F. O., Voigt, F. F., Schmid, B., Helmchen, F., Huisken, J. Rapid 3D light-sheet microscopy with a tunable lens. Opt Express. 21, 21010-21026 (2013).
- Liu, Y., Rollins, A. M., Jenkins, M. W. CompassLSM: axially swept light-sheet microscopy made simple. Biomed Opt Express. 12, 6571-6589 (2021).
- Kolesová, H., Olejníčková, V., Kvasilová, A., Gregorovičová, M., Sedmera, D. Tissue clearing and imaging methods for cardiovascular development. iScience. 24 (4), 102387 (2021).
- Sands, G. B., et al. It's clearly the heart! Optical transparency, cardiac tissue imaging, and computer modelling. Prog Biophys Mol Biol. 168, 18-32 (2022).
- Wilson, A. J., Sands, G. B., LeGrice, I. J., Young, A. A., Ennis, D. B. Muscle mechanics and ventricular function: Myocardial mesostructure and mesofunction. Am J Physiol - Hear Circ Physiol. 323, H257 (2022).
- Lee, S. E., et al. Three-dimensional cardiomyocytes structure revealed by diffusion tensor imaging and its validation using a tissue-clearing technique. Sci. Reports. 8, 1-11 (2018).
- Sereti, K. I., et al. Analysis of cardiomyocyte clonal expansion during mouse heart development and injury. Nat Commun. 9, 754 (2018).
- Olianti, C., et al. 3D imaging and morphometry of the heart capillary system in spontaneously hypertensive rats and normotensive controls. Sci. Reports. 10, 1-9 (2020).
- Olianti, C., et al. Optical clearing in cardiac imaging: A comparative study. Prog Biophys Mol Biol. 168, 10-17 (2022).
- Baek, K. I., et al. Advanced microscopy to elucidate cardiovascular injury and regeneration: 4D light-sheet imaging. Prog Biophys Mol Biol. 138, 105-115 (2018).
- Merz, S. F., et al. Contemporaneous 3D characterization of acute and chronic myocardial I/R injury and response. Nat Commun. 10, 1-14 (2019).
- Zhang, X., et al. 4D Light-sheet imaging and interactive analysis of cardiac contractility in zebrafish larvae. APL Bioeng. 7, 26112 (2023).
- Lee, J., et al. 4-Dimensional light-sheet microscopy to elucidate shear stress modulation of cardiac trabeculation. J Clin Invest. 126, 1679-1690 (2016).
- Zhang, X., Alexander, R. V., Yuan, J., Ding, Y. Computational Analysis of Cardiac Contractile Function. Curr Cardiol Rep. 24, 1983-1994 (2022).
- Zhang, X., et al. 4D Light-sheet Imaging of Zebrafish Cardiac Contraction. J Vis Exp. (203), e66263 (2024).
- Huisken, J., Swoger, J., Del Bene, F., Wittbrodt, J., Stelzer, E. H. K. K. Optical sectioning deep inside live embryos by selective plane illumination microscopy. Science. 305, 1007-1009 (2004).
- Molbay, M., Kolabas, Z. I., Todorov, M. I., Ohn, T., Ertürk, A. A guidebook for DISCO tissue clearing. Mol Syst Biol. 17, 9807 (2021).
- Chi, J., Crane, A., Wu, Z., Cohen, P. Adipo-clear: a tissue clearing method for three-dimensional imaging of adipose tissue. J Vis Exp. (137), e58271 (2018).
- Wan, Y., McDole, K., Keller, P. J. Light-sheet microscopy and its potential for understanding developmental processes. Ann Rev Cell Dev Biol. 35, 655-681 (2019).
- Yuan, J., et al. Extended reality for biomedicine. Nat Rev Methods Prim. 3, 1-1 (2023).
- Ding, Y., et al. Saak transform-based machine learning for light-sheet imaging of cardiac trabeculation. IEEE Trans Biomed Eng. 68, 225-235 (2020).
- Buffinton, C. M., Benjamin, A. K., Firment, A. N., Moon, A. M. Myocardial wall stiffening in a mouse model of persistent truncus arteriosus. PLoS One. 12 (9), e0184678 (2017).
- Trincot, C. E., et al. Adrenomedullin induces cardiac lymphangiogenesis after myocardial infarction and regulates cardiac edema via Cx43. Circ Res. 124, 101 (2019).
- Yokoyama, T., et al. Quantification of sympathetic hyperinnervation and denervation after myocardial infarction by three-dimensional assessment of the cardiac sympathetic network in cleared transparent murine hearts. PLoS One. 12, e0182072 (2017).
- Coram, R. J., et al. Muscleblind-like 1 is required for normal heart valve development in vivo. BMC Dev Biol. 15, 36 (2015).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır