Method Article
تي موجة ايون التنقل الكتلة الطيفي : الإجراءات التجريبية الأساسية لتحليل البروتين مجمع
In This Article
Summary
ايون التنقل الكتلة الطيفي هو الغاز الناشئة في المرحلة التي تفصل بين الأيونات التكنولوجيا ، استنادا إلى اصطدامها المقطع العرضي والشامل. الأسلوب يوفر ثلاثي الأبعاد معلومات عن طوبولوجيا الشاملة وشكل مجمعات البروتين. هنا ، ونحن الخطوط العريضة الأساسية لإجراء وضع الصك والتحسين ، ومعايرة مرات الانجراف ، وتفسير البيانات.
Abstract
ايون التنقل (IM) هو الأسلوب الذي يقيس الوقت الذي يستغرقه لايون للسفر عن طريق خلية الضغط تحت تأثير حقل كهربائي ضعيف. سرعة الأيونات التي تجتاز المنطقة الانجراف يعتمد على حجمها : أيونات كبيرة سوف تشهد أكبر عدد من الاصطدامات مع الغاز الخلفية خاملة (عادة N 2) ، وبالتالي السفر لأكثر ببطء من خلال الجهاز IM من تلك الأيونات التي تضم أصغر المقطع العرضي. بشكل عام ، في الوقت الذي يستغرقه لأيونات لترحيل على الرغم من أن المرحلة الغاز الكثيفة تفصل بينهما ، وفقا لاصطدامها المقطع العرضي (Ω).
في الآونة الأخيرة ، واقترن الدردشة مع مطياف الكتلة الطيفي ، وأفرج عن السفر على الموجة (T - الموجة) Synapt ايون التنقل مطياف الكتلة (MS - IM). دمج مطياف الكتلة مع حركة الايونات تمكن بعدا جديدا لفصل العينة والتعريف ، مما أسفر عن طيف ثلاثي الأبعاد (الشامل لتوجيه الاتهام ، وكثافة ، والانجراف الوقت). هذا الأسلوب يسمح للفصل التداخل الطيفي في التناقص ، وتمكن من القرار مجمعات متجانسة مع كتلة متشابهة جدا ، أو نسب الشامل إلى تهمة ، ولكن الأوقات الانجراف مختلفة. وعلاوة على ذلك ، والقياسات الزمنية العائمة توفير طبقة هامة من المعلومات الهيكلية ، كما هو متعلق Ω الى الشكل العام وطوبولوجيا من أيون. يتم حساب العلاقة بين القيم المقاسة والانجراف الوقت Ω باستخدام منحنى المعايرة ولدت من البروتينات calibrant مع مقاطع عرضية محددة 1.
قوة النهج IM - MS تكمن في قدرته على تحديد التعبئة الوحيدات والشكل العام للجمعيات في تركيزات بروتين micromolar ، و 1 شبه الفسيولوجية شروطه. العديد من الدراسات الحديثة على حد سواء IM البروتينات الفردية والمجمعات 2،3 بروتين غير التساهمية 4-9 ، تظاهر بنجاح أن يتم الاحتفاظ بنية البروتينات الرباعية في مرحلة الغاز ، وسلط الضوء على إمكانات هذا النهج في دراسة الهندسة المجالس بروتين غير معروف . هنا ، ونحن نقدم وصفا مفصلا لIMS - MS تحليل البروتين المجمعات باستخدام Synapt (الرباعي ايون التنقل من مرة والطيران) HDMS الصك (المياه المحدودة ، والتجاري الوحيد IM - MS وسيلة متاحة حاليا) 10. نحن تصف الخطوات التحسين الأساسية ، ومعايرة الاصطدام المقاطع العرضية ، وطرق لمعالجة البيانات وتفسيرها. الخطوة النهائية لبروتوكول يناقش أساليب لحساب القيم النظرية Ω. عموما ، فإن البروتوكول لا محاولة لتغطية كل جانب من جوانب IM - MS توصيف المجالس البروتين ، وإنما هدفها هو تقديم الجوانب العملية للطريقة الجديدة للباحثين في هذا المجال.
Protocol
الإجراء وصفنا يركز فقط على IM - MS تحليل مجمعات البروتين. لذا ، نقترح أن الباحثين غير ملم مع الحقل من MS الهيكلية الرجوع إلى خطوات إعداد العينات ، ومعايرة الأدوات والماجستير وبالترادف MS إجراءات التحسين وصفها في Kirshenbaum وآخرون. https://www.jove.com/index/details 2009. STP؟ ID = 1954. بصفة عامة ، ويشمل هذا البروتوكول تركيزات منخفضة micromolar المعقدة (1-20 ميكرون) في منطقة عازلة متطايرة مثل خلات الأمونيوم (0،005-1 م ، ودرجة الحموضة 6-8). بالنظر إلى أن يتم استهلاكها 1-2 ميكرولتر في nanoflow الشعرية ، نقترح 10-20 ميكرولتر كوحدة تخزين الحد الأدنى ، لتمكينها من تحسين الظروف MS.
الجزء 1 : امتلاك ايون التنقل الطيف الطيف الشامل
- تعيين مطياف الكتلة على الأوضاع التالية العملية : TOF التنقل ، اقتناء ايون ايجابية ، والخامس واسطة.
- بدوره على جميع الغازات (API ، ومصيدة IMS). نستخدم N 2 لفصل الرسائل الفورية ، وصول لمصيدة / نقل. القيم الأولية الموصى بها هي 1.5 مل / دقيقة للمنطقة فخ ، وتدفق الغاز من 24 مل / دقيقة للجهاز IMS.
- تعيين نطاق حيازة م / ض. للحصول على بروتين معقد غير معروف ، نقترح استخدام الأولي لمجموعة واسعة الشامل ، ومن ثم يمكن تخفيضها إلى القيم المرغوبة. في موازاة ذلك ، ضبط الوضع MS لكفاءة الإرسال القصوى. للمجمعات الكبيرة ، يجب تعيين النطاق الشامل من اقتناء 1000 -- 32000 م / ض ، وملف MS إلى تلقائي. خلاف ذلك ، يمكن ضبط الوضع ، وفقا للجدول التالي :
م / ض يسكن (٪) الطريق المنحدر (٪) 960 10 20 3200 30 40 10667 - تحقق من إعداد واللاسلكية ، إذا لزم الأمر ، والتكيف مع القيم المناسبة للمجمعات كبيرة من البروتين ، وبالتالي :
مصدر فخ IMS نقل RF أوفست 450 380 380 380 RF ربح 0 0 0 0 RF حد 450 380 380 380 - تطبيق الجهد الشعرية (1،050-1،400 V) ، وانخفاض ضغط nanoflow (0،00-0،03 بار). مرة واحدة يبدأ الرش ، في محاولة لتخفيف الضغط nanoflow إلى قيمة الحد الأدنى. بالإضافة إلى ذلك ، ضبط الموقف من الشعرية ، مع الاحترام للمخروط.
- ضبط المعلمات اقتناء MS ، للحصول على الطيف الترددي جيدا حل MS : التدرج الضغط على الصك ، والمخروط أخذ العينات وكذلك استخراج مخروط ينبغي ، كل تحيز ، ونقل الإعدادات فخ محتمل ، أن يكون الأمثل (مفصلة في المرتبطة إن الرب بروتوكول Kirshenbaum وآخرون. https://www.jove.com/index/details.stp؟ID=1954 2009). على الرغم من أن هذه المعلمات هي التي تعتمد على العينة ، وترد الشروط التي استخدمناها للحصول على MS أطياف ايون الجماهير المختلفة ، من الببتيد في مجمعات البروتين ، في الجدول رقم 1 ، (انظر أيضا الشكل رقم 1). لتقليل تفعيل محاولة للحد تدريجيا معقدة (في الخامس من الخطوات 10 ~) عينة المخروط ، وفخ التحيز الفولتية دون تغيير موقف الذروة.
- مرة واحدة بعد الحصول على الطيف الكتلي الأمثل ينبغي أن تعدل ملف الانجراف الوقت. عند تحليل المجالس البروتين ، والظروف المثلى لكلا القياسات الشامل والتنقل وغالبا ما تكون غير متوافقة ، وبالتالي ، فإنه من المهم تحقيق التوازن السليم بين البلدين. عموما ، يجب أن يكون الأمثل لمثل هذه المؤامرة حركة الايونات التي يتم توزيعها على قمم مجموعة الانجراف طوال الوقت ، وذروة التعريف على نحو سلس وتقترب من توزيع جاوس (الشكل 2A ، 2B). ذروة التباين الكبير يمكن أن تكون ذات صلة فصل سوء التشكل متعددة.
- كقاعدة عامة ، لا يمكن ضبطها المعلمات الثلاث ، تي موجة السرعة ، وارتفاع الأمواج وT - IMS معدل تدفق الغاز لتعظيم الفصل التنقل. وسوف يزيد من سرعة موجة T - يوسع من قاعدة توزيع الوقت ملف الانحراف ، بينما زادت قيم الارتفاع تي موجة سوف تضييقه. وبالمثل ، فإن زيادة تدفق الغاز IMS تحول ملف الوقت الانجراف نحو أعلى القيم (IMS الحد الأدنى من الغاز تدفق ينبغي أن تكون 10 مل / دقيقة). نقترح ترك اثنين من المتغيرات الثلاثة المتاحة ثابتة ، وتحقيق الاستفادة المثلى من الثالثة حتى الطيف IM هو حل جيد (الشكل 2B). تحقيقا لهذه الغاية ، تعيين سرعة الموجة تي وتدفق الغاز الى 250 م / ث و 24 مل / دقيقة ، وإعادةspectively. ثم ، كنقطة انطلاق ، تعيين ارتفاع موجة T - V إلى 3 ، وبطريقة متدرجة ، وزيادة في العلاوات الخامس 1. بشكل عام ، وسوف تتطلب أكبر أيونات ارتفاعات أعلى الموجة. عادة ، ليس هناك حاجة لتعديل ضغط IMS ، ولكن هناك حاجة الفولتية العالية عند التحيز للضبط ، والحد من الغاز IMS ستمكن انخفاضا في قيمة الجهد التحيز ، وبالتالي انخفاض في تنشيط بروتين معقد. عموما ، يمكن التوصل إلى قرار القصوى من 10-12 طن / Δt.
- عندما لا يتم تحسين الشروط (T - انخفاض أو ارتفاع موجة ارتفاع موجة T - السرعة و / أو ارتفاع ضغط IM) ، فإن أيونات لا تعبر من خلال الجهاز الدردشة على نحو فعال ، ورحلتهم قد يستغرق وقتا أطول من الوقت اللازم لايون المقبل ان يفرج عنها في الخلية حزمة التنقل. ونتيجة لذلك ، سيتم إطلاق حزمة جديدة من ايون فخ المنطقة قبل أن يتم تسليم الحزمة السابقة إلى المنطقة انتهازي. وهذا يؤدي إلى إحداث "ترحيل" ، في ذروة التي لوحظت في الجزء الأول من الانجراف الطيف الساعة متطابقة إلى أن من الأيونات في حافة المخلفات (الشكل 2C). ويمكن القضاء على هذه الأداة عن طريق زيادة ارتفاع الموجة تي ، وتقليل موجة T - السرعة والضغط IMS. بالإضافة ، يمكن تعديلها في الوقت الإفراج فخ. وعلاوة على ذلك ، فمن المهم للتحقق من أن يتم تعيين نقل T - موجة الارتفاع إلى ما لا يقل عن 5 خامسا لمنع تسرب أيونات نحو الخلية IMS ، نوصي أن تظل ارتفاع فخ التنقل في المستويات القصوى (30 V).
- قد سرعة منخفضة والسعة العالية للنقل T - موجات تؤدي الى "امتد" لتوزيع ملف الانجراف الوقت (الشكل 2D). هذه الأداة يحدث عندما لا يتم الحفاظ على فصل حركة الأيونات (أيون صول / الانجراف الوقت) من خلال نقل والمناطق TOF ، وذلك بسبب التزامن بين الجزئي وتيرة انتهازي ونقل السرعة تي الموجة. من أجل القضاء على هذا التأثير ، سواء في الوقت أو انتهازي ينبغي تعديل نقل T - موجة السرعة. منذ يرتبط تردد انتهازي لمجموعة الشامل ، وهذا قد قطعة أثرية تعود الى الظهور عندما يتم تغيير هذه المعلمة. تي موجة ارتفاع تمارس ذات تأثير بسيط ، على الرغم من تخفيض لها قد تساعد أيضا على القضاء على التموجات.
- مرة واحدة هي الأمثل المعلمات المذكورة أعلاه ، يمكن الحصول على البيانات IM - MS.
الجزء 2 : فحص الظروف التجريبية لضمان القياسات تنقل الهياكل الأصلية
لتحقيق حل للغاية قمم MS ، غالبا ما يتم تنشيط البروتين داخل المجمعات مطياف الكتلة ، لتعزيز تجريد من المياه المتبقية ومكونات عازلة 11. ومع ذلك ، إذا تم زيادة طاقة التنشيط تتجاوز قيمة العتبة ، يمكن أن يتسبب جزئيا تتكشف تشكيل دول متعددة وسيطة 12 ، والتي من غير المحتمل أن تتوافق مع بنية حل الأصلي للدولة ، (الشكل 3A - C). ونتيجة لذلك ، قد يكون تحول وقت الذروة من الانجراف ، وتوسيع ، مما يعكس السكان غير متجانسة من كشف الهياكل.
من أجل الحصول على البيانات في الوقت الانجراف حل يتفق مع المرحلة الهياكل ، لا بد من السيطرة بعناية الفولتية المستخدمة لتسريع الأيونات ، قبل الانفصال الدردشة. علاوة على ذلك ، لقرار MS عالية فمن الأفضل لزيادة نقل بدلا من الجهد فخ. كما يتم وضع جهاز IM ، أولا ، تليها منطقة ونقل المحلل TOF ، وبالتالي تفعيل يتبع القياس الدردشة والأيونات تبقى غير متأثرة ، بينما يمكن زيادة دقة MS.
للتحقق من صحة التي يتم تنفيذها في ظل ظروف الحصول على البيانات التي تحافظ على الهيكل الأصلي للمجمع ، فمن المستحسن أن يتم تسجيل البيانات عبر مجموعة من الظروف التجريبية والحل ، وليس وفقا لأقصى حد ، واحدة مجموعة من المعلمات :
- زيادة الفولتية الشعرية والمخروط بطريقة تدريجية ، في حين رصد تأثير على الطيف الانجراف الوقت.
- كما في الخطوة 1 ، وزيادة الجهد فخ الاصطدام بطريقة متدرجة ، والحصول على البيانات على فترات V 10.
- للتعرف على التشكل كشف وتقييم البيانات التي يحصل عليها ، وتحدث يدويا تفارق المجمع البروتين المعايرة العينة مع حمض الخليك على نطاق ودرجة الحموضة من 2-7 ، وسجل البيانات (الشكل 3B).
الجزء 3 : الربط بين قيم الوقت الانجراف والمناطق مستعرضة
بخلاف قياسات الدردشة التقليدية ، التي ترتبط في الوقت خطيا الانجراف قياس القيم Ω ، في نظام IMS T - الموجة ، ويتم تحديد المنطقة مقطعية بنهج المعايرة. وهكذا ، بدلا من القياس المطلق ، يتم إنشاء العلاقة النسبية بين الأسي مرات يقاس الانجراف وΩ 1،13 : 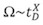
حيث t D هي المرة الانجراف قياسه ، والعاشر هو ثابت النسبة التي يمكن استخلاصها من منحنى المعايرة. المعايرة هو تنفيذبقلم قياس مرات الانجراف مع أيونات Ω المعروفة (تقاس من التجارب التقليدية IM).
- ومعايرة القياسات الوقت الانجراف به التشويه والتحريف البروتينات الخيلي السيتوكروم C ، الحصان الميوجلوبين القلب والابقار اليوبيكويتين مع المقاطع عبر الاصطدام معروفة. تحقيقا لهذه الغاية ، والحلول من 10 ميكرومتر في 49/49/2 ، ونسبة الحجم ، ينبغي إعداد الماء / الميثانول / حامض الخليك (ترد الكواشف المستخدمة في الجدول 3).
- اكتساب IM - MS البيانات للبروتينات calibrant بالضبط تحت الظروف نفسها التي استخدمت أداة لاستهداف بروتين أو بروتين معقد :
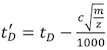 (الجزء 1). ينبغي لجميع الفولتية وقيم الضغط تكون متطابقة ، للحفاظ على ضبط الفصل الدردشة.
(الجزء 1). ينبغي لجميع الفولتية وقيم الضغط تكون متطابقة ، للحفاظ على ضبط الفصل الدردشة. - لكل ولاية تهمة من البروتينات calibrant استخراج الوقت الانجراف التجريبية القيمة (ر D) (وصفها في الجزء 4).
- تصحيح كل من الانجراف calibrant مرات (ر D) (الجدول 2) باستخدام المعادلة التالية :
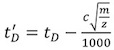 ، حيث m / z هو نسبة إلى كتلة من تهمة ايون لاحظت ، وج هو دورة العمل المحسن (EDC) معامل التأخير 1. قيمته ، وعادة ما بين 1.4 و 1.6 ، والتي تعتمد على الصك. يشار إلى أن قيمة EDC داخل النظام | الإعدادات اقتناء | إعداد اقتناء التبويب.
، حيث m / z هو نسبة إلى كتلة من تهمة ايون لاحظت ، وج هو دورة العمل المحسن (EDC) معامل التأخير 1. قيمته ، وعادة ما بين 1.4 و 1.6 ، والتي تعتمد على الصك. يشار إلى أن قيمة EDC داخل النظام | الإعدادات اقتناء | إعداد اقتناء التبويب. - به البروفيسور ديفيد كروس ، Clemmer قسم قاعدة البيانات :
http://www.indiana.edu/ ~ clemmer / البحث / عبر ٪ 20section 20database/Proteins/protein_cs.htm ٪ 14 لكل من الصحيح calibrant المقطع العرضي لكل دولة تهمة ايون والشامل مخفضة.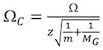
حيث Ω C هو تصحيح المقطع العرضي ، Ω هو الأدب المقطع العرضي ، Z هي الدولة تهمة ايون ، m هو الوزن الجزيئي للcalibrant أيون ، و M G هو الوزن الجزيئي للغاز خلفية IM (عادة N 2). - وفي المؤامرة (ر د) في مقابل (Ω C) (الشكل 4A).
- منحنى الناتج يناظر المعادلة التالية :
 ويمكن استخراج X المعلمات وA بواسطة تركيب مؤامرة لعلاقة خطية. س المنحدر يتوافق مع نسبة عامل والأسي ويمثل ثابت تناسب التي تحددها.
ويمكن استخراج X المعلمات وA بواسطة تركيب مؤامرة لعلاقة خطية. س المنحدر يتوافق مع نسبة عامل والأسي ويمثل ثابت تناسب التي تحددها. - حساب معامل الارتباط تناسب ص 2 ، وذلك باستخدام معادلة بيرسون :
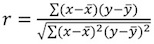 . القيم المقبولة ل2 ص أكبر من 0.95 (الشكل 4B). ويجوز للمعامل الارتباط انخفاض قيمة يكون راجعا الى :
. القيم المقبولة ل2 ص أكبر من 0.95 (الشكل 4B). ويجوز للمعامل الارتباط انخفاض قيمة يكون راجعا الى : - تتكشف ناقصة من calibrants البروتين. وهذا يؤدي إلى اتساع الذروة بسبب التجمع غير متجانسة من الدول الوسيطة.
- في تجربتنا ، يمكن أن تتدهور العينة الذين تتراوح أعمارهم بين الأطياف الدردشة.
- تختلف ظروف تجريبية تستخدم لبروتينات calibrant مختلفة. في هذه الحالة ، المتهم بالتآمر في بيانات كل على حدة توليد البروتين يجب أن معاملات الارتباط متنوعة ، على الرغم من كل واحد منهم يجب ان يكون أعلى من 0.95.
- بيانات صاخبة وغير صحيحة وتجانس مركزة من الانجراف توزيع الوقت.
- احتساب الخطأ.
- Recorrect الوقت الانجراف calibrant باستخدام عامل تحديد الأسي ، X ، مشتقة في خطوة 7 :
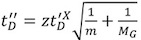
- كخطوة التحقق من الصحة ، مقابل replot Ω C
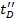 وتحديد معامل الارتباط. قيم أعلى من 0.95 وينتظر أن تتم.
وتحديد معامل الارتباط. قيم أعلى من 0.95 وينتظر أن تتم. - وفقا للإجراءات المنصوص عليها في الخطوة 4 ، وتصحيح الانحراف في الوقت يقاس من البروتين المستهدفة أو معقدة البروتين :
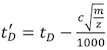
- معايرة الوقت الانجراف في مجمع البروتين / البروتينات المستهدفة باستخدام عامل الأسي ، X ، تعريفها في الخطوة 7 :
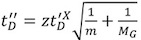
- Ω حساب المجمع البروتين / البروتينات المستهدفة باستخدام ثابت تناسب المحدد ، A ، المحددة في الخطوة 7 :
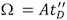 .
. - لكل حالة تجريبية ، وينبغي أن تتكرر الخطوات 2-13. عند تحديد مساحة مقطعية للبروتين غير معروف أو بروتين معقد ، ونحن نوصي بأن تتكرر كل تجربة ما لا يقل عن ثلاث مرات ، وتحديد الانحراف المعياري لهذه القياسات ثلاث نسخ.
الجزء 4 : تحديد قيم الوقت الانجراف
البرامج المطلوبة : MassLynx وDriftscope (مياه).
- فتح الطيف IM - MS باستخدام برنامج Driftscope.
- من القائمة الرئيسية ، حدد السادسمصريات وChromatogram ازل ، دوام الانجراف والطيف (اختياري) ، وترك النشطة فقط عرض الخريطة 2D الوقت الانجراف مقابل م / ز.
- من شريط القوائم واختيار العرض | خيارات | تحرير عرض لوحة وتعديل القيم الحدية لتقليل شدة الضوضاء في الخلفية (في معظم الحالات ، يمكن تعريف هذا الإعداد كما يوجد 30-40 ٪ = = التهم وماكس 100 ٪).
- اختيار العرض | خريطة 2D مقياس كثافة ، وسوف تظهر ثلاثة خيارات : مقياس خطي ، سجل مقياس وميدان مقياس الجذر. وهناك خيار للدخول مقياس (لوغاريتمي تحويل البيانات) سوف تضغط على رمز اللون كثافة ، وتمكن في وقت واحد من ظهور مجموعة واسعة من شدة (على العكس من الخيارات الجذرية الخطية ومربع ، والذي لن يؤدي إلا إلى القمم على أشده تصبح مرئية) .
- من لوحة الأدوات ، استخدم أداة التحديد زر. وهذا الخيار تفعيل خيارات الاختيار المختلفة ، وتمكينها من اختيار المنطقة المعنية داخل الطيف. الأداة الأكثر دقة هو تمكين المنطقة من اختيارات الفائدة ، والتي تتحدد من خلالها يمكن رسم الحدود في جميع أنحاء المنطقة من الفائدة ، وبالتالي استبعاد جميع البيانات غير ضرورية وقمم الضجيج. وبالمثل ، فإن الخيارات واختيار المتعامد باند مفيدة ، عندما لا حاصرت المنطقة من اهتمام القمم زائدة عن الحاجة.
- مرة واحدة يتم تحديد المنطقة ذات الاهتمام ، استخدم الأمر قبول الحالية التحديد لإزالة المعلومات غير الضرورية.
- تصدير البيانات إلى MassLynx ، مع الحفاظ على المعلومات في الوقت الانجراف.
- في غضون MassLynx ، فتح chromatogram من الطيف الانجراف الوقت الذي يمكن توفيره ، والجمع بين صناديق الوقت. والطيف الشامل المطابق تلقائيا فتح.
- تطبيق وظيفة من خلال تحديد التمليس (ينبغي ضبطها خصيصا لكل الطيف ، وذلك باستخدام الحد الأدنى من القيم) حجم النافذة وعدد من المعلمات على نحو سلس.
- تطبيق خط الأساس الطرح ، إذا لزم الأمر.
- مركز قياس الطيف والشامل ، للتحقق من هوية البروتين ودقة الشامل.
- لكل ولاية تهمة ، والجمع بين مجموعة م / ض. فإن الوقت الانجراف المقابلة الطيف تظهر تلقائيا. على نحو سلس ومركز الوقت الانجراف الوضع ، وتحديد قيمة الوقت العائمة التي تشير إلى النقطه الوسطى من كل الذروة.
الجزء 5 : نتائج الممثل

الشكل 1. التمثيل التخطيطي للصك HDMS Synapt تشير المؤشرات الرئيسية الانضباطي من IMS - MS الاستحواذ. وصفت المعلمات التجريبية المستخدمة لقياس MS - IM وفقا لموقعها في الصك. هو اللون شعاع ايون في الحمراء ، ويسمى الضغط في كل منطقة باستخدام رمز اللون. لوحة على الجزء السفلي يوضح التدرج المحتملة على طول الصك وتحديد الاختلافات المحتملة في فخ التصادم وطاقات النقل فضلا عن التحيز المحتملة. يتم الرجوع إليها كل الإمكانيات لقراءة تدعم الجهد ثابت الإزاحة التي عادة ما يتم تعيين ل120V.

الشكل 2. توزيعات ايون الوقت التنقل وصوله للبروتين Gβυ.
ألف ألف عالية السرعة موجة T - يؤدي إلى توزيع ضيق من الانجراف التعريف الوقت. المؤامرة يوضح توزيع الوقت صول اتهام دول 16 + (الحمراء) ، 15 + (الأخضر) ، 14 + (الأزرق) ، و 13 + (قرمزي) ، فضلا عن ملف الانجراف الوقت الإجمالي (الأسود) من البروتين βυ G.
باء الوقت الأمثل الطيف الانجراف مع شكل سلس ذروة غاوسي. التسميات لون مشابه كما في A.
C. A 'ترحيل' ، والذي يحدث عندما يكون الوقت المستغرق لأيونات لاجتياز الخلية التنقل أبطأ من الفترة الزمنية الفاصلة بين حقن الحزم ايون جديدة في الجهاز. نتيجة لذلك ، في الوقت الانجراف تمديد ذروة يظهر في بداية من الطيف. ويمكن التخلص من هذا التأثير عن طريق زيادة ارتفاع الموجة تي ، وتقليل موجة T - السرعة والضغط IMS.
"التموجات" دال الاصطناعي هي سبب عندما تتم مزامنة جزئيا نقل T - سرعة الموجة والتردد انتهازي. ويمكن التغلب على هذا التأثير إما عن طريق ضبط وتيرة سرعة نقل انتهازي أو تي الموجة.
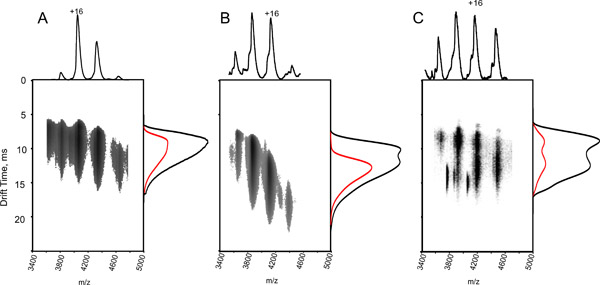
الشكل 3. تأثير التنشيط ايون والجزئي على تغيير طبيعة الظروف IM - MS أطياف الهيموغلوبين. قطعة من الوقت مقابل الانجراف م / ض للمجمع رباعي القسيمات الهيموغلوبين ، وذلك باستخدام محلول مائي من 10 ملي خلات الأمونيوم (الرقم الهيدروجيني = 7.6) (A ، C) وإضافة حامض الخليك بنسبة 0.1 ٪ (B). الحصول على البيانات باستخدام الطاقة الجهد فخ اصطدام 13 (B A ،) V و 35 V (C) ، على الرغم من أن في كل اللوحات الثلاث الطيف الكتلي (المتوقع على الجزء العلوي) مشابها ، مع سلسلة تهمة رباعي القسيمات تركزت في 4000 م / ض ملف الانحراف الوقت (المتوقع على الجانبين) مختلفة (مجموع توزيع الوقت هو الانجراففي الأسود ، والتعريف + 16 في الحمراء). وقتا أطول من الانجراف العينة متمسخ جزئيا ، وحصل في وباء وأيونات الغاز المرحلة تفعيلها ، في الحصول على C ، يدل على درجة معينة من تتكشف. هذه الملاحظة يوضح أنه على الرغم من كتلة تقاس يناظر مجمع سليمة ، وتعطل هيكلها الحل. نتيجة لذلك ، تتطلب التحكم الدقيق للظروف تجريبية.
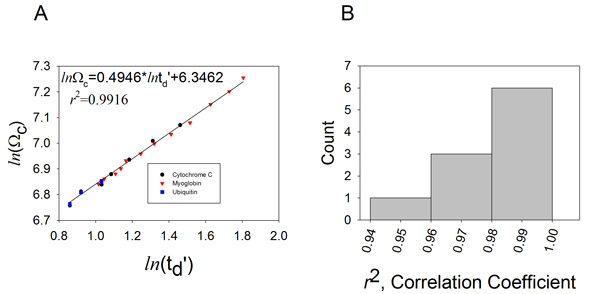
الشكل 4. من خلال توليد منحنى المعايرة والمقاييس الانجراف الوقت ويمكن ربط الاصطدام المقاطع العرضية.
المقاسة ألف قيم الوقت الانجراف من دول متعددة من تهمة الخيلي السيتوكروم C (الدوائر) ، الحصان الميوجلوبين القلب (المثلثات) والابقار اليوبيكويتين (المربعات) وتآمر ضد القيم Ω الأدب تصحيح لكل من أيون الدولة المسؤول والشامل مخفضة. وتعطي وظيفة تناسب خطي الموافق : LN (Ω C) = XLN (ر D ') + A. يتم عرض عامل يحدد الأسي (X) ، وصالح ، ثابت العزم (A) ، ومعامل الارتباط في مؤامرة للبيانات المكتسبة في سرعة موجة T - 350 م / ث ، وارتفاع موجة ثابتة خامسا ب 11. رسم بياني لتوزيع معامل الارتباط التي تم الحصول عليها من 10 معايرة تجارب متتالية.
| عينة بروتين / المعايير الفنية | GluFibrino - الببتيد مونومر 1.6 كيلو دالتون | الميوجلوبين مونومر 17 كيلو دالتون | الهيموغلوبين tetramer 67 كيلو دالتون | ترانسفيرين مونومر 80 كيلو دالتون | GroEL 14 ميه 801 كيلو دالتون |
| دعم ضغط ، ميللي بار | 4.4 | 5.0 | 5.1 | 5.1 | 6.5 |
| الضغط الفخ ، ميللي بار | 1.6x10 -2 | 2.4x10 -2 | 2.4x10 -2 | 2.6x10 -2 | 2.8x10 -2 |
| IMS الضغط ، ميللي بار | 4.4x10 -1 | 4.4x10 -1 | 4.4x10 -1 | 4.4x10 -1 | 4.2x10 -1 |
| أخذ العينات الجهد المخروط ، والخامس | 46 | 80 | 80 | 80 | 118 |
| استخراج الجهد المخروط ، والخامس | 1.7 | 1 | 1 | 1 | 3 |
| التحيز الجهد ، والخامس | 20 | 20 | 25 | 25 | 50 |
| فخ الاصطدام الطاقة ، والخامس | 20 | 15 | 15 | 15 | 80 |
| نقل الطاقة الاصطدام ، والخامس | 5 | 12 | 12 | 12 | 15 |
الجدول 1. ظروف تجريبية تستخدم لتحليل الجزيئات.
| مستوى البروتين | الكتلة الجزيئية (م) | رسوم (ض) | م / ض | اصطدام المقطع العرضي (في 2) |
| السيتوكروم C | 12213 | 10 | 1222.3 | 2226 |
| 11 | 1111.3 | 2303 | ||
| 12 | 1018.8 | 2335 | ||
| 13 | 940.5 | 2391 | ||
| 14 | 873.4 | 2473 | ||
| 15 | 815.2 | 2579 | ||
| 16 | 764.3 | 2679 | ||
| 17 | 719.4 | 2723 | ||
| 18 | 679.5 | 2766 | ||
| الميوجلوبين | 16952 | 11 | 1542.1 | 2942 |
| 12 | 1413.7 | 3044 | ||
| 13 | 1305.0 | 3136 | ||
| 14 | 1211.9 | 3143 | ||
| 15 | 1131.1 | 3230 | ||
| 16 | 1060.5 | 3313 | ||
| 17 | 998.2 | 3384 | ||
| 18 | 942.8 | 3489 | ||
| 19 | 893.2 | 3570 | ||
| 20 | 848.6 | 3682 | ||
| 21 | 808.2 | 3792 | ||
| 22 | 771.6 | 3815 | ||
| اليوبيكويتين | 8565 | 8 | 1071.6 | 1442 |
| 8 | 1071.6 | 1622 | ||
| 9 | 952.7 | 1649 | ||
| 10 | 857.5 | 1732 | ||
| 11 | 779.6 | 1802 | ||
الجدول 2. Calibrant البروتينات والاصطدام بها عبر المقاطع القيم التي تحددها قياسات IMS التقليدية 14.
| الأجهزة | شركة | فهرس العدد |
| Synapt HDMS - 32K RF مولد | المياه المحدودة. | |
| P - 97 يلهب براون micropipette مجتذب | سوتر الآلات | P - 97 |
| بصق المغطي | الإلكترون المجهر العلوم | EMS550 |
| مجهر مجهر | نيكون | |
| الكواشف | شركة | رقم كتالوج |
| خلات الأمونيوم | سيغما الدريخ | سيغما ، A2706 |
| CSI 99.999 ٪ | سيغما الدريخ | الدريتش ، 203033 |
| الميثانول | سيغما الدريخ | Fluka ، 34966 |
| حمض الخليك | فيشر العلمية | AC12404 |
| فرسي الميوجلوبين (من قلب الحصان) | سيغما الدريخ | M1882 |
| فرسي السيتوكروم ج (من قلب الحصان) | سيغما الدريخ | C - 2506 |
| اليوبيكويتين البقري (من خلايا الدم الحمراء) | سيغما الدريخ | U6253 |
| الهيموغلوبين | سيغما الدريخ | H2625 |
| غاز | تعليقات | |
| النيتروجين النقي 99.999 ٪ | 8 أسطوانات متر مكعب | |
| الأرجون ، نقي 99.999 ٪ | 8.8 meterscylinder مكعب | |
الجدول 3. الكواشف والمعدات.
Discussion
بروتوكول الموصوفة هنا يمكن تحديد المقطع العرضي الاصطدام من البروتينات أو مجمعات البروتين مع هيكل من ثلاثة مجهولة الأبعاد ، وذلك بهدف توفير المعلومات عن شكلها العام ، والتعبئة الوحيدات والطوبولوجيا. تحقيقا لهذه الغاية بمجرد اصطدام قيم المقطع العرضي وصفت من الضروري تحويل هذه القيم إلى التفاصيل الهيكلية. هذه العملية تتطلب جهودا إضافية التجريبية فضلا عن التحليل الحسابي ، التي تجري مناقشتها بايجاز أدناه.
بادئ ذي بدء ، فمن المستحسن لتحليل البروتينات أو مجمعات البروتين مع الهياكل المعروفة. ويمكن توفير هذه القياسات لمراقبة الجودة مفيدة للمنهجية ، وسيمكن تقييم دقة المعلمات اقتناء بمقارنة النظرية والقيم المقاسة Ω. ويمكن حساب النظرية المقطعية المناطق من بنية الكريستال إحداثيات باستخدام MOBCAL 15،16 البرمجيات ، وهو مفتوح المصدر FORTRAN البرمجيات القائمة على السماح لتحرير رمز وفقا لاحتياجات التشغيل. لتشغيل مثل هذه الحسابات هو مطلوب منها لتعديل البرنامج بحيث يتم زيادة عدد الحسابات التكرارية في تنفيذ هيكل المدخلات والتي تقبل الملفات التي تحتوي على تنسيق عدد كبير من الذرات 1.
وقد تم وضع استراتيجية IM - MS لتحديد ترتيبات طوبولوجي مفارز داخل الجمعيات المتعددة المكونات المقترحة مؤخرا 4،6. الأسلوب ينطوي على رصد مسارات التفكك المجالس البروتين إلى مكونات أصغر. ويتحقق هذا التفكك من خلال التكيف للظروف المرحلة تسيطر حل ، مما يثير لتوزيع subcomplexes تعكس "لبنات البناء" في الجمعيات. قياس متزامنة من القيم Ω المعقدة على حد سواء منتجات سليمة والتفكيك يولد القيود الهيكلية التي تستخدم بعد ذلك لحساب النماذج الطوبوغرافية للمجمعات البروتين. الافتراض الأساسي وراء هذه المنهجية هو أن تحتفظ subcomplexes لدت الأم تشبه تأكيدات ، بل والدراسات الحديثة أثبتت أن يتم الحفاظ على بنية حل للمنتجات التفكيك وإعادة ترتيب رئيسيا في أي حل أو أي من مراحل الغاز حدثت 4،6.
الخطوة الأخيرة في تخصيص بنية البروتينات الرباعية إلى أيونات الغاز المرحلة المعقدة من المناسب القيم عبر الباب الاصطدام على نماذج الكمبيوتر الذي تم إنشاؤه. وتستخدم أساليب النمذجة من أجل استكشاف مختلف الترتيبات طوبولوجي ممكن من الوحدات الفرعية ويتم حسابها في القيم Ω السيليكو ومقارنة لتلك التجارب. وتستخدم حاليا سوى عدد قليل النهج الحسابية ، مثل الأسلوب الخشن الحبيبات spheretype يقارب قطره 1،8 مفارز. على العموم ، فإن هذا الحقل لا تزال في سنواتها الأولى ، ومطلوب مزيد من التطوير لجعل هذا النهج العام ، والتي تنطبق على مجموعة واسعة من المجمعات.
Disclosures
Acknowledgements
المؤلفان بالشكر إلى أعضاء الفريق لاستعراضها شارون حرجة ، ومساهماتها في المخطوطة. ونحن ممتنون للدعم البرامج وموراشا Bikura ، علم إسرائيل مؤسسة (المنحة رقم 378/08 و1823-1807) ، وجوزيف كوهن مينيرفا مركز للبحوث غشاء حيوي ، وبرنامج الأسرة Chais زملاء للعلماء الجديد ، إبراهيم وسونيا Rochlin المؤسسة ؛ تراست الخيرية الأسرة وولفسون ، وهيلين وميلتون ألف مركز للهيكل Kimmelman الجزيئية البيولوجية والجمعية ، وتركة شلومو وBeirzwinsky سابين ؛ Meil دي بوتون Aynsley ، وكارين سيم ، المملكة المتحدة.
References
- Ruotolo, B. T. Ion mobility-mass spectrometry analysis of large proteincomplexes. Nat Protoc. 3 (7), 1139-1152 (2008).
- Scarff, C. A., Thalassinos, K., Hilton, G. R., Scrivens, J. H. Travelling wave ion mobility mass spectrometry studies of protein structure: biological significance and comparison with X-ray crystallography and nuclear magnetic resonance spectroscopy measurements. Rapid Commun Mass Spectrom. 22 (20), 3297-3304 (2008).
- Smith, D. P. Deciphering drift time measurements from travelling wave ion mobility spectrometry-mass spectrometry studies. Eur J Mass Spectrom (Chichester, Eng). 15 (2), 113-130 (2009).
- Leary, J. A. Methodology for measuring conformation of solvent-disrupted protein subunits using T-WAVE ion mobility MS: an investigation into eukaryotic initiation factors. J Am Soc Mass Spectrom. 20 (9), 1699-1706 (2009).
- Lorenzen, K. Determination of stoichiometry and conformational changes in the first step of the P22 tail assembly. J Mol Biol. 379 (2), 385-396 (2008).
- Pukala, T. L. Subunit architecture of multiprotein assemblies determined using restraints from gas-phase measurements. Structure. 17 (9), 1235-1243 (2009).
- van Duijn, E. Chaperonin complexes monitored by ion mobility mass spectrometry. J Am Chem Soc. 131 (4), 1452-1459 (2009).
- Ruotolo, B. T. Evidence for macromolecular protein rings in the absence of bulk water. Science. 310 (5754), 1658-1661 (2005).
- Ruotolo, B. T., Robinson, C. V. Aspects of native proteins are retained in vacuum. Curr Opin Chem Biol. 10 (5), 402-408 (2006).
- Giles, K. Applications of a travelling wave-based radio-frequency-only stacked ring ion guide. Rapid Commun Mass Spectrom. 18 (20), 2401-2414 (2004).
- McKay, A. R., Ruotolo, B. T., Ilag, L. L., Robinson, C. V. Mass measurements of increased accuracy resolve heterogeneous populations of intact ribosomes. J Am Chem Soc. 128 (35), 11433-11442 (2006).
- Ruotolo, B. T. Ion mobility-mass spectrometry reveals long-lived, unfolded intermediates in the dissociation of protein complexes. Angew Chem Int Ed Engl. 46 (42), 8001-8004 (2007).
- Morton, V. L., Stockley, P. G., Stonehouse, N. J., Ashcroft, A. E. Insights into virus capsid assembly from non-covalent mass spectrometry. Mass Spectrom Rev. 27 (6), 575-595 (2008).
- Valentine, S. J., Counterman, A. E., Clemmer, D. E. A database of 660 peptide ion cross sections: use of intrinsic size parameters for bona fide predictions of cross sections. J Am Soc Mass Spectrom. 10 (11), 1188-1211 (1999).
- Mesleh, M. F. Structural information from ion mobility measurements: effects of the long-range potential. J Phys Chem. 100, 16082-16086 (1996).
- Shvartsburg, A. A., Jarrold, M. F. An exact hard-spheres scattering model for the mobilities of polyatomic ions. Chem Phys Lett. 261, 86-91 (1996).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved