Method Article
T波离子迁移质谱蛋白复合物分析的基本实验程序
摘要
离子迁移质谱是一个新兴的技术,分离离子气相,他们的碰撞截面和质量的基础上。该方法提供了对整体的拓扑结构和蛋白质复合物的形状的三维信息。在这里,我们勾勒出一个仪器设置和优化,校准漂移的时间,和数据解释的基本程序。
摘要
离子淌度(IM)是一种方法,措施离子穿过一个微弱的电场的影响下加压细胞所需的时间。离子穿过漂移区的速度,这取决于它们的大小:大离子的经验与背景的惰性气体( 通常 N 2)将更多的碰撞,从而比那些包括一个较小的的离子穿过的IM设备更慢的横截面。在一般情况下,的时间,需要的离子迁移,虽然稠密气体相分离,根据他们的碰撞截面(Ω)。
近日,IM法加上质谱和一个行波(T波)SYNAPT离子迁移质谱仪(IM - MS)被释放。离子迁移质谱相结合,使样品分离和定义一个额外的维度,产生一个三维频谱(质量负责,强度和漂移时间)。此分离技术使光谱重叠,以减少,质量非常相似,或质荷比,但不同的漂移时间,使异构配合物的决议。此外,漂移时间的测量提供了一个重要的结构信息层,Ω是与离子的整体形状和拓扑。定义截面1校准蛋白质产生的校正曲线计算测得的漂移时间值和Ω之间的相关性。
的IM - MS方法的力量在于它能够定义亚基在微摩尔浓度的蛋白质集会的包装和整体造型, 近生理条件1。几个最近2,3个人的蛋白质和非共价键蛋白质复合物 4-9 IM的研究,成功地证明,蛋白质的四级结构是保持在气相,并强调这种方法的潜力,在未知的几何形状的蛋白质集会的研究。在这里,我们提供的IMS - MS分析的蛋白复合物使用的SYNAPT(四极离子迁移的飞行时间)HDMS仪器(沃特公司;目前唯一的商业IM - MS仪器)详细的说明10。我们描述的基本优化步骤,碰撞截面校准,数据处理和解释方法。该协议的最后一步讨论理论Ω值计算的方法。总体而言,该协议并不试图掩盖IM - MS的表征蛋白质装配的每一个方面,而是它的目标是引进在该领域的新的研究方法的实际问题。
研究方案
我们所描述的过程,仅仅着眼于IM - MS的蛋白质复合物的分析。因此,我们建议,样品制备步骤,仪器校准和MS串联质谱Kirshenbaum 等人所描述的优化程序的结构MS领域不熟悉的研究人员是指2009年https://www.jove.com/index/details。 STP?ID = 1954年。在一般情况下,此协议涉及到复杂的微摩尔浓度低挥发性缓冲区,如醋酸铵(0.005 - 1米,PH值6-8)(1-20μM)。鉴于1-2μL每纳流毛细管消耗,我们建议10-20μL作为体积最小,使MS条件的优化。
第1部分:收购离子迁移质谱谱
- 设置以下操作模式:移动飞行时间质谱仪,正离子采集,和V -模式。
- 打开所有的气体(API,陷阱和IMS)。我们使用IM分离,N 2和Ar陷阱/转让。推荐的初始值是1.5毫升/分钟的陷阱区域,和24毫升/分的IMS设备的气体流量。
- 设置的m / z收购范围。对于一个未知的蛋白质复合体,我们建议初次使用宽的质量范围,这样就可以减少到所需的值。同时,调整最大传输效率的MS的个人资料。对于大型复合物,收购质量范围内应设置从1000 - 32000米/ Z,和MS配置文件自动。否则,可以设置配置文件,根据下面的图表:
为m / z 停留时间(%) 斜坡(%) 960 10 20 3200 30 40 10667 - 检查RF的设置,如果有必要,调整大蛋白复合物的适当的值,因此:
来源 陷阱 IMS的 转让 射频偏移 450 380 380 380 RF增益 0 0 0 0 射频限制 450 380 380 380 - 应用毛细管电压(1,050-1,400 V)和纳流压力低(0.00-0.03栏)。一旦启动喷雾,尽量减少到最低值的纳流压力。此外,调整的毛细血管的位置,锥体。
- 调整MS采集参数,以获得一个分辨的质谱图:压力梯度沿仪器,采样锥以及提取锥,偏见,陷阱和转移潜在的设置,都应该得到优化(在相关详细朱庇特协议Kirshenbaum 等人,2009年https://www.jove.com/index/details.stp?ID=1954)。虽然这些参数样本依赖的条件下,我们获得MS各种离子群众的光谱,从肽蛋白复合物的使用,表1所列(见图1)。为了减少复杂的尝试激活,逐步减少(〜10 V的步骤)的样品锥,陷阱和偏置电压的峰的位置没有改变。
- 一旦获得一个最佳的质谱漂移时间的个人资料,应调整。分析蛋白质的集会,质量和流动性测量的最佳条件时,往往是不相容的,因此,重要的是两者之间取得适当的平衡。总体而言,离子迁移情节,应优化等分布在整个漂移的时间范围,峰,峰形顺利,接近高斯分布(图2A,2B)。重大峰的不对称性,可以与多种构象差分离。
- 作为一般规则,三个参数,T波T波的速度,高度和IMS气体流量可以调整,以优化流动分离。增加T波的速度将扩大漂移时间分布情况,同时增加T波高度值将缩小。同样,IMS气体流量的增加将转向更高的值(最小的IMS气体流量应为10毫升/分钟)的漂移时间剖面。我们建议留两个固定的三个可用的变量,优化第三,直到IM频谱以及分辨(图2B)。为此,T波的速度和气体流量为250米/秒和24毫升/分钟,重新spectively。然后,作为一个起点,设置3伏T波的高度,以逐步的方式,在1 V的增量增加。在一般情况下,较大的离子会要求更高的浪高。通常情况下,有没有需要修改的IMS压力;然而,高偏置电压时需要调整,减少了IMS气体使偏置电压值下降,因此,在蛋白质复合物激活的减少。总体而言,最大分辨率可达到10-12吨/ΔT。
- 当条件不优化(低T波高度或高T波的速度和/或高的IM压力),离子不会遍历的IM设备有效,他们的旅程可能比未来离子所需的时间更长包被释放到流动细胞。因此,一个新的离子的数据包将被释放前一个数据包之前已交付推进区域从陷阱区域。这将导致一个“翻车”的效果,在第一部分的漂移时间谱观测到的峰值是相同的拖尾边缘(图2C)离子。这件神器,可以消除通过增加T波的高度,并降低T波的速度和IMS的压力。此外,陷阱释放时间可以调整。此外,重要的是要验证转让T波的高度设置为至少5五,为了防止对IMS细胞的离子泄漏,我们建议保持在最高水平(30 V),流动性陷阱的高度。
- 低速和高振幅转移的T波,可能会导致“荡漾”漂移时间分布情况(图2D)。此工件发生时是通过转让和TOF地区保持离子(离子抵达/漂移时间)的流动分离,由于部分同步推进的频率和转移T波的速度。为了消除这种影响,推进时间,应调整或转让T波的速度。自推频率是相关的质量范围,这件神器,可能会重新出现时,此参数改变。 T波高度施加轻微的效果,虽然它的减少可能也有助于消除涟漪。
- 一旦上述参数进行了优化,IM - MS的数据可以被收购。
第2部分:筛选实验条件,以确保原生结构的流动性测量
为了实现高度解决的质谱峰,蛋白质复合物往往是激活内质谱仪,以促进残留的水和缓冲组件 11剥离。但是,如果活化能为超出阈值的增加,部分展开可以诱导形成多个中间状态 12,这是不太可能对应到原生状态的解决方案结构(图3A - C )。因此,漂移时间高峰期可能会转移和扩大,反映展开结构的异构人口。
为了获得与解决方案相结构一致的漂移时间的数据,它必须小心地控制电压,用于加速离子之前的IM分离。此外,高质谱分辨率最好是增加而不是陷阱电压传输。由于IM设备定位,第一,其次是转移区域和飞行时间分析仪,因此,激活如下IM测量和离子不受影响,而MS的精度可以提高。
为了验证数据采集,保持天然结构复杂的条件下进行,这是建议,数据是通过一系列的实验和解决方案的条件,而不是根据一个单一的,优化的参数设置记录:
- 增加毛细血管和圆锥的电压,以逐步的方式,同时监控漂移时间谱的影响。
- 第1步中,以逐步的方式增加的陷阱碰撞电压,并在10 V的间隔获取数据。
- 要确定折叠的构象和评估所获得的数据,人工诱导的蛋白复合物的解离,由乙酸滴定样品的pH值范围2-7,并记录数据(图3B)。
第3部分:漂移时间值和截面积之间的关联
与传统IM测量,测量的漂移时间值线性相关Ω不同的是,在T波的IMS系统,截面积是指由校准方法。因此,而不是绝对测量,测量漂移倍和1,13Ω之间产生一个相对指数的相关性: 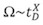
T D测量的漂移时间, 和X是可以从校准曲线中提取的比例常数。校准执行通过测量与已知的Ω(从传统的IM实验测量)的离子漂移时间。
- 漂移时间的测量校准使用变性的蛋白马细胞色素C,马心肌红蛋白和牛泛称为碰撞截面。为此,49/49/2 10微米,体积比的解决方案,水/甲醇/醋酸应准备(在表3中列出所用试剂)。
- 获得完全一样的仪器为目标蛋白质或蛋白质复合体的使用条件下校准蛋白质IM - MS数据:
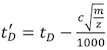 (第1部分)。所有的电压和压力值应该是相同的,保持IM的分离设置。
(第1部分)。所有的电压和压力值应该是相同的,保持IM的分离设置。 - 对于每个充电状态的校准蛋白提取实验漂移的时间价值(T D)(第4部分中描述) 。
- 纠正每个校准漂移时间(T D)(见表2)使用下列公式:
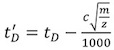 ,其中m / z为所观察到的离子的质荷比,C是增强占空比(EDC)的延迟系数 1 。其值通常介于1.4和1.6,仪器的依赖。 EDC值是表示系统|采集设置|采集设置“选项卡内。
,其中m / z为所观察到的离子的质荷比,C是增强占空比(EDC)的延迟系数 1 。其值通常介于1.4和1.6,仪器的依赖。 EDC值是表示系统|采集设置|采集设置“选项卡内。 - 使用大卫克莱默教授的截面数据库:
http://www.indiana.edu/〜克莱默/研究/交叉%20section%20database/Proteins/protein_cs.htm 14离子充电状态和减少群众的正确的校准截面。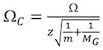
,其中C是Ω的纠正截面,Ω是文学截面,z为离子的电荷态,M是分子量校准离子,M G IM背景气体的分子量(通常N 2)。 - 剧情(T D)反对(Ω 三 )(图4A)。
- 由此产生的曲线对应下列公式:
 参数 x和一个可提取拟合的线性关系的情节。斜坡x对应指数的比例系数,A代表拟合待定常数。
参数 x和一个可提取拟合的线性关系的情节。斜坡x对应指数的比例系数,A代表拟合待定常数。 - 计算拟合的相关系数R 2,使用Pearson的方程:
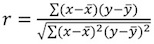 。可接受的R 2值大于0.95(图4B)。可能是由于较低的相关系数的值:
。可接受的R 2值大于0.95(图4B)。可能是由于较低的相关系数的值: - 蛋白校准物的不完全展开。这将导致以峰值扩大由于中间状态的异构大会。
- 根据我们的经验,年龄样品可以恶化的IM光谱。
- 用于校准的不同蛋白的不同的实验条件。在这种情况下,分别绘制每个蛋白质的数据应产生多样的相关系数,但他们每个人应大于0.95。
- 嘈杂的数据和不正确的平滑和漂移时间分布为中心。
- 计算错误。
- Recorrect使用确定的指数因子,X,在第7步,校准漂移时间:
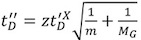
- 作为一个验证步骤,重绘ΩC对
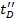 定义的相关系数。较高的值大于0.95是可以预期的。
定义的相关系数。较高的值大于0.95是可以预期的。 - 根据在步骤4中所描述的程序,正确的目标蛋白质或蛋白质复合体的测量漂移时间:
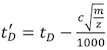
- 校准的使用步骤7中定义的指数因子,X的目标蛋白/蛋白复杂的漂移时间:
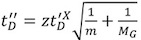
- 计算Ω靶蛋白/蛋白质复杂的使用合适的待定常数, 一个定义,在第7步:
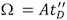 。
。 - 对于每一个实验条件,步骤应重复2至13。当定义未知的蛋白质或蛋白质复合体的横截面面积,我们建议每次实验至少重复3次,并确定这些一式三份测量的标准偏差。
第4部分:定义漂移时间值
所需的软件:MassLynx和Driftscope(水域)。
- 打开使用的Driftscope软件的IM - MS谱。
- 从主菜单中,选择六EW和取消选中色谱,漂移时间和频谱(可选),离开积极的2D地图显示漂移时间与米/ Z.
- 从菜单栏中,选择“显示|选项|显示编辑器面板和调整强度阈值,以最大限度地减少背景噪声(在大多数情况下,这个设置可以被定义为敏= 30-40%,最大为100%计数)。
- 选择显示| 2D地图强度等级,会出现三个选项:线性度,对数刻度和平方根量表。数刻度(对数数据转换)选择将压缩强度的颜色代码,使广泛的强度的同时出现(而不是线性和平方根选项,其中只有最激烈的高峰将成为可见) 。
- 从工具栏面板,使用“选择工具”按钮。此选项将激活不同的选择方案,使有关地区内的频谱的选择。最精确的工具是利率选择的地区,启用其中一个边界可能感兴趣的区域周围绘制,从而排除了所有不必要的的数据和噪声峰值的手段。同样,正交和频带选择的选项是有用的,感兴趣的区域时是不是多余的山峰包围的。
- 一旦选择感兴趣的区域,使用接受当前选择“命令删除不必要的信息。
- 导出数据MassLynx,同时保留了漂移时间信息。
- MassLynx内,打开保存的漂移时间谱的色谱图,并结合时间箱。相应的质谱会自动打开。
- 申请定义应进行调整窗口的大小和平滑参数的数量(,专门为每个频谱,使用最小的值)的平滑功能。
- 应用基准减法,如果必要的话。
- 中心的频谱和测量的质量,来验证蛋白质的身份和质量准确度。
- 每次充电状态,结合的m / z范围内。将自动显示相应的漂移时间谱。光滑,中心的漂移时间的配置文件,定义说明中的各峰的质心漂移的时间价值。
第5部分:代表结果

图1。 SYNAPT HDMS表明IMS的MS收购的主要可调参数的仪器的示意图。根据他们在仪器内的地位,用于IM - MS测量的实验参数标记。离子束被染成红色,并在每个区域的压力是指定使用颜色代码。在底部的面板说明电位梯度沿仪器和定义的陷阱和转让碰撞能量以及偏置潜力的潜在差异。所有的潜能读背上被引用的静态偏置电压,通常是设置为120V。

图2。离子迁移到达时间分布的Gβυ蛋白。
A.高T波的速度导致的漂移时间剖面分布窄。该图说明了到达时间分布 16 +(红色),15 +(绿色),14 +(蓝色),13 +(洋红色)充电状态,以及作为总的漂移时间剖面的Gβυ蛋白(黑色) 。
B.优化的漂移时间与平稳的高斯峰形谱。 在类似的彩色标签。
C. A“翻车”的效应,即当离子采取遍历的流动性细胞的时间是比注射新的离子进入设备的数据包之间的间隔慢。因此,扩展的漂移时间高峰将出现在频谱开始。可以消除这种效应,通过增加T波的高度,并减少T波的速度和IMS的压力。
D.人为的“涟漪”时引起的T波传输的速度和推杆频率部分同步。通过调整推进的频率或转让T波的速度,这种效果是可以克服的。
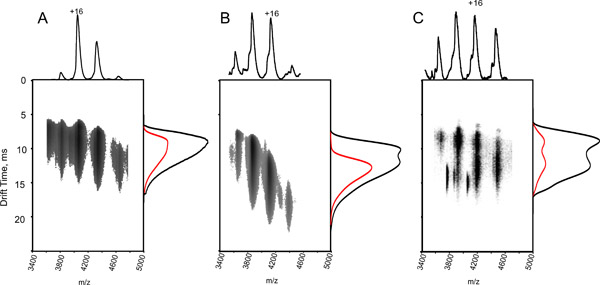
图3。离子激活和IM - MS的血红蛋白光谱部分变性条件的影响 。漂移与时间的m / z为四聚体血红蛋白复杂的剧情,使用10 mM醋酸铵水溶液(pH值= 7.6)(A, C)此外,0.1%醋酸(二)。使用陷阱13 V(A,B)碰撞能量电压35 V,(c)虽然在所有三个小组质谱(预计在顶部)4000 m / z为一四聚的电荷为中心的系列,看起来类似,所获得的数据漂移时间剖面(双方预计)是不同的(总漂移时间分布在黑色,16 +配置文件)在红。漂移时间较长的部分变性样品,在B中获得的,并激活气相离子,在C获得,表明某种程度的开展。这一观察结果说明,即使测得的质量相当于一个完整的复杂,其解决方案的结构被打乱。因此,需要小心控制实验条件。
图4。通过生成校准曲线,漂移时间的测量和相关碰撞截面可以。
A.马细胞色素 C(圆圈),马 心脏肌红蛋白(三角形)和牛的泛素(正方形)多电荷态测量漂移时间值对文学Ω离子充电状态和减少群众的修正值绘制。适合产生相应的线性函数:LN(ΩC)= XLN(T D')+ A所确定的指数因子(X)符合确定的常数(a),相关系数都积在350米/秒的T波的速度,和一个静态波高11诉B采集到的数据显示。获得连续10个标定实验的相关系数分布的直方图。
| 蛋白质样品/技术参数 | GluFibrino - 肽 单体 1.6 kDa的 | 肌红蛋白 单体 17 kDa的 | 血红蛋白 四聚体 67 kDa的 | 转 单体 80 kDa的 | GroEL的 14夏季 801 kDa的 |
| 备份的压力,毫巴 | 4.4 | 5.0 | 5.1 | 5.1 | 6.5 |
| 陷阱的压力,毫巴 | 1.6x10 -2 | 2.4x10 -2 | 2.4x10 -2 | 2.6x10 -2 | 2.8x10 -2 |
| IMS的压力,毫巴 | 4.4x10 -1 | 4.4x10 -1 | 4.4x10 -1 | 4.4x10 -1 | 4.2x10 -1 |
| 采样锥电压,V | 46 | 80 | 80 | 80 | 118 |
| 提取锥电压,V | 1.7 | 1 | 1 | 1 | 3 |
| 偏置电压,V | 20 | 20 | 25 | 25 | 50 |
| 陷阱碰撞能量,V | 20 | 15 | 15 | 15 | 80 |
| 转移碰撞能量,V | 5 | 12 | 12 | 12 | 15 |
表1:用于分析大分子的实验条件。
| 标准蛋白 | 分子质量(M) | 收费(Z) | 为m / z | 碰撞截面(2) |
| 细胞色素C | 12213 | 10 | 1222.3 | 2226 |
| 11 | 1111.3 | 2303 | ||
| 12 | 1018.8 | 2335 | ||
| 13 | 940.5 | 2391 | ||
| 14 | 873.4 | 2473 | ||
| 15 | 815.2 | 2579 | ||
| 16 | 764.3 | 2679 | ||
| 17 | 719.4 | 2723 | ||
| 18 | 679.5 | 2766 | ||
| 肌红蛋白 | 16952 | 11 | 1542.1 | 2942 |
| 12 | 1413.7 | 3044 | ||
| 13 | 1305.0 | 3136 | ||
| 14 | 1211.9 | 3143 | ||
| 15 | 1131.1 | 3230 | ||
| 16 | 1060.5 | 3313 | ||
| 17 | 998.2 | 3384 | ||
| 18 | 942.8 | 3489 | ||
| 19 | 893.2 | 3570 | ||
| 20 | 848.6 | 3682 | ||
| 21 | 808.2 | 3792 | ||
| 22 | 771.6 | 3815 | ||
| 泛 | 8565 | 8 | 1071.6 | 1442 |
| 8 | 1071.6 | 1622 | ||
| 9 | 952.7 | 1649 | ||
| 10 | 857.5 | 1732 | ||
| 11 | 779.6 | 1802 | ||
表2。校准蛋白质和他们的碰撞截面,通过传统的 IMS measurments 14测定值。
| 设备 | 公司 | 目录编号 |
| SYNAPT HDMS - 32K RF发生器 | 沃特世公司 | |
| P - 97烈焰红唇 - 布朗微量拉马 | 萨特仪器 | P - 97 |
| 溅射镀膜机 | 电子显微镜科学 | EMS550 |
| 双目显微镜 | 尼康 | |
| 试剂 | 公司 | 目录编号 |
| 醋酸铵 | Sigma - Aldrich公司 | 西格玛,A2706 |
| CSI 99.999% | Sigma - Aldrich公司 | Aldrich公司,203033 |
| 甲醇 | Sigma - Aldrich公司 | Fluka公司,34966 |
| 醋酸 | Fisher Scientific则 | AC12404 |
| 马肌红蛋白(马心) | Sigma - Aldrich公司 | M1882 |
| 马细胞色素C(马心) | Sigma - Aldrich公司 | C - 2506 |
| 牛泛素(红细胞) | Sigma - Aldrich公司 | U6253 |
| 血红蛋白 | Sigma - Aldrich公司 | H2625 |
| 燃气 | 评论 | |
| 氮气,纯度达到99.999% | 8立方米缸 | |
| 氩气,99.999%的纯 | 8.8立方米meterscylinder | |
表3。试剂和仪器。
讨论
这里所描述的协议使定义一个未知的三维结构的蛋白质或蛋白质复合物的碰撞截面,其整体造型,包装亚基和拓扑提供信息的目的。为此,一旦碰撞截面值描述有必要将这些值转换结构的细节。这个过程,需要额外的实验努力,以及计算分析,下面简要讨论。
首先,它是建议进行分析与已知结构的蛋白质或蛋白质复合物。这些测量数据可以提供一个有用的质量控制的方法,将使比较Ω理论和测量值的采集参数的精度评估。可以计算出晶体结构的理论截面领域坐标使用MOBCAL 15,16软件,它是一个开放源码的FORTRAN为基础的软件,根据运营商需要允许代码编辑。运行这样的计算,它是需要修改的方案等,每输入结构进行迭代计算的数量增加,并含有大量原子的坐标文件被接受1。
IM - MS的战略定义拓扑安排在多元集会亚基最近已建议4,6。该方法涉及的蛋白质装配的分解途径,以更小的元件监测。这种分解是通过调整控制的解决方案相条件下,这就会引起subcomplexes的“积木”的集会反射分布。完整复杂和拆卸产品的Ω值同时测量计算的蛋白质复合物的拓扑模型,然后使用生成的结构限制。这种方法的基本假设是产生subcomplexes保留自己的母语一样确认,而事实上最近的研究表明,维护和拆装产品的解决方案的结构是没有任何一个解决方案或气体阶段的主要重排发生4,6。
气相蛋白复合物离子的四级结构的分配中的最后一步是计算机生成的模型拟合的碰撞截面值。建模方法,以探讨亚基不同的可能的拓扑安排和他们在硅片 Ω值的计算和比较实验。目前只有少数的计算方法是,像spheretype粗粒度的方法,直径接近亚基1,8。整体而言,这一领域仍然是在它的早期,并进一步发展的需要,使这种方法是通用的,适用于广泛的复合物。
披露声明
致谢
作者要感谢他们的严格审查,并为他们贡献的手稿沙龙组的成员。我们Morasha和Bikura方案,以色列科学基金会(批准号:1823至1807年和378/08),约瑟夫科恩密涅瓦生物膜研究中心,翟氏父子家庭研究员新科学家计划,亚伯拉罕的支持表示感谢索尼娅Rochlin基金会,欧胜家庭慈善信托基金的海伦和米尔顿答Kimmelman中心生物分子结构及组装;什洛莫和萨宾Beirzwinsky房地产; Meil德波顿Aynsley,和Karen暹粒,英国。
参考文献
- Ruotolo, B. T. Ion mobility-mass spectrometry analysis of large proteincomplexes. Nat Protoc. 3 (7), 1139-1152 (2008).
- Scarff, C. A., Thalassinos, K., Hilton, G. R., Scrivens, J. H. Travelling wave ion mobility mass spectrometry studies of protein structure: biological significance and comparison with X-ray crystallography and nuclear magnetic resonance spectroscopy measurements. Rapid Commun Mass Spectrom. 22 (20), 3297-3304 (2008).
- Smith, D. P. Deciphering drift time measurements from travelling wave ion mobility spectrometry-mass spectrometry studies. Eur J Mass Spectrom (Chichester, Eng). 15 (2), 113-130 (2009).
- Leary, J. A. Methodology for measuring conformation of solvent-disrupted protein subunits using T-WAVE ion mobility MS: an investigation into eukaryotic initiation factors. J Am Soc Mass Spectrom. 20 (9), 1699-1706 (2009).
- Lorenzen, K. Determination of stoichiometry and conformational changes in the first step of the P22 tail assembly. J Mol Biol. 379 (2), 385-396 (2008).
- Pukala, T. L. Subunit architecture of multiprotein assemblies determined using restraints from gas-phase measurements. Structure. 17 (9), 1235-1243 (2009).
- van Duijn, E. Chaperonin complexes monitored by ion mobility mass spectrometry. J Am Chem Soc. 131 (4), 1452-1459 (2009).
- Ruotolo, B. T. Evidence for macromolecular protein rings in the absence of bulk water. Science. 310 (5754), 1658-1661 (2005).
- Ruotolo, B. T., Robinson, C. V. Aspects of native proteins are retained in vacuum. Curr Opin Chem Biol. 10 (5), 402-408 (2006).
- Giles, K. Applications of a travelling wave-based radio-frequency-only stacked ring ion guide. Rapid Commun Mass Spectrom. 18 (20), 2401-2414 (2004).
- McKay, A. R., Ruotolo, B. T., Ilag, L. L., Robinson, C. V. Mass measurements of increased accuracy resolve heterogeneous populations of intact ribosomes. J Am Chem Soc. 128 (35), 11433-11442 (2006).
- Ruotolo, B. T. Ion mobility-mass spectrometry reveals long-lived, unfolded intermediates in the dissociation of protein complexes. Angew Chem Int Ed Engl. 46 (42), 8001-8004 (2007).
- Morton, V. L., Stockley, P. G., Stonehouse, N. J., Ashcroft, A. E. Insights into virus capsid assembly from non-covalent mass spectrometry. Mass Spectrom Rev. 27 (6), 575-595 (2008).
- Valentine, S. J., Counterman, A. E., Clemmer, D. E. A database of 660 peptide ion cross sections: use of intrinsic size parameters for bona fide predictions of cross sections. J Am Soc Mass Spectrom. 10 (11), 1188-1211 (1999).
- Mesleh, M. F. Structural information from ion mobility measurements: effects of the long-range potential. J Phys Chem. 100, 16082-16086 (1996).
- Shvartsburg, A. A., Jarrold, M. F. An exact hard-spheres scattering model for the mobilities of polyatomic ions. Chem Phys Lett. 261, 86-91 (1996).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。