Method Article
Т-волны ионной подвижности-масс-спектрометрии: Основные экспериментальные процедуры для комплексного анализа белков
В этой статье
Резюме
Ионная подвижность-масс-спектрометрии является новым газофазной технологии, которая отделяет ионы, исходя из их столкновения сечения и массы. Метод обеспечивает трехмерную информацию об общей топологии и форма белковых комплексов. Здесь мы опишем основные процедуры для настройки инструмента и оптимизация, калибровка дрейфа раз, и интерпретации данных.
Аннотация
Ионная подвижность (IM) представляет собой метод, который измеряет время, необходимое для ионно путешествовать по давлением клетке под влиянием слабого электрического поля. Скорость, с которой ионы пересекают области дрейфа зависит от их размеров: крупные ионы будут испытывать большее число столкновений с фоном инертным газом (как правило, N 2) и, следовательно, больше путешествовать медленно через устройство IM, чем те ионы, которые составляют меньше поперечное сечение. В общем, время, которое требуется для переноса ионов хотя плотной газовой фазы их разделяет, в соответствии с их сечение столкновений (Ω).
В последнее время И. М. спектрометрии в сочетании с масс-спектрометрии и бегущей волны (Т-волны) Synapt подвижности ионов масс-спектрометра (IM-МС) был освобожден. Интеграция масс-спектрометрии с ионной подвижности позволяет дополнительное измерение разделения образца и определения, что дает трехмерный спектр (масса времени заряда, интенсивность и дрейф). Это разделение техника позволяет спектрального перекрытия уменьшаться, и дает разрешение гетерогенных комплексов с очень похожие массы, или массы к заряду, но разные времена дрейфа. Более того, измерения времени дрейфа обеспечивают важный уровень структурной информации, а Ω имеет отношение к общей формы и топологии иона. Корреляции между измеренным временем дрейфа ценностей и Ω рассчитывается с использованием калибровочной кривой, полученные от calibrant белков с заданными сечениями 1.
Сила IM-MS подхода заключается в его способности определять упаковки субъединицы и общая форма белка сборки в микромолярных концентрации, и почти физиологическое состояние 1. Несколько недавних исследований И. М. как отдельных белков 2,3 и нековалентных белковых комплексов 4-9, успешно продемонстрировано, что четвертичная структура белка поддерживается в газовой фазе, и подчеркнули потенциал этого подхода в изучении белков собраний неизвестным геометрии . Здесь мы предоставляем подробное описание IMS-МС анализа белковых комплексов использованием Synapt (Квадрупольные-Ion Mobility-Время-Flight) HDMS инструмент (Waters Ltd; только коммерческих IM-MS инструмент в настоящее время) 10. Мы опишем основные шаги, оптимизация, калибровка столкновения сечения, а также методы обработки и интерпретации данных. Заключительный шаг протокола обсуждаются методы расчета теоретических значений Ω. В целом, протокол не пытается охватить все аспекты IM-MS характеристика белка сборки, а, скорее, его цель заключается во внедрении практических аспектов метод новых исследователей в этой области.
протокол
Процедура мы описываем сосредотачивается исключительно на IM-МС анализа белковых комплексов. Таким образом, мы предполагаем, что исследователи не знакомы с области структурной MS относятся к пробоподготовки шагов, калибровки прибора и MS и MS тандеме оптимизации процедур, описанных в Киршенбаум и соавт. Http://www.jove.com/index/details 2009. STP? ID = 1954. В целом, этот протокол включает в себя низкие микромолярных концентрации комплекса (1-20 мкм) в летучих буфера, такие как ацетат аммония (0,005 - 1 М, рН 6-8). Учитывая, что 1-2 мкл потребляются в nanoflow капилляр, мы предлагаем 10-20 мкл, как минимальный объем, чтобы дать возможность оптимизации условий MS.
Часть 1: Приобретение подвижности ионов масс-спектрометрии спектр
- Установить масс-спектрометр на следующие режимы работы: Mobility-TOF, положительные приобретения иона, а V-режиме.
- Включите все газы (API, ловушки и IMS). Мы используем N 2 для разделения IM, и Аг для Ловушка / передачи. Рекомендуемые начальные значения 1,5 мл / мин для Ловушка региона, а поток газа от 24 мл / мин для устройства IMS.
- Установите т / г приобретения диапазона. По неизвестной белковый комплекс, мы предлагаем первоначального использования широкого спектра массу, которая затем может быть уменьшена до нужных значений. Параллельно, настроить профиль MS для максимальной эффективности передачи. Для крупных комплексов, диапазон приобретения масса должна быть установлена от 1000 - 32000 т / г, и профиль MS Авто. В противном случае, профиль может быть установлен в соответствии со следующей таблицей:
м / г обитать (%) рампа (%) 960 10 20 3200 30 40 10667 - Проверьте настройки и РФ, при необходимости, подстраиваться под значения, соответствующие большие белковые комплексы, таким образом:
Источник Ловушка IMS Передача Смещение РФ 450 380 380 380 ВЧ усиление 0 0 0 0 РФ предельных 450 380 380 380 - Применение капиллярного напряжения (1,050-1,400 В) и низкого давления nanoflow (0.00-0.03 бар). После распыления начинается, попробуйте уменьшить nanoflow давление на минимальное значение. Кроме того, отрегулируйте положение капилляра, по отношению к конусу.
- Настройте параметры MS приобретения, приобретать хорошо разрешенных MS спектра: градиента давления вдоль инструмента, и отбор проб конус, а также добыча конуса, предвзятость, ловушки и передачи потенциальных настройки, все должны быть оптимизированы (подробно в соответствующем Юпитер протокол Киршенбаум и соавт. https://www.jove.com/index/details.stp?ID=1954 2009). Хотя эти параметры выборки зависимыми, условия, которые мы использовали для приобретения MS спектры различных масс иона, от пептида белковых комплексов, изложены в таблице 1 (см. также рис. 1). Чтобы свести к минимуму активацию комплекса попытаться постепенно снижать (с шагом в ~ 10 В) образца конусом, ловушки и напряжения смещения, не меняя положения пика.
- После оптимальный спектр масс получается профиль время дрейфа должна быть скорректирована. При анализе белков сборок, оптимальные условия как для массы и подвижности измерений часто несовместимы, поэтому важно, чтобы ударить правильный баланс между ними. В целом, сюжет подвижность ионов должна быть оптимизирован таким образом, что пики распределены по всему диапазону время дрейфа, и пик профиля гладкая, приближаясь распределения Гаусса (рис. 2А, 2Б). Значительные пик асимметрии может быть связано с плохим разделения нескольких конформаций.
- Как правило, тремя параметрами, Т-скорость волны, Т-волны высотой и IMS расхода газа может быть настроена для оптимизации мобильности разделения. Увеличение Т-скорость волны будет расширяться распределения времени дрейфа профиля, в то время увеличился Т-волны значения высоты сузит его. Точно также, увеличение потока IMS газ будет сдвиг профиля время дрейфа в сторону более высоких значений (минимальный газ IMS поток должен быть не менее 10 мл / мин). Мы предлагаем оставить две из трех доступных переменных фиксированной, и оптимизация третьих, пока спектр IM хорошо разрешаются (рис. 2б). С этой целью набора Т-волны скорости и потока газа до 250 м / с и 24 мл / мин, повторносоответственно. Тогда, как отправную точку, установить Т-волны высотой до 3 В, а в поэтапно, увеличить ее с шагом 1 V. В общем, больше ионов, потребует увеличения высоты волны. Как правило, нет необходимости изменять давление IMS, однако при высоких напряжениях смещения, необходимые для настройки, уменьшая газ IMS позволит уменьшение величины напряжения смещения и, следовательно, сокращения белкового комплекса активации. В целом, максимальное разрешение 10-12 т / Δt может быть достигнута.
- Когда условия не оптимизированы (низкая Т-волны высоты или высоких Т-волн и / или высокого давления IM), ионы не будет проходить через устройство IM эффективно, и их путешествие может занять больше времени, чем время, необходимое для следующего иона пакет будет выпущен в подвижности клетки. В результате, новый пакет иона будет освобожден из ловушки регионе до предыдущий пакет был доставлен толкатель регионе. Это приведет к "опрокидывания" эффект, в котором пик наблюдался в первой части спектра время дрейфа идентична ионов в хвостохранилище края (рис. 2). Этот артефакт может быть устранен за счет увеличения Т-волны высотой, и снижение зубца Т скорость и IMS давления. Кроме того, время Ловушка релиз может быть скорректирована. Кроме того, важно, чтобы проверить, что передача Т-волны высотой установлен, по крайней мере 5 В. Для предотвращения утечки ионов к ячейке IMS, мы рекомендуем, чтобы высота мобильности ловушку быть на максимальном уровне (30 В).
- Низкая скорость и высокая амплитуда передачи Т-волны могут привести к "ряби" в распределении времени дрейфа профиль (рис. 2D). Этот артефакт возникает, когда мобильность разделение ионов (ионный прибытия / дрейф времени) не поддерживается посредством передачи и ToF регионов, из-за частичной синхронизации между частотой толкателя и передачи Т-волны. Для того чтобы устранить этот эффект, либо время толкач или передачи Т-волны скорости должна быть скорректирована. С толкача частота связана с диапазоном масс, этот артефакт может появиться снова, когда этот параметр будет изменен. Т-волны высотой оказывает незначительное влияние, хотя его снижение может также помочь устранить рябь.
- Как только вышеупомянутые параметры оптимизированы, IM-MS данные могут быть приобретены.
Часть 2: Отбор экспериментальных условий для обеспечения мобильности измерения родных структур
Для достижения высокой решен MS пики, белковые комплексы, часто активируется в течение масс-спектрометра, в целях содействия снятия остаточной воды и буферных компонентов 11. Однако, если энергия активации увеличивается выше порогового значения, частичный разворачивается может быть вызвано формирования нескольких промежуточных состояний 12, которые вряд ли соответствуют родной, решение-государственного устройства (рис. 3А-C). В результате пик время дрейфа может быть сдвинута и расширили, отражая гетерогенной популяции развернулась структур.
Для того чтобы получить время дрейфа данные в соответствии с решением фазы структур, очень важно тщательно контролировать напряжение используется для ускорения ионов до разделения обмена мгновенными сообщениями. Более того, для разрешения высокой MS желательно увеличить передачи, а не ловушка напряжения. Как устройство IM позиционируется, прежде всего, следует региона Передача и анализатор TOF, следовательно, активации следующим измерения мгновенных сообщений и ионов остается неизменным, в то время как точность MS может быть увеличена.
Для подтверждения того, что сбор данных осуществляется в условиях, которые поддерживают нативной структуры комплекса, рекомендуется, чтобы данные регистрировались в диапазоне экспериментальных и решение условий, а не по одному, оптимизированный набор параметров:
- Увеличение капиллярного и конус напряжений в поэтапно, в то время мониторинга влияния на спектр время дрейфа.
- Как и в шаге 1, увеличение напряжения Ловушка столкновения в поэтапно, и получать данные на 10 интервалов V.
- Чтобы определить развернулась конформации и оценить полученные данные, вручную вызывать диссоциацию белкового комплекса путем титрования образца с уксусной кислотой в течение диапазоне рН 2-7, и записывать данные (рис. 3б).
Часть 3: Корреляция между дрейф значения времени и площади поперечного сечения
В отличие от обычных измерений И. М., в которых измеренные значения времени дрейфа линейно связаны с Ω, в T-волновая система IMS, площадь поперечного сечения определяется калибровки подход. Таким образом, вместо абсолютном измерении, относительный экспоненциальной корреляции генерируется между измеренным дрейф раза и 1,13 Ω: 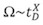
где £ D является измеряется время дрейфа, а Х доля константа, которая может быть извлечена из калибровочной кривой. Калибровка выполнятьред путем измерения дрейфа раза ионов с известными Ω (измеряется от обычных экспериментов IM).
- Измерения Drift времени калибруется с помощью денатурированных белков лошадиного цитохрома С, миоглобина сердца лошади и быка убиквитин с известными столкновения сечения. Для этого решения 10 мкм 49/49/2, объему, вода / метанол / уксусная кислота должна быть подготовлена (используемых реагентов приведены в Таблице 3).
- Приобретать IM-MS данные для calibrant белков при точно тех же условиях, прибор, используемый для белка-мишени или белкового комплекса:
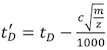 (Часть 1). Все напряжения и давления должны быть одинаковыми, чтобы сохранить Настройки чата разделения.
(Часть 1). Все напряжения и давления должны быть одинаковыми, чтобы сохранить Настройки чата разделения. - Для каждого зарядового состояния calibrant белков экстракта экспериментальное значение временного дрейфа (£ D) (описаны в Части 4).
- Правильное каждый из calibrant раз дрейф (т D) (табл. 2), используя следующее уравнение:
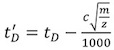 , Где т / г массы к заряду иона наблюдается, с-Расширенные рабочий цикл (EDC) задержки коэффициентом 1. Ее значение, как правило, от 1,4 до 1,6, это зависит от инструмента. Значение EDC указывается в Системе | Настройки Приобретение | Приобретение вкладку Настройка.
, Где т / г массы к заряду иона наблюдается, с-Расширенные рабочий цикл (EDC) задержки коэффициентом 1. Ее значение, как правило, от 1,4 до 1,6, это зависит от инструмента. Значение EDC указывается в Системе | Настройки Приобретение | Приобретение вкладку Настройка. - Использование кросс-раздел База данных профессор Дэвид Клеммер это:
http://www.indiana.edu/ ~ Клеммер / Аналитика / кросс% 20section% 20database/Proteins/protein_cs.htm 14 правильных каждый из calibrant сечения для ионно состояние заряда и приведенная масса.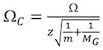
, Где Ω С исправлены сечения, Ω является литература сечения, г является состояние заряда иона, т-молекулярной массой calibrant иона, а M G-молекулярный вес газа фоне IM (как правило, N 2). - Участок В (т D) против В (Ω С) (рис. 4).
- В результате кривая соответствует следующей формуле:
 Параметры X и могут быть извлечены путем установки заговор с целью линейная зависимость. Склоне X соответствует экспоненциальный фактор пропорции и представляет отделка определяется постоянной.
Параметры X и могут быть извлечены путем установки заговор с целью линейная зависимость. Склоне X соответствует экспоненциальный фактор пропорции и представляет отделка определяется постоянной. - Рассчитать подходят коэффициент корреляции R 2, по формуле Пирсона:
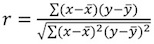 . Допустимые значения для г 2 больше, чем 0,95 (рис. 4б). Более низкое значение коэффициента корреляции может быть связано с:
. Допустимые значения для г 2 больше, чем 0,95 (рис. 4б). Более низкое значение коэффициента корреляции может быть связано с: - Неполное раскрытие белка calibrants. Это приведет к расширению пика из-за гетерогенных сборке промежуточных состояний.
- По нашему опыту, в возрасте образец может ухудшиться спектров мгновенных сообщений.
- Разнородных экспериментальных условий, используемых для различных calibrant белков. В этом случае построение данные для каждого белка в отдельности должны генерировать разнообразные коэффициенты корреляции, хотя каждый из них должен быть выше, чем 0,95.
- Шумная данных и неправильных сглаживания и центрирования распределения времени дрейфа.
- Расчет ошибки.
- Recorrect calibrant время дрейфа использования определяется экспоненциальным множителем, X, полученный в шаге 7:
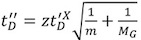
- Как этапа проверки, Replot Ω C по сравнению с
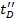 и определить коэффициент корреляции. Более высокие значения, чем 0,95 следует ожидать.
и определить коэффициент корреляции. Более высокие значения, чем 0,95 следует ожидать. - В соответствии с процедурой, описанной в пункте 4, правильные показания дрейф белка-мишени или белкового комплекса:
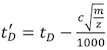
- Калибровка время дрейфа белка-мишени / белкового комплекса использованием экспоненциального множителя, X, определенный в Шаг 7:
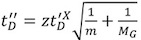
- Рассчитать Ω целевого белка / белкового комплекса использованием отделки определяется постоянной,, определенный в Шаг 7:
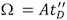 .
. - Для каждой экспериментальной состоянии, Шаги 2 до 13 следует повторить. При определении площади поперечного сечения неизвестный белок и белковый комплекс, мы рекомендуем, чтобы каждый эксперимент повторяется по крайней мере три раза, а стандартное отклонение этих трех экземплярах измерений определены.
Часть 4: Определение значений времени пролета
Необходимое программное обеспечение: MassLynx и Driftscope (Waters).
- Открытое IM-MS спектр использования Driftscope программного обеспечения.
- В главном меню выберите ViEW и снимите Хроматограмма, время дрейфа и спектра (опция), оставив активным только 2D-карту, показывающую время дрейфа по сравнению с м / z.
- В строке меню, выберите Показать | Options | Показать Панель редактора и регулировки параметров пороговой интенсивности, чтобы минимизировать фонового шума (в большинстве случаев, этот параметр может быть определен как Min = 30-40% и Макс = 100 подсчитывает%).
- Выберите Display | 2D шкале интенсивности карты, и три варианта появится: линейной шкалы, Вход Масштаб и площади Шкала Root. Выбор Логарифмическая шкала (логарифмическая преобразование данных) будет сжимать код интенсивность цвета, а также включить одновременным появлением широкого спектра интенсивности (в отличие от линейных и квадратных варианты корня, с которой только наиболее интенсивные пики, которые остаются невидимыми) .
- На панели инструментов панели, используйте кнопки Selection Tool. Эта опция активирует различные варианты выбора, и разрешить выделение соответствующего региона в спектре. Наиболее точный инструмент Включить области интереса Выбор, с помощью которой граница может быть проведена по всему региону интерес, тем самым исключая все ненужные данные и шумом вершин. Кроме того, Ортогональные и группы вариантов выбора полезны, когда область интереса не окружен избыточных пиков.
- Как только область интереса выбран, используйте команду Принять Текущий выбор, чтобы удалить ненужную информацию.
- Экспорт данных в MassLynx, сохраняя при этом информацию дрейф времени.
- В MassLynx, открытые хроматограмме сохранены спектр время дрейфа, и объединить времени бункеров. Соответствующего спектра масс откроется автоматически.
- Применить сглаживание функции, определяя размер окна и числа гладких параметров (должен быть настроен специально для каждого спектра, используя минимальные значения).
- Применять базовые вычитание, если это необходимо.
- Центр спектра и измерения массы, для проверки идентичности белка и массовой точностью.
- Для каждого заряда государства, объединить т / г диапазона. Соответствующий спектр время дрейфа появится автоматически. Гладкая и в центре профиля дрейф времени, и определить значение времени пролета с указанием тяжести каждого пика.
Часть 5: Представитель Результаты

Рисунок 1. Схематическое изображение инструмента Synapt HDMS определения основных настраиваемых параметров ИМС-МС приобретения. Экспериментальные параметры, используемые для IM-MS измерений помечены согласно их позиции в инструменте. Ионного пучка окрашена в красный, а давление в каждом регионе обозначается использованием цветового кода. Панели в нижней иллюстрирует градиент потенциала вдоль инструмента и разности потенциалов определении ловушки и энергии Передача столкновения, а также смещения потенциал. Все потенциалы для чтения спины ссылки на статические смещения напряжения, который обычно устанавливается на 120В.

Рисунок 2. Ионная подвижность время прибытия распределения Gβυ белка.
А. высоких Т-волн приводит к узким распределением профиля время дрейфа. Сюжет иллюстрирует распределение времени прибытия Состояниями 16 + (красный), 15 + (зеленый), 14 + (синий), и 13 + (пурпурный) заряда, а также общего профиля время дрейфа (в черном) белка βυ G.
Б. оптимизированным спектром время дрейфа с гладкой формы пика Гаусса. Подобные этикетки цвета, как в.
C. "опрокидывания" эффект, который возникает, когда время, необходимое для ионов пройти мобильности ячейки происходит медленнее, чем интервал между инъекциями новых ионных пакетов в устройстве. В результате расширенного пиковое время дрейфа появляется в начале спектра. Этот эффект может быть устранен за счет увеличения Т-волны высотой, и снижение зубца Т скорость и IMS давления.
"Рябь" Д. Искусственные возникают, когда передача Т-волн и толкателя частоты частично синхронизированы. Этот эффект может быть преодолена путем изменения либо частоты толкач или передачи Т-волны.
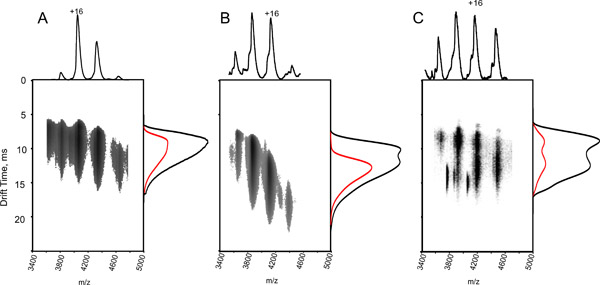
Рисунок 3. Влияние ионной активации и частичное денатурирующих условиях на IM-МС спектры гемоглобина. Земельный время дрейфа по сравнению с т / г для тетрамерной комплекс гемоглобина, используя водный раствор 10 мМ ацетата аммония (рН = 7,6) (А, С) и добавлением 0,1%-ной уксусной кислоты (Б). Данные получены с помощью ловушки энергии столкновения напряжением 13 В (А, В) и 35 V (C) Хотя во всех трех панелях масс-спектр (в проекции сверху) похожа, с тетрамерной серии заряда с центром в 4000 м / г, Профиль время дрейфа (прогноз по бокам) отличается (всего распределение времени дрейфв черном, и 16 + профиле красным цветом). Чем дольше время дрейфа частично денатурированные образцы, полученные в В, а в газовой фазе активированного ионами, полученным в С, что свидетельствует о какой-то степени раскрытия. Это наблюдение показывает, что даже если измеренная масса соответствует нетронутыми комплекса, его структуру решения нарушается. Как следствие, тщательный контроль экспериментальных условиях не требуется.
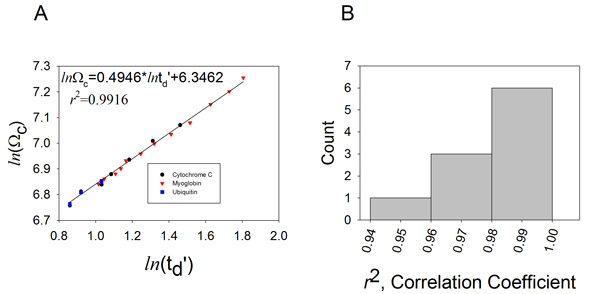
Рисунок 4. Создавая калибровочной кривой, снос временных измерений и столкновения сечения могут быть взаимосвязаны.
А. Измеренное время дрейфа значений нескольких состояниях заряд лошадиного цитохрома С (кружки), конные сердце миоглобина (треугольники) и бычьего убиквитин (квадраты) были построены в отношении литературы значения Ω с поправкой на оба состояния иона заряд и приведенная масса. Подходят дает линейная функция, отвечающая: п (Ω С) = XLN (т D ') + А. Определяется экспоненциальным множителем (X), соответствует определенной постоянной (), а коэффициент корреляции выводятся на участок для данных, полученных при Т-волны скорость 350 м / с, а статическая высота волны 11 В. В. Гистограмма распределения коэффициента корреляции получены из 10 последовательных экспериментов калибровки.
| Образце белка / Технические параметры | GluFibrino- пептид мономер 1,6 кДа | Миоглобин мономер 17 кДа | Гемоглобин тетрамер 67 кДа | Трансферрина мономер 80 кДа | GroEL 14-Мер 801 кДа |
| Резервное давление, мБар | 4,4 | 5,0 | 5,1 | 5,1 | 6,5 |
| Ловушка давления, мБар | 1.6x10 -2 | 2.4x10 -2 | 2.4x10 -2 | 2.6x10 -2 | 2.8x10 -2 |
| IMS Давление, мБар | 4.4x10 -1 | 4.4x10 -1 | 4.4x10 -1 | 4.4x10 -1 | 4.2x10 -1 |
| Выборка конус напряжение, В | 46 | 80 | 80 | 80 | 118 |
| Добыча конус напряжение, В | 1,7 | 1 | 1 | 1 | 3 |
| Напряжение смещения, В | 20 | 20 | 25 | 25 | 50 |
| Ловушка энергии столкновения, V | 20 | 15 | 15 | 15 | 80 |
| Передача энергии при столкновении, V | 5 | 12 | 12 | 12 | 15 |
Таблица 1. Условия эксперимента используются для анализа макромолекул.
| Стандартный белка | Молекулярная масса (м) | Сборов (г) | м / г | Сечение столкновений (в 2) |
| Цитохром С | 12213 | 10 | 1222,3 | 2226 |
| 11 | 1111,3 | 2303 | ||
| 12 | 1018,8 | 2335 | ||
| 13 | 940,5 | 2391 | ||
| 14 | 873,4 | 2473 | ||
| 15 | 815,2 | 2579 | ||
| 16 | 764,3 | 2679 | ||
| 17 | 719,4 | 2723 | ||
| 18 | 679,5 | 2766 | ||
| Миоглобин | 16952 | 11 | 1542,1 | 2942 |
| 12 | 1413,7 | 3044 | ||
| 13 | 1305,0 | 3136 | ||
| 14 | 1211,9 | 3143 | ||
| 15 | 1131,1 | 3230 | ||
| 16 | 1060,5 | 3313 | ||
| 17 | 998,2 | 3384 | ||
| 18 | 942,8 | 3489 | ||
| 19 | 893,2 | 3570 | ||
| 20 | 848,6 | 3682 | ||
| 21 | 808,2 | 3792 | ||
| 22 | 771,6 | 3815 | ||
| Убиквитин | 8565 | 8 | 1071,6 | 1442 |
| 8 | 1071,6 | 1622 | ||
| 9 | 952,7 | 1649 | ||
| 10 | 857,5 | 1732 | ||
| 11 | 779,6 | 1802 | ||
Таблица 2. Calibrant белков и их столкновения сечения, определяемых с обычными measurments IMS 14.
| Устройства | Компания | Номер в каталоге |
| Synapt HDMS-32К ВЧ-генератора | Воды ООО | |
| Р-97 Flaming-Браун микропипетки съемник | Саттер инструменты | Р-97 |
| Sputter для нанесения покрытий | Электронная микроскопия наук | EMS550 |
| Бинокулярный микроскоп | Nikon | |
| Реагенты | Компания | Номер по каталогу |
| Ацетата аммония | Sigma-Aldrich | Sigma, A2706 |
| CsI 99,999% | Sigma-Aldrich | Aldrich, 203033 |
| Метанол | Sigma-Aldrich | Fluka, 34966 |
| Уксусная кислота | Fisher Scientific | AC12404 |
| Коневодство миоглобина (из конского сердца) | Sigma-Aldrich | M1882 |
| Коневодство цитохром с (из конского сердца) | Sigma-Aldrich | C-2506 |
| Говядина убиквитин (от красных кровяных телец) | Sigma-Aldrich | U6253 |
| Гемоглобин | Sigma-Aldrich | H2625 |
| Газ | Комментарии | |
| Азот, 99,999% чистой | 8 кубических метров цилиндра | |
| Аргон, 99,999% чистой | 8,8 кубических meterscylinder | |
Таблица 3. Реагенты и оборудование.
Обсуждение
Протокол, описанный здесь, позволяет определить сечение столкновения белков или белковых комплексов с неизвестной трехмерной структуры, с целью предоставления информации об их общую форму, подразделения упаковки и топологии. С этой целью один раз столкновения значения сечения изображены необходимо преобразовать эти значения структурных деталей. Этот процесс требует дополнительных экспериментальных усилий, а также компьютерного анализа, которые кратко описаны ниже.
Начнем с того, рекомендуется проанализировать белки или белковые комплексы с известными структурами. Эти измерения могут предоставить полезную контроль качества методологии и позволит точность оценки параметров регистрации, сравнивая теоретический и измеряется Ω ценностей. Теоретические сечения области может быть вычислена по кристаллической структуре координат с использованием MOBCAL 15,16 программное обеспечение, которое является открытым исходным кодом FORTRAN программное обеспечение позволяет редактирования кода в соответствии с потребностями оператора. Для запуска таких расчетов требуется изменить программу так, что число итерационных расчетов, выполненных на вход структуры увеличивается, и которые координируют файлов, содержащих большое число атомов принимаются 1.
IM-MS стратегии для определения топологического расположения субъединиц в многокомпонентных сборки был недавно предложен 4,6. Метод включает в себя мониторинг путей диссоциации белка сборки более мелкие компоненты. Это разделение достигается путем контролируемого регулированию условий решения фазы, что приводит к распределению подкомплексы отражает "строительные блоки" сборки. Одновременное измерение значений Ω как нетронутыми сложных и разборки продукции порождает структурные ограничения, которые затем используются для расчета топологических моделей белковых комплексов. Базовой посылке методологии, что созданный подкомплексы сохраняют свой родной подобных подтверждений, да и недавние исследования показали, что решение структуры разборки продукции поддерживается и никаких серьезных перестановки в любом растворе или газовой фаз произошло 4,6.
Последний шаг в назначении четвертичной структуры в газовой фазы белкового комплекса ионов уместно столкновения значения сечения в компьютерной модели. Моделирование подходы используются для того, чтобы изучить различные возможные топологические механизмы подразделений и их значения в кремнии Ω рассчитывается и по сравнению с экспериментальными. В настоящее время только несколько вычислительных подходы используются, как spheretype крупнозернистого метод, который приближается к диаметру субъединиц 1,8. В целом, это поле еще в первые годы своего существования и дальнейшего развития необходимо, чтобы сделать этот подход, общий, и применимы к широкому кругу комплексов.
Раскрытие информации
Благодарности
Авторы выражают благодарность членам Шарон группы за их критический обзор, и за их вклад в рукописи. Мы благодарны за поддержку и Мораша бикура программы, Израиль научного фонда (грант пп 1823/07 и 378/08), Йозеф Кон Минерва Центре Биомембранных исследований, семьи Chais стипендиатов программы для новых ученых, Авраам и Соня Rochlin фонда; семьи Вольфсон Благотворительный фонд; Хелен и Милтон А. Kimmelman Центра биомолекулярных Структура и Ассамблеи; имении Шломо и Сабин Beirzwinsky; Meil де Боттон Эйнсли, и Карен Сием, Великобритания.
Ссылки
- Ruotolo, B. T. Ion mobility-mass spectrometry analysis of large proteincomplexes. Nat Protoc. 3 (7), 1139-1152 (2008).
- Scarff, C. A., Thalassinos, K., Hilton, G. R., Scrivens, J. H. Travelling wave ion mobility mass spectrometry studies of protein structure: biological significance and comparison with X-ray crystallography and nuclear magnetic resonance spectroscopy measurements. Rapid Commun Mass Spectrom. 22 (20), 3297-3304 (2008).
- Smith, D. P. Deciphering drift time measurements from travelling wave ion mobility spectrometry-mass spectrometry studies. Eur J Mass Spectrom (Chichester, Eng). 15 (2), 113-130 (2009).
- Leary, J. A. Methodology for measuring conformation of solvent-disrupted protein subunits using T-WAVE ion mobility MS: an investigation into eukaryotic initiation factors. J Am Soc Mass Spectrom. 20 (9), 1699-1706 (2009).
- Lorenzen, K. Determination of stoichiometry and conformational changes in the first step of the P22 tail assembly. J Mol Biol. 379 (2), 385-396 (2008).
- Pukala, T. L. Subunit architecture of multiprotein assemblies determined using restraints from gas-phase measurements. Structure. 17 (9), 1235-1243 (2009).
- van Duijn, E. Chaperonin complexes monitored by ion mobility mass spectrometry. J Am Chem Soc. 131 (4), 1452-1459 (2009).
- Ruotolo, B. T. Evidence for macromolecular protein rings in the absence of bulk water. Science. 310 (5754), 1658-1661 (2005).
- Ruotolo, B. T., Robinson, C. V. Aspects of native proteins are retained in vacuum. Curr Opin Chem Biol. 10 (5), 402-408 (2006).
- Giles, K. Applications of a travelling wave-based radio-frequency-only stacked ring ion guide. Rapid Commun Mass Spectrom. 18 (20), 2401-2414 (2004).
- McKay, A. R., Ruotolo, B. T., Ilag, L. L., Robinson, C. V. Mass measurements of increased accuracy resolve heterogeneous populations of intact ribosomes. J Am Chem Soc. 128 (35), 11433-11442 (2006).
- Ruotolo, B. T. Ion mobility-mass spectrometry reveals long-lived, unfolded intermediates in the dissociation of protein complexes. Angew Chem Int Ed Engl. 46 (42), 8001-8004 (2007).
- Morton, V. L., Stockley, P. G., Stonehouse, N. J., Ashcroft, A. E. Insights into virus capsid assembly from non-covalent mass spectrometry. Mass Spectrom Rev. 27 (6), 575-595 (2008).
- Valentine, S. J., Counterman, A. E., Clemmer, D. E. A database of 660 peptide ion cross sections: use of intrinsic size parameters for bona fide predictions of cross sections. J Am Soc Mass Spectrom. 10 (11), 1188-1211 (1999).
- Mesleh, M. F. Structural information from ion mobility measurements: effects of the long-range potential. J Phys Chem. 100, 16082-16086 (1996).
- Shvartsburg, A. A., Jarrold, M. F. An exact hard-spheres scattering model for the mobilities of polyatomic ions. Chem Phys Lett. 261, 86-91 (1996).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены