Method Article
T-dalgası İyon Hareketlilik-Kütle Spektrometresi: Protein Karmaşık Analiz Temel Deneysel Prosedürler
Özet
İyon hareketliliği-kütle spektrometresi ve çarpışma kesiti ve kitle dayalı, iyonlar ayıran yeni ortaya çıkan bir gaz faz teknolojisi. Yöntemi protein komplekslerinin genel topoloji ve şekil üç boyutlu bilgi sağlar. Burada, araç ayarı ve optimizasyonu, sürüklenme kez kalibrasyon, ve verilerin yorumlanması için temel bir prosedürü anahat.
Özet
İyon hareketlilik (IM), zayıf bir elektrik alan etkisi altında basınçlı bir hücre yoluyla seyahat için bir iyon için alınan önlemler bir yöntemdir. Iyonları drift bölgeye hareket hızı hangi boyutlarına bağlıdır: küçük bir oluşturan bu iyonların daha büyük iyonları arka plan inert gaz (genellikle N 2) ile daha fazla sayıda çarpışmaların bir deneyim ve böylece Sohbet cihaz üzerinden daha yavaş seyahat kesit. Genel olarak, zaman ve çarpışma kesiti (Ω) göre, yoğun gaz fazında onları ayıran rağmen göç iyonları için alır.
Son zamanlarda, Sohbet spektrometrisi, kütle spektrometresi ve-dalga (T-dalgası) Synapt iyon hareketliliği kütle spektrometresi (IM-MS) serbest bırakıldı ile birleştiğinde. Iyon hareketliliği ile kütle spektrometresi entegrasyonu, verimli bir üç boyutlu spektrum (şarj, yoğunluk ve sürüklenme zaman kitle), örnek ayırma ve tanımı ekstra bir boyut sağlar. Bu ayırma tekniği spektral örtüşme azaltmak için izin verir, ve çok benzer bir kitle, veya kitle-şarj oranları, ancak farklı sürüklenme kez heterojen komplekslerinin çözünürlüğü sağlar. Ayrıca, Ω iyon genel şekli ve topoloji ile ilgili olarak sürüklenme zaman ölçümleri, önemli bir yapısal bilgi katmanı sağlar. Sürüklenme zaman ölçülen değerler ve Ω arasında korelasyon tanımlanan kesitler 1 kalibratörü proteinlerin elde edilen kalibrasyon eğrisi kullanılarak hesaplanır.
IM-MS yaklaşımın güç altbirim ambalaj ve mikromolar konsantrasyonlarda protein meclislerinin genel şekli tanımlama yeteneği yatıyor ve yakın fizyolojik koşullarda 1. Son zamanlardaki birkaç anlık ileti çalışmaları, bireysel proteinler 2,3 ve non-kovalent protein kompleksleri 4-9 hem gaz fazı başarıyla protein kuaterner yapısı muhafaza olduğunu göstermiş, ve bilinmeyen bir geometri protein meclislerinin çalışmada, bu yaklaşımın potansiyel vurgulanan . 10; Burada, Synapt kullanarak protein kompleksleri IMS-MS analizi (kuadropol-Ion Hareketlilik-Zaman-Uçuş) HDMS enstrüman (sadece ticari IM-MS cihazı mevcut Waters Ltd) ayrıntılı bir açıklama sağlar. Biz temel optimizasyon adımları, çarpışma kesitler kalibrasyon ve veri işleme ve yorumlama yöntemleri açıklanmaktadır. Protokolün son adım, teorik Ω değerleri hesaplamak için yöntemler anlatılmaktadır. Genel olarak, protokol protein meclislerinin IM-MS karakterizasyonu her yönünü kapsayacak şekilde girişiminde bulunmamış, bunun yerine, amacına alanında yeni araştırmacılar yöntemin pratik yönlerini tanıtmaktır.
Protokol
Tarif prosedür sadece protein komplekslerinin IM-MS analizi odaklanır. Bu nedenle, yapısal MS alanında tanışmamak araştırmacılar, numune hazırlama adımları, enstrüman kalibrasyonu ve MS ve tandem MS optimizasyonu prosedürleri Kirshenbaum ark bakın öneririz 2009 https://www.jove.com/index/details . stp? ID = 1954. Genel olarak, bu protokol, amonyum asetat (1 M, pH 6-8 0.005) gibi uçucu bir tampon karmaşık mikromolar düşük konsantrasyonlarda (1-20 mcM) içerir. 1-2 ul kılcal nanoflow başına tüketilen olduğu göz önüne alındığında, MS koşullarının optimizasyonu sağlamak için, minimum hacim olarak 10-20 ul öneririz.
Bölüm 1: bir iyon hareketliliği-kütle spektrometresi spektrumu Kazanılması
- Hareketlilik-TOF, pozitif iyon satın alma, ve V-modu: Aşağıdaki çalışma modları kütle spektrometresi ayarlayın.
- (API, tuzak ve IMS), tüm gazlar açın. Biz tuzak / Transfer IM ayrılması için N 2 ve Ar kullanın. Önerilen başlangıç değerleri Tuzak bölge için 1.5 ml / dk ve 24 ml / dk IMS cihazı bir gaz akışı.
- M / z satın aralığını ayarlayın. Bilinmeyen bir protein kompleksi için, sonra istediğiniz değerleri azaltılmış olabilir, çok geniş bir kitle yelpazede, ilk kullanmanızı öneririz. Buna paralel olarak, maksimum iletim verimliliği için MS profili ayarlayın. Büyük kompleksler, satın kütle aralığı 1.000 - 32.000 m / z ve Auto MS profili. Aksi takdirde, profil aşağıdaki tabloya göre ayarlanmalıdır.
m / z durmak (%) rampası (%) 960 10 20 3200 30 40 10667 - , Böylece RF ayarını kontrol edin ve gerekirse, büyük protein kompleksleri için uygun değerleri ayarlamak:
Kaynak Tuzak IMS Transfer RF Ofset 450 380 380 380 RF Kazanç 0 0 0 0 RF Sınırı 450 380 380 380 - Kılcal gerilimi (1,050-1,400 V) ve düşük nanoflow basıncı (,00-,03 bar) uygulayın. Sprey başlatılan sonra, en az bir değere nanoflow basıncı azaltmak için deneyin. Buna ek olarak, koni ile ilgili, kılcal konumunu ayarlamak.
- Iyi çözülmesi MS spektrum elde etmek için, MS toplama parametreleri ayarlayın: cihaz boyunca basınç gradiyenti ve örnekleme koni çıkarma koni gibi, önyargı, Trap ve potansiyel ayarları Transferi, (ilgili ayrıntılı optimize edilmiş olmalıdır vallahi protokolü Kirshenbaum ve ark 2009 https://www.jove.com/index/details.stp?ID=1954). Bu parametreler, örnek bağımlı olmasına rağmen, protein kompleksleri peptid, çeşitli iyon kitlelerin MS spektrumları elde etmek için kullanılan koşulları, Tablo 1'de özetlenmiştir (Şekil 1). Tepe konumunu değiştirmeden yavaş yavaş (~ 10 V adımlarla) örnek koni, tuzak ve önyargı gerilimleri azaltmak için karmaşık deneyin aktivasyonu en aza indirmek için.
- Bir kez optimum bir kütle spektrumu sürüklenme zaman profili ayarlanabilir olmalıdır elde edilir. Protein meclisleri, kütle ve mobilite ölçümleri için en uygun koşulları analiz ederken genellikle uyumsuz, bu nedenle ikisi arasında uygun bir denge kurmak önemlidir. Genel olarak, iyon hareketliliği arsa doruklarına tüm sürüklenme zaman aralığı dağılmış olduğu gibi optimize edilmiş, ve pik profil düzgün bir Gauss dağılımı (Şekil 2A, 2B) yaklaşan olmalıdır. Önemli pik asimetri, birden fazla konformasyonlarının fakir ayrımı ile ilgili olabilir.
- Genel bir kural olarak, üç parametre, T-dalgası hızı, T-dalga yüksekliği ve IMS gaz debisi hareketlilik ayırma optimize etmek için ayarlanmış olabilir. Artmış T-dalga yüksekliği değerleri dar ise T-dalgası hızının artırılması, sürüklenme zaman dağıtım profili genişletmek olacaktır. Benzer şekilde, IMS gaz akışını artırarak, daha yüksek değerler (minimal IMS gaz akışı 10 ml / dk olmalıdır) doğru sürüklenme zaman profili kayacak. Biz sabit üç değişkenlerin iki bırakarak ve Sohbet spektrumu (Şekil 2B) iyi çözüme kadar üçüncü optimize öneririz. Bu amaçla, 250 m / s ve 24 ml / dk, yeniden T-dalgası hız ve gaz akışısonuçları sunulmaktadır. Sonra, bir başlangıç noktası olarak, 3 V T-dalga yüksekliği ve aşamalı bir şekilde, 1 V artışlarla artırmak. Genel olarak, daha büyük iyonları, daha yüksek dalga boyları gerekecektir. Genellikle, IMS basınç değiştirmeye gerek yoktur; Ancak, yüksek önyargı gerilimler önyargı gerilim değeri bir azalma ve dolayısıyla protein kompleksi aktivasyon bir azalma sağlayacak IMS gazı azaltarak, ayarlama için gereklidir. Genel olarak, 10-12 t / ¨ t maksimum çözünürlük ulaşılabilir.
- Koşulları (düşük T-dalga yüksekliği veya yüksek T-dalgası hız ve / veya yüksek Sohbet basınç), optimize edilmiş değildir, iyonlar etkili IM cihaz üzerinden hareket olmaz ve kendi yolculuk sonraki iyon için gerekli süreden daha uzun sürebilir paket hareketlilik hücre içine çıkacak. Sonuç olarak, önceki paket itici bölgeye teslim edilmeden önce, yeni bir iyon paketi tuzak bölgesinden çıkacak. Bu sürüklenme zamanlı spektrum ilk bölümünde gözlenen pik atık kenarına (Şekil 2C) iyonlarının aynı olduğu, bir "roll-over 'etkiye yol açacaktır. T-dalga yüksekliğinin artırılması ve T-dalgası hız ve IMS basıncı azaltarak Bu yapıyı ortadan kaldırılabiliyor. Buna ek olarak, tuzak bırakma zamanı ayarlanabilir. Ayrıca, Transfer T-dalga yüksekliği IMS hücre doğru iyonları sızıntılarını önlemek için en az 5 V. ayarlanmış olduğunu doğrulamak için önemlidir, biz hareketlilik tuzak yüksekliği maksimum seviyelere (30 V) tutulması önerilir.
- Transferi T dalgaları Düşük hız ve yüksek genlik kayması zaman dağıtım profili (Şekil 2B) "dalgalanma" yol açabilir. Iyonları (iyon varış / sürüklenme zaman) Transfer ve TOF bölgelerde hareketlilik ayırma sağlanmaktadır olmadığında Bu yapıyı itici frekans arasında kısmi senkronizasyon ve transfer T-dalgası hız nedeniyle oluşur. Itici veya Transfer T-dalgası hızı ayarlanabilir olmalıdır ya da bu etkiyi ortadan kaldırmak için. Itici frekansı kütle aralığı ile ilgili olduğundan bu parametre değiştiğinde, bu artifakı yeniden. T-dalga yüksekliği, onun azaltılması da dalgaların ortadan kaldırmak için yardımcı olsa küçük bir etki gösterir.
- Söz konusu parametreler optimize sonra, IM-MS veri elde edilebilir.
Bölüm 2: deneysel koşullar altında doğal yapıları mobilite ölçümleri sağlamak için Eleme
Yüksek çözülmesi MS doruklarına ulaşmak için, protein kompleksleri, kalan su ve tampon parçaları 11 sıyırma teşvik etmek için sık sık, kütle spektrometresi içinde aktive edilir . Ancak, aktivasyon enerjisi, bir eşik değeri aşan artış ise, yerli, çözüm-devlet yapısı (Şekil 3A-C) karşılık vermemektedirler birden fazla ara durumları 12, şekillendirme unfolding kısmi indüklenen olabilir. Sonuç olarak, kayma zaman zirve kaydırılır ve genişlemiş, heterojen nüfus yapıları gelişeceğini yansıtan olabilir.
Çözüm faz yapıları ile uyumlu sürüklenme zamanlı veri elde etmek için, Sohbet ayrılması öncesinde hızlanan iyonları için kullanılan gerilimler, dikkatle kontrol etmek için esastır. Ayrıca, yüksek lisans çözümü için tuzak geriliminden daha ziyade Transferi artırmak için tercih edilir. Sohbet cihazı yerleştirilmiş olduğu gibi, ilk Transfer bölge ve TOF analizörü, bu nedenle, etkinleştirme Sohbet ölçümü takip eder ve MS doğruluğu artış olabilir iyonlar etkilenmez.
Veri toplama, karmaşık doğal yapısını korumak koşullar altında yapılır doğrulamak için, verileri parametre seti, tek bir optimize göre çeşitli deneysel ve çözüm koşulları yerine üzerinde olması tavsiye edilir:
- Sürüklenme zamanlı spektrum üzerindeki etkisi izlerken, kapiller ve koni gerilimler, kademeli bir şekilde artırın.
- Adım 1 olduğu gibi, kademeli bir şekilde Tuzak çarpışma gerilimi artırmak ve 10 V aralıklarla veri elde.
- Açılmış konformasyonlar belirlemek ve elde edilen verileri değerlendirmek için, bir pH aralığı 2-7 örnek üzerinden asetik asit ile titre edilerek elle disosiasyon protein kompleksi, neden, ve kayıt verileri (Şekil 3B).
Bölüm 3: sürüklenme saat değerleri ve kesitsel alanlar arasındaki korelasyon
Ölçülen kayma saat değerleri doğrusal Ω ile ilgili olan geleneksel sohbet ölçümleri, aksine, T-dalgası IMS sistemi, kesit alanı, bir kalibrasyon yaklaşımı ile tanımlanır. Bu nedenle, mutlak bir ölçü daha ziyade, ölçülen kayma kez ve Ω 1,13 arasında göreceli bir üstel bir ilişki oluşturulur: 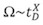
t D ölçülen kayma süresi ve X bir kalibrasyon eğrisi elde edilebilir oranda sabittir. Kalibrasyon gerçekleştirmek.bilinen Ω (geleneksel Sohbet deneyler ölçülen) iyonlarının sürüklenme kez ölçerek ed.
- Drift zaman ölçümleri denatüre proteinler bilinen çarpışma kesitler ubikuitin at sitokrom C, kalp miyoglobin at ve sığır kullanılarak kalibre edilir. Bu amaçla, 49/49/2 10 mcM, hacim oranı çözümleri, su / metanol / asetik asit (kullanılan reaktifler Tablo 3'te özetlenmiştir) hazırlanmış olmalıdır.
- Kalibratörü proteinlerin IM-MS veri elde hedef protein ya da protein kompleksi için kullanılan tam olarak aynı cihaz koşulları altında:
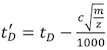 (Bölüm 1). Sohbet ayrımı ayarlarını korumak için tüm gerilimleri ve basınç değerleri aynı olmalıdır.
(Bölüm 1). Sohbet ayrımı ayarlarını korumak için tüm gerilimleri ve basınç değerleri aynı olmalıdır. - Kalibratörü proteinlerin her şarj durumu için deneysel sürüklenme zaman değeri (t D) (Bölüm 4 açıklanan) ayıklayın.
- Aşağıdaki denklemi kullanarak kalibratörü sürüklenme kez her (t D) (Tablo 2) düzeltmeler:
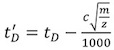 M / z gözlenen iyon şarj kitle oranı, ve c Gelişmiş Duty Cycle (EDC) gecikme katsayısı 1. Değeri genellikle 1.4 ve 1.6 arasında, alet-bağımlı. Toplama Ayarlar | | Satın Alma Kurulumu sekmesini EDC değeri Sistemi içinde gösterilir.
M / z gözlenen iyon şarj kitle oranı, ve c Gelişmiş Duty Cycle (EDC) gecikme katsayısı 1. Değeri genellikle 1.4 ve 1.6 arasında, alet-bağımlı. Toplama Ayarlar | | Satın Alma Kurulumu sekmesini EDC değeri Sistemi içinde gösterilir. - Prof. David Clemmer Kesit Veritabanı Kullanımı:
http://www.indiana.edu/ ~ clemmer / Araştırma / çapraz% 20section% 20database/Proteins/protein_cs.htm 14 iyon şarj durumu ve azaltılmış kitle kalibratörü kesit her düzeltin.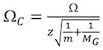
Ω C kesit düzeltilmiş Ω kesit, z iyon şarj devlet edebiyat m kalibratörü iyon moleküler ağırlığı ve M G IM arka plan gaz molekül ağırlığı ( genellikle N 2). - Konu olarak karşı (t D) (Ω C) (Şekil 4A).
- Ortaya çıkan eğrisi aşağıdaki denklemle karşılık gelir:
 Parametreler, X ve A doğrusal bir ilişki için arsa takarak elde edilebilir. X eğimi üstel oranı faktörü karşılık gelir ve uygun belirlenmiş sabit temsil eder.
Parametreler, X ve A doğrusal bir ilişki için arsa takarak elde edilebilir. X eğimi üstel oranı faktörü karşılık gelir ve uygun belirlenmiş sabit temsil eder. - Pearson denklemi kullanarak fit korelasyon katsayısı r 2, hesaplayın:
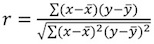 . R 2 için kabul edilebilir değerler 0.95 (Şekil 4B) daha fazladır. Daha düşük bir korelasyon katsayısı değeri nedeniyle olabilir:
. R 2 için kabul edilebilir değerler 0.95 (Şekil 4B) daha fazladır. Daha düşük bir korelasyon katsayısı değeri nedeniyle olabilir: - Eksik protein calibrants, tutmasına olanak tanır. Bu ara devletlerin heterojen montaj nedeniyle genişleyen zirve için yol açacaktır.
- Bizim tecrübelerimize göre, yaşlı bir örnek Sohbet spektrumları düşürebilir.
- Birbirine benzemeyen deneysel koşullar farklı kalibratörü proteinler için kullanılan. Bu durumda, her bir protein için veri komplo ayrı ayrı her biri 0.95 'den yüksek olmalıdır rağmen, farklı korelasyon katsayıları oluşturmanız gerekir.
- Gürültülü veri ve yanlış düzeltme ve sürüklenme zaman dağıtım merkezleme.
- Hesaplama hatası.
- 7. adımda elde edilen tespit üstel faktör, X kullanarak kalibratörü drift zaman Recorrect:
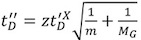
- Bir doğrulama adımı olarak, Replot Ω C vs.
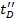 ve korelasyon katsayısı tanımlamak. 0.95 'den daha yüksek değerler beklenemez.
ve korelasyon katsayısı tanımlamak. 0.95 'den daha yüksek değerler beklenemez. - Adım 4 açıklanan prosedüre göre, hedef protein ya da protein kompleksi ölçülen kayma zaman doğru:
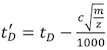
- Adım 7 tanımlanan üstel faktör, X kullanarak hedef protein / protein kompleksi sürüklenme zaman Kalibre:
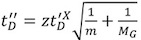
- : Adım 7 tanımlanan fit belirlenen sabit kullanarak hedef protein / protein kompleksi Ω, A, hesaplamak
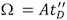 .
. - Her deneysel koşul için, 2 ila 13 Adımlar tekrarlanması gerekir. Bilinmeyen bir protein ya da protein kompleksi kesit alanı tanımlarken, her deney en az üç kez tekrarlandı ve bu üç nüsha ölçümlerin standart sapma tespit edilmesi önerilir.
Bölüm 4: sürüklenme saat değerleri tanımlama
Gerekli yazılım: MassLynx ve Driftscope (Waters).
- IM-MS spektrum Driftscope yazılımını kullanarak açın.
- Ana menüden, Vi seçinew ve işaretini kaldırın Kromatogram, Drift Zaman ve Spektrum (isteğe bağlı), m / z simgesine vs sürüklenme zamanı gösteren sadece 2B harita etkin bırakarak
- Seçenekler | | menü çubuğu, Ekran Display Editor Paneli seçin ve arka plan gürültüsünü en aza indirmek için Yoğunluk Eşik değerleri ayarlayın (çoğu durumda, bu ayar Min =% 30-40 ve Max =% 100 sayıları olarak tanımlanır).
- Ekran Seçin | 2B Harita Şiddeti Ölçeği ve üç seçenek görünecektir: Lineer Cetvel Ölçeği Giriş ve Karekök Ölçeği. Giriş Ölçeği (logaritmik verileri dönüştürmek) bir seçim yoğunluğu renk kodu sıkıştırmak ve yoğunlukları geniş bir yelpazede eşzamanlı bir görünüm sağlar (doğrusal ve kare kök seçenekleri aksine, sadece en yoğun zirveleri görünür olacak) .
- Araç çubuğu panelinden Selection Tool butonunu kullanın. Bu seçenek, farklı seçim seçenekleri etkinleştirmek ve yelpaze içinde ilgili bölge seçimi sağlayacak. En hassas araç, faiz bölgenin etrafında bir sınır çizilir, böylece tüm gereksiz verileri ve gürültü zirveleri hariç hangi yoluyla Faiz Seçim Bölgesi etkinleştirin. Aynı şekilde, Dik ve Bant Seçimi seçenekleri ilgi bölgede gereksiz zirveleri ile çevrili olmadığında yararlıdır.
- Ilgi bölge seçildikten sonra, gereksiz bilgileri kaldırmak için Geçerli Seçim komutu kabul kullanın.
- Sürüklenme zamanı bilgileri korurken, MassLynx İhracat verileri.
- MassLynx içinde kaydedilen sürüklenme zamanlı spektrum kromatogram açın ve zaman kutuları birleştirmek. Karşılık gelen kütle spektrumu otomatik olarak açılacaktır.
- Pencere boyutu ve yumuşak parametrelerin sayısı (minimum değerler kullanılarak her spektrum için özel olarak ayarlanmış olmalıdır) tanımlayan düzgünleştirilmesi işlevini uygulayın.
- Gerekirse, bazal çıkarma uygulayın.
- Merkezi spektrumu ve kütle ölçümü, protein kimlik ve kütle doğruluğu doğrulamak için.
- Her şarj durumu için, m / z aralığı birleştirir. Ilgili sürüklenme zamanlı spektrum otomatik olarak görünecektir. Pürüzsüz ve merkezi sürüklenme zaman profili, ve her tepe centroid belirterek sürüklenme zaman değerini tanımlamak.
Bölüm 5: Temsilci Sonuçlar

Şekil 1. IMS-MS ediniminin büyük ayarlanabilir parametreleri belirten Synapt HDMS enstrüman şematik. IM-MS ölçümleri için kullanılan deneysel parametreler cihazın içindeki konumlarına göre etiketlenir. Iyon demeti kırmızı renkli olup, her bölgede basınç bir renk kodu kullanılarak belirlenmiştir. Alt panel, enstrüman ve Trap ve Transfer çarpışma enerjileri yanı sıra Önyargı potansiyelini tanımlayan potansiyel farkı boyunca potansiyel gradyan göstermektedir. Okuma-sırtlarını Tüm potansiyelleri genellikle 120V Statik Ofset gerilimi başvurulur.

Şekil 2. Gβυ protein Ion mobilite varış zamanı dağılımları.
A. yüksek bir T-dalgası hız sürüklenme zaman profilinin dar bir dağıtım yol açar. Arsa, varış saatini dağıtım gösterir 16 + (kırmızı), 15 + (yeşil), 14 + (mavi), ve 13 + (kırmızı) sorumlu devletlerin yanı sıra, G βυ protein, toplam sürüklenme zaman profili (siyah) .
B. düzgün bir Gauss pik şekli ile optimize edilmiş bir kayma zamanlı spektrum. A gibi benzer renkli etiketler.
C. 'roll-over' etkisi, hareketlilik hücre çapraz iyonları için alınan yeni iyon paketlerin cihazın içine enjeksiyonlar arasındaki aralık daha yavaş oluşur. Sonuç olarak, genişletilmiş sürüklenme zaman zirve yelpazenin başında görünür. T-dalga yüksekliğinin artırılması ve T-dalgası hız ve IMS basıncı azaltarak Bu etki ortadan kaldırılabilir.
Transfer T-dalgası hız ve itici frekans kısmen eşitlenir D. Yapay 'dalgalanmalar' kaynaklanır. Bu etki, itici frekans veya Transfer T-dalgası hızı ayarlayarak üstesinden gelinebilir.
Şekil 3. Iyon aktivasyonu ve hemoglobin IM-MS spektrumları kısmi denatüre koşullarının etkisi. Tetramerik hemoglobin kompleksi m / z karşı sürüklenme zaman Arsa, 10 mM amonyum asetat sulu bir çözüm kullanarak (pH = 7.6) (A, C) ve% 0.1 asetik asit (B) eklenmesi. Veri Tuzak çarpışma enerjisi 13 V (A, B) gerilim ve 35 V (C) rağmen, her üç panel kütle spektrumu (üst yansıtılan) 4.000 m / z merkezli bir tetramerik şarj serisi ile benzer kullanılarak elde sürüklenme zaman profili (yanlarda yansıtılan) farklı (toplam sürüklenme zaman dağılımısiyah ve 16 + profil) kırmızı. B C elde elde kısmen denatüre örnek uzun sürüklenme zaman, ve gaz faz aktif iyonlar, bir dereceye kadar ortaya konma göstergesidir. Bu gözlem, ölçülen kütle sağlam bir kompleks karşılık bile, çözüm yapısı bozulmuş olduğunu göstermektedir. Sonuç olarak, deneysel koşullar dikkatli kontrol gereklidir.
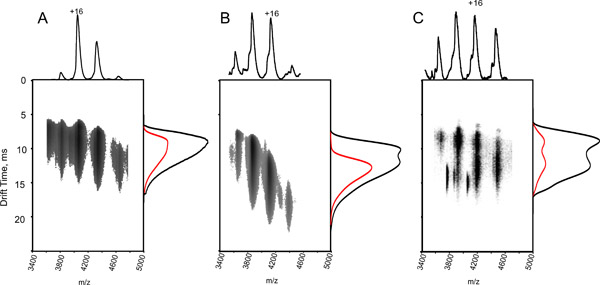
Şekil 4. Bir kalibrasyon eğrisi oluşturarak, zaman ölçümleri sürüklenme ve çarpışma kesitler ilişkili olabilir.
A. iyon şarj durumu ve azaltılmış kitle için düzeltilmiş edebiyat Ω değerlerine karşı çizilen at sitokrom C (daireler), at kalp miyoglobin (üçgen) ve (kareler) ubikuitin sığır çoklu şarj devletlerin sürüklenme saat değerleri ölçülmüştür. Ln (Ω C) = XLN (D ') + A.: uyum karşılık doğrusal bir fonksiyon verimleri Arsa üzerinde 350 m / s, T-dalgası hızı, 11 V. B statik bir dalga yüksekliği elde edilen veriler için belirlenen üstel faktörü (X), (A) uygun belirlenmiş sabit ve korelasyon katsayısı görüntülenir. Korelasyon katsayısı dağılımları bir histogram elde edilen 10 ardışık kalibrasyon deneyleri.
| Protein örnek / Teknik parametreler | GluFibrino- peptid monomer 1.6 kDa | Miyoglobin monomer 17 kDa | Hemoglobin tetramer 67 kDa | Transferrin monomer 80 kDa | GroEL 14-mer 801 kDa |
| Yedekleme basınç, mBar | 4,4 | 5,0 | 5,1 | 5,1 | 6,5 |
| Tuzak basınç, mBar | 1.6x10 -2 | 2.4x10 -2 | 2.4x10 -2 | 2.6x10 -2 | 2.8x10 -2 |
| IMS Basınç, mBar | 4.4x10 -1 | 4.4x10 -1 | 4.4x10 -1 | 4.4x10 -1 | 4.2x10 -1 |
| Örnekleme koni gerilimi, V | 46 | 80 | 80 | 80 | 118 |
| Ekstraksiyon koni gerilimi, V | 1,7 | 1 | 1 | 1 | 3 |
| Bias voltajı, V | 20 | 20 | 25 | 25 | 50 |
| Tuzak çarpışma enerjisi, V | 20 | 15 | 15 | 15 | 80 |
| Transfer çarpışma enerjisi, V | 5 | 12 | 12 | 12 | 15 |
Tablo 1 makromoleküllerin analiz etmek için kullanılan deneysel şartlar.
| Standart protein | Moleküler Kütle (m) | Ücretleri (z) | m / z | Çarpışma Kesit (2) |
| Sitokrom C | 12213 | 10 | 1222,3 | 2226 |
| 11 | 1111,3 | 2303 | ||
| 12 | 1018,8 | 2335 | ||
| 13 | 940,5 | 2391 | ||
| 14 | 873,4 | 2473 | ||
| 15 | 815,2 | 2579 | ||
| 16 | 764,3 | 2679 | ||
| 17 | 719,4 | 2723 | ||
| 18 | 679,5 | 2766 | ||
| Miyoglobin | 16952 | 11 | 1542,1 | 2942 |
| 12 | 1413,7 | 3044 | ||
| 13 | 1305,0 | 3136 | ||
| 14 | 1211,9 | 3143 | ||
| 15 | 1131,1 | 3230 | ||
| 16 | 1060,5 | 3313 | ||
| 17 | 998,2 | 3384 | ||
| 18 | 942,8 | 3489 | ||
| 19 | 893,2 | 3570 | ||
| 20 | 848,6 | 3682 | ||
| 21 | 808,2 | 3792 | ||
| 22 | 771,6 | 3815 | ||
| Ubiquitin | 8565 | 8 | 1071,6 | 1442 |
| 8 | 1071,6 | 1622 | ||
| 9 | 952,7 | 1649 | ||
| 10 | 857,5 | 1732 | ||
| 11 | 779,6 | 1802 | ||
Tablo 2 kalibratörü proteinler ve geleneksel IMS ölçümleri 14 tarafından belirlenen, çarpışma kesitleri değerleri.
| Cihazlar | Şirket | Katalog numarası |
| Synapt HDMS-32K RF jeneratörü | Waters Ltd. | |
| P-97 Flaming-Brown mikropipet çektirmesi | Sutter Aletleri | P-97 |
| Lak Sputter | Elektron Mikroskopi Bilimler | EMS550 |
| Binoküler mikroskop | Nikon | |
| Reaktifler | Şirket | Katalog Numarası |
| Amonyum Asetat | Sigma-Aldrich | Sigma, A2706 |
| CsI 99.999% | Sigma-Aldrich | Aldrich, 203.033 |
| Metanol | Sigma-Aldrich | Fluka, 34.966 |
| Asetik asit | Fisher Scientific | AC12404 |
| Atçılık miyoglobin (at kalp) | Sigma-Aldrich | M1882 |
| Atçılık sitokrom c (at kalpten) | Sigma-Aldrich | C-2506 |
| Ubikuitin Sığır (kırmızı kan hücreleri) | Sigma-Aldrich | U6253 |
| Hemoglobin | Sigma-Aldrich | H2625 |
| Gaz | Yorumlar | |
| Azot,% 99.999 saf | 8 metreküp silindir | |
| Argon,% 99.999 saf | 8.8 metreküp meterscylinder | |
Tablo 3. Reaktifler ve ekipmanları.
Tartışmalar
Burada açıklanan protokol genel şekli, altbirimlerine ambalaj ve topoloji hakkında bilgi sağlamak amacı ile, bilinmeyen bir üç boyutlu yapıya sahip protein ya da protein kompleksleri çarpışma kesiti tanımlamanıza olanak sağlar. Bu amaçla yapısal detayları için bu değerleri dönüştürmek için gerekli olan çarpışma kesiti değerleri bir kez tasvir edilmektedir. Bu işlem ek deneysel çabalarının yanı sıra, aşağıda kısaca ele alınmıştır hesaplamalı analiz, gerektirir.
Başlamak için, bilinen yapılara sahip, protein ya da protein kompleksleri analiz etmek için tavsiye edilir. Bu ölçümler metodoloji yararlı bir kalite kontrol sağlayabilir ve satın parametrelerin doğruluğu, teorik ve ölçülen Ω değerleri karşılaştırarak değerlendirmesini sağlayacaktır. Teorik kesit alanları kristal yapısı hesaplanabilir operatör ihtiyaçlarına göre izin veren açık kaynak kod düzenleme FORTRAN tabanlı yazılım MOBCAL 15,16 yazılım kullanarak koordine etmektedir. Bu tür hesaplamalarda çalışan için giriş yapısı başına yapılan hesaplamalar iteratif sayısı arttı ve koordinat dosyaları içeren çok sayıda atomların 1 kabul edilir olduğundan bu programı değiştirmek için gereklidir.
Çok bileşenli derlemeleri içinde alt birimden topolojik düzenlemeler tanımlamak için bir IM-MS stratejisi son zamanlarda 4,6 sürülmüştür. Bu yöntem, küçük parçalara protein meclislerinin disosiasyon yolların izlenmesi içerir. Bu disosiasyon meclislerinin "yapı blokları" yansıtıcı subcomplexes bir dağıtım doğurur, çözüm aşaması koşulları kontrollü ayar ile elde edilir. Ω değerleri sağlam bir kompleks ve demontaj ürünler hem de eş zamanlı ölçümü, sonra protein kompleksleri topolojik modelleri hesaplamak için kullanılan yapısal sınırlamalar üretir. Bu metodoloji altında yatan temel varsayım oluşturulan subcomplexes kendi anadili gibi teyitleri korumak ve aslında son yıllarda yapılan çalışmalarda, demontaj ürünlerin çözüm yapısını sürdürmüş olduğunu göstermiştir ve ya çözüm ya da gaz fazlarında önemli bir yeniden düzenlenmesi 4,6 oluştu.
Gaz faz protein kompleksi iyonları kuaterner yapısı atama son adım bilgisayar modelleri çarpışma kesiti değerleri donanımdır. Modelleme yaklaşımları farklı olası topolojik alt birimden düzenlemeler ve onların siliko Ω değerleri hesaplanmış ve deneysel olanlarla karşılaştırıldığında keşfetmek amacıyla istihdam edilmektedir. Şu anda sadece birkaç hesaplama yaklaşımlar altbirimden çapı 1,8 yaklasik spheretype iri taneli bir yöntem gibi kullanılır. Bütün olarak bakıldığında, bu alanda hala ilk yıllarında ve daha da geliştirilmesi, bu yaklaşımın genel ve geniş bir yelpazede kompleksleri uygulanabilir yapmak için gereklidir.
Açıklamalar
Teşekkürler
Yazarlar Sharon grup üyeleri, eleştiri ve el yazması katkıları için teşekkür ederim. Biz destek için Morasha ve Bikura Programlar, İsrail Bilim Vakfı (Grant No 1823-1807 ve 378/08), Biomembrane Araştırma Josef Cohn Minerva Merkezi, Yeni bilim adamları için Chais Aile Fellows Programı, İbrahim minnettarız Sonia Rochlin Vakfı; Wolfson Aile Charitable Trust, Helen ve Milton A. KimmelKimmelman Merkezi Biyomoleküler Yapı ve Meclis için; Shlomo ve Sabine Beirzwinsky emlak; Meil de Botton Aynsley, ve Karen Siem Reap, İngiltere.
Referanslar
- Ruotolo, B. T. Ion mobility-mass spectrometry analysis of large proteincomplexes. Nat Protoc. 3 (7), 1139-1152 (2008).
- Scarff, C. A., Thalassinos, K., Hilton, G. R., Scrivens, J. H. Travelling wave ion mobility mass spectrometry studies of protein structure: biological significance and comparison with X-ray crystallography and nuclear magnetic resonance spectroscopy measurements. Rapid Commun Mass Spectrom. 22 (20), 3297-3304 (2008).
- Smith, D. P. Deciphering drift time measurements from travelling wave ion mobility spectrometry-mass spectrometry studies. Eur J Mass Spectrom (Chichester, Eng). 15 (2), 113-130 (2009).
- Leary, J. A. Methodology for measuring conformation of solvent-disrupted protein subunits using T-WAVE ion mobility MS: an investigation into eukaryotic initiation factors. J Am Soc Mass Spectrom. 20 (9), 1699-1706 (2009).
- Lorenzen, K. Determination of stoichiometry and conformational changes in the first step of the P22 tail assembly. J Mol Biol. 379 (2), 385-396 (2008).
- Pukala, T. L. Subunit architecture of multiprotein assemblies determined using restraints from gas-phase measurements. Structure. 17 (9), 1235-1243 (2009).
- van Duijn, E. Chaperonin complexes monitored by ion mobility mass spectrometry. J Am Chem Soc. 131 (4), 1452-1459 (2009).
- Ruotolo, B. T. Evidence for macromolecular protein rings in the absence of bulk water. Science. 310 (5754), 1658-1661 (2005).
- Ruotolo, B. T., Robinson, C. V. Aspects of native proteins are retained in vacuum. Curr Opin Chem Biol. 10 (5), 402-408 (2006).
- Giles, K. Applications of a travelling wave-based radio-frequency-only stacked ring ion guide. Rapid Commun Mass Spectrom. 18 (20), 2401-2414 (2004).
- McKay, A. R., Ruotolo, B. T., Ilag, L. L., Robinson, C. V. Mass measurements of increased accuracy resolve heterogeneous populations of intact ribosomes. J Am Chem Soc. 128 (35), 11433-11442 (2006).
- Ruotolo, B. T. Ion mobility-mass spectrometry reveals long-lived, unfolded intermediates in the dissociation of protein complexes. Angew Chem Int Ed Engl. 46 (42), 8001-8004 (2007).
- Morton, V. L., Stockley, P. G., Stonehouse, N. J., Ashcroft, A. E. Insights into virus capsid assembly from non-covalent mass spectrometry. Mass Spectrom Rev. 27 (6), 575-595 (2008).
- Valentine, S. J., Counterman, A. E., Clemmer, D. E. A database of 660 peptide ion cross sections: use of intrinsic size parameters for bona fide predictions of cross sections. J Am Soc Mass Spectrom. 10 (11), 1188-1211 (1999).
- Mesleh, M. F. Structural information from ion mobility measurements: effects of the long-range potential. J Phys Chem. 100, 16082-16086 (1996).
- Shvartsburg, A. A., Jarrold, M. F. An exact hard-spheres scattering model for the mobilities of polyatomic ions. Chem Phys Lett. 261, 86-91 (1996).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır