A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
إنتاج المعدلة وراثيا القيطم المورق عن طريق تقييد أنزيم التكامل وساطة وزرع النووية
In This Article
Summary
هذا البروتوكول الفيديو يوضح طريقة لتوليد المعدلة وراثيا القيطم المورق عن طريق إدخال الجينات المحورة إلى نواة الحيوان المنوي تليها النووية الى زرع بويضة غير مخصبة.
Abstract
التكامل مستقرة من المنتجات الجينات المستنسخة في جينوم القيطم هو ضروري للتحكم في الزمان والمكان والتعبير ، والتعبير عن الجينات في مراحل لاحقة من التطور الجنيني ، وتحديد مدى القدرة على تنظيم والمروجين التعبير الجيني داخل الجنين. ويمكن استخدام بروتوكول تظاهر هنا لتنتج بكفاءة الأجنة وراثيا القيطم المورق. هذا النهج ينطوي على transgenesis ثلاثة أجزاء : 1. يتم عزل الحيوانات المنوية من نوى عاشرا الكبار خصية المورق عن طريق العلاج مع lysolecithin التي permeabilizes غشاء البلازما المنوية. 2. مستعدة استخراج البيض بواسطة الطرد المركزي بسرعة منخفضة ، إضافة إلى الكالسيوم يؤدي إلى التقدم إلى استخراج الطور البيني من دورة الخلية ، والطرد المركزي بسرعة عالية لعزل الطور البيني العصارة الخلوية. 3. يتم الجمع بين النواة واستخراج الحمض النووي مع البلازميد الخطي لتكون كما قدم التحوير وكمية صغيرة من انزيم التقييد : زرع النووية. خلال رد فعل قصير ، استخراج البيض decondenses جزئيا لونين الحيوانات المنوية وانزيم يكسر قيود يولد الكروموسومات التي تشجع على إعادة التركيب من التحوير في جينوم. ثم يتم زرع نواة الحيوان المنوي في علاج بويضة غير مخصبة. التكامل بين التحوير وعادة ما يحدث قبل الانقسام والجنينية الأولى من نوعها أن الأجنة الناتجة ليست خيالية. ويمكن تحليل هذه الأجنة دون أي حاجة لتربية للجيل القادم ، والسماح لجيل فعال وسريع من الأجنة وراثيا للتحليلات المروج وظيفة الجين. عاشرا الكبار المورق الناتجة عن هذا الإجراء نشر أيضا عن طريق التحوير germline ويمكن استخدامها لتوليد حيوانات معدلة وراثيا خطوط لأغراض متعددة.
Protocol
وقد وصفت في البداية نسخ معدلة من هذا النهج transgenesis في 1 و 2.
A. إعداد الحيوانات المنوية النوى
ويتم تكييف هذا الأسلوب من إعداد نواة موراي 3 ، ولكن تم حذف مثبطات الأنزيم البروتيني لأنها تتداخل مع التطور اللاحق للزرع البويضات مع الحيوانات المنوية النوى. وتجمد Aliquots عند درجة -80 ويمكن أن تستخدم لزرع ما يقرب من 6 أشهر.
وينبغي إعداد جميع الحلول ووضعها على الجليد قبل بدء التحضير.
- تخدير 1-2 الذكور البالغين X. المورق عن طريق الغمر في Tricaine مدة لا تقل عن 20 دقيقة تليها بخع ، وإزالة الخصيتين.
- لفة الخصيتين على منشفة ورقية لإزالة الدم ، والأوعية الدموية والدهون في الجسم ، وغسل منهم لفترة وجيزة في طبق بتري 60 ملم تحتوي على 1XMMR ، وإزالة أي قطعة إضافية من الدهون في الجسم. الحرص على عدم ثقب الخصيتين ، حيث أن هذه النشرات الحيوانات المنوية.
- نقل الخصيتين إلى طبق بيتري الجافة من عيار 60 ملم والخصيتين أضعف بالملقط حتى لا توجد أجزاء مرئية. وينبغي أن يتم النقع على أكمل وجه ممكن للحصول على عوائد عالية من النوى.
- إضافة 2mLs الباردة العازلة إعداد النووي (NPB ؛ 1X من المخزون) إلى أضعف وماصة بلطف صعودا وهبوطا.
- بخ أضعف من خلال حوالي 4 سمك القماش القطني على القمع ، وجمع في أنبوب 15 مل (مثل فالكون 2059) ؛ شطف الطبق مع 8mLs من NPB ووضع هذا شطف من خلال القماش القطني ، وجمع في الأنبوب. بأيد القفاز ضغط على القماش القطني لجمع السائل المتبقي في الأنبوب.
- بيليه الحيوانات المنوية عند 3000 دورة في الدقيقة لمدة 10 دقيقة. في 4 درجات مئوية في الدوار الدلو المتأرجح (1480g على سبيل المثال في الدوار HB - 4 Sorvall أو ما يعادلها) مع محولات أنبوب المناسب. صب طاف ؛ إضافة إلى NPB 8mL هذا الأنبوب وماصة صعودا وهبوطا مع 10 مل ماصة لتكوير resuspend ؛ سبين أسفل مرة أخرى كما طاف أعلاه وصب. يوازن 1mL من NPB إلى درجة حرارة الغرفة خلال زيادة ونقصان.
- Resuspend بيليه في غرفة 1mL NPB درجة الحرارة باستخدام 1 مل pipetteman الطرف ، إضافة 50μl من lysolecithin 10mg/mL الطازجة ، مزيج بلطف ، واحتضان لمدة 5 دقائق. في درجة حرارة الغرفة.
- إضافة 10 مل BSA 1XNPB الباردة +3 ٪ في أنبوب لمنع رد الفعل lysolecithin ، مزيج بلطف ، وتدور باستمرار لمدة 10 دقيقة في 3000 دورة في الدقيقة في الدوار الدلو المتأرجح. صب طاف. الكرية lysolecithin المعالجة ينبغي أن ننظر قليلا أكثر شفافة (أبيض أقل غموضا) مما كان عليه قبل العلاج lysolecithin.
- صب المزيج وطاف resuspend بيليه في 5 مل BSA NPB الباردة +0.3 ٪ ، بلطف مع ماصة 10 مل وتدور باستمرار لمدة 10 دقيقة في 3000rpm على النحو الوارد أعلاه.
- صب وطاف بيليه resuspend في 500μl العازلة للتخزين ونقل الحيوانات المنوية إلى أنبوب مل 1.5. هذا هو المخزون الخاص بك النوى الآن. متجر على الجليد أثناء التحقق من العائد من النوى.
- للتحقق من محصول النوى ، ومكان 98 ميكرولتر من العازلة تخفيف الحيوانات المنوية (SDB) ، 1 ميكرولتر من المخزون النووي و1μl من 1:100 التخفيف من المخزون هويشت في أنبوب إيبندورف 1.5mL. مزيج المخزون النووي بشكل جيد للغاية باستخدام أسلاك شائكة قص طرف ماصة (أو كبيرة فتح) قبل إزالة ميكرولتر 1. مزيج SDB المخفف / هويشت / النوى بشكل جيد للغاية ويسمح لكمية صغيرة في التدفق الى داخل القاعة لعدادة الكريات نويباور تحسن عمل شعري. عدد النوى في مربع من عدادة الكريات تحت المجهر المركب. من الذكور ، ويجب الحصول على التهم ما لا يقل عن 100-200 (X10 4 خلايا / مل) لهذا التخفيف 1:100 من المخزون لتركيز الأسهم مخفف من الخلايا 5 1 - 2X10 / ميكرولتر. إذا كان لديك مخزون أقل تركيزا ، والسماح للتسوية نواة لعدة ساعات ، وإزالة بعض طاف ، والفرز. ترك نواة في 4 درجات مئوية خلال الليل للسماح لاختراق الجلسرين لتحسين الحفظ بالتبريد ؛ المزيج ثم المخزون النووي بشكل جيد مع تلميح ماصة فوهة واسعة ، وإعداد aliquots 20μl ، والتجميد في النيتروجين السائل.
باء إعداد مستخلصات سرعة عالية
ويتم تكييف هذا الأسلوب من موراي (3) وينتج استخراج عصاري خلوي الطور البيني التي من شأنها تعزيز تورم وجزئية decondensation لونين من نواة الحيوان المنوي المضافة. ويمكن استخراج المجمدة في aliquots صغيرة في -80 درجة مئوية وإذابة قبل الاستخدام.
- 3-5 أيام قبل حقن HCG ، رئيس 8-12 البالغات X. المورق من خلال ضخ 50 يو PMSG في كيس الليمفاوية الظهرية. في المساء قبل إعداد استخراج ، وضخ كل ضفدع مع 500 وحدة قوات حرس السواحل الهايتية ومكان الضفادع 2 / حاوية في 1XMMR 2 لتر. منذ عام واحد مع الضفدع lysing أو تفعيل البيض يمكن أن ينال من إعداد استخراج ، فإنه من المستحسن أن الضفادع إلى أزواج منفصلة عن الإباضة.
- في صباح اليوم التالي ، وإعداد والبرد كل الحلول قبل بدء التحضير. بلطف ، وطرد البيض يدويا من كل ضفدع كبير في بeakers تحتوي 1X MMR. شاشة البيض من كل حاوية ، وحذف أي دفعات من البيض مع علامات lysing ، أو التبقيع التنشيط (المرئية التي تصبغ انكماش في نصف الكرة الحيواني) من هذا الإجراء. جمع البيض متواصلة مع تصبغ حتى. ويمكن أيضا أن تكون جيدة البيض التي تم جمعها من MMR 1X في الدلاء الضفادع. وينبغي أن إجمالي حجم البيض يكون> 100 مل من الإناث 8-12.
- دي هلام البيض. للقيام بذلك ، إزالة MMR قدر الإمكان ، إضافة كمية صغيرة من محلول السيستين ، ودوامة البيض. استبدال حل السيستين جديدة عدة مرات خلال اجتثاث jellying. دي هلام كل دفعة من البيض بشكل منفصل وتجاهل دفعات مع الكسر أو تنشيط البويضة. الجمع بين ما تبقى من البيض.
- غسل البيض أربع مرات في 35 مل من ~ العازلة استخراج (الميزانية) ، ثم مرتين في 25 مل من CSF - الخارجة مع مثبطات الأنزيم البروتيني.
- لحزمة البيض : البيض في نقل أنابيب ultraclear بيكمان. السماح للبيض لتسوية. إزالة أكبر قدر - CSF الخارجة ممكن. الطرد المركزي البيض باستخدام SW بيكمان 40 تي الدوار (أو الدوار مماثلة) في 1000 دورة في الدقيقة (150g) لثوانى 60 ~ في 4 درجات مئوية. الحل إزالة الفائض من الجزء العلوي من البيض معبأة.
- لسحق البيض وتوليد هيولي استخراج : الطرد المركزي البيض في 10000 دورة في الدقيقة (16،000 ز) لمدة 10 دقيقة على 4 درجات مئوية. ينبغي للبيض منفصلة في ثلاث طبقات : دهن (العلوي) ، السيتوبلازم (في الوسط) ، وصفار (القاع). جمع طبقة هيولي من كل أنبوب مع إبرة عيار 18 عن طريق إدخال الإبرة من خلال أنبوب في قاعدة طبقة هيولي. نقل السيتوبلازم لأنبوب جديد بيكمان ultraclear على الجليد.
- إضافة إلى مثبطات الأنزيم البروتيني السيتوبلازم معزولة إلى التركيز النهائي لل1X. Recentrifuge السيتوبلازم على 16000 ز لمدة 10 دقيقة على 4 درجات مئوية. جمع السيتوبلازم توضيح كما هو موضح أعلاه. نتوقع الحصول على ،75-1 السيتوبلازم مل / الضفادع.
- إضافة 1 / 20 من حجم استخراج من خليط الطاقة في العينة. نقل السيتوبلازم في أنابيب البولي ذات الجدران السميكة للنابذة فائقة السرعة بيكمان TL - 100. عقد أنابيب حوالي 3 مل لكل وينبغي أن لا يقل عن نصف الكامل.
- إضافة 1 م 2 CaCl إلى كل أنبوب إلى تركيز النهائي من 0.4 مم. احتضان الأنابيب لمدة 15 دقيقة في درجة حرارة الغرفة. هذا يعطل CSF ويدفع إلى استخراج الطور البيني.
- التوازن أنابيب الطرد المركزي ومنها في نابذة فائقة السرعة بيكمان TL - 100 - 100.3 باستخدام TLA الدوار في 70000 دورة في الدقيقة (200000 ز) مقابل 1.5 ساعة عند 4 درجات مئوية. والسيتوبلازم يجزئ إلى أربع طبقات ، من أعلى إلى أسفل : الدهون ، العصارة الخلوية ، غشاء / الميتوكوندريا ، والجليكوجين / ريبوسوم.
- إزالة الطبقة عصاري خلوي من كل أنبوب (~ 1 مل إذا تم تحميلها 2-3 مل في أنبوب) عن طريق إدراج حقنة في الجزء العلوي من أنبوب من خلال طبقة الدهون. نقل جزء عصاري خلوي لأنابيب جديدة وrecentrifuge العينات في 70000 دورة في الدقيقة (200000 ز) لمدة 20 دقيقة على 4 درجات مئوية.
- قسامة وطاف في 25 ميكرولتر aliquots في 0.5 مل من الأنابيب. سريع تجميد aliquots في النيتروجين السائل وتخزينه في -80 درجة مئوية حتى الاستخدام. لتحديد ما إذا كان استخراج فعال ، يمكن حضنت نواة الحيوان المنوي في استخراج وملطخة هويشت لتحديد ما إذا نوى تضخم بشكل واضح (رشاقته وإطالة) في غضون 10 دقيقة من إضافة في درجة حرارة الغرفة.
رد فعل جيم Transgenesis ونقل النووي
هام : تأكد من أن الحلول والمعدات والضفادع كلها جاهزة قبل بداية رد فعل. بمجرد أن تبدأ ، يجب المضي قدما في التفاعل باستخدام جدول زمني تقريبي هو موضح أدناه ، لأن العديد من مكونات لا تبقى ثابتة لمدة 30 دقيقة>. في حين يتم الاحتفاظ الأسهم نواة الحيوان المنوي على الجليد ، يجب أن تبقى ردود الفعل transgenesis (سواء مخففة ومركزة) في درجة حرارة الغرفة.
- إناث الضفادع الوزراء. في المساء قبل transgenesis ، وضخ عدة (3-5) الضفدع الإناث البالغات مع 800 وحدة HCG في كيس الليمفاوية الظهرية للحصول على البيض الطازج وضعت بداية في اليوم التالي.
- في يوم من إجراء transgenesis ، وإعداد أو تقديمهم إلى درجة حرارة الحلول اللازمة لtransgenesis :
- الطازجة السيستين (2.5 ٪ في 1XMMR ، pH8.0). ستحتاج عدة مئات من ملليلتر لاستخدامها في ذلك اليوم.
- 0.2XMMR Ficoll +6 ٪ للأطباق وزرع الأجنة وراثيا الانتعاش و0.2XMMR +100 ميكروغرام / مل جنتاميسين (بدون Ficoll) لجمع الأجنة. وينبغي أن الحلول لن تكون أكثر دفئا من 18-21 يجب رفع درجة مئوية ، والأجنة وراثيا من خلال الانشقاقات المبكرة في درجات حرارة تتراوح بين 16 و 21 درجة مئوية ، لأن ارتفاع درجات الحرارة يؤثر سلبا على كل من تواتر transgenesis والتطور الجنيني.
- ذوبان الجليد ويوازن aliquots إلى درجة حرارة الغرفة المجمدة للSDB (الحيوانات المنوية العازلة التخفيف) لزرع اليوم ، ذوبان الجليد في استخراج عالية السرعة والمكان على الجليد ، وإعداد 100mM MgCl 2 الحل.
- الخروج عشرأطباق ه حقن agarose وملء مع MMR / Ficoll الحل ، وإعداد وقبل تشغيل مضخة التسريب لتحقيق الاستقرار في التدفق.
- تأكد من أن الضفادع الإناث وضع البيض وذات جودة عالية. على النحو الأمثل ، ينبغي أن يكون لها قشرة البيض شركة (شكل عقد بعد jellying دي).
- إعداد رد فعل transgenesis :
- بلطف شديد (باستخدام ماصة غيض قص) خلط الأوراق المالية والجمع بين النوى في أنبوب إيبندورف 1.5mL :
4μl النوى (~ 4 - 8X10 نوى 5)
خطي 2μl البلازميد (100ng/μl)
احتضان 5 دقائق في درجة حرارة الغرفة. - بينما يسير الحضانة ، تمييع 0.5μl من انزيم التقييد في 4.5μl O 2 H وإضافة 1μl إنزيم المخفف ل18μl من SDB ، 2μl من MgCl 2 و 2μl استخراج عالية السرعة. إضافة إلى هذا الخليط التفاعل النوى ، البلازميد. احتضان 10 دقيقة ليرتفع أكثر من النوى.
- خلال هذه الحضانة ، أزمة البيض 2-3 الضفادع ودي هلام في حل السيستين. غسلها جيدا (5X) مع 1XMMR ، واستخدام ماصة واسعة تحمل لنقل البيض dejellied 400-500 على كل طبق بشكل جيد يحتوي على agarose 0.2X MMR Ficoll +4 ٪. هذا يستغرق عادة حوالي 10 دقيقة ، وذلك مرة واحدة على استعداد أطباق البيض وعادة ما يكون رد الفعل هو على استعداد لتخفيف.
- حوالي 15-20 دقيقة بعد بدء خطوة ، مزيج بلطف رد الفعل (نوى / استخراج / DNA) مع طرف قص وإضافة إلى 150 حول 5μl SDB ميكرولتر في درجة حرارة الغرفة. النوى في هذا المزيج المخفف في حالة مستقرة لمدة 1hr. ، في حين أنها لا تحتفظ القدرة زرع طالما عندما غادرت في خليط المركزة.
- بلطف شديد (باستخدام ماصة غيض قص) خلط الأوراق المالية والجمع بين النوى في أنبوب إيبندورف 1.5mL :
- تحميل الإبرة : مزيج من رد فعل مخفف أعد أعلاه بلطف شديد مع طرف فوهة ماصة واسعة ، ثم تحميل الإبرة على وجه السرعة ، كما نوى سوف يستقر بسرعة في أنبوب. لإبرة backload ، ضع قطعة من أنبوب Tygon غرامة على نهاية الحافة ماصة 200μl قص. رسم الحل في تلميح ماصة ، ثم إرفاق أنابيب إلى الإبرة والسماح للحل لدخول إبرة عن طريق الجاذبية أو محبطة بلطف الغطاس ماصة.
- إبرة تعلق على ضخ أنابيب وتبدأ عملية زرع النوى. وينبغي أن يكون سريعا الحقن ، الضحلة وعمودي تقريبا غشاء البلازما البويضة لتجنب إحداث أضرار. بمعدل تدفق اقترح (10nl/sec) ، والحفاظ على ابرة في البويضة لثوان 0.5 ~. يجب إكمال 1-2 الاطباق زرع في غضون 20-30 دقيقة.
بعد الحقن ، وترك الأطباق في 16-20 درجة مئوية حتى الأجنة وصلت إلى مرحلة الخلية 4-8. فرز الأجنة الشق بعيدا عن جيرانهم غير الشق من خلال نقل (مع ماصة باستير الزجاج مع تلميح تقريبا قطرها نفس البويضة) إلى صحن كبير جديدة من Ficoll 0.2XMMR +4 ٪. تقسيم الأجنة الشق إلى مجموعات صغيرة (10-15 الأجنة / بئر لوحة 6 أيضا) والثقافة في 0.2XMMR (لا Ficoll) +100 ميكروغرام / مل الجنتاميسين من خلال التنمية في وقت مبكر. يجب فحص الأجنة أثناء تكون المعيدة مع أي أجنة الموت إزالتها فورا وتغيير وسائل الإعلام حسب الحاجة.
المشاكل :
- تم حظر الإبرة : تدفق الحل من الإبرة ينبغي ظهر بوضوح خلال عمليات الزرع. إذا كانت إبرة يصبح سدت الجسيمات مرئية ، وتغيير الإبر أو محاولة لازالة الانقاض من قبل طرف لقطة مع ملقط ودفع حل عن طريق الإبرة.
- لم يتم الحصول على البيض الشق : تأكد من أن التخفيفات نوى حجم الحيوانات المنوية والحقن المناسبة وأنه لا يتم حظر الإبرة خلال الزرع. إذا كان حجم حقن عالية جدا ، قد لا يلتصق البيض أيضا ، وبدلا من اظهار تصبغ مشوه أو أضرار.
- العديد من الأجنة تموت أثناء تكون المعيدة. ويمكن لعوامل عدة تعزز بقاء الجنين :
- رعاية مع نوى خلال إعداد والتفاعل الأنزيمي. نوى Decondensed هشة وتحتاج إلى زرع باستخدام الجدول الزمني المذكور أعلاه. لا مكان لهم على الجليد.
- الأضرار التي لحقت الكروموسومات نواة الحيوان المنوي أثناء عملية التفاعل ونقل النووي انزيم يؤثر على وتيرة transgenesis والتطور الطبيعي للأجنة. الضرر الكروموسومات إلى نوى يعزز كفاءة transgenesis بل يؤثر سلبا على البقاء على قيد الحياة / التطور الطبيعي. ويمكن خفض أو حذف انزيم التقييد خلال حضانة الانزيم تعزيز معدل النمو الطبيعي ولكن قد يقلل تواتر transgenesis البلازميد أو عدد النسخ التي أدخلت على جينوم الجنين.
- إذا الأريمة الراحل من خلال أجنة المعيدة تظهر علامات اللون أو موت الخلية فإنه من الممكن أيضا أن يستخدم كاشف للزرع وسامة بالنسبة للبيض. بالإضافة إلى ذلك ، إذا كان البيضق لم يكن لديك قشرة ثابتة ، فإنها قد تخضع لتخارج المعيدة وتفشل في توليد الطبيعي بعد المعيدة الأجنة.
- عدد الأجنة معربا عن التحوير منخفضة. زيادة كمية الانزيم قيود.
ممثل نتائج الأجنة وراثيا
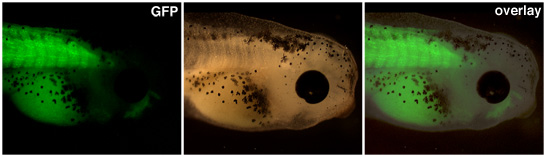
وينبغي أن تثار الأجنة وراثيا الناتجة عن نقل المواد النووية حتى التعبير عن مروج للاهتمام واضح. في الشكل 1 أعلاه ، مروج أكتين العضلات محركات التعبير عن بروتين الفلورية الخضراء في somites هذا الشرغوف المعدلة وراثيا.
Discussion
ليتم اختبارها كل بناء المعدلة وراثيا ، ونحن عموما زرع النوى في 500-1000 البيض ، وفي هذا النطاق ، ونحن يمكن أن تولد الأجنة وراثيا التعبير عن ما يصل الى 10 بنيات مختلفة في اليوم الواحد ، اعتمادا على كيفية العديد من الإناث التي يسببها لوضع البيض. هذه زرع حوالي ثلث يلتصق البيض ?...
Disclosures
وقد أجريت تجارب على الحيوانات وفقا للمبادئ التوجيهية واللوائح التي وضعتها لرعاية الحيوان واستخدام اللجنة في جامعة واشنطن في كلية الطب.
Acknowledgements
يتم توفير التمويل اللازم لعملنا من قبل المعاهد الوطنية للصحة ، ومارس من الدايمات ، والجمعية الأميركية للسرطان.
Materials
A. إعداد الحيوانات المنوية النوى
الكواشف :
- 1X MMR (2mm وCaCl 2 ، HEPES 5mm ، و pH7.5 ، 2mm وبوكل ، 1MM MgCl 2 ، كلوريد الصوديوم 100mM).
- 0.1 ٪ Tricaine Methanesulfonate (MS222 ، إيثيل استر حمض أمينوبنزويك ، سيغما A - 5040) ، 0.1 ٪ بيكربونات الصوديوم. تذوب في الماء.
- 2X زبدة التحضير النووية (NPB). في اليوم من إعداد نواة الحيوان المنوي ، يشكلون ما نسبته 30 مل من NPB 2X من aliquots للحلول تخزين الأوراق المالية المجمدة : 500 ملي السكروز (1.5 M الأسهم) ، و 30 HEPES ملم (1M الأسهم ؛ عاير مع KOH بحيث الرقم الهيدروجيني 7.7 هو في 15 ملم) ، 1 trihydrochloride سبيرمدين ملم (سيغما S - 2501 ، و 10 سهم ملم) ، 0.4 tetrahydrochloride السبيرمين ملم (سيغما S - 1141 ، و 10 سهم ملم) ، 2 مم dithiothreitol (سيغما D - 0632 و 100 سهم ملم) ، 2 مم EDTA (500 ملي EDTA ، ودرجة الحموضة 8.0).
- استخدام 2XNPB لجعل أ 1X 30ml NPB ، B. 10ML 1XNPB +3 ٪ BSA (V كسر ، سيغما A - 7906) ، ج. 5ml 1XNPB BSA +0.3 ٪.
- Lysolecithin : 100 ميكرولتر من 10 ملغ / مل - L - α - lyso الليسيثين ، صفار البيض (Calbiochem ، 440154) ؛ تذوب في درجة حرارة الغرفة قبل الاستخدام. تخزين صلبة الأسهم عند 20 درجة مئوية. تجاهل مسحوق الأوراق المالية إذا أصبح لزجة.
- ألبومين المصل البقري (BSA) : 10 ٪ (W / V) BSA (V كسر ، سيغما A - 7906) يشكلون 5 مل في الماء في اليوم من إعداد نواة الحيوان المنوي.
- تخزين الحيوانات المنوية العازلة (1ml) 1X NPB ، الجلسرين 30 ٪ ، 0.3 ٪ BSA.
- الحيوانات المنوية تخفيف العازلة : 250 السكروز مم ، 75 مم بوكل ، 0.5 trihydrochloride سبيرمدين مم ، 0.2 tetrahydrochloride السبيرمين ملم. يعاير إلى الرقم الهيدروجيني 7،3-7،5 وتخزين 0،5-1 aliquots مل عند 20 درجة مئوية.
- هويشت رقم 33342 (سيغما B - 2261) : 10 ملغ / مل الأسهم في DH 2 O ، وتخزينها في ضوء ضيق سفينة عند 20 درجة مئوية.
المعدات :
- يتأرجح الدوار دلو وأجهزة الطرد المركزي
- القماش الجبني
- أدوات تشريح (مقص وملقط)
- مضان المجهر
- قمع
- قفازات
- عدادة الكريات
- الإبر (26 مقياس)
- ورقة المناشف
- أطباق بتري (60 ملم)
- ماصات
- البلاستيك (5 و 10 مل)
- Pipetman نصائح (1 مل و200μl)
- محاقن (1 مل)
- أنابيب (14 مل ؛ فالكون 2059)
- أنابيب
- microcentrifuge (1.5 مل)
باء إعداد مستخلصات سرعة عالية
الكواشف :
- 1X مارك والتعديل رينغر (MMR) : 100 مم كلوريد الصوديوم ، 2 مم بوكل ، 1 ملم MgCl 2 ، 2 مم CaCl 2 ، 5 ملي HEPES ، ودرجة الحموضة 7.5. إعداد المخزون 10X ، وضبط درجة الحموضة مع هيدروكسيد الصوديوم إلى 7.5.
- 20X العازلة استخراج (الميزانية) الأسهم الملح : 2 م بوكل ، 20 ملي MgCl 2 ، 2 مم CaCl 2 ، فلتر تعقيم وتخزينها في 4 درجات مئوية.
- استخراج العازلة (الخارجة ؛ الطازجة وتخزينها على الجليد) : 1X الأملاح الخارجة ، 50 ملي السكروز ، HEPES 10MM (1 M الأسهم ، مع معاير KOH بحيث الرقم الهيدروجيني هو 7.7 عندما تضعف إلى 15 مم ؛ فلتر تعقيم ، وتخزينها في aliquots عند 20 درجة مئوية). تعد حوالي 100 مل.
- تتكون في 1X الأملاح الخارجة قبل الاستخدام ومعاير لدرجة الحموضة 7.8 مع هيدروكسيد الصوديوم : 2 ٪ (W / V) L - 1 - سيستين هيدروكلوريد هيدرات. تعد حوالي 300 مل.
- CSF - الخارجة : 1X الأملاح الخارجة ، 1 ملم MgCl 2 (بالإضافة إلى MgCl 2 موجودة في الأملاح الخارجة ؛ التركيز النهائي 2 مم) ، HEPES 10 مم ، ودرجة الحموضة 7.7 ، 50 السكروز ملم ، 5 ملم EGTA ، ودرجة الحموضة 7.7. تجهيز 50 مل.
- مثبطات الأنزيم البروتيني : خليط من leupeptin ، chymostatin وpepstatin ، كل حل لتركيز النهائي من 10 ملغ / مل في سلفوكسيد ثنائي ميثيل (DMSO). في مخزن صغير في aliquots 20 درجة مئوية.
- 1 م 2 CaCl.
- مزيج الطاقة : 150 ملي فوسفات الكرياتين ، 20 ملي ATP ، 20 ملي MgCl 2.
- فرس حامل المصل موجهة الغدد التناسلية (PMSG) : 100 U / مل PMSG (PG600 ® ، إنترفيت ، شركة ، 021825). تذوب في المياه وتخزينها على 20 درجة مئوية.
- الإنسان gonadotropin المشيمي (HCG) : 1000 U / مل HCG (CHORULON ® ، إنترفيت ، شركة ، 057176). تذوب في المياه وتخزينها في 4 درجة مئوية.
المعدات :
- القيطم المورق الإناث
- الإبر (18 و قياس 26)
- ماصة باستير
- تتحمل واسعة
- محاقن (1 مل)
- مواسير microcentrifuge (0.5 مل)
- أنابيب البولي جدار سميك (بيكمان ، 349622)
- مواسير ultraclear (14 × 95 مم ؛ بيكمان ، 344060)
- نابذة فائقة السرعة والدوارات (على سبيل المثال ، بيكمان TL - 100 مع تي الدوارات 40 SW وTLA 100.3)
- الأكواب لجمع البيض
- الدلاء أو حاويات لعقد الضفادع الإناث (على سبيل المثال ، 4 - L الأكواب البلاستيكية مع أغطية عيون).
جيم النووية الزرع.
الكواشف :
- 2.5 ٪ في agarose 0.1XMMR (لصنع أطباق الحقن)
- 2.5 ٪ سيستين في 1XMMR، pH8.0 ، الذي أعد في اليوم للاستخدام
- Ficoll
- 10 ملغ / مل الجنتاميسين (الأسهم 1000X)
- ارتفاع سرعة استخراج البيض (انظر أعلاه)
- 100 MgCl 2
- 10X MMR (انظر أعلاه)
- انزيم التقييد (مثل NOTI من نيو انغلاند Biolabs)
- الحيوانات المنوية تخفيف العازلة (SDB ، انظر أعلاه) ، ونواة الحيوان المنوي (انظر أعلاه)
- الإنسان gonadotropin المشيمي (HCG) على النحو الوارد أعلاه
- الزيوت المعدنية (سيغما ، M8410)
- خطي البلازميد أن قدم مثل التحوير : إعداد خطي البلازميد بتركيز حوالي 100 نانوغرام / ميكرولتر في العقيمة ، nuclease خالية من المياه (تريس ونتجنب EDTA تحتوي على مخازن ، والتي هي سامة إلى حد ما إلى الأجنة). الانزيم تقييد استخدامها ليصبح خطي على البلازميد ليس من الضروري أن يكون هو نفسه واحد المستخدمة في نقل ردود الفعل النووية. نستخدم عادة NOTI لجميع ردود الفعل ، بغض النظر عن ما هو خطي مع البلازميد. بعض معايرة الإنزيم المستخدم في تخفيف رد فعل قد يكون من الضروري ، كما يمكن للانزيم يسبب الكثير من الآثار السلبية على التنمية في مرحلة ما بعد المعيدة. يمكن تنقية البلازميد في عدة طرق مختلفة : نحن عادة استخدام تنقية Qiagen PCR Qiaquick عدة وفقا لتوجيهات مصنعين ؛ تنقية فرقة واحدة من مادة هلامية ليست ضرورية. إذا تتم تنقيته البلازميد باستخدام الفينول / كلوروفورم الاستخراج وهطول الأمطار الإيثانول ، تكون معينة لإزالة جميع آثار المواد العضوية والايثانول.
المعدات :
أطباق Agarose للحقن : في طبق بتري البلاستيك 60 ملم ، وإرساء 35mmX35mm صغيرة تزن قارب على المنصهر agarose 2.5 ٪ في 0.1XMMR المياه لإنشاء الاكتئاب مع القاع agarose المغلفة لملء مع البيض. مرة واحدة agarose وشددت ، في التفاف parafilm وتخزينها في 4 درجات مئوية حتى الاستخدام. جعل الأطباق 2-3 مقدما عن كل ردود الفعل المعدلة وراثيا كنت تخطط للقيام به.
مضخة التسريب : نحن نستخدم مضخة حقن حقنة واحدة من جهاز هارفارد ، ومجهزة حقنة سم 3 / إبرة مليئة الزيوت المعدنية (سيغما M - 8410). كليلة رأس إبرة حقنة (لمنعها من ثقب الأنبوب) وإرفاق أنابيب tygon الغرامة. تشغيل المضخة في 10nl/sec ~ ، وهذا يفترض أن الوقت الإبرة في كل واحدة منها لن يكون هناك أكثر من 1 ثانية. وينبغي تشغيل المضخة قبل لعدة دقائق قبل انطلاق لtransgenesis اليوم لأؤكد أن المكبس لتدفق الحقنة مع مكبس وهذا التدفق المطرد إيجابية من النفط من الأنبوب يحدث.
الإبر لنقل المواد النووية. باستخدام مجتذب micropipette ، وتوليد الإبر مع نصائح وطويلة المنحدرة. هذه القصاصة مع forcep تحت المجهر تشريح مجهزة ميكرومتر العين للحصول على 80 ميكرون ~ فتح مع شكل مشطوف.
معدات أخرى : القيطم المورق الإناث ، stereomicroscope ، حاضنة ، micromanipulator ، microinjection مجتذب الإبرة (على سبيل المثال النموذجي P - 87 ، سوتر) ، والإبر محقنة (26 مقياس) ، والإبر microinjection الزجاج ، والعين لقطة ميكرومتر معايرة من النصائح إبرة microinjection 80μm إلى قطرها ، أطباق بتري ، وزن الزوارق 35mm ، Tygon أنابيب (ID = 1 / 32 بوصة ، OD = 3 / 32 بوصة)
References
- Kroll, K. L., Amaya, E. Transgenic Xenopus embryos from sperm nuclear transplantations reveal FGF signaling requirements during gastrulation. Development. 122, 3173-3183 (1996).
- Amaya, E., Kroll, K. L. A method for generating transgenic frog embryos. Methods Mol Biol. 97, 393-414 (1999).
- Murray, A. W. Cell cycle extracts. Methods Cell Biol. 36, 581-605 (1991).
- Hartley, K. O., Hardcastle, Z., Friday, R. V., Amaya, E., Papalopulu, N. Transgenic Xenopus embryos reveal that anterior neural development requires continued suppression of BMP signaling after gastrulation. Developmental Biology. 238, 168-184 (2001).
- Karaulanov, E., Knöchel, W., Niehrs, C. Transcriptional regulation of BMP4 synexpression in transgenic Xenopus. EMBO J. 23, 844-856 (2004).
- Ogino, H., Fisher, M., Grainger, R. M. Convergence of a head-field selector Otx2 and Notch signaling: a mechanism for lens specification. Development. 135, 249-2458 (2008).
- Taylor, J. J., Wang, T., Kroll, K. L. Tcf- and Vent-binding sites regulate neural-specific geminin expression in the gastrula embryo. Developmental Biology. 289, 494-506 (2006).
- Marsh-Armstrong, N., Huang, H., Berry, D. L., Brown, D. D. Germ-line transmission of transgenes in Xenopus laevis. Proceedings of the National Academy of Sciences of the United States of America. 96, 14389-14393 (1999).
- Offield, M. F., Hirsch, N., Grainger, R. M. The development of Xenopus tropicalis transgenic lines and their use in studying lens developmental timing in living embryos. Development. 127, 1789-1797 (2000).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved