Zum Anzeigen dieser Inhalte ist ein JoVE-Abonnement erforderlich. Melden Sie sich an oder starten Sie Ihre kostenlose Testversion.
Method Article
Herstellung transgener Xenopus laevis Durch Restriktionsenzym-vermittelte Integration und Reaktorsicherheit Transplantation
In diesem Artikel
Zusammenfassung
Dieses Video-Protokoll beschreibt eine Methode zur Herstellung transgener Xenopus laevis Durch die Einführung von Transgenen in Spermakerne durch nukleare Transplantation in unbefruchteten Eiern gefolgt.
Zusammenfassung
Stabile Integration der klonierten Genprodukte in die Xenopus Genom ist notwendig, um die Zeit und den Ort des Ausdrucks kontrollieren, um Gene in späteren Stadien der embryonalen Entwicklung zum Ausdruck bringen, und um festzulegen, wie Enhancer und Promotoren regulieren die Genexpression im Embryo. Das Protokoll zeigt hier können verwendet werden, um effizient zu produzieren transgenen Xenopus laevis Embryonen werden. Diese Transgenese Ansatz beinhaltet drei Teile: 1. Sperm Kerne sind von Erwachsenen getrennt X. laevis Hoden durch Behandlung mit Lysolecithin, die die Spermien Plasmamembran permeabilizes. 2. Egg Extrakt wird durch Zentrifugation bei niedriger Geschwindigkeit, Zugabe von Calcium, um den Extrakt führen, um Fortschritte zu des Zellzyklus Interphase und eine High-Speed Zentrifugation zur Interphase Cytosol isolieren vorbereitet. 3. Nuclear Transplantation: die Kerne und extrahieren mit dem linearisierten Plasmid-DNA als Transgen und eine kleine Menge Restriktionsenzym eingeführt werden kombiniert. Während einer kurzen Reaktionszeit, Ei-Extrakt teilweise decondenses die Spermien Chromatin und dem Restriktionsenzym erzeugt Chromosomenbrüche dass die Rekombination des Transgens in das Genom zu fördern. Die behandelten Spermien Kerne sind dann in unbefruchtete Eier transplantiert. Integration des Transgens erfolgt in der Regel vor der ersten embryonalen Spaltung, so dass die entstehenden Embryonen nicht chimäre. Diese Embryonen können, ohne dass auf die nächste Generation zu züchten, so dass für eine effiziente und schnelle Generierung von transgenen Embryonen für die Analysen der Promotor und Gen-Funktion analysiert werden. Adult X. laevis, die sich aus diesem Verfahren auch propagieren das Transgen durch die Keimbahn und kann verwendet werden, um Linien transgener Tiere für verschiedene Zwecke zu erzeugen.
Protokoll
Modifizierte Versionen dieses Transgenese Ansatz wurden zunächst in 1 und 2 beschrieben.
A. Spermienkern Vorbereitung
Diese Kerne Herstellungsverfahren ist von Murray 3 angepasst, aber die Protease-Inhibitoren wurden weggelassen, da sie mit anschließender Entwicklung von Eiern mit Spermienkern transplantiert stören. Aliquots werden bei -80 ° C eingefroren und kann für Transplantationen für ca. 6 Monate verwendet werden.
Alle Lösungen sollten vorbereitet und auf Eis gestellt vor Beginn der Vorbereitung.
- Anesthetize 1-2 erwachsenen männlichen X. laevis durch Eintauchen in Tricaine für mindestens 20 min durch Rückenmarkzerstörung gefolgt; entfernen Sie die Hoden.
- Rollen Sie den Hoden auf ein Papiertuch, das Blut, Blutgefäße und fetten Körper zu entfernen, waschen Sie sie kurz in einer 60 mm Petrischale mit 1XMMR, und entfernen Sie alle zusätzlichen Fettstücke Körper. Achten Sie darauf, Punktion der Hoden, da diese Versionen der Spermien.
- Transfer-Hoden zu einem trockenen 60-mm-Petrischale und Mazerat Hoden mit einer Pinzette, bis keine sichtbaren Brocken sind. Mazeration sollte so gründlich wie möglich durchgeführt werden, um hohe Ausbeuten der Kerne zu erhalten.
- Add 2mLs kalten atomaren Praparationspuffer (NPB; 1X ab Lager), um die Mazerat und sanft Pipette auf und ab.
- Squirt Mazerat durch ca. 4 Dicken cheesecloth auf einen Trichter, das Sammeln in einen 15 ml-Röhrchen (zB Falcon 2059); spülen Teller mit 8mLs von NPB und setzen diese durch die Gaze spülen, sammeln sie in die Röhre. Mit Handschuhen drücken Sie die Gaze zu restliche Flüssigkeit in den Schlauch zu sammeln.
- Pellet die Spermien bei 3000 rpm für 10 min. bei 4 ° C in einem Ausschwingrotor (zB 1480g in einer Sorvall HB-4 Rotor oder gleichwertig) mit den entsprechenden Rohradapter. Dekantieren, fügen 8mL NPB dieser Pipette und Reagenzglas nach oben und unten mit einer 10 mL Pipette Pellet; Spin wieder wie oben und dekantieren. Äquilibrieren 1ml von NPB auf Raumtemperatur während der Spin.
- Pellet in 1 ml Raumtemperatur NPB mit einer 1 mL pipetteman Spitze, fügen Sie 50 ul 10mg/ml frisch zubereiteten Lysolecithin, vorsichtig mischen und Inkubation für 5 min. bei Raumtemperatur.
- Fügen Sie 10 ml kaltem 1XNPB +3% BSA, um das Rohr auf die Lysolecithin Reaktion zu stoppen, vorsichtig mischen und Spin-Down für 10 min bei 3000 rpm in einem Ausschwingrotor. Dekantieren. Die Lysolecithin-behandelten Pellets sollten leicht durchscheinender (weniger Deckweiß), als es vor Lysolecithin Behandlung haben.
- Dekantieren und Pellet in 5 ml kaltem NPB +0,3% BSA, vorsichtig mischen mit 10 mL Pipette und Spin-Down für 10 min bei 3000rpm wie oben.
- Dekantieren und Pellet in 500μl der Spermien Pufferspeicher und in ein 1,5 ml Tube. Das ist jetzt Ihre Kerne Lager. Auf Eis, während Sie die Ausbeute an Kernen zu überprüfen.
- Um die Ausbeute an Kernen zu überprüfen, statt 98 ul der Spermien Verdünnungspuffer (SDB), 1 ul des nuklearen Bestands-und 1μl von 1:100 Verdünnung der Hoechst Aktie in einem 1,5 ml Eppendorf-Röhrchen. Mix der nuklearen Lager sehr gut mit einer Rasierklinge abgeschnitten-(oder große Öffnung) Pipettenspitze kurz vor dem Entfernen der 1 ul. Mix der verdünnten SDB / Hoechst / Kerne sehr gut und erlauben eine kleine Menge in die Kammer von einem verbesserten Neubauer Hämazytometer durch Kapillarwirkung fließen. Graf Kerne in einem Quadrat der Hämazytometer unter einem zusammengesetzten Mikroskop. Von einem Mann, sollten Sie zählt von mindestens 100-200 (X10 4 Zellen / ml) für diese 1:100 Verdünnung des Bestandes zu erhalten für eine unverdünnte Lager Konzentration von 1-2x10 5 Zellen / ul. Wenn Ihr Bestand ist weniger konzentriert, lassen Sie die Kerne für mehrere Stunden absitzen, entfernen Sie einige der Überstand, und zu erzählen. Lassen Sie die Kerne bei 4 ° C über Nacht, damit das Glycerin zur besseren Kryokonservierung eindringen, dann mischen die nukleare Lager auch mit einer großen Öffnung Pipettenspitze, bereiten 20 &mgr; l Aliquots, und frieren in flüssigem Stickstoff.
B. Herstellung von High-Speed-Extrakt
Diese Methode wird von Murray 3 angepasst und erzeugt eine Zwischenphase zytosolischen Extrakt, Schwellungen und teilweise Chromatin Dekondensation des zugesetzten Spermienkern fördern wird. Auszug kann in kleinen Portionen bei -80 ° C eingefroren und wieder aufgetaut vor dem Gebrauch.
- 3-5 Tage vor der HCG-Injektion, prime 8-12 erwachsenen weiblichen X. laevis durch die Injektion von 50 U der PMSG in den dorsalen Lymphsack. Am Abend vor Extraktzubereitung, injizieren jeder Frosch mit 500 Einheiten HCG und Platz 2 Frösche / Container in 2 Liter 1XMMR. Da ein Frosch mit Lyse oder Aktivierung Eier der Extrakt Vorbereitung gefährden können, ist es ratsam, Frösche in Paare getrennt für den Eisprung.
- Am nächsten Morgen vorzubereiten und Chill alle Lösungen vor Beginn der Vorbereitung. Sanft, manuell zu vertreiben Eier aus jeder Frosch in großen beakers bestehend aus 1x MMR. Bildschirm die Eier aus jedem Behälter und lassen Sie alle Chargen von Eiern mit Anzeichen einer Marmorierung, Lyse oder Aktivierung (visualisiert durch Kontraktion der Pigmentierung in der Tier-Hemisphäre) aus dem Verfahren. Sammeln ungebrochen Eier mit noch Pigmentierung. Gute Eier können auch aus dem 1X MMR in den Frosch Eimern gesammelt werden. Das Gesamtvolumen der Eier sollte> 100 mL werden von der 8-12 Weibchen.
- De-Gelee die Eier. Um dies zu tun, entfernen Sie so viel wie möglich MMR, fügen Sie eine kleine Menge an Cystein-Lösung, und schwenken Sie die Eier. Ersetzen Sie mit frischen Cystein-Lösung mehrmals de-Gelieren. De-Gelee jede Charge von Eiern getrennt und entsorgen Chargen mit Bruch oder Ei-Aktivierung. Kombinieren Sie den Rest der Eier.
- Waschen Sie die Eier viermal in ~ 35 ml Extrakt-Puffer (XB) und dann zweimal in 25 ml CSF-XB mit Protease-Inhibitoren.
- Um die Eier packen: Übertragung der Eier in Beckman UltraClear Röhren. Lassen Sie die Eier zu begleichen. Entfernen Sie so viel CSF-XB wie möglich. Zentrifugieren Sie die Eier mit einem Beckman SW 40 Ti Rotor (oder ähnliche Rotor) bei 1000 Umdrehungen pro Minute (150g) für ~ 60 sec bei 4 ° C. Entfernen Sie überschüssige Lösung von der Spitze der verpackten Eier.
- Um die Eier zu zerschlagen und zu generieren cytoplasmatischen Extrakt: Zentrifuge die Eier bei 10.000 rpm (16.000 g) für 10 min bei 4 ° C. Die Eier sollten in drei Schichten zu trennen: Lipid-(oben), Zytoplasma (Mitte) und Eigelb (unten). Sammeln Sie die zytoplasmatische Schicht aus jedem Röhrchen mit einem 18-Gauge-Nadel durch die Nadel durch das Rohr an der Basis der cytoplasmatischen Schicht. Übertragen Sie die Zytoplasma in ein frisches UltraClear Beckman Röhrchen auf Eis.
- Add-Protease-Inhibitoren, die isoliert Zytoplasma zu einer Endkonzentration von 1X. Zentrifugieren das Zytoplasma bei 16.000 g für 10 min bei 4 ° C. Sammeln Sie die geklärt Zytoplasma wie oben beschrieben. Erwarten Sie, 0,75-1 ml Plasma / frog zu erhalten.
- Add 1 / 20 des Extraktes Volumen von Energie-Mix auf die Probe. Übertragen Sie die Zytoplasma in dickwandige Polycarbonat-Röhren für die Beckman TL-100 Ultrazentrifuge. Tubes halten etwa 3 ml und sollte mindestens halb voll.
- Add 1 M CaCl 2 in jedes Röhrchen bis zu einer Endkonzentration von 0,4 mM. Die Röhrchen für 15 min bei Raumtemperatur. So inaktiviert CSF und schiebt den Extrakt in der Interphase.
- Bilanz der Rohre und Zentrifuge sie in einer Beckman TL-100 Ultrazentrifuge mit einem TLA-100,3 Rotor bei 70.000 rpm (200.000 g) für 1,5 h bei 4 ° C. Das Zytoplasma wird fraktionieren in vier Schichten, von oben nach unten: Lipid, Cytosol, Membran / Mitochondrien und Glykogen / Ribosomen.
- Entfernen Sie die zytosolischen Schicht aus jedem Röhrchen (~ 1 mL wenn 2-3 mL wurde in das Rohr geladen) durch Einsetzen einer Spritze in das obere Ende des Rohres durch die Lipid-Schicht. Übertragen Sie die cytosolische Fraktion an die frische Röhrchen und zentrifugieren Sie die Proben bei 70.000 rpm (200.000 g) für 20 min bei 4 ° C.
- Aliquot des Überstandes in 25-ul-Aliquots in 0,5-ml-Röhrchen. Quick-Freeze der Aliquots in flüssigem Stickstoff eingefroren und bei -80 ° C bis zur Verwendung. Um festzustellen, ob der Extrakt wirksam ist, kann Spermakerne in Extrakt inkubiert und gefärbt mit Hoechst zu bestimmen, ob die Kerne sichtbar anschwellen (verdicken und verlängern) innerhalb von 10 min der Zugabe bei Raumtemperatur.
C. Transgenese Reaktion und Kerntransfer
Wichtig: Überprüfen Sie, dass die Lösungen, die Ausrüstung und Frösche sind alle vor dem Beginn einer Reaktion bereit. Sobald Sie anfangen, müssen Sie mit der Reaktion mit dem ungefähren Zeitplan unten beschrieben vorgehen, da viele Komponenten nicht bleiben für> 30 Minuten stabil. Während die Spermakerne Lager auf Eis gehalten wird, sollte Transgenese Reaktionen (sowohl verdünnt und konzentriert) bei Raumtemperatur aufbewahrt werden.
- Prime weiblichen Frösche. Am Abend vor Transgenese, spritzen mehrere (3-5) erwachsenen Weibchen Frosch mit 800 Einheiten HCG in den dorsalen Lymphsack zu frisch gelegten Eier zu Beginn des nächsten Tages zu erhalten.
- Der Tag der Transgenese Verfahren, vorzubereiten oder zu bringen Temperatur der Lösungen für Transgenese benötigt:
- Frisch aus Cystein (2,5% in 1XMMR, pH 8,0). Sie müssen mehrere hundert Milliliter verwendet an diesem Tag sein.
- 0.2XMMR +6% Ficoll zur Transplantation Gerichte und Wiederherstellung von transgenen Embryos und 0.2XMMR 100 ug / ml Gentamicin (ohne Ficoll) zum Anheben Embryonen. Lösungen sollten nicht wärmer als 18-21 ° C und transgenen Embryos durch frühe Spaltungen sollte bei Temperaturen zwischen 16 und 21 ° C erhöht werden, da höhere Temperaturen beeinträchtigen sowohl die Häufigkeit der Transgenese und Embryonalentwicklung.
- Auftauen und Gleichgewicht auf Raumtemperatur gefrorenen Aliquots von SDB (Spermien Verdünnungspuffer) für den Tag der Transplantation, tauen die hohe Geschwindigkeit zu extrahieren und auf Eis stellen, und bereiten Sie einen 100mm MgCl 2-Lösung.
- Raus the Agarose Injektion Gerichte und füllen sich mit MMR / Ficoll-Lösung und einzurichten und Vorlauf der Infusionspumpe, um den Fluss zu stabilisieren.
- Prüfen Sie, ob weibliche Frösche legen Eier und sind von hoher Qualität. Optimalerweise sollten Eier haben eine feste Rinde (hold Form nach de-Gelieren).
- Einrichten einer Transgenese Reaktion:
- Sehr sanft (mit einer abgeschnittenen Pipettenspitze) mischen die Kerne Lager und kombinieren in einem 1,5 ml Eppendorf-Röhrchen:
4μl Kerne (~ 4-8X10 5 Kerne)
2μl linearisierte Plasmid (100ng/μl)
Inkubieren 5 Minuten bei Raumtemperatur. - während der Inkubation verläuft, verdünnte 0.5μl des Restriktionsenzyms in 4.5μl H 2 O und fügen 1μl des verdünnten Enzyms zu 18μl des SDB, 2μl MgCl 2 und 2μl von High-Speed-Extrakt. Fügen Sie diese Mischung auf die Kerne-Plasmid-Reaktion. Inkubieren 10 weitere Minuten, um die Kerne quellen.
- Während dieser Inkubation Squeeze Eier 2 bis 3 Frösche und de-Gelee in Cystein-Lösung. Waschen Sie sie gut (5fach) mit 1XMMR, und verwenden Sie eine weite Bohrung Pipette auf 400-500 dejellied Eier zu jedem Agarose gut Schale mit 0,2 X MMR +4% Ficoll übertragen. Dies dauert in der Regel etwa 10 Minuten, so einmal Eierspeisen die Reaktion bereit sind, ist in der Regel bereit, zu verdünnen.
- Etwa 15-20 Minuten nach dem Start Schritt ein, mischen Sie die Reaktion (Kerne / extract / DNA) mit einer abgeschnittenen Spitze und fügen Sie über 5μl zu 150 ul SDB bei Raumtemperatur. Kerne in dieser verdünnten Mischung für etwa 1 Stunde. Stabil, während sie nicht behalten zu tun Transplantation Kapazität so lange, als in der konzentrierten Mischung links.
- Sehr sanft (mit einer abgeschnittenen Pipettenspitze) mischen die Kerne Lager und kombinieren in einem 1,5 ml Eppendorf-Röhrchen:
- Legen Sie die Nadel: Mix der verdünnten Reaktion hergestellt oben sehr vorsichtig mit einem breiten Öffnung Pipettenspitze, dann laden Sie die Nadel schnell, als Keime rasch siedeln sich in der Röhre. Dazu tendieren, die Nadel, ein Stück der feinen Tygon-Schlauch auf das Ende einer abgeschnittenen 200 ul Pipettenspitze. Zeichnen Sie die Lösung in die Pipettenspitze, dann legen Sie den Schlauch an der Nadel und lassen Sie die Lösung, um die Nadel durch die Schwerkraft geben oder leicht deprimierend die Pipette Kolben.
- Bringen Sie Nadel Schlauchpumpe und beginnen Transplantationen von Kernen. Die Injektionen sollten schnelle, flache und etwa senkrecht zu der Eizelle Plasmamembran zu vermeiden, Schaden anzurichten. An der Fließgeschwindigkeit vorgeschlagen (10nl/sec), halten Sie die Nadel in die Eizelle für ~ 0,5 Sekunden. Sie sollte 1-2 Gerichte der Transplantationen innerhalb von 20-30 Minuten abgeschlossen.
Nach Injektionen, verlassen Sie die Gerichte bei 16-20 ° C, bis die Embryonen 4-8 Zellen-Stadium erreicht haben. Sortieren Sie die Spalten Embryonen von ihren nicht-spaltende Nachbarn durch die Übertragung (mit einem Glas Pasteur Pipette mit einer Spitze etwa den gleichen Durchmesser wie ein Ei), um eine frische große Schüssel 0.2XMMR +4% Ficoll. Unterteilen Sie die Spaltung Embryonen in kleinere Gruppen (10-15 Embryonen / Well einer 6-well-Platte) und Kultur in 0.2XMMR (keine Ficoll) +100 pg / mL Gentamicin durch frühe Entwicklung. Embryonen sollten während der Gastrulation überprüft werden mit jedem sterbenden Embryonen unverzüglich entfernt und die Medien bei Bedarf geändert.
Fehlerbehebung:
- Needle ist blockiert: Lösung Flow aus der Nadel sollte während der Transplantationen deutlich. Wenn die Nadel verstopft durch sichtbare Partikel, ändern Nadeln oder versuchen, den Fremdkörper durch Abschneiden der Spitze mit einer Pinzette und Schieben Lösung durch die Nadel zu entfernen.
- Keine Spaltung Eier erhalten: Überprüfen Sie, dass Verdünnungen von Spermakerne und Injektionsvolumen angemessen sind und dass die Nadel nicht während der Transplantation blockiert. Wenn Injektionsvolumen zu hoch ist, kann Eier auch nicht spalten und stattdessen zeigen verfärbt Pigmentierung oder Schäden.
- Viele Embryonen sterben während der Gastrulation. Verschiedene Faktoren können zu verbessern Embryo Überleben:
- Vorsicht mit den Kernen während der Vorbereitung und der enzymatischen Reaktion. Dekondensierten Kerne sind instabil und müssen transplantiert mit dem Zeitplan oben. Bewahren Sie CDs nicht auf dem Eis.
- Die chromosomale Schäden, die durch die Spermakerne während der Enzymreaktion und Kerntransfer nachhaltig wirkt sich sowohl auf die Häufigkeit der Transgenese und die normale Entwicklung des Embryos. Chromosomale Schäden an den Kernen erhöht die Effizienz der Transgenese sondern wirkt sich negativ auf das Überleben / normale Entwicklung. Sinkende oder Weglassen Restriktionsenzym während der Enzyminkubation verbessern können die Rate der normalen Entwicklung, sondern kann Häufigkeit der Transgenese oder Plasmid-Kopienzahl in den Embryo Genom eingebracht verringern.
- Wenn späten Blastula durch Gastrula Embryonen Anzeichen von Verfärbung oder Zelltod zeigen, dass es auch möglich, dass ein Reagenz für die Transplantation verwendet toxisch auf die Eier war. Darüber hinaus, wenn Eis nicht über eine feste Rinde, können sie durchlaufen Exogastrulation und nicht in den normalen Post-Gastrula Embryonen zu erzeugen.
- Die Zahl der Embryonen zum Ausdruck des Transgens ist gering. Erhöhen Sie die Menge des Restriktionsenzyms.
Vertreter Transgene Embryo Ergebnisse
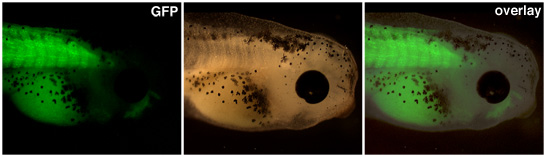
Transgene Embryonen aus kerntechnischen Transfers sollten angehoben werden, bis Ausdruck aus dem Promotor von Interesse ist sichtbar werden. In Abbildung 1 oben treibt ein Muskel Actinpromotor Ausdruck des grün fluoreszierenden Proteins in den Somiten dieser transgenen Kaulquappe.
Diskussion
Für jede transgene Konstrukt getestet werden wir in der Regel Transplantation Kerne in 500-1000 Eier; in diesem Maßstab können wir transgenen Embryos Ausdruck bis zu 10 verschiedenen Konstrukte pro Tag erzeugen, je nachdem, wie viele Frauen werden dazu veranlasst, Eier zu legen. Von diesen Transplantationen, etwa ein Drittel der Eier spalten und 60-80% dieser Spaltung Embryonen durch Gastrulation normal fortgesetzt. Je nach Reaktionsbedingungen, zwischen 10-50% dieser Embryonen auszudrücken das Transgen von Interess...
Offenlegungen
Tierversuche wurden in Übereinstimmung mit den Richtlinien und Vorschriften her durch die Animal Care Set durchgeführt und Verwenden Ausschuss an der Washington University School of Medicine.
Danksagungen
Die Finanzierung unserer Arbeit wird durch die NIH, die March of Dimes und der American Cancer Society.
Materialien
A. Spermienkern Vorbereitung
Reagenzien:
- 1X MMR (2mm CaCl 2, 5 mM HEPES, pH 7,5, 2 mM KCl, 1 mM MgCl 2, 100 mM NaCl).
- 0,1% Tricaine Methansulfonat (MS222, Aminobenzoesäure-ethylester, Sigma A-5040), 0,1% Natriumbicarbonat. In Wasser auflösen.
- 2X Nuclear Vorbereitung Butter (NPB). Am Tag der Spermakerne Vorbereitung, Make-up 30 ml 2X NPB von Aliquoten der Stammlösungen eingefroren gelagert: 500 mM Saccharose (1,5 M Lager), 30 mM HEPES (1M Lager titriert mit KOH, so dass pH 7,7 bei 15 mM), 1 mM Spermidin Trihydrochlorid (Sigma S-2501; 10 mM Lager), 0,4 mM Spermin Tetrahydrochlorid (Sigma S-1141; 10 mM Lager), 2 mM Dithiothreitol (Sigma D-0632; 100 mM Lager), 2 mM EDTA (500 mM EDTA, pH 8,0).
- Verwenden Sie die 2XNPB zu machen a. 30ml 1X NPB, b. 10ml 1XNPB +3% BSA (Fraktion V, Sigma A-7906), c. 5ml 1XNPB +0,3% BSA.
- Lysolecithin: 100 ul 10 mg / ml L-α-Lyso-Lecithin, Eigelb (Calbiochem, 440.154); bei Raumtemperatur lösen sich kurz vor dem Gebrauch. Shop solide Aktie bei 20 ° C. Entsorgen Sie die Lagerung von Pulvern, wenn sie klebrig wird.
- Rinderserumalbumin (BSA): 10% (w / v) BSA (Fraktion V, Sigma A-7906) Make up 5 ml in Wasser am Tag der Spermakerne Vorbereitung.
- Sperm Pufferspeicher (1 ml) 1X NPB, 30% Glycerin, 0,3% BSA.
- Sperm Verdünnungspuffer: 250 mM Saccharose, 75 mM KCl, 0,5 mM Spermidin Trihydrochlorid, 0,2 mM Spermin Tetrahydrochlorid. Titriert auf pH 7,3-7,5 und speichern 0,5-1 ml Aliquots bei 20 ° C.
- Hoechst Nr. 33342 (Sigma B-2261): 10 mg / ml Stammlösung in dH 2 O, Speicher in einem lichtdichten Behälter bei 20 ° C.
Ausstattung:
- Ausschwingrotor und Zentrifuge
- cheesecloth
- Dissektion Werkzeuge (Zange und Schere)
- Fluoreszenzmikroskop
- Trichter
- Handschuhe
- Zählkammer
- Nadeln (26 Gauge)
- Papierhandtücher
- Petrischalen (60 mm)
- Pipetten
- Kunststoff (5 und 10 ml)
- Pipetman Tipps (1 ml und 200 ul)
- Spritzen (1 ml)
- Rohre (14 ml, Falcon, 2059)
- Rohre
- Mikrozentrifuge (1,5 ml)
B. Herstellung von High-Speed-Extrakt
Reagenzien:
- 1X Marcs Geändert Ringer (MMR): 100 mM NaCl, 2 mM KCl, 1 mM MgCl 2, 2 mM CaCl 2, 5 mM HEPES, pH 7,5. Bereiten Sie eine 10fach und pH-Wert einstellen mit NaOH auf 7,5.
- 20x Extrakt-Puffer (XB) Salz stock: 2 M KCl, 20 mM MgCl 2, 2 mM CaCl 2, Filter-sterilisiert und bei 4 ° C lagern
- Extract-Puffer (XB, frisch zubereitet und auf Eis gelagert): 1x XB Salze, 50 mM Saccharose, 10 mM HEPES (1 M Lager, mit KOH titriert, so dass pH beträgt 7,7, wenn auf 15 mM verdünnt, Filter-sterilisiert, und speichern Sie in Aliquots bei 20 ° C). Bereiten Sie etwa 100 ml.
- 2% (w / v) L-Cystein-Hydrochlorid 1-Hydrat: Made in 1X XB Salze vor der Verwendung und titriert auf pH 7,8 mit NaOH. Bereiten Sie ca. 300 ml.
- CSF-XB: 1X XB Salze, 1 mM MgCl 2 (neben 2 in XB Salze MgCl; Endkonzentration 2 mM), 10 mM HEPES, pH 7,7, 50 mM Saccharose, 5 mM EGTA, pH 7,7. Bereiten Sie 50 ml.
- Protease-Inhibitoren: Mischung von Leupeptin Chymostatin und Pepstatin, jeweils gelöst, um eine Endkonzentration von 10 mg / ml in Dimethylsulfoxid (DMSO). Shop in kleinen Aliquots bei 20 ° C.
- 1 M CaCl 2.
- Energiemix: 150 mM Kreatinphosphat, 20 mM ATP, 20 mM MgCl 2.
- Pregnant Mare Serum Gonadotropin (PMSG): 100 U / ml PMSG (PG600 ®, Intervet, Inc., 021825). In Wasser auflösen und gelagert bei 20 ° C.
- Humanem Chorion-Gonadotropin (HCG): 1000 U / ml HCG (CHORULON ®, Intervet, Inc., 057176). In Wasser gelöst und bei 4 ° C.
Ausstattung:
- Xenopus laevis Weibchen
- Needles (18 und 26 Gauge)
- Pasteurpipette
- weite Bohrung
- Spritzen (1 ml)
- Tubes, Mikrozentrifuge (0,5 ml)
- Rohre, dickwandige Polycarbonat (Beckman, 349622)
- Tubes, UltraClear (14 x 95 mm; Beckman, 344060)
- Ultrazentrifuge und Rotoren (zB Beckman TL-100 mit Rotoren SW 40 Ti und TLA-100.3)
- Becher für Eiersammlung
- Eimer oder Behälter zur Aufnahme von weiblichen Frösche (z. B. 4-L-Kunststoffbehälter mit Mesh-Deckel).
C. Nuclear Transplantation.
Reagenzien:
- 2,5% Agarose in 0.1XMMR (zur Herstellung Injektion Geschirr)
- 2,5% Cystein in 1XMMR, PH 8,0, am Tag der Verwendung hergestellt
- Ficoll
- 10 mg / ml Gentamycin (1000X Lager)
- High-Speed-Ei-Extrakt (siehe oben)
- 100 MgCl 2
- 10X MMR (siehe oben)
- Restriktionsenzym (zB NotI aus New England Biolabs)
- Sperm Verdünnungspuffer (SDB, siehe oben) und Spermakerne (siehe oben)
- Humanem Chorion-Gonadotropin (HCG) wie oben
- Mineralöl (Sigma, M8410)
- Linearisierten Plasmid als Transgen eingeführt werden: Bereiten linearisierten Plasmids in einer Konzentration von etwa 100 ng / ul in sterile, Nuklease-freies Wasser (wir vermeiden Tris und EDTA-haltigen Puffer, die etwas giftig für Embryonen). Das Restriktionsenzym verwendet, um das Plasmid linearisieren muss nicht die gleiche wie die in den Kerntransfer Reaktion eingesetzt werden. Wir verwenden normalerweise NotI für alle Reaktionen, unabhängig davon, was Plasmid wird mit linearisiert. Einige Kalibrierung des Enzymverdünnung in der Reaktion verwendet werden kann, notwendig, als zu viel Enzym schädliche Wirkungen auf post-Gastrula Entwicklung. Plasmide können auf verschiedene Weise gereinigt werden: Wir verwenden normalerweise die Qiagen QIAquick PCR Purification Kit nach Angaben des Herstellers Richtungen; Reinigung von einer einzigen Bande aus einem Gel ist nicht erforderlich. Wenn Plasmid wird gereinigt, indem Phenol / Chloroform Extraktionen und Ethanolfällung, sicher sein, um alle Spuren von organischen und Ethanol zu entfernen.
Ausstattung:
Agarose Gerichte zur Injektion: In einer 60 mm Petrischale aus Kunststoff, lag eine kleine 35mmX35mm wiegen Boot auf geschmolzenem 2,5% Agarose in Wasser 0.1XMMR eine Depression mit einer Agarose-beschichteten Boden für die Befüllung mit Eiern zu schaffen. Sobald Agarose ausgehärtet ist, wickeln Sie sie in Parafilm und lagern bei 4 ° C bis zur Verwendung. Machen Sie 2-3 Gerichte im Voraus für jede transgene Reaktion, die Sie planen zu tun.
Infusionspumpe: Wir verwenden eine einzige Spritze Infusionspumpe aus Harvard Apparatus, mit einer 3-ml-Spritze / Nadel mit Mineralöl gefüllten ausgestattet (Sigma M-8410). Blunt die Nadel der Spritze Spitze (um es von Perforieren den Schlauch zu halten) und befestigen Sie den feinen Tygon-Schlauch. Führen Sie die Pumpe bei ~ 10nl/sec; dies setzt voraus, dass die Zeit die Nadel in jedes Ei wird nicht größer als 1 sec sein. Die Pumpe sollte für einige Minuten vor Beginn der Transgenese für den Tag, um sicherzustellen, dass der Kolben der Spritze bündig mit den Kolben und das stetige positive Ölfluss aus dem Schlauch auftritt ist bereits ausgeführt werden.
Nadeln für die nukleare Transfers. Mit einer Mikropipette Abzieher, erzeugen Nadeln mit langen, schrägen Spitzen. Clip diese mit einem ForceP unter einem Binokular mit einem Okularmikrometer ausgestattet, um eine ~ 80 Mikron Öffnung mit einer abgeschrägten Form zu erhalten.
Weitere Ausstattung: Xenopus laevis Weibchen, Stereomikroskop, Inkubator, Mikromanipulator, Mikroinjektionsnadel Abzieher (z. B. Modell P-87, Sutter), Injektionsnadeln (26 Gauge), Glas Mikroinjektion Nadeln, Okularmikrometer für kalibrierte Clipping Mikroinjektionsnadel Tipps 80 um Durchmesser, Petrischalen, wiegen Boote 35mm, Tygon-Schlauch (ID = 1 / 32 Zoll, OD = 3 / 32 in.)
Referenzen
- Kroll, K. L., Amaya, E. Transgenic Xenopus embryos from sperm nuclear transplantations reveal FGF signaling requirements during gastrulation. Development. 122, 3173-3183 (1996).
- Amaya, E., Kroll, K. L. A method for generating transgenic frog embryos. Methods Mol Biol. 97, 393-414 (1999).
- Murray, A. W. Cell cycle extracts. Methods Cell Biol. 36, 581-605 (1991).
- Hartley, K. O., Hardcastle, Z., Friday, R. V., Amaya, E., Papalopulu, N. Transgenic Xenopus embryos reveal that anterior neural development requires continued suppression of BMP signaling after gastrulation. Developmental Biology. 238, 168-184 (2001).
- Karaulanov, E., Knöchel, W., Niehrs, C. Transcriptional regulation of BMP4 synexpression in transgenic Xenopus. EMBO J. 23, 844-856 (2004).
- Ogino, H., Fisher, M., Grainger, R. M. Convergence of a head-field selector Otx2 and Notch signaling: a mechanism for lens specification. Development. 135, 249-2458 (2008).
- Taylor, J. J., Wang, T., Kroll, K. L. Tcf- and Vent-binding sites regulate neural-specific geminin expression in the gastrula embryo. Developmental Biology. 289, 494-506 (2006).
- Marsh-Armstrong, N., Huang, H., Berry, D. L., Brown, D. D. Germ-line transmission of transgenes in Xenopus laevis. Proceedings of the National Academy of Sciences of the United States of America. 96, 14389-14393 (1999).
- Offield, M. F., Hirsch, N., Grainger, R. M. The development of Xenopus tropicalis transgenic lines and their use in studying lens developmental timing in living embryos. Development. 127, 1789-1797 (2000).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenWeitere Artikel entdecken
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten