需要订阅 JoVE 才能查看此. 登录或开始免费试用。
Method Article
生产转基因非洲爪蟾限制性内切酶介导的整合和核移植
摘要
这个视频协议演示了用于产生转基因的方法非洲爪蟾由引进到精子细胞核转基因细胞核移植到未受精卵。
摘要
稳定整合到爪蟾基因组克隆的基因产物,是必要的控制表达的时间和地点,在胚胎发育的后期阶段基因表达,并定义如何增强子和启动子调节胚胎中的基因表达。这里展示的协议,可以用来有效地生产转基因爪蟾胚胎。这种转基因的方法包括三个部分:1。精子细胞核分离成年X.蟾睾丸治疗溶血卵磷脂,permeabilizes精子质膜。 2。卵提取物准备,由低速离心此外,钙,造成提取的进展细胞周期相间,和高速离心分离相间细胞质。 3。核移植:细胞核和提取物相结合,与线性质粒DNA限制性内切酶的转基因和少量引进。在很短的反应,鸡蛋中提取部分decondenses精子染色质和限制性内切酶产生的染色体断裂,促进到基因组的基因重组。经处理后的精子核,然后移植到未受精卵。转基因的整合,通常会出现之前的第一等,由此产生的胚胎嵌合胚胎卵裂。没有任何需要繁殖下一代,允许转基因胚胎的新一代高效,快速的启动子和基因功能分析,可以分析这些胚胎。成人X。蟾此过程还通过生殖细胞传播的转基因和可用于产生转基因动物用于多种用途的线。
研究方案
这种转基因方法修改后的版本,最初在1和2。
A.精子细胞核的准备
此核的制备方法是改编自美利3,但蛋白酶抑制剂已被省略,因为它们与干扰卵子与精子细胞核移植的后续发展。分装冷冻于-80 ° C,可使用约6个月移植。
所有的解决方案应准备,并置于冰上开始前的准备。
- 麻醉1-2成年男性X 。 pithing 蟾 Tricaine浸泡至少20分钟,取出睾丸。
- 卷纸巾上的睾丸清除血液,血管和脂肪体,60毫米的Petri 1XMMR菜洗一下,并删除任何额外的脂肪体件。小心不要穿刺睾丸,因为这将释放精子。
- 传输睾丸干60毫米培养皿中浸渍睾丸和钳,直到没有明显的块。浸渍应尽可能彻底完成,获得产量高的核。
- 添加2mLs冷核准备缓冲区(NPB的; 1X股票)的浸渍,轻轻地吸液管向上和向下。
- 通过约4水枪浸渍厚度的棉布上一个漏斗,收集到15毫升管(如猎鹰2059);与NPB的8mLs冲洗盘,并付诸表决通过的棉布冲洗,收集管。带着手套的手挤在纱布收集到管内剩余的液体。
- 佩莱在10分钟3000转的精子。在4 °彗星在一个适当的管适配器(例如一个Sorvall HB - 4转子或相当于1480克)的水平转头。倒出上清液;添加8mL NPB的管吸管向上和向下与10 mL的吸管重新悬浮颗粒;以上,倒出上清液再次离心。 NPB的1ML平衡至室温,在旋转。
- 1ML室温下使用1毫升pipetteman提示NPB的悬浮颗粒,加入50μL的10mg/ml的新鲜的溶血卵磷脂,轻轻混匀,孵育5分钟。在室温下。
- 添加10毫升冷1XNPB 3%牛血清白蛋白管停止反应,溶血卵磷脂,轻轻混匀,10分钟在一个水平转头在3000 RPM和自旋。倒出上清液。治疗溶血卵磷脂颗粒看起来应该稍微半透明(少不透明白色)比前溶血卵磷脂治疗。
- 倒出上清液,重悬在5毫升冷NPB的0.3%BSA的颗粒,轻轻混匀,在10 mL的吸管,在3000RPM降速为10分钟以上。
- 弃上清,重悬沉淀的精子存储缓冲区,并转移到1.5 mL管500μL。现在这是您的原子核股票。冰商店,而你检查的原子核的收益率。
- 要检查的原子核的产量,98精子稀释缓冲液(SDB),1μL核股票和1:100稀释Hoechst公司的股票在1.5ml的Eppendorf管中加入1μl液。混合核股票非常好,使用前取出1μL剃刀削波(或大开放)枪头。混合稀释康体发展局/赫斯特/原子核非常好,允许少量流入室通过毛细作用是改善纽鲍尔hemacytometer。原子核的复合显微镜下计数hemacytometer平方。从一名男性,你应该得到的未经稀释的股票浓度为1 - 2X10 5细胞/μL此1:100稀释的股票至少100-200计数(X10 的 4细胞/ mL) 。如果你的股票是不太集中,让核解决了几个小时,除去上清液,各显神通。离开原子核4 ° C过夜允许甘油渗透到更好的冷冻保存,然后用大孔吸头混合核股票,准备20μL分装,并冻结在液氮中。
B.高速提取物的制备
这种方法是改编自美利3和生产,这将促进局部肿胀和增加精子核染色质decondensation相间的细胞质中提取。提取物可被冻结在小分装于-80 ° C,并在使用前解冻。
- 3-5天前,注射HCG,成年女性X.总理8-12 蟾由背淋巴囊PMSG注射50 ü。提取准备前的晚上,与500个单位的HCG和2青蛙/ 2公升1XMMR容器注入每个青蛙。由于裂解或激活蛋青蛙可以妥协的提取物的制备,最好是分成对排卵青蛙。
- 第二天早上,准备和寒意开始之前的准备所有解决方案。轻轻地,手动从每个青蛙驱逐到鸡蛋大Beakers含有1X的MMR。屏幕从每个集装箱的鸡蛋和花斑,裂解或激活的迹象,从程序(可视化在动物半球的色素沉着收缩)省略任何批次的鸡蛋。收集完整的鸡蛋,甚至色素沉着。优良的受精卵也可以收集从1X孕产妇死亡率在青蛙的桶。鸡蛋的总量应超过100毫升,从8-12位女性。
- 果冻蛋。要做到这一点,尽可能删除尽可能多的孕产妇死亡率,添加少量的半胱氨酸溶液,漩涡鸡蛋。用新鲜的半胱氨酸溶液替换在DE - jellying几次。德果冻每个批次的鸡蛋分开丢弃破损或卵子激活批次。结合其余的鸡蛋。
- 洗净的鸡蛋与蛋白酶抑制剂的4倍〜35 mL提取缓冲液(预算外)中,然后在25毫升的脑脊液XB的2倍。
- 收拾鸡蛋:鸡蛋转移到贝克曼ultraclear管。允许定居的鸡蛋。删除尽可能多的CSF - XB。离心机的鸡蛋,一个贝克曼SW 40钛转子(或类似的转子)在1000 rpm〜60秒(150克)4 ° C。删除多余的溶液从盒装鸡蛋的顶部。
- 粉碎鸡蛋和产生细胞质提取:10,000 RPM(16,000 G)为10分钟,在4 ° C离心鸡蛋鸡蛋应该分成三个层次:,脂质(上),细胞质(中心),和蛋黄(底部)。从每管收集18针头插入针管通过在基地的细胞质层的细胞质层。细胞质转移到一个新的ultraclear贝克曼管上冰。
- 分离出细胞质的1X终浓度添加蛋白酶抑制剂。 Recentrifuge细胞质中,在10分钟的16000克在4 ° C。收集上文所述的澄清细胞质。期望获得0.75-1毫升细胞质/青蛙。
- 新增的能源结构样品的提取量的1 / 20。贝克曼TL - 100超速离心机,聚碳酸酯厚壁管转移到细胞质中。管持有约3毫升,并应至少一半为满。
- 每管添加1个M氯化钙2到终浓度为0.4 mm。在室温下15分钟的孵育管。这灭活CSF和推入相间的提取物。
- 平衡管和离心一个贝克曼TL - 100为1.5小时使用一个TLA的100.3转子70,000 RPM(200,000 G)在4超速离心机° C。细胞质内将分馏成四层,从上到下:血脂,细胞质,细胞膜/线粒体,糖原/核糖体。
- 从每管(如果装入管2-3毫升〜1毫升)取下注射器插入管的顶部,通过脂质层细胞质层。胞内的一小部分转移新鲜管和recentrifuge 70,000 RPM(200,000 G)为20分钟,在4 ° C的样品
- 分装上清液0.5 mL管分装成25μL。快速冻结,直到使用液氮储存于-80 ° C等分。要确定是否是有效的提取,精子细胞核中提取孵育,并用Hoechst染色,以确定是否明显隆起的原子核(加厚并延长)除了在室温下10分钟内。
C.转基因反应和核转移
重要事项:检查解决方案,设备和青蛙都开始反应前的准备。一旦你开始,你必须进行使用的大致时间表如下所述的反应,因为许多组件不保持稳定> 30分钟。虽然精子细胞核股票放在冰上,转基因反应(稀释和浓缩),应在室温下保存。
- 女蛙总理。转基因前的晚上,注入若干个(3-5)成年女性青蛙背淋巴囊绒毛膜促性腺激素800单位,获得新鲜,从第二天开始产卵。
- 当天的转基因过程中,准备或带来温度为转基因所需的解决方案:
- 新鲜的半胱氨酸(2.5%),pH8.0 1XMMR。您将需要要使用的那一天几百毫升。
- 0.2XMMR 6%聚蔗糖转基因胚胎和0.2XMMR 100微克/毫升庆大霉素(不聚蔗糖)为提高胚胎移植的菜肴和恢复。解决方案不应温度超过18-21℃,应通过转基因胚胎早期分裂提出的温度在16至21℃,因为较高的温度造成不利影响都转基因和胚胎发育的频率。
- 解冻和平衡至室温冷冻等分深圳发展银行当天的移植(精液稀释液),解冻的高速提取物对冰和地点,并准备一个100mm的MgCl 2的解决方案。
- 走出日发送琼脂糖注射菜肴和填写MMR /聚蔗糖溶液,并建立和运行前输液泵,以稳定的流量。
- 检查女性青蛙正在铺设和鸡蛋的高品质。理想情况下,鸡蛋应该有一个坚定的皮质(保持形状后去jellying)。
- 成立一个转基因反应:
- 轻轻地(使用裁剪枪头)混合的原子核股票,并结合在1.5ml的Eppendorf管:
4μl原子核(〜4 - 8X10 5原子核)
2μL线性质粒(100ng/μl)
在室温下孵育5分钟。 - 孵化进展的同时,淡化0.5μL限制性内切酶4.5μlH 2 O和添加稀释的酶加入1μl18μl深圳发展银行,MgCl 2的2μL和高速提取物2μL。添加这种混合物的核质粒的反应。孵化10多分钟,膨胀的原子核。
- 在此孵化,鸡蛋挤2-3青蛙和半胱氨酸的解决方案,果冻。洗好(5X)1XMMR,并使用大口径吸管转移到每个琼脂糖以及菜含有0.2X孕产妇死亡率4%聚蔗糖的400-500 dejellied鸡蛋。这通常需要10分钟左右,所以一旦蛋菜准备的反应通常是准备来稀释。
- 开始一步约15-20分钟后,轻轻地削尖混合反应(核/提取/ DNA),并在室温下添加5μL至150μL康体发展局。在此稀释混合物的原子核是稳定的,约1小时。,而他们不保留,只要在浓混合气时左移植能力。
- 轻轻地(使用裁剪枪头)混合的原子核股票,并结合在1.5ml的Eppendorf管:
- 负载针:准备上述宽口枪头轻轻混合稀释后的反应,然后装入针及时,作为核管迅速将落户。回程针,削200μL枪头年底到了一块细聚乙烯管。绘制成枪头的解决方案,然后将其附加的针管,让溶液通过重力进入针或轻轻按下吸管柱塞。
- 附加针,泵管,并开始细胞核移植。注射应快速,浅,约鸡蛋的质膜垂直,以避免做损害。在血流建议(10nl/sec)速度,保持针在蛋〜0.5秒。你应该在20-30分钟内完成1-2个菜的移植。
注射后,留在16-20 ° C的菜,直到胚胎已达到4-8细胞阶段。远离非裂解邻居排序切割胚胎转移(用玻璃巴斯德吸管小费大约一个鸡蛋的直径相同)0.2XMMR 4%聚蔗糖到一个新的大盘。细分成更小的群体(10-15 / 6孔板胚胎)和文化0.2XMMR(无聚蔗糖)通过早期开发的100微克/毫升庆大霉素裂解胚胎。应检查在原肠胚,任何死亡的胚胎及时清除和媒体的需要更改。
故障排除:
- 针被堵塞针的解决方案,从流量应在移植明显。如果针可见颗粒物堵塞,更换针头或尝试以消除碎片,裁剪钳尖端,推动解决方案,通过针。
- 没有切割鸡蛋得到检查,精子细胞核和注射量的稀释适当的针是不是在移植封锁。如果注射量过高时,鸡蛋也可能不切割,而显示变色的色素沉着或损坏。
- 在原肠胚形成许多胚胎死亡。有几个因素可以提高胚胎存活率:
- 照顾,在制备过程中的细胞核和酶反应。 Decondensed原子核是脆弱的,需要使用上述的时间表被移植。不要置于冰上。
- 在酶反应和核转移的影响持续精子细胞核的染色体损伤的转基因频率和胚胎的正常发育。细胞核的染色体损伤,提高了转基因效率,但负面影响生存/正常发展。减少或省略限制性内切酶,在酶的潜伏期可以增强正常发展的速度,但可能会降低转基因或引入到胚胎基因组的质粒拷贝数的频率。
- 如果后期通过原肠期胚胎的囊胚显示变色或细胞死亡的迹象,它也有可能是用于移植的一种试剂是有毒的鸡蛋。此外,如果卵子s没有有一个坚定的皮质的,他们可能会接受exogastrulation,不能产生正常后原肠期胚胎。
- 表达转基因胚胎的数量是低的。限制性内切酶的增加量。
代表转基因胚胎的结果
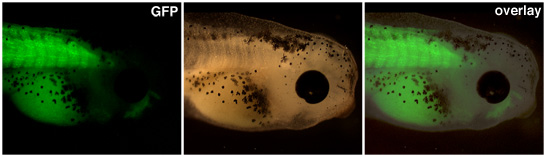
直到从利益的推动者表达是可见的,应提高核转让产生的转基因胚胎。在上面的图1中,肌动蛋白启动子驱动绿色荧光蛋白在这种转基因小蝌蚪的体节的表达。
讨论
对于每一个转基因构造进行测试,我们一般移植到500-1000鸡蛋核;在这个规模,我们可以产生转基因胚胎的表达每天10个不同的结构,取决于有多少女性是诱导产卵。在这些移植中,约三分之一的鸡蛋切割和60-80%,这些切割胚胎正常继续通过原肠。根据使用条件的反应,这些胚胎的10-50%之间,表达转基因利益。因此,一旦这个过程是在实验室建立的,它有可能为一名工人在一天的不同质粒表达的?...
披露声明
动物实验动物护理所规定的准则和法规的规定执行,并使用在华盛顿大学医学院委员会。
致谢
我们的工作经费由美国国立卫生研究院,March of Dimes的,和美国癌症协会提供。
材料
A.精子细胞核的准备
试剂:
- 1X孕产妇死亡率(氯化钙2MM 2,5MM HEPES,PH7.5,2mm的氯化钾,氯化镁1MM 2,100mm的氯化钠)。
- 0.1%Tricaine,甲烷磺酸(MS222,氨基甲酸乙酯,Sigma公司A - 5040),0.1%碳酸氢钠。溶于水。
- 2X核制备黄油(NPB)的。在一天的精子细胞核的准备,使从冻存的股票解决方案分装30毫升2X NPB:蔗糖1.5米(股票)500毫米,30毫米HEPES(1M股票;用KOH滴定,使pH值7.7在15毫米),1毫米的精胺trihydrochloride(Sigma公司的S - 2501; 10毫米股票),0.4毫米的精胺tetrahydrochloride(Sigma公司的S - 1141; 10 mM的股票),二硫苏糖醇(SIGMA D - 0632,100毫米存量)2毫米,2毫米EDTA(500毫米EDTA,pH值8.0)。
- 使用2XNPB使A. 30毫升1X NPB的,B. 10毫升1XNPB 3%牛血清白蛋白(组分V,Sigma公司A - 7906),C. 5毫升1XNPB 0.3%牛血清白蛋白。
- 溶血卵磷脂:100μL10 mg / ml的大号-α- LYSO,卵磷脂,蛋黄(Calbiochem,440154);使用前在室温下溶解。商店坚实的股票在20 ° C如果它变得粘稠,放弃股票粉。
- 牛血清白蛋白(BSA):10%(W / V)牛血清白蛋白(组分V,Sigma公司一个- 7906)化妆水5毫升,精子细胞核准备当天。
- 精子储存缓冲区(1毫升)1X NPB的,30%甘油,0.3%BSA。
- 精子稀释缓冲液:蔗糖250毫米,75毫米氯化钾,0.5毫米的精胺trihydrochloride,0.2毫米的精胺tetrahydrochloride。滴定pH值7.3-7.5和存储0.5-1毫升分装在20 ° C。
- 赫斯特(SIGMA的B - 2261)33342号,20轻紧船只存放在10毫克/毫升DH 2 O的股票° C。
设备:
- 水平转头和离心
- 棉布
- 清扫工具(镊子和剪刀)
- 荧光显微镜
- 漏斗
- 手套
- 血球
- 针(26计)
- 纸巾
- 培养皿(60毫米)
- 移液器
- 塑料(5和10 ml)
- Pipetman技巧(1毫升和200μL)
- 注射器(1毫升)
- 管(14毫升;猎鹰,2059)
- 管
- 微量(1.5毫升)
B.高速提取物的制备
试剂:
- 1X马克的修改林格(MMR):100毫米氯化钠,氯化钾2毫米,1毫米MgCl 2的氯化钙 ,2毫米,5毫米的HEPES,pH值7.5。准备10倍的股票,用NaOH调节pH至7.5。
- 20X提取缓冲液(预算外)盐股票:2米氯化钾, 氯化镁 2 20毫米,2毫米氯化钙 2,过滤,消毒和储存于4 ° C 。
- 提取缓冲液(预算外;新鲜配制和储存在冰):1X预算外盐,50毫米蔗糖,10MM的HEPES(1米的股票,用KOH滴定,使pH为7.7时,稀释至15毫米;过滤消毒,分装商店在20 ° C)。准备约100毫升。
- 2%(W / V)L -半胱氨酸盐酸盐一水合物:在使用前1X预算外盐和滴定,pH值用NaOH 7.8。准备约300毫升。
- CSF - XB:1X预算外盐,1毫米MgCl 2的 (除了MgCl 2的目前在预算外盐;终浓度为2毫米),10毫米的HEPES,pH值7.7,50毫米蔗糖,5毫米EGTA,pH值7.7。准备50毫升。
- 蛋白酶抑制剂:亮肽素,chymostatin,和胃酶抑素,每到一个终浓度为10毫克/毫升的二甲基亚砜(DMSO)溶解的混合物。商店在小分装在20 ° C
- 1个M 氯化钙 。
- 能源结构:150毫米的磷酸肌酸,20毫米ATP,20毫米氯化镁 2 。
- 孕马血清促性腺激素(PMSG):100 U /毫升PMSG(PG600 ®,英特威公司,021825)。易溶于水,储存在20 ° C
- 人绒毛膜促性腺激素(HCG):1000 U / ml的绒毛膜促性腺激素(CHORULON ®,英特威公司,057176)。易溶于水,储存在4 ° C
设备:
- 非洲爪蟾女性
- 针(18和26计)
- 巴斯德吸管
- 大口径
- 注射器(1毫升)
- 管,离心(0.5毫升)
- 管,厚壁聚碳酸酯(贝克曼,349622)
- 管,ultraclear(14 × 95毫米;贝克曼,344060)
- 超速离心机及转子(如美国贝克曼TL - 100转子SW 40钛和TLA 100.3)
- 对鸡蛋收集的烧杯
- 女蛙(如4 - L的网状盖塑料烧杯)控股的桶或容器。
C.核移植。
试剂:
- 在0.1XMMR 2.5%琼脂糖凝胶(注射菜)
- 2.5%的半胱氨酸在1XMMRpH8.0,准备一天的使用上
- 聚蔗糖
- 10毫克/毫升庆大霉素(1000X股票)
- 高速卵提取物(见上文)
- 100 MgCl 2的
- 10X的MMR(见上文)
- 限制性内切酶(如New England Biolabs公司的NotI)
- 精子稀释缓冲液(康体局;见上文)和精子细胞核(见上文)
- 上面的人绒毛膜促性腺激素(HCG)
- 矿物油(Sigma公司,M8410)
- 线性质粒转基因介绍:准备线性质粒的浓度约为100 ng /μL的无菌,无核酸酶的水(我们避免Tris和EDTA中的缓冲区,这是有点到胚胎毒性)。使用线性质粒限制性内切酶没有被用于核转移反应的相同。我们通常使用的所有反应NotI,不管什么质粒线性化。一些在反应中使用的酶稀释校准,可能是必要的,因为太多的酶后胚囊发展造成不利影响。纯化的质粒可以在几种不同的方式:我们通常使用的Qiagen公司Qiaquick PCR纯化试剂盒,根据制造商的方向;净化一个单一的条带从凝胶是没有必要的。如果质粒纯化采用酚/氯仿抽提,乙醇沉淀,一定的去除有机物和乙醇的所有痕迹。
设备:
注射用琼脂糖菜:在一个60毫米的塑料培养皿中,躺着一个小35mmX35mm权衡船在水中0.1XMMR熔融2.5%琼脂糖琼脂糖涂层底部填充用鸡蛋一个抑郁症。一旦琼脂糖硬化,在封口膜的包装和储存在4℃,直到使用C。在你计划做的每一个转基因反应提前2-3个菜。
输液泵:我们用一个单一的注射器输液泵从哈佛仪器,配备3毫升注射器/填充矿物油针(Sigma公司的M - 8410)。钝的注射器针头(保持射孔油管)和附加罚款聚乙烯管。 〜10nl/sec运行的泵;这个假设针在每个鸡蛋的时间将不超过1秒。泵应前几分钟开始前一天,以保证注射器的柱塞与活塞和积极,稳定的石油流管发生冲洗的转基因的运行。
针核转让。使用微量拉马,针长,倾斜的提示。剪辑与配备眼微米〜80微米的开放获取与斜面形状在解剖显微镜下forcep的这些。
其他设备: 爪蟾雌性,体视显微镜,培养箱,显微,显微注射针拉马(如模型P - 87,萨特),注射器针头(26计),玻璃微量注射针,眼显微注射针尖80μm的直径为校准裁剪微米,皮氏培养皿中,权衡船35毫米,聚乙烯管(ID = 1 / 32英寸,OD = 3 / 32英寸)
参考文献
- Kroll, K. L., Amaya, E. Transgenic Xenopus embryos from sperm nuclear transplantations reveal FGF signaling requirements during gastrulation. Development. 122, 3173-3183 (1996).
- Amaya, E., Kroll, K. L. A method for generating transgenic frog embryos. Methods Mol Biol. 97, 393-414 (1999).
- Murray, A. W. Cell cycle extracts. Methods Cell Biol. 36, 581-605 (1991).
- Hartley, K. O., Hardcastle, Z., Friday, R. V., Amaya, E., Papalopulu, N. Transgenic Xenopus embryos reveal that anterior neural development requires continued suppression of BMP signaling after gastrulation. Developmental Biology. 238, 168-184 (2001).
- Karaulanov, E., Knöchel, W., Niehrs, C. Transcriptional regulation of BMP4 synexpression in transgenic Xenopus. EMBO J. 23, 844-856 (2004).
- Ogino, H., Fisher, M., Grainger, R. M. Convergence of a head-field selector Otx2 and Notch signaling: a mechanism for lens specification. Development. 135, 249-2458 (2008).
- Taylor, J. J., Wang, T., Kroll, K. L. Tcf- and Vent-binding sites regulate neural-specific geminin expression in the gastrula embryo. Developmental Biology. 289, 494-506 (2006).
- Marsh-Armstrong, N., Huang, H., Berry, D. L., Brown, D. D. Germ-line transmission of transgenes in Xenopus laevis. Proceedings of the National Academy of Sciences of the United States of America. 96, 14389-14393 (1999).
- Offield, M. F., Hirsch, N., Grainger, R. M. The development of Xenopus tropicalis transgenic lines and their use in studying lens developmental timing in living embryos. Development. 127, 1789-1797 (2000).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。