A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
הפקה של טראנסגנטי Xenopus laevis על ידי שילוב אנזימים מתווכת הגבלת והשתלות גרעיני
In This Article
Summary
זה פרוטוקול וידאו מדגים שיטה להפקת מהונדס Xenopus laevis על ידי הכנסת transgenes לתוך גרעין הזרע בעקבות השתלת גרעיני ביצים מופרית.
Abstract
שילוב יציב של מוצרים גן משובט לתוך הגנום Xenopus יש צורך לשלוט על הזמן והמקום של ביטוי, להביע את הגנים בשלבים מאוחרים יותר של ההתפתחות העוברית, וכדי להגדיר כיצד משפרי ומקדמי לווסת התבטאות גנים בתוך העובר. פרוטוקול הפגינו כאן ניתן להשתמש כדי לייצר ביעילות מהונדס Xenopus laevis עוברים. גישה זו transgenesis כוללת שלושה חלקים: 1. גרעינים זרע מבודדים מבוגר X. laevis testis על ידי טיפול lysolecithin, אשר permeabilizes הממברנה הפלסמטית הזרע. 2. ביצה היא תמצית שהוכנה על ידי צנטריפוגה במהירות נמוכה, תוספת של סידן לגרום לחלץ להתקדם שלבי הביניים של מחזור התא, וכן צנטריפוגה במהירות גבוהה לבודד cytosol שלבי הביניים. 3. השתלת גרעיני: גרעין ותמצית בשילוב עם ה-DNA פלסמיד לינארית להיות הציג כמו transgene ואת כמות קטנה של אנזים הגבלה. במהלך התגובה קצר, לחלץ ביצה חלקית decondenses הכרומטין זרע האנזים הגבלה יוצרת הפסקות כרומוזומליות המקדמים של transgene רקומבינציה לתוך הגנום. גרעינים זרע שטופלו מושתלים מכן לתוך ביצים מופרית. שילוב של transgene מתרחשת בדרך כלל לפני המחשוף העוברית הראשונה כגון כי עוברי וכתוצאה מכך הם לא chimeric. עוברים אלו ניתן לנתח ללא כל צורך לגדל את הדור הבא, המאפשר לדור יעיל ומהיר של עוברים מהונדס עבור ניתוחים של האמרגן ותפקוד הגן. למבוגרים X. laevis הנובע הליך זה גם להפיץ את דרך transgene germline והוא יכול לשמש כדי ליצור שורות של חיות טרנסגניות למטרות מרובות.
Protocol
גרסאות של גישה זו transgenesis תוארו לראשונה בשנת 1 ו -2.
גרעינים א זרע הכנה
שיטה זו הכנה גרעינים מותאמת מוריי 3, אבל מעכבי פרוטאז הושמטו כפי שהם להפריע להתפתחות הבאות של ביצים המושתלים עם גרעיני זרע. Aliquots קפואים ב -80 מעלות וניתן להשתמש בו עבור השתלות במשך כ 6 חודשים.
כל הפתרונות צריכים להיות מוכנים והניח על הקרח לפני תחילת ההכנה.
- הרדימי 1-2 מבוגר זכר X. laevis על ידי טבילה Tricaine דקות לפחות 20 ואחריו pithing; להסיר את האשכים.
- מגלגלים את האשכים על מגבת נייר כדי להסיר את הדם, כלי הדם השומן בגוף, לשטוף אותם בקצרה בצלחת פטרי 60 מ"מ המכיל 1XMMR, ולהסיר כל החלקים הנוספים של השומן בגוף. הקפד לא לנקב את האשכים, כמו זה משחרר את הזרע.
- העברת האשכים אל צלחת פטרי יבש 60 מ"מ האשכים מרוכך עם מלקחיים עד שאין גושים נראים לעין. מסמוס צריך להיעשות כמו ביסודיות ככל האפשר כדי להשיג תשואות גבוהות של גרעינים.
- הוסף חוצץ 2mLs קר הכנה גרעיני (NPB: 1X ממלאי) את מרוכך פיפטה בעדינות מעלה ומטה.
- מרוכך Squirt על דרך 4 שכבות של אריג על משפך, איסוף לשפופרת 15 מ"ל (למשל Falcon 2059); לשטוף צלחת עם 8mLs של NPB ולשים זה לשטוף באמצעות גזה, איסוף זה בצינור. בידיים עטויות כפפות לסחוט את גזה כדי לאסוף נוזלים הנותרים לתוך הצינור.
- גלולה הזרע בסל"ד 3000 עבור 10 דקות. ב 4 מעלות צלזיוס הרוטור דלי מתנדנד (1480g למשל רוטור Sorvall HB-4 או שווה ערך) עם מתאמי הצינור המתאים. NPB להוסיף 8ml אל הצינור הזה פיפטה מעלה ומטה עם טפטפת מ"ל 10 עד resuspend גלולה;; למזוג supernatant ספין למטה שוב supernatant מעל למזוג. לאזן 1mL של NPB לטמפרטורת החדר במהלך הסיבוב.
- Resuspend גלולה ב NPB 1mL טמפרטורת החדר באמצעות 1 מ"ל pipetteman טיפ, להוסיף 50μl של lysolecithin 10mg/mL טריים, מערבבים בעדינות, דגירה של 5 דקות. בטמפרטורת החדר.
- הוסף 10 מ"ל BSA קר 1XNPB 3% ל הצינור כדי לעצור את התגובה lysolecithin, מערבבים בעדינות, ספין למטה 10 דקות ב 3000 סל"ד ב הרוטור דלי מתנדנד. למזוג supernatant. Lysolecithin שטופלו גלולה צריך להיראות קצת יותר שקוף (לבן אטום פחות) מאשר לפני הטיפול lysolecithin.
- למזוג supernatant ו resuspend גלולה ב 5 מ"ל קר NPB BSA 0.3%, לערבב בעדינות עם טפטפת 10 מ"ל ו - ספין למטה 10 דקות ב 3000rpm לעיל.
- למזוג supernatant ו resuspend גלולה ב 500μl של חיץ זרע אחסון והעברת צינור 1.5 מ"ל. זהו עכשיו במלאי הגרעינים שלך. חנות על הקרח בזמן לבדוק את התשואה של גרעינים.
- כדי לבדוק את התשואה של גרעינים, מקום 98 μl של חיץ זרע דילול (sdb), 1 μl של המניה גרעיני 1μl של דילול 1:100 של המניה Hoechst בצינור Eppendorf 1.5mL. מערבבים את מלאי גרעיני היטב באמצעות כתער מקוטע (או גדול הפתיחה) טיפ פיפטה רק לפני הסרת μl 1. מערבבים את sdb בדילול מלא / Hoechst / גרעינים היטב לאפשר כמות קטנה לזרום לתוך החדר של hemacytometer Neubauer משופרת על ידי פעולה נימי. ספירת גרעינים בכיכר של hemacytometer מתחת למיקרוסקופ המתחם. מ זכר אחד, אתה צריך להשיג סעיפים של לפחות 100-200 (X10 4 תאים / מ"ל) עבור דילול זה 1:100 של המניה ריכוז המניה חי של 1-2x10 5 תאים / μl. אם המניה שלך מרוכז פחות, בואו הגרעינים להתיישב במשך כמה שעות, להסיר חלק supernatant, ולספר. השאירו את הגרעינים ב 4 ° C למשך הלילה כדי לאפשר גליצרול לחדור עבור cryopreservation טוב יותר, ואז לערבב את מלאי גרעיני היטב עם טיפ גדול פתח פיפטה, להכין aliquots 20μl, ומקפיאים בחנקן נוזלי.
ב הכנת תמצית מהירות גבוהה
שיטה זו מותאמת מוריי 3 ומייצרת תמצית cytosolic שלבי הביניים אשר תקדם decondensation הכרומטין נפיחות חלקית של גרעיני זרע הוסיף. תמצית ניתן קפוא aliquots קטן -80 ° C ו להפשיר לפני השימוש.
- 3-5 ימים לפני הזריקה HCG, הממשלה 8-12 מבוגר הנשי X. laevis על ידי הזרקת 50 U של PMSG לתוך שק הלימפה הגבי. בערב שלפני הכנת תמצית, להזריק כל צפרדע עם 500 יחידות HCG ומקום 2 צפרדעים / מיכל לתוך 1XMMR ליטר 2. מאז צפרדע אחת עם lysing או הפעלת ביצים יכולים להתפשר על הכנת תמצית, רצוי להפריד צפרדעים לתוך זוגות לקראת הביוץ.
- למחרת בבוקר, להכין צמרמורת כל הפתרונות לפני תחילת ההכנה. בעדינות ידנית לגרש ביצים כל צפרדע לתוך b גדולeakers המכיל 1X MMR. מסך ביצים ממיכל כל להשמיט כל קבוצות של ביצים עם סימני lysing נימרו, או הפעלה (דמיינו על ידי התכווצות של פיגמנטציה בחצי הכדור החי) מן הנוהל. איסוף ביצים רצוף עם פיגמנטציה אפילו. ביצים טוב ניתן גם שנאספו MMR 1X ב דליים צפרדע. ההיקף הכולל של ביצים צריך להיות> 100 8-12 מ"ל מן הנקבות.
- De-ג'לי את הביצים. כדי לעשות זאת, להסיר MMR ככל האפשר, להוסיף כמות קטנה של פתרון ציסטאין, ומערבלים את הביצים. החלף עם פתרון ציסטאין טרי מספר פעמים במהלך דה קרישה. De-ג'לי כל אצווה של ביצים בנפרד ולמחוק קבוצות עם שבירה או הפעלת ביצה. מערבבים את שאר הביצים.
- לשטוף את הביצים ארבע פעמים ~ 35 מ"ל של תמצית חיץ (XB) ולאחר מכן פעמיים בתוך 25 מ"ל של CSF-XB עם מעכבי פרוטאז.
- כדי לארוז את הביצים: להעביר את הביצים לתוך צינורות Beckman ultraclear. אפשר ליישב את הביצים. הסר כמה CSF-XB האפשרי. צנטריפוגה את הביצים באמצעות SW Beckman 40 Ti הרוטור (רוטור או דומה) ב 1000 סל"ד (150 גרם) של ~ 60 שניות ב 4 ° C. הסר פתרון עודף מהחלק העליון של הביצים ארז.
- כדי לרסק את הביצים ליצור cytoplasmic לחלץ: צנטריפוגה את הביצים על 10,000 סל"ד (16,000 ז) עבור 10 דקות ב 4 ° C. הביצים צריך להפריד לשלוש שכבות: שומנים בדם (למעלה), הציטופלסמה (במרכז) וחלמון (התחתון). איסוף שכבת cytoplasmic מהצינור כל אחד עם מחט 18-מד ידי החדרת מחט דרך הצינור בבסיס שכבת cytoplasmic. מעבירים את הציטופלסמה אל צינור טרי Beckman ultraclear על הקרח.
- הוסף מעכבי הפרוטאז כדי הציטופלסמה מבודד לריכוז סופי של 1X. Recentrifuge הציטופלסמה ב g 16,000 עבור 10 דקות ב 4 ° C. אסוף את הציטופלסמה הבהיר כמתואר לעיל. מצפה לקבל 0.75-1 הציטופלסמה mL / צפרדע.
- מוסיפים 1 / 20 מהנפח תמצית של תמהיל האנרגיה המדגם. העברה לתוך הציטופלסמה עבה חומה צינורות פוליקרבונט עבור ultracentrifuge TL-100 Beckman. צינורות להחזיק כ 3 מ"ל כל אחד צריך להיות לפחות חצי מלא.
- הוסף 1 M CaCl 2 אל צינור כל לריכוז סופי של 0.4 מ"מ. דגירה צינורות במשך 15 דקות בטמפרטורת החדר. זה inactivates CSF ודוחף את תמצית לתוך שלבי הביניים.
- מאזן צינורות צנטריפוגה אותם ultracentrifuge TL-100 Beckman באמצעות הרוטור 100.3-TLA ב 70,000 סל"ד (200,000 גרם) במשך 1.5 שעות ב 4 ° C. הציטופלסמה יהיה fractionate לארבע שכבות, מלמעלה למטה:, שומנים cytosol, קרום / המיטוכונדריה, ואת גליקוגן / ריבוזומים.
- הסירו את השכבה cytosolic מהצינור כל (~ 1 מ"ל אם 2-3 מ"ל נטען לתוך הצינור) על ידי החדרת המזרק לתוך החלק העליון של הצינור דרך שכבת השומנים. העברת חלק cytosolic לצינורות טריים recentrifuge דגימות ב 70,000 סל"ד (200,000 גרם) במשך 20 דקות ב 4 ° C.
- Aliquot supernatant תוך 25-μl aliquots ב 0.5-מ"ל צינורות. מהיר להקפיא את aliquots בחנקן נוזלי חנות ב -80 ° C עד השימוש. כדי לקבוע אם לחלץ את יעיל, גרעינים זרע יכול להיות מודגרות בתמצית ומוכתמים Hoechst כדי לקבוע אם הגרעינים בעליל להתנפח (לעבות ולהאריך) בתוך 10 דקות של תוספת בטמפרטורת החדר.
ג התגובה Transgenesis והעברת גרעיני
חשוב: בדוק פתרונות, ציוד צפרדעים יהיו מוכנים לגמרי לפני תחילת התגובה. ברגע שתתחיל, אתה חייב להמשיך עם התגובה באמצעות לוח זמנים משוער המתוארים להלן, שכן מרכיבים רבים אינם נשארים יציבים> 30 דקות. בעוד מניות גרעין הזרע נשמר על הקרח, תגובות transgenesis (הן בדילול ומרוכז) יש לשמור בטמפרטורת החדר.
- צפרדעים נקבה הממשלה. ערב לפני transgenesis, להזריק מספר (3-5) נשים צפרדע מבוגר עם 800 יחידות HCG בשק הלימפה הגב להשיג טרי ביצים בתחילת למחרת.
- יום של ההליך transgenesis, להכין או להביא לטמפרטורה הפתרונות הדרושים transgenesis:
- ציסטאין טריים (2.5% ב 1XMMR, pH8.0). יהיה עליך כמה מאות מיליליטר לשמש באותו יום.
- 0.2XMMR Ficoll 6% עבור מנות השתלה ושחזור של עוברים מהונדס ו 0.2XMMR 100 מיקרוגרם / מ"ל גנטמיצין (ללא Ficoll) לגיוס עוברים. פתרונות לא צריך להיות חם יותר מאשר 18-21 מעלות צלזיוס ועוברים מהונדס יש להעלות דרך השסעים מוקדם בטמפרטורות שבין 16 ו - 21 ° C, שכן בטמפרטורות גבוהות הן להשפיע לרעה על תדירות transgenesis ואת ההתפתחות העוברית.
- להפשיר לאזן את הטמפרטורה בחדר aliquots קפוא של sdb (דילול מאגר זרע) עבור השתלות של היום, להפשיר את תמצית מהירות במקום גבוה על הקרח, ולהכין 100mm MgCl 2 פתרון.
- צא הדואר agarose מנות הזרקה ולמלא עם פתרון ה-MMR / Ficoll, ולהקים מראש להפעיל את משאבת עירוי כדי לייצב את הזרימה.
- בדוק כי צפרדעים הנקבה להטיל ביצים הם באיכות גבוהה. באופן אופטימלי, צריך ביצים קליפה המשרד (להחזיק צורה אחרי דה קרישה).
- הגדרת התגובה transgenesis:
- מאוד בעדינות (בעזרת פיפטה טיפ מקוטע) לערבב את מניות גרעין ולשלב בתוך שפופרת 1.5mL Eppendorf:
גרעינים 4μl (~ 4-8x10 5 גרעינים)
2μl לינארית פלסמיד (100ng/μl)
דגירה 5 דקות בטמפרטורת החדר. - זמן הדגירה הוא הליך, לדלל 0.5μl של אנזים הגבלה ב 4.5μl H 2 O ולהוסיף 1μl של אנזים מדולל כדי 18μl של sdb, 2μl של MgCl 2 ו 2μl של תמצית במהירות גבוהה. מוסיפים את התערובת לתגובה גרעינים, פלסמיד. דגירה 10 דקות יותר להתנפח את הגרעינים.
- במהלך הדגירה זה, לסחוט ביצים 2-3 צפרדעים דה ג'לי בפתרון ציסטאין. לשטוף אותם היטב (5X) עם 1XMMR, ולהשתמש פיפטה נשא רחב להעביר ביצים dejellied 400-500 על כל מנה agarose היטב המכיל 0.2X Ficoll MMR 4%. בדרך כלל זה לוקח בערך 10 דקות, אז פעם אחת המנות ביצה מוכנים התגובה היא בדרך כלל מוכן לדלל.
- כ 15-20 דקות לאחר תחילת שלב, לערבב בעדינות את התגובה (גרעינים / לחלץ / DNA) עם טיפ מקוטע ולהוסיף על 5μl עד 150 sdb μl בטמפרטורת החדר. גרעינים בתערובת זו בדילול יציבים כ 1 שעות., בעוד שהם לא שומרים על כושר השתלת עוד כאשר נותרו תערובת מרוכזת.
- מאוד בעדינות (בעזרת פיפטה טיפ מקוטע) לערבב את מניות גרעין ולשלב בתוך שפופרת 1.5mL Eppendorf:
- טען את מחט: מערבבים את התגובה בדילול מוכן מעל בעדינות עם קצה פתח רחב פיפטה, ולאחר מכן לטעון את המחט מיד, כמו גרעינים יישב במהירות בצינור. כדי המחט backload, במקום חתיכת צינור Tygon קנס על סיום קצה מקוטע פיפטה 200μl. צייר את הפתרון אל קצה פיפטה, ואז לצרף את צינורות אל המחט ויאפשר פתרון כדי להזין את המחט על ידי כוח הכבידה או מדכא בעדינות על הבוכנה פיפטה.
- צרף מחט לשאוב צינורות ולהתחיל השתלות של גרעינים. זריקות צריך להיות מהיר, רדוד כ בניצב הממברנה הפלסמטית של הביצית, כדי למנוע נזק. בקצב של זרימת הציע (10nl/sec), לשמור את המחט הביצה עבור ~ 0.5 שניות. אתה צריך להשלים 1-2 מנות של השתלות בתוך 20-30 דקות.
לאחר זריקות, להשאיר את הכלים ב 16-20 מעלות צלזיוס עד העוברים הגיעו לשלב 4-8 תאים. מיין עוברים ביקוע מן השכנים הלא השחיטה שלהם על ידי העברת (עם פיפטה פסטר זכוכית עם טיפ בערך בקוטר זהה ביצה) כדי בקערה גדולה טרי Ficoll 0.2XMMR 4%. לחלק את העוברים ביקוע לקבוצות קטנות (10-15 עוברים / גם צלחת 6-באר) ותרבות 0.2XMMR (אין Ficoll) 100 מיקרוגרם / מ"ל גנטמיצין דרך בהתפתחות המוקדמת. לעוברים יש לבדוק במהלך gastrulation עם כל העוברים למות להסיר לאלתר את התקשורת השתנתה לפי הצורך.
פתרון בעיות:
- מחט חסומה: זרימה פתרון מן המחט צריכה להיות ברורה במהלך השתלות. אם המחט נחסם על ידי חומר חלקיקי לעין, לשנות מחטים או לנסות להסיר את הלכלוך על ידי חיתוך קצה עם מלקחיים ודוחף פתרון דרך המחט.
- אין ביצים ביקוע מתקבלים: לבדוק דילולים של גרעיני זרע ונפח ההזרקה מתאימים וכי מחט לא נחסמה במהלך ההשתלה. אם נפח הזרקה גבוה מדי, ביצים יכול גם לא לדבוק ובמקום להראות פיגמנטציה או נזק ודהוי.
- עוברים רבים מתים במהלך gastrulation. מספר גורמים יכולים לשפר את ההישרדות העובר:
- לטפל עם גרעינים במהלך הכנת התגובה האנזימטית. גרעינים Decondensed שבירים ויש צורך המושתלים באמצעות לוח הזמנים לעיל. אין למקם אותם על הקרח.
- הנזק שנגרם כרומוזומליות גרעיני זרע במהלך התגובה אנזים והעברת גרעיני משפיע על תדירות transgenesis לבין התפתחות תקינה של עוברים. נזק כרומוזומלית אל הגרעינים משפר את היעילות של transgenesis אבל משפיעה לרעה על ההישרדות / התפתחות תקינה. הקטנת או השמטת אנזים הגבלה במהלך הדגירה את האנזים יכולים לשפר את קצב התפתחות תקינה, אך עשוי להקטין תדירות transgenesis או מספר עותק הפלסמיד מוחדר בגנום העובר.
- אם blastula מאוחר עוברים דרך gastrula להראות סימנים של שינוי צבע או מוות של תאים אפשר גם כי מגיב המשמש השתלות היה רעיל את הביצים. בנוסף, אם ביצהזה לא צריך קליפה המשרד, הם עשויים לעבור exogastrulation ולא מצליחים ליצור נורמלי שלאחר gastrula עוברים.
- מספר עוברי המבטא את transgene נמוכה. להגדיל את כמות אנזים הגבלה.
נציג העובר תוצאות טראנסגנטי
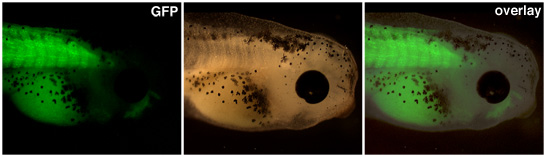
עוברים טראנסגנטי כתוצאה מהעברות גרעיני יש להעלות עד ביטוי מן האמרגן של עניין נראה לעין. באיור 1 לעיל, מקדם אקטין בשריר כוננים הביטוי של חלבון פלואורסצנטי ירוק את somites של הראשן זה מהונדס.
Discussion
עבור כל אחד לבנות מהונדס להיבדק, אנחנו בדרך כלל השתלת גרעינים לתוך 500-1000 ביצים, בקנה המידה הזה, אנחנו יכולים ליצור עוברים מהונדס המבטא עד 10 מבנים שונים ליום, תלוי כמה נקבות רבות המושרה להטיל ביצים. של השתלות אלו, כשליש לדבוק ביצים 60-80% מהם עוברים דרך gastrulation ביקוע להמשיך ?...
Disclosures
ניסויים בבעלי חיים בוצעו בהתאם להנחיות והתקנות שנקבעו על ידי טיפול בבעלי חיים ושימוש ועדת באוניברסיטת וושינגטון בית הספר לרפואה.
Acknowledgements
המימון עבודתנו מסופק על ידי ה-NIH, מצעד הפרוטות, ואת האגודה האמריקנית למלחמה בסרטן.
Materials
גרעינים א זרע הכנה
ריאגנטים:
- 1X MMR (2mm CaCl 2, HEPES 5mm, pH7.5, 2mm KCl, 1mm MgCl 2, NaCl 100mm).
- 0.1% Tricaine Methanesulfonate (MS222, aminobenzoic חומצה אתיל אסתר, Sigma A-5040), סודיום ביקרבונט 0.1%. להתמוסס במים.
- חמאת 2X הכנה גרעיני (NPB). ביום הכנת הגרעינים זרע, לפצות 30 מ"ל NPB 2X מ aliquots של פתרונות מניות מאוחסנים קפוא: סוכרוז 500 מ"מ (1.5 המניות M), 30 HEPES מ"מ (1M המניות; לכיל עם KOH כך pH 7.7 נמצא 15 מ"מ), 1 spermidine mM trihydrochloride (Sigma S-2501: 10 מניות מ"מ), 0.4 mM tetrahydrochloride spermine (Sigma S-1141: 10 מניות מ"מ), 2 מ"מ dithiothreitol (Sigma D-0632: 100 מניות מ"מ), 2 מ"מ EDTA (500 mM EDTA, pH 8.0).
- השתמש 2XNPB לעשות א 30 מ"ל 1X NPB, ב 10 מ"ל 1XNPB 3% BSA (חלק V, Sigma A-7906), כ 5 מ"ל 1XNPB 0.3% BSA.
- Lysolecithin: 100 μl של 10 מ"ג / מ"ל L-α-lyso, לציטין, חלמון ביצה (Calbiochem, 440,154); מתמוססים בטמפרטורת החדר לפני השימוש. חנות מניות מוצק בטמפרטורה של 20 ° C. מחק את אבקת המניות אם הוא הופך להיות דביק.
- שור בסרום אלבומין (BSA): 10% (w / v) BSA (חלק V, Sigma A-7906) מאפרים 5 מ"ל מים ביום הכנת גרעיני זרע.
- אחסון זרע חיץ (1ml) 1X NPB, גליצרול 30%, BSA 0.3%.
- דילול חיץ זרע: סוכרוז 250 מ"מ, 75 מ"מ KCl, spermidine trihydrochloride 0.5 מ"מ, 0.2 mM tetrahydrochloride spermine. לכיל ל-pH 7.3-7.5 ולאחסן aliquots 0.5-1 מ"ל ב 20 ° C.
- Hoechst מס '33342 (Sigma B-2261): 10 מ"ג / מ"ל המניות DH 2 O, חנות כלי חזק אור ב 20 ° C.
ציוד:
- דלי הרוטור נדנוד צנטריפוגות
- גזה
- דיסקציה של כלים (מלקחיים ומספריים)
- מיקרוסקופ פלואורסצנטי
- משפך
- כפפות
- hemocytometer
- מחטים (26 מד)
- מגבות נייר
- צלחות פטרי (60 מ"מ)
- pipettes
- פלסטיק (5 ו - 10 מ"ל)
- Pipetman טיפים (1 מ"ל ו 200μl)
- מזרקים (1 מ"ל)
- צינורות (14 מ"ל; פלקון, 2059)
- צינורות
- microcentrifuge (1.5 מ"ל)
ב הכנת תמצית מהירות גבוהה
ריאגנטים:
- 1X מארק השתנה Ringer (MMR): 100 מ"מ NaCl, KCl mM 2, 1 mM MgCl 2, 2 מ"מ CaCl 2, 5 HEPES מ"מ, pH 7.5. הכינו מלאי 10X, ולהתאים pH עם NaOH עד 7.5.
- 20X חלץ חיץ (XB) מניות מלח: 2 M KCl, 20 מ"מ MgCl 2, 2 מ"מ CaCl 2, מסנן לעקר ולאחסן ב 4 ° C.
- תמצית חיץ (XB, שזה עתה הוכנו מאוחסנים על הקרח): 1X XB מלחים, סוכרוז 50 מ"מ, HEPES 10mm (1 מ 'מניות, עם KOH טיטרציה pH כך כי הוא 7.7 כאשר מדולל ל 15 מ"מ; פילטר לעקר, ולאחסן aliquots בשעה 20 ° C). הכן על 100 מ"ל.
- 2% (w / v) L-ציסטאין הידרוכלוריד 1-מימה: Made למעלה 1X מלחי XB לפני השימוש טיטרציה pH 7.8 עם NaOH. הכן על 300 מ"ל.
- CSF-XB: 1X מלחי XB, 1 mM MgCl 2 (בנוסף MgCl 2 המצויים מלחי XB; הריכוז הסופי 2 מ"מ), 10 HEPES מ"מ, pH 7.7, סוכרוז 50 מ"מ, 5 מ"מ EGTA, pH 7.7. הכן 50 מ"ל.
- מעכבי פרוטאז: תערובת של leupeptin, chymostatin ו pepstatin, כל מומסים לריכוז סופי של 10 מ"ג / מ"ל sulfoxide דימתיל (DMSO). אחסן aliquots קטן 20 ° C.
- 1 M CaCl 2.
- תמהיל אנרגיה: 150 mM קריאטין פוספט, 20 mM ATP, 20 מ"מ MgCl 2.
- בהריון Mare סרום גונדוטרופין (PMSG): 100 U / ml PMSG (PG600 ®, Intervet, Inc, 021,825). מתמוססים במים ומאוחסנים בטמפרטורה של 20 ° C.
- כוריוני אנושי גונדוטרופין (HCG): 1000 U / ml HCG (CHORULON ®, Intervet, Inc, 057,176). מתמוססים במים מאוחסנים 4 ° C.
ציוד:
- Xenopus laevis נקבות
- מחטים (18 ו - 26 מד)
- פיפטה פסטר
- רחב לשעמם
- מזרקים (1 מ"ל)
- צינורות, microcentrifuge (0.5 מ"ל)
- צינורות, בעובי קיר פוליקרבונט (Beckman, 349,622)
- צינורות, ultraclear (14 x 95 מ"מ; Beckman, 344,060)
- Ultracentrifuge ו הרוטורים (למשל, Beckman TL-100 עם רוטורים SW 40 טי ו-TLA 100.3)
- כוסות איסוף ביצים
- דליים או מיכלי לקיום צפרדעים הנשי (למשל, 4-L כוסות פלסטיק עם מכסים רשת).
ג השתלה גרעינית.
ריאגנטים:
- Agarose 2.5% ב 0.1XMMR (להכנת מנות הזרקה)
- ציסטאין 2.5% ב 1XMMR, PH8.0, שהוכן ביום להשתמש
- Ficoll
- 10 מ"ג / מ"ל gentamycin (מניות 1000x)
- מהירות גבוהה לחלץ ביצה (ראה לעיל)
- 100 MgCl 2
- MMR 10X (ראה לעיל)
- הגבלת אנזים (למשל NotI מניו אינגלנד Biolabs)
- דילול זרע חיץ (sdb: ראה לעיל) גרעינים זרע (ראה לעיל)
- גונדוטרופין כוריוני אנושי (HCG) לעיל
- שמן מינרלי (Sigma, M8410)
- לינארית פלסמיד להיות הציג כמו transgene: הכן לינארית פלסמיד בריכוז של כ - 100 ng / μl ב סטרילי, nuclease ללא מים (אנו נמנעים טריס ו EDTA המכילים מאגרים, שהם רעילים מעט עוברים). אנזים הגבלה משמש linearize הפלסמיד אינו חייב להיות זהה לזה המשמש בתגובה העברת גרעיני. אנחנו בדרך כלל להשתמש NotI לתגובות כל, ולא משנה מה היא לינארית עם פלסמיד. חלק כיול של דילול האנזים המשמש התגובה עשוי להיות נחוץ, אנזים כמו יותר מדי יכול לגרום להשפעות שליליות על התפתחות שלאחר gastrula. פלסמיד יכול להיות מטוהרים במספר דרכים שונות: בדרך כלל אנו משתמשים Qiaquick Qiagen ערכת טיהור PCR על פי הנחיות היצרנים, טיהור של להקה אחת מן ג'ל אינו הכרחי. אם הפלסמיד הוא מטוהרים באמצעות פנול / כלורופורם עקירות ומשקעים אתנול, להיות בטוח כדי להסיר את כל עקבות של חומרים אורגניים ואתנול.
ציוד:
מנות agarose להזרקה: ב 60 מ"מ צלחת פטרי מפלסטיק, להניח 35mmX35mm קטן שוקל סירה על agarose 2.5% מותך 0.1XMMR מים כדי ליצור דיכאון עם תחתית agarose מצופה למילוי עם ביצים. לאחר agarose התקשה, עוטפים ומאחסנים parafilm ב 4 ° C עד השימוש. בצע 2-3 מנות מראש על כל תגובה מהונדס אתה מתכנן לעשות.
משאבת עירוי: אנו משתמשים מזרק אחד אינפוזיה משאבה מ Apparatus הרווארד, מצויד מזרק 3 סמ"ק / מחט מלא שמן מינרלי (Sigma M-8410). בלאנט את מחט המזרק קצה (כדי למנוע ממנו ניקוב בצינור) וכן לצרף את צינורות tygon בסדר. הפעל את המשאבה ב ~ 10nl/sec; זו מניחה כי זמן המחט היא כל ביצה לא יהיה גדול מ -1 שניות. משאבה צריך להיות מראש לרוץ במשך כמה דקות לפני transgenesis החל היום כדי להבטיח את הבוכנה של המזרק הוא מיושר עם בוכנה וכי תזרים חיובי יציב של שמן מתוך הצינור מתרחש.
מחטים עבור העברות גרעיני. בעזרת חולץ micropipette, ליצור עם מחטים, טיפים ארוך משופע. תמונות אלה עם המלקחיים תחת מיקרוסקופ לנתח מצויד מיקרומטר עינית להשיג ~ 80 מיקרון הפתיחה עם צורה משופעים.
ציוד נוסף: Xenopus laevis נקבות, stereomicroscope, חממה, micromanipulator, מחט microinjection חולץ (למשל דגם P-87, סאטר), מחטי מזרק (26 מד), microinjection מחטים זכוכית, מיקרומטר עינית מכויל עבור קטיעה של מחט טיפים microinjection לקוטר 80μm, בצלחות פטרי, לשקול סירות 35mm, צינורות Tygon (ID = 1 / 32 בו, OD = 3 / 32 אינץ')
References
- Kroll, K. L., Amaya, E. Transgenic Xenopus embryos from sperm nuclear transplantations reveal FGF signaling requirements during gastrulation. Development. 122, 3173-3183 (1996).
- Amaya, E., Kroll, K. L. A method for generating transgenic frog embryos. Methods Mol Biol. 97, 393-414 (1999).
- Murray, A. W. Cell cycle extracts. Methods Cell Biol. 36, 581-605 (1991).
- Hartley, K. O., Hardcastle, Z., Friday, R. V., Amaya, E., Papalopulu, N. Transgenic Xenopus embryos reveal that anterior neural development requires continued suppression of BMP signaling after gastrulation. Developmental Biology. 238, 168-184 (2001).
- Karaulanov, E., Knöchel, W., Niehrs, C. Transcriptional regulation of BMP4 synexpression in transgenic Xenopus. EMBO J. 23, 844-856 (2004).
- Ogino, H., Fisher, M., Grainger, R. M. Convergence of a head-field selector Otx2 and Notch signaling: a mechanism for lens specification. Development. 135, 249-2458 (2008).
- Taylor, J. J., Wang, T., Kroll, K. L. Tcf- and Vent-binding sites regulate neural-specific geminin expression in the gastrula embryo. Developmental Biology. 289, 494-506 (2006).
- Marsh-Armstrong, N., Huang, H., Berry, D. L., Brown, D. D. Germ-line transmission of transgenes in Xenopus laevis. Proceedings of the National Academy of Sciences of the United States of America. 96, 14389-14393 (1999).
- Offield, M. F., Hirsch, N., Grainger, R. M. The development of Xenopus tropicalis transgenic lines and their use in studying lens developmental timing in living embryos. Development. 127, 1789-1797 (2000).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved