Se requiere una suscripción a JoVE para ver este contenido. Inicie sesión o comience su prueba gratuita.
Method Article
La producción de transgénicos Xenopus laevis Integración mediada por la enzima de restricción y transferencia nuclear
En este artículo
Resumen
Este protocolo de vídeo se muestra un método para la generación de transgénicos Xenopus laevis Por la introducción de transgenes en los núcleos de esperma seguido por transplante nuclear en óvulos no fertilizados.
Resumen
La integración estable de productos de los genes clonados en el genoma de Xenopus es necesario para controlar el tiempo y el lugar de expresión, para expresar los genes en las etapas posteriores del desarrollo del embrión, y para definir cómo potenciadores y promotores de regular la expresión génica en el embrión. El protocolo ha demostrado aquí se puede utilizar para producir de manera eficiente transgénicos Xenopus laevis embriones. Este enfoque implica la transgénesis tres partes: 1. Los núcleos de los espermatozoides están aislados de adultos X. laevis testículos mediante el tratamiento con lisolecitina, que permeabilizes la membrana plasmática del espermatozoide. 2. Extracto de huevo se prepara por centrifugación a baja velocidad, además de calcio para hacer que el extracto de avanzar a la interfase del ciclo celular, y una centrifugación de alta velocidad para aislar el citosol de la interfase. 3. Transplante nuclear: los núcleos y el extracto se combinan con el ADN de plásmido linealizado para ser presentado como el transgén y una pequeña cantidad de enzima de restricción. Durante una reacción a corto, extracto de huevo parcialmente decondenses la cromatina de los espermatozoides y la enzima de restricción genera roturas cromosómicas que promueven la recombinación de los transgenes en el genoma. Los núcleos de los espermatozoides tratados son luego trasplantadas en los huevos no fertilizados. La integración del transgén ocurre generalmente antes de la primera división embrionaria de tal manera que los embriones resultantes no son quiméricos. Estos embriones pueden ser analizados sin necesidad de criar a la próxima generación, lo que permite la generación eficiente y rápida de los embriones transgénicos para el análisis del promotor y la función del gen. Adultos X. laevis como resultado de este procedimiento también se propagan los transgenes a través de la línea germinal y se puede utilizar para generar líneas de animales transgénicos con fines múltiples.
Protocolo
Versiones modificadas de este enfoque transgénesis fueron inicialmente descritos en 1 y 2.
Los espermatozoides A. núcleos preparación
Este método de preparación núcleos es una adaptación de Murray 3, pero los inhibidores de la proteasa se han omitido, ya que interfieren con el desarrollo posterior de los huevos trasplantados con núcleos de los espermatozoides. Alícuotas se congelan a -80 ° C y puede ser utilizado en los trasplantes de aproximadamente 6 meses.
Todas las soluciones deben ser preparados y colocados en hielo antes de comenzar la preparación.
- Anestesiar a 2.1 varones adultos X. laevis por inmersión en tricaína por lo menos durante 20 minutos seguido de descabello; extirpar los testículos.
- Rollo de los testículos en una toalla de papel para quitar la sangre, los vasos sanguíneos y grasa corporal, lavar brevemente en una placa de Petri de 60 mm que contiene 1XMMR, y eliminar cualquier pieza adicional de la grasa corporal. Tenga cuidado de no perforar los testículos, ya que esto libera el esperma.
- La transferencia de los testículos a un seco de 60 mm placa de Petri y los testículos macerar con unas pinzas hasta que no haya trozos visibles. Maceración se debe hacer tan a fondo como sea posible para obtener altos rendimientos de los núcleos.
- Añadir 2mls tampón frío preparación nuclear (NPB, 1X de stock) para el macerado y suavemente la pipeta hacia arriba y abajo.
- Squirt macerar por unos 4 estopilla de un grosor de un embudo, recoger en un tubo de 15 ml (por ejemplo, Falcon 2059); Enjuague plato con 8mLs de NPB y poner esta aclaración a través de la gasa, la recogida en el tubo. Con las manos enguantadas apretar la gasa para recoger el líquido residual en el tubo.
- Se precipitan los espermatozoides a 3.000 rpm durante 10 min. a 4 ° C en un rotor basculante (1480g por ejemplo, en un Sorvall HB-4 del rotor o equivalente) con los adaptadores de tubo apropiado. Decantar el sobrenadante, añadir NPB 8 ml de este tubo y la pipeta hacia arriba y hacia abajo con una pipeta de 10 mL para volver a suspender pellet, girar de nuevo como antes, y se decanta el sobrenadante. Equilibre 1 ml de NPB a temperatura ambiente durante el giro.
- Resuspender el pellet en 1 ml NPB temperatura ambiente usando un 1 mL pipetteman punta, agregar 50μl de lisolecitina 10mg/mL recién hecho, mezclar suavemente e incubar durante 5 min. a temperatura ambiente.
- Agregar 10 ml de BSA frío 1XNPB 3% en el tubo para detener la reacción lisolecitina, mezclar suavemente y centrifugar durante 10 minutos a 3000 rpm en un rotor basculante. Decantar el sobrenadante. El pellet lisolecitina tratado debería ser un poco más transparente (menos blanco opaco) que lo hizo antes del tratamiento lisolecitina.
- Decantar el sobrenadante y resuspender el pellet en 5 ml de BSA frío NPB 0,3%, mezclar suavemente con una pipeta de 10 ml y centrifugar durante 10 minutos a 3.000 rpm que el anterior.
- Decantar el sobrenadante y el precipitado se resuspende en 500μl de buffer de almacenamiento de esperma y transferir a un tubo de 1,5 ml. Este es ahora su acción núcleos. Guárdelo en hielo mientras se revisa el rendimiento de los núcleos.
- Para comprobar el rendimiento de los núcleos, el lugar 98 l de tampón de dilución de esperma (SDB), 1 l de las acciones nucleares y 1μl de dilución 1:100 de las acciones de Hoechst en un tubo Eppendorf 1,5 ml. Mezcla de las acciones nucleares muy bien con una maquinilla de afeitar-recortada (o gran apertura) punta de la pipeta justo antes de la eliminación de la l 1. Mezcla de los gases de SDB / Hoechst / núcleos muy bien y deje una pequeña cantidad de flujo en la cámara de un mejor hemocitómetro Neubauer por capilaridad. Contar con núcleos en una plaza del hemocitómetro bajo un microscopio compuesto. De un hombre, usted debe obtener los recuentos de por lo menos 100 a 200 (X10 4 células / ml) de esta dilución 1:100 de las acciones para una concentración de acciones sin diluir de 1-2x10 5 células / microlitro. Si su acción es menos concentrado, que los núcleos de resolver durante varias horas, eliminar algunas de las sobrenadante, y el recuento. Deje los núcleos a 4 ° C durante la noche para permitir que el glicerol para penetrar mejor para la criopreservación, a continuación, mezclar la acción nuclear y con un gran orificio punta de la pipeta, preparar alícuotas de 20μl, y la congelación en nitrógeno líquido.
B. Preparación del extracto de alta velocidad
Este método es una adaptación de Murray 3 y produce un extracto de la interfase citosólica que promuevan la descondensación de la cromatina y la hinchazón parcial de los núcleos de los espermatozoides añadió. Extracto se puede congelar en pequeñas alícuotas a -80 ° C y descongelar antes de su uso.
- 3-5 días antes de la inyección de HCG, el primer 8.12 de mujeres adultas X. laevis mediante la inyección de 50 U de PMSG en el saco linfático dorsal. La noche antes de la preparación del extracto, se inyecta cada rana con 500 unidades de HCG y el lugar dos ranas / contenedor en 2 1XMMR litros. Desde una rana con lisis o activación de los huevos puede poner en peligro la preparación del extracto, es aconsejable separar las ranas en parejas para la ovulación.
- A la mañana siguiente, preparar y refrigerar todas las soluciones antes de comenzar la preparación. Suavemente, de forma manual expulsar a los huevos de rana en cada gran beakers contiene 1X MMR. Pantalla de los huevos de cada recipiente y omitir los lotes de huevos con signos de manchas, o la activación de lisis (visualizado por la contracción de la pigmentación en el hemisferio animal) por el procedimiento. Recoger los huevos ininterrumpida con la pigmentación. Buenos huevos también pueden ser recogidos de la MMR 1X en los cubos de la rana. El volumen total de los huevos debe ser> 100 ml de 8.12 las mujeres.
- De jalea los huevos. Para ello, retire MMR tanto como sea posible, agregue una pequeña cantidad de solución de cisteína, y agitar los huevos. Vuelva a colocar con una solución de cisteína fresca varias veces durante el de-gelificante. De jalea cada lote de huevos por separado y desechar lotes con rotura o la activación del huevo. Combine el resto de los huevos.
- Lavar los huevos cuatro veces en el ~ 35 ml de tampón de extracción (EP), y luego dos veces en 25 ml de LCR-XB con inhibidores de la proteasa.
- Para empacar los huevos: la transferencia de los huevos en los tubos Beckman ultraclaros. Que los huevos a un acuerdo. Eliminar la mayor cantidad de LCR-XB como sea posible. Centrifugar los huevos con un Beckman SW 40 Ti rotor (rotor o similar) a 1000 rpm (150 g) de ~ 60 segundos a 4 ° C. Retire el exceso de solución de la parte superior de los huevos embalados.
- Para aplastar los huevos y el extracto de generar citoplasma: los huevos centrífuga a 10.000 rpm (16.000 g) durante 10 min a 4 ° C. Los huevos se deben separar en tres capas: lipídica (arriba), el citoplasma (centro), y la yema (parte inferior). Recoger la capa de citoplasma de cada tubo con una aguja de calibre 18 mediante la inserción de la aguja a través del tubo en la base de la capa de citoplasma. Transferencia del citoplasma a un nuevo tubo de ultraclaros Beckman en el hielo.
- Añadir inhibidores de la proteasa para el citoplasma aislado a una concentración final de 1X. Centrifugar el citoplasma a 16.000 g durante 10 min a 4 ° C. Recoger el citoplasma aclaró como se describió anteriormente. Esperan obtener 0.75-1 citoplasma ml / rana.
- Añadir 1 / 20 del volumen de extracción de la matriz energética de la muestra. Transferencia en el citoplasma de paredes gruesas tubos de policarbonato para el Beckman TL-100 ultracentrífuga. Los tubos de retención de 3 ml cada una y deben ser por lo menos a la mitad.
- Añadir 1 M de CaCl 2 a cada tubo a una concentración final de 0,4 mM. Incubar los tubos durante 15 minutos a temperatura ambiente. Esto inactiva CSF y empuja el extracto en la interfase.
- Balance de los tubos y centrifugar en una Beckman TL-100 ultracentrífuga con un rotor TLA-100.3 a 70.000 rpm (200000 g) de 1,5 horas a 4 ° C. El citoplasma se fraccionará en cuatro capas, de arriba a abajo: lípidos, el citosol, la membrana / mitocondrias, glucógeno y / ribosomas.
- Eliminar la capa citosólica de cada tubo (~ 1 ml 2-3 ml, si se cargan en el tubo) mediante la inserción de una jeringa en la parte superior del tubo a través de la capa lipídica. La transferencia de la fracción citosólica a tubos nuevos y centrifugar las muestras a 70.000 rpm (200000 g) durante 20 min a 4 ° C.
- Alícuota del sobrenadante en alícuotas de 25 l en tubos de 0.5 ml. Congelar rápidamente las alícuotas en nitrógeno líquido y se almacenan a -80 ° C hasta su uso. Para determinar si el extracto es efectivo, los núcleos de los espermatozoides pueden ser incubados en el extracto y se tiñeron con Hoechst para determinar si los núcleos se hinchan visiblemente (espesar y alargar) en 10 minutos de la adición a temperatura ambiente.
C. reacción de transgénesis y la transferencia nuclear
Importante: Asegúrese de que las soluciones, los equipos y las ranas están listos antes de iniciar una reacción. Una vez que comience, se debe proceder con la reacción con el calendario aproximado se describe a continuación, ya que muchos componentes no se mantienen estables durante> 30 minutos. Mientras que el stock núcleos de espermatozoides se mantiene en hielo, las reacciones de la transgénesis (diluido y concentrado) debe mantenerse a temperatura ambiente.
- Primer ranas hembra. La noche antes de la transgénesis, se inyectan varios (3-5) adultos ranas hembras con 800 unidades de HCG en el saco linfático dorsal de obtener huevos recién a partir del día siguiente.
- El día del procedimiento de transgénesis, preparar o llevar a la temperatura de las soluciones necesarias para la transgénesis:
- Cisteína recién hecho (2,5% en 1XMMR, pH 8,0). Usted tendrá varios cientos de mililitros que se utilizarán ese día.
- 0.2XMMR 6% Ficoll para los platos de trasplante y la recuperación de embriones transgénicos y 100 mg 0.2XMMR / ml de gentamicina (sin Ficoll) para elevar los embriones. Las soluciones no deben ser más caliente que 18-21 ° C y embriones transgénicos debe ser recaudado a través de divisiones temprana a temperaturas entre 16 y 21 ° C, ya que las altas temperaturas afectan negativamente tanto la frecuencia de la transgénesis y el desarrollo embrionario.
- Descongelar y alcancen la temperatura ambiente alícuotas congeladas de los TRS (buffer de dilución de espermatozoides) en los trasplantes del día, descongelar el extracto de alta velocidad y el lugar en el hielo, y preparar una solución de 100 mM de MgCl 2.
- Salir ªe inyección de platos de agarosa y se llenan de MMR / Ficoll, y el sistema y antes de hacer funcionar la bomba de infusión para estabilizar el flujo.
- Compruebe que las ranas hembra está poniendo y los huevos son de alta calidad. De manera óptima, los huevos deben tener una corteza firme (mantener la forma después de de-gelificante).
- Establecer una reacción transgénesis:
- Con mucho cuidado (con una punta de la pipeta recortado) mezcla la acción y los núcleos se combinan en un tubo de 1,5 ml Eppendorf:
Núcleos 4μl (~ 4-8X10 5 núcleos)
2μl plásmido linealizado (100ng/μl)
Incubar 5 minutos a temperatura ambiente. - al mismo tiempo de incubación es de procedimiento, diluir 0.5μl de enzima de restricción en 4.5μl H 2 O y añadir 1μl de enzima diluida a 18μl de SDB, 2μl de MgCl 2 y 2μl de extracto de alta velocidad. Agregue esta mezcla a la reacción de los núcleos de plásmido. Incubar 10 minutos más para engrosar los núcleos.
- Durante la incubación, apriete los huevos de las ranas y 2-3 de la gelatina en una solución de cisteína. Lave bien (5 veces) con 1XMMR, y el uso de una pipeta de diámetro ancho para la transferencia de 400 a 500 huevos dejellied a cada plato de agarosa y que contiene 0,2 X Ficoll MMR 4%. Esto suele tardar unos 10 minutos, por lo que una vez que se preparan platos de huevos que la reacción es por lo general dispuestos a diluir.
- Aproximadamente 15-20 minutos después de iniciar el paso uno, mezcle suavemente la reacción (núcleos / extraer / ADN) con una punta cortada y añadir unos 5μl a 150 l SDB a temperatura ambiente. Los núcleos de esta mezcla diluida se mantienen estables durante aproximadamente 1 hora., Mientras que no retienen la capacidad de trasplante, siempre y cuando se le deja en la mezcla de concentrados.
- Con mucho cuidado (con una punta de la pipeta recortado) mezcla la acción y los núcleos se combinan en un tubo de 1,5 ml Eppendorf:
- La carga de la aguja: Mezclar la reacción diluida preparada anteriormente muy suavemente con un orificio de la punta de pipeta de ancho, a continuación, cargar la aguja rápidamente, como núcleos establecerán rápidamente en el tubo. De retrocarga de la aguja, coloque un pedazo de tubo Tygon bien en el extremo de una pipeta de punta recortada 200μl. Dibuje la solución en la punta de la pipeta, a continuación, conecte el tubo a la aguja y deje que la solución para entrar en la aguja por la gravedad o suavemente el émbolo pipeta.
- Coloque la aguja a la bomba de tubo y comenzar los trasplantes de núcleos. Las inyecciones deben ser rápida y superficial y aproximadamente perpendicular a la membrana plasmática del huevo para evitar un daño. A la velocidad del flujo sugerido (10nl/sec), mantener la aguja en el óvulo de ~ 0,5 segundos. Debe completar 2.1 platos de trasplantes dentro de 20-30 minutos.
Después de las inyecciones, dejar los platos en 16-20 ° C hasta que los embriones han alcanzado la etapa de 4-8 células. Clasificar los embriones cortando lejos de su falta de escisión mediante la transferencia de los vecinos (con una pipeta Pasteur de vidrio con una punta de aproximadamente el mismo diámetro que un óvulo) de un plato fresco grande de Ficoll 0.2XMMR 4%. Subdividir los embriones escindir en grupos más pequeños (10-15 embriones / pocillo de una placa de 6 pocillos) y la cultura en 0.2XMMR (no Ficoll) 100 mg / ml de gentamicina a través del desarrollo temprano. Los embriones se debe comprobar durante la gastrulación con los embriones mueren se extirpan a tiempo y los medios de cambiar cuando sea necesario.
Solución de problemas:
- La aguja está bloqueado: flujo de la solución de la aguja debe ser evidente en los trasplantes. Si la aguja se obstruye por partículas en su interior, el cambio de agujas o tratar de eliminar los restos de recorte de la punta con una pinza y empujar una solución a través de la aguja.
- No cortando huevos se obtienen: comprobar que las diluciones de los núcleos de los espermatozoides y el volumen de inyección son apropiados y que la aguja no fue bloqueada durante el trasplante. Si el volumen de inyección es demasiado alto, los huevos no pueden romper, y también se muestran en lugar de pigmentación color o daños.
- Muchos embriones mueren durante la gastrulación. Hay varios factores que pueden mejorar la supervivencia de los embriones:
- tener cuidado con los núcleos durante la preparación y la reacción enzimática. Núcleos decondensed son frágiles y necesitan ser trasplantados con el calendario anterior. No los coloque en el hielo.
- El daño en los cromosomas sostenida por los núcleos de los espermatozoides durante la reacción enzimática, la transferencia nuclear afecta tanto a la frecuencia de la transgénesis y el desarrollo normal de los embriones. Daño en los cromosomas de los núcleos aumenta la eficiencia de la transgénesis, pero afecta negativamente a la supervivencia / desarrollo normal. La disminución de la enzima de restricción u omisión durante la incubación de la enzima puede mejorar el ritmo de desarrollo normal, pero puede disminuir la frecuencia de la transgénesis o el número de copias del plásmido introducido en el genoma del embrión.
- Si a finales de blástula a gástrula embriones muestran signos de decoloración o la muerte celular también es posible que un reactivo utilizado para el trasplante era tóxico para los huevos. Además, si huevos no tienen una corteza firme, pueden someterse a exogastrulation y no para generar normales gástrula post-embriones.
- El número de embriones que expresan el transgén es baja. Aumentar la cantidad de enzima de restricción.
Representante de los resultados de embriones transgénicos
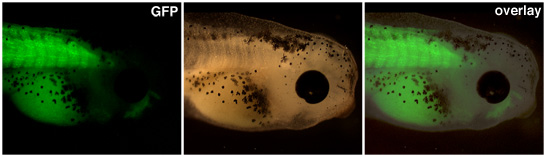
Embriones transgénicos resultantes de transferencias nucleares debe ser elevado hasta la expresión del promotor de interés es visible. En la figura 1, un promotor de la actina del músculo unidades de expresión de la proteína fluorescente verde en las somitas de este renacuajo transgénicos.
Discusión
Para cada constructo transgénico a ensayar, por lo general, el trasplante en los núcleos 500-1000 huevos; a esta escala, podemos generar embriones transgénicos que expresan un máximo de 10 construcciones diferentes por día, dependiendo de cómo muchas mujeres se ven inducidos a poner sus huevos. De estos trasplantes, aproximadamente un tercio de los huevos y se unirá el 60-80% de estos embriones cortando proceder a través de la gastrulación normalmente. Dependiendo de las condiciones de reacción utilizadas, ent...
Divulgaciones
Los experimentos con animales se realizaron de acuerdo con las directrices y normas establecidas por el Cuidado de Animales y el empleo Comisión en Washington University School of Medicine.
Agradecimientos
La financiación de nuestro trabajo es proporcionado por el NIH, la March of Dimes y la Sociedad Americana del Cáncer.
Materiales
Los espermatozoides A. núcleos preparación
Reactivos:
- 1X MMR (2 mM CaCl 2, 5 mM HEPES, pH 7,5, 2 mM KCl, 1mM MgCl2, 100 mM NaCl).
- 0,1% tricaína metanosulfonato (MS222, éster etílico del ácido aminobenzoico, A-5040 Sigma), 0,1% de bicarbonato de sodio. Se disuelven en agua.
- Mantequilla Preparación 2X Nuclear (NPB). En el día de la preparación de los núcleos de los espermatozoides, que hasta 30 ml de 2X NPB de alícuotas de las soluciones madre almacenadas congeladas: 500 mM de sacarosa (1,5 M de valores), 30 mM HEPES (stock 1M, se valora con KOH, para que un pH de 7,7 se encuentra en 15 mM), 1 mM trihidrocloruro espermidina (Sigma S-2501, 10 mM de existencias), 0,4 mM tetrahidrocloruro espermina (Sigma S-1141, 10 mM de existencias), 2 mM de ditiotreitol (Sigma D-0632, 100 mM de existencias), 2 mM EDTA (500 mM EDTA, pH 8,0).
- Utilice el 2XNPB para hacer a. 30ml NPB 1X, b. 10ml 1XNPB 3% de BSA (fracción V, Sigma A-7906), c. 5 ml BSA 1XNPB 0,3%.
- Lisolecitina: 100 l de 10 mg / ml de L-α-liso-lecitina, yema de huevo (Calbiochem, 440154); disolver a temperatura ambiente antes de su uso. Tienda sólida de valores a 20 ° C. Deseche el polvo de acciones si se vuelve pegajosa.
- Albúmina de suero bovino (BSA): 10% (w / v) BSA (fracción V, Sigma A-7906) constituyen el 5 ml de agua en el día de la preparación de los núcleos de los espermatozoides.
- Los espermatozoides de almacenamiento intermedio (1 ml) 1X NPB, el 30% de glicerol, 0,3% de BSA.
- Tampón de dilución de los espermatozoides: 250 mM de sacarosa, 75 mM KCl, 0,5 mM trihidrocloruro espermidina, espermina tetrahidrocloruro 0,2 mM. Valorar a un pH de 7.3 a 7.5 y almacenar 0,5-1 ml alícuotas a 20 ° C.
- Hoechst N º 33342 (Sigma B-2261): 10 mg / ml en dH 2 O, almacenar en un recipiente estanca a la luz a 20 ° C.
Equipos:
- Rotor basculante y centrifugar
- estopilla
- herramientas de disección (pinzas y tijeras)
- microscopio de fluorescencia
- embudo
- guantes
- hemocitómetro
- agujas (calibre 26)
- toallas de papel
- placas de Petri (60 mm)
- pipetas
- de plástico (5 y 10 ml)
- Pipetman consejos (1 ml y 200μl)
- Jeringas (1 ml)
- tubos (14 ml; Falcon, 2059)
- tubos
- microcentrífuga (1,5 ml)
B. Preparación del extracto de alta velocidad
Reactivos:
- 1X Marc Modificado Ringer (MMR): 100 mM NaCl, 2 mM de KCl, MgCl2 1 mM, CaCl2 2 mM, 5 mM HEPES, pH 7,5. Preparar un 10X, y ajustar el pH con NaOH a 7,5.
- Extracto 20X buffer (RE) de sales: 2 M KCl, 20 mM MgCl 2, 2 mM CaCl 2, filtro esterilizar y almacenar a 4 ° C.
- Extracto de buffer (XB, recién preparados y almacenados en hielo): 1X sales XB, 50 mM de sacarosa, 10 mM HEPES (1 M de valores, se titula con KOH, para que el pH es de 7,7 cuando se diluye a 15 mm, filtro de esterilizar y almacenar en alícuotas a 20 ° C). Prepare unos 100 ml.
- 2% (w / v) de L-cisteína clorhidrato de 1-hidrato: Hecho en 1X sales XB antes de su uso y pH a 7,8 con NaOH. Prepare unos 300 ml.
- CSF-XB: 1X sales XB, 1 mM MgCl 2 (además de MgCl2 presentes en las sales de XB, concentración final 2 mM), HEPES 10 mM, pH 7,7, 50 mM de sacarosa, 5 mM EGTA, pH 7,7. Prepare 50 ml.
- Inhibidores de la proteasa: Mezcla de leupeptina, quimostatina, y pepstatina, cada uno disuelto a una concentración final de 10 mg / ml en dimetilsulfóxido (DMSO). Tienda en pequeñas alícuotas a 20 ° C.
- 1 M de CaCl2.
- Mezcla de energía: 150 el fosfato de creatina mM, 20 mM ATP, 20 mM MgCl 2.
- Embarazo gonadotropina de suero de yegua (PMSG): 100 U / ml PMSG (PG600 ®, Intervet, Inc., 021 825). Se disuelven en agua y se almacena a 20 ° C.
- Gonadotropina Coriónica Humana (HCG): 1000 U / mL hCG (CHORULON ®, Intervet, Inc., 057 176). Disolver en agua y se almacenan a 4 ° C.
Equipos:
- Xenopus laevis mujeres
- Agujas (18 y calibre 26)
- Pipeta Pasteur
- de ancho diámetro
- Jeringas (1 ml)
- Tubos de microcentrífuga (0,5 ml)
- Tubos de pared gruesa de policarbonato (Beckman, 349622)
- Tubos, ultraclaros (14 x 95 mm; Beckman, 344060)
- Ultracentrífuga y rotores (por ejemplo, Beckman TL-100 con rotores SW 40 Ti y TLA-100.3)
- Vasos para la recolección de huevos
- Cubos o contenedores para la celebración de las ranas hembra (por ejemplo, 4-L vasos de plástico con tapas de malla).
C. transplante nuclear.
Reactivos:
- 2,5% de agarosa en 0.1XMMR (para la fabricación de platos de la inyección)
- 2,5% de cisteína en 1XMMR, PH 8,0, preparada en el día de uso
- Ficoll
- 10 mg / ml de gentamicina (stock 1000X)
- de alta velocidad extracto de huevo (véase más arriba)
- 100 MgCl2
- MMR de 10 aumentos (ver más arriba)
- Enzimas de restricción (por ejemplo, NotI de New England Biolabs)
- Buffer de dilución de esperma (SDB; ver más arriba) y los núcleos de los espermatozoides (ver arriba)
- Gonadotropina Coriónica Humana (HCG) que el anterior
- aceite mineral (Sigma, M8410)
- Plásmido linealizado para ser presentado como el transgén: Prepare plásmido linealizado a una concentración de 100 ng / l en agua estéril, agua libre de nucleasa (evitamos Tris y EDTA que contienen buffers, que son algo tóxicos a los embriones). La enzima de restricción utilizada para linealizar el plásmido no tiene por qué ser la misma que la utilizada en la reacción de transferencia nuclear. Por lo general, el uso NotI para todas las reacciones, a pesar de lo plásmido linearizado con. Algunos de calibración de la dilución de la enzima utilizada en la reacción puede ser necesario, la enzima que en exceso puede causar efectos adversos en la post-gástrula desarrollo. Plásmido puede ser purificado de varias maneras diferentes: por lo general utilizan el kit de purificación de Qiagen Qiaquick PCR de acuerdo con las instrucciones del fabricante, la purificación de una sola banda de un gel no es necesario. Si el plásmido se purifica con fenol / cloroformo extracción y precipitación con etanol, asegúrese de eliminar todos los restos de materia orgánica y etanol.
Equipos:
Platos de agarosa para la inyección: En un plato de Petri de 60 mm de plástico, había un pequeño peso 35mmX35mm barco en el 2,5% de agarosa fundida en 0.1XMMR agua para crear una depresión con un fondo de agarosa recubiertas con relleno de huevos. Una vez que se ha endurecido de agarosa, envolver en parafina y se almacenan a 4 ° C hasta su uso. Haga 2-3 platos de antemano para cada reacción de transgénicos va a hacer.
Bomba de infusión: Usamos una bomba de jeringa única infusión de Harvard Apparatus, equipado con una jeringa de 3 ml / aguja llena de aceite mineral (Sigma M-8410). Mitigar la punta de la aguja de jeringa (para evitar que la tubería de perforación) y conecte el tubo de Tygon bien. Funcionar la bomba a ~ 10nl/sec, lo que supone que el tiempo que la aguja está en cada huevo no será superior a 1 seg. La bomba debe ser pre-corra por varios minutos antes de la transgénesis de partida para el día para asegurar que el émbolo de la jeringa esté alineada con el pistón y flujo constante positiva de petróleo de la tubería que está ocurriendo.
Agujas para las transferencias nucleares. El uso de un extractor de micropipeta, generar agujas con puntas de largo e inclinado. Clip estos con una pinza en un microscopio equipado con un micrómetro ocular para obtener un ~ 80 micrones de abertura con forma de bisel.
Otros equipos: Xenopus laevis mujeres, microscopio estereoscópico, incubadora, micromanipulador, extractor de microinyección aguja (por ejemplo, modelo P-87, Sutter), agujas de jeringas (calibre 26), agujas de vidrio microinyección, micrómetro ocular calibrado para el recorte de las puntas de aguja de microinyección de diámetro 80μm, placas de Petri, pesan los barcos de 35 mm, tubo Tygon (ID = 1 / 32 de pulgada, OD = 3 / 32 pulg)
Referencias
- Kroll, K. L., Amaya, E. Transgenic Xenopus embryos from sperm nuclear transplantations reveal FGF signaling requirements during gastrulation. Development. 122, 3173-3183 (1996).
- Amaya, E., Kroll, K. L. A method for generating transgenic frog embryos. Methods Mol Biol. 97, 393-414 (1999).
- Murray, A. W. Cell cycle extracts. Methods Cell Biol. 36, 581-605 (1991).
- Hartley, K. O., Hardcastle, Z., Friday, R. V., Amaya, E., Papalopulu, N. Transgenic Xenopus embryos reveal that anterior neural development requires continued suppression of BMP signaling after gastrulation. Developmental Biology. 238, 168-184 (2001).
- Karaulanov, E., Knöchel, W., Niehrs, C. Transcriptional regulation of BMP4 synexpression in transgenic Xenopus. EMBO J. 23, 844-856 (2004).
- Ogino, H., Fisher, M., Grainger, R. M. Convergence of a head-field selector Otx2 and Notch signaling: a mechanism for lens specification. Development. 135, 249-2458 (2008).
- Taylor, J. J., Wang, T., Kroll, K. L. Tcf- and Vent-binding sites regulate neural-specific geminin expression in the gastrula embryo. Developmental Biology. 289, 494-506 (2006).
- Marsh-Armstrong, N., Huang, H., Berry, D. L., Brown, D. D. Germ-line transmission of transgenes in Xenopus laevis. Proceedings of the National Academy of Sciences of the United States of America. 96, 14389-14393 (1999).
- Offield, M. F., Hirsch, N., Grainger, R. M. The development of Xenopus tropicalis transgenic lines and their use in studying lens developmental timing in living embryos. Development. 127, 1789-1797 (2000).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados