Для просмотра этого контента требуется подписка на Jove Войдите в систему или начните бесплатную пробную версию.
Method Article
Получение трансгенных Xenopus laevis По рестрикции Интеграция опосредованного и ядерной трансплантации
В этой статье
Резюме
Это видео демонстрирует протокол метод для создания трансгенных Xenopus laevis Путем внедрения трансгенов в ядрах сперматозоидов следуют ядерной трансплантации в неоплодотворенные яйца.
Аннотация
Стабильная интеграция продуктов клонированных генов в геноме Xenopus необходимо контролировать время и место выражения, чтобы выразить гены на более поздних стадиях эмбрионального развития, и определить, как усилители и промоутеров регулируют экспрессию генов в эмбрион. Протокол продемонстрировали здесь может быть использован для эффективного получения трансгенных Xenopus laevis эмбрионов. Этот подход включает в себя трансгенез трех частей: 1. Сперма ядер изолированы от взрослых X. laevis яичка обработкой лизолецитин, который permeabilizes спермы плазматической мембране. 2. Яйцо экстракт готовится низкой скорости центрифугирования, добавление кальция вызывает экстракт для перехода к интерфазе клеточного цикла, а также высокоскоростным центрифугированием, чтобы изолировать межфазной цитозоле. 3. Ядерной трансплантации: ядер и экстракта в сочетании с линеаризованной плазмидой ДНК, чтобы вводить в качестве трансгенов и небольшое количество фермента рестрикции. Во время короткой реакции, яичный экстракт частично decondenses спермы хроматина и рестрикции генерирует хромосомных разрывов, которые способствуют рекомбинации трансгенов в геном. Лечение спермы ядер затем пересаживают в неоплодотворенные яйца. Интеграция трансгенов обычно происходит до первого эмбрионального расщепления, что в результате эмбрионы не являются химерные. Эти эмбрионы могут быть проанализированы без необходимости разводить для следующего поколения, что позволяет для эффективного и быстрого поколение трансгенных эмбрионов для анализа промоутер и функции гена. Взрослый X. laevis в результате этой процедуры также распространяются через трансгенов зародышевой линии и может быть использован для создания линии трансгенных животных для различных целей.
протокол
Модифицированные версии этой трансгенез подход изначально были описаны в 1 и 2.
А. спермы ядер подготовки
Этот метод ядер препарата адаптирована из Мюррей 3, но ингибиторы протеазы, были исключены, поскольку они мешают последующее развитие яиц пересаженных со спермой ядер. Аликвоты заморожены при температуре -80 ° С и может быть использована для трансплантации в течение примерно 6 месяцев.
Все решения должны быть подготовлены и помещают на лед до начала подготовки.
- Анестезию 1-2 взрослых мужчин X. laevis погружением в Tricaine не менее 20 мин, а затем по pithing; удалить яички.
- Ролл яички на бумажное полотенце, чтобы удалить кровь, кровеносные сосуды и жира, вымыть их кратко в 60 мм чашки Петри содержащие 1XMMR, и удалить все дополнительные куски жира в организме. Будьте осторожны, не прокол яичек, так как это освобождает спермы.
- Передача яичек сухие 60-мм чашку Петри и вымачивать яички щипцами, пока Есть никаких видимых куски. Мацерация должно быть сделано так тщательно, как можно получать высокие урожаи ядер.
- Добавить 2mLs холодного ядерного буфера подготовки (НПБ; 1X со склада), чтобы вымачивать и осторожно пипеткой вверх и вниз.
- Squirt вымачивать через около 4 толщины марлю на воронку, сбор в 15 мл трубки (например, Сокол 2059); промыть посуду с 8mLs НПБ и положить это полоскание через марлю, собирая ее в трубу. С сжать руки в перчатках марлю для сбора оставшейся жидкости в трубе.
- Гранул спермы при 3000 оборотов в минуту в течение 10 мин. при 4 ° С в роторе размахивая ведром (например, 1480g в Sorvall HB-4 ротора или эквивалент) с соответствующими адаптерами трубки. Декантировать супернатант, добавить 8 мл НПБ этой трубки и пипетки вверх и вниз с 10 мл пипетки для ресуспендирования гранул; спином вниз снова, как и выше, и перелить супернатант. Уравновешиваются 1 мл НПБ до комнатной температуры во время вращения.
- Ресуспендируют осадок в 1 мл комнатной температуре НПБ использованием 1 мл pipetteman отзыв, добавить 50 мкл 10mg/mL свежеприготовленные лизолецитин, аккуратно перемешать и инкубировать 5 мин. при комнатной температуре.
- Добавьте 10 мл холодного 1XNPB +3% BSA в трубке, чтобы остановить лизолецитина реакцию, аккуратно перемешать и со спином вниз в течение 10 мин при 3000 оборотов в минуту в Бакет ротор. Декантировать супернатант. Лизолецитина обработанных гранул должна выглядеть немного более прозрачным (менее непрозрачная белая), чем это было до лизолецитина лечения.
- Декантировать супернатант и ресуспендируют осадок в 5 мл холодной НПБ 0,3% БСА, осторожно смешать с 10 мл пипетки и со спином вниз в течение 10 мин при 3000 оборотов в минуту и выше.
- Декантировать супернатант и ресуспендируют осадок в 500 мкл спермы буфера хранения и передачи по 1,5 мл трубки. Это теперь ваше ядер акций. Магазин на льду во время проверки выхода ядер.
- Чтобы проверить, выход ядра, место 98 мкл спермы буфером для разведения (SDB), 1 мкл ядерных запасов и 1 мкл 1:100, разведение акции Хехст в 1,5 мл трубки Эппендорф. Смешайте семенного материала очень хорошо использовании бритвы подстриженные (или большого открытия) пипетки непосредственно перед удалением 1 мкл. Смешайте разбавленный SDB / Hoechst / ядер очень хорошо, и позволяют небольшим количеством течь в палату улучшенной hemacytometer Нойбауэр под действием капиллярных сил. Граф ядер в квадрате hemacytometer под соединение микроскопа. С одним мужчиной, вы должны получить насчитывает, по крайней мере 100-200 (X10 4 клеток / мл) в течение этого 1:100 разбавление состава для неразбавленного концентрация запасов 1-2-10 5 кл / мкл. Если ваши акции менее концентрированный, не говоря ядер урегулировать в течение нескольких часов, удалить некоторые из надосадочной и пересчета голосов. Оставьте ядер при 4 ° С в течение ночи, чтобы проникнуть глицерина для улучшения криоконсервации, а затем смесь семенного материала и с большим отверстием кончика пипетки, готовить 20 мкл аликвоты, и заморозить в жидком азоте.
В. Подготовка Высокая скорость извлечения
Этот метод адаптирован из Мюррей 3 и производит межфазной цитозольного экстракта, что будет способствовать опухоль и частичная хроматина деконденсации добавил спермы ядер. Извлечение могут быть заморожены в небольших аликвот при -80 ° С и размораживать перед использованием.
- 3-5 дней до инъекции HCG, премьер 8-12 взрослой самки X. laevis путем введения 50 ЕД в PMSG в спинной мешок лимфы. Вечером перед экстракт подготовки, придать каждой лягушки с 500 единиц HCG и место 2 лягушек / контейнер на 2 1XMMR литров. Так как одна лягушка с лизирующего или активации яйца может скомпрометировать экстракт подготовки, целесообразно разделить лягушек на пары для овуляции.
- Следующим утром, готовить и холод все решения перед началом приготовления. Аккуратно, вручную исключить яйца из каждой лягушки в большом бeakers содержащие 1X MMR. Экран яиц из каждого контейнера и пропустить какой-либо партии яиц с признаками пятнистость, лизирующего или активации (визуализируется сокращение пигментации в животном полушарии) от процедуры. Сбор яиц с непрерывной даже пигментацией. Хорошие яйца также могут быть собраны из 1X MMR в лягушку ведра. Общий объем яйца должен быть> 100 мл из 8-12 самок.
- Де-желе яйца. Чтобы сделать это, удалить как можно больше MMR насколько это возможно, добавить небольшое количество цистеина решение, и водоворот яйца. Замените свежим раствором цистеина несколько раз в течение де-jellying. Де-желе каждой партии яиц отдельно и отказаться от партий с поломкой или яйцо активации. Комбинат остальные яйца.
- Мойте яйца четыре раза в ~ 35 мл экстракта буфер (ВБ), а затем два раза в 25 мл ликвора-XB с ингибиторами протеазы.
- Для упаковки яиц: передача яйца в Бекман труб ultraclear. Разрешить яйца, чтобы обосноваться. Удалить столько CSF-XB насколько это возможно. Центрифуга яйца использованием Beckman SW 40 Ti ротора (или аналогичный ротора) при 1000 оборотов в минуту (150 г) в течение ~ 60 сек при 4 ° C. Удалите излишки раствора из верхней части упакованных яиц.
- Чтобы раздавить яйца и генерировать цитоплазматических выписке: центрифуги яйца в 10000 оборотов в минуту (16,000 г) в течение 10 мин при 4 ° C. Яйца должны разделиться на три слоя: липидов (вверху), цитоплазма (в центре) и желток (внизу). Сбор цитоплазматических слой из каждой пробирки с 18-иглы, вставив иглу через трубки на базе цитоплазматического слоя. Передача цитоплазмы в новую пробирку ultraclear Бекман на льду.
- Добавить ингибиторов протеазы в изолированной цитоплазмы в конечной концентрации 1X. Recentrifuge цитоплазме при 16000 г в течение 10 мин при 4 ° C. Сбор уточнил цитоплазме как описано выше. Ожидайте получения 0.75-1 цитоплазме мл / лягушку.
- Добавить 1 / 20 от объема экстракта энергетическом балансе образца. Передача цитоплазмы в толстостенных труб поликарбоната для Beckman TL-100 ультрацентрифуге. Трубы держать около 3 мл каждая и должны быть по крайней мере наполовину.
- Добавить 1 М CaCl 2 в каждую пробирку, чтобы конечная концентрация 0,4 мм. Инкубировать пробирки в течение 15 мин при комнатной температуре. Это инактивирует CSF и толкает экстракта в интерфазе.
- Баланс труб и их в центрифуге Beckman TL-100 ультрацентрифуге использованием TLA-100,3 ротора при 70 000 оборотов в минуту (200 000 г) в течение 1,5 ч при 4 ° C. Цитоплазма будет фракционирования на четыре слоя, сверху вниз: липидов, цитозоль, мембрана / митохондрии, и гликоген / рибосом.
- Удалить цитозольного слой из каждой пробирки (~ 1 мл 2-3 мл, если была загружена в трубке), вставляя шприц в верхней части трубки, через липидный слой. Передача цитозольного долю на свежий труб и recentrifuge образцов при 70 000 оборотов в минуту (200 000 г) в течение 20 мин при 4 ° C.
- Алиготе супернатанта в 25-мкл аликвоты в 0,5-мл пробирки. Быстрый заморозить порциями в жидком азоте и хранят при температуре -80 ° С до использования. Для определения того, экстракт является эффективным, сперма ядер может быть инкубировали в экстракте и окрашивали Hoechst для определения ядер заметно набухают (утолщаться и удлинить) в течение 10 мин сложения при комнатной температуре.
C. Реакция трансгенез и переноса ядра
Важно: Убедитесь, что решения, оборудование и лягушек все готовы до начала реакции. Как только вы начнете, вы должны приступить к реакции с помощью приблизительный график, описанных ниже, так как многие компоненты не остаются стабильными в течение> 30 минут. Хотя запас спермы ядер держится на льду, трансгенез реакций (как разбавленной и концентрированной) должны храниться при комнатной температуре.
- Премьер женский лягушек. Вечером перед трансгенез, ввести несколько (3-5) взрослых женщин лягушка с 800 единиц HCG в спинной лимфатический мешок для получения свежих яйца начиная со следующего дня.
- День трансгенез процедуры, подготовить или привлечь к температуре решения, необходимые для трансгенез:
- Только что сделал цистеина (2,5% в 1XMMR, pH8.0). Вам понадобится несколько сотен миллилитров, которые будут использоваться в тот день.
- 0.2XMMR +6% Ficoll для трансплантации блюд и восстановления трансгенных эмбрионов и 0.2XMMR +100 мкг / мл гентамицина (без Ficoll) для повышения эмбрионов. Решения не должны быть теплее 18-21 ° С и трансгенных эмбрионов должны быть подняты до начала раскола при температуре от 16 до 21 ° С, так как более высокие температуры отрицательно сказаться как на частоте трансгенеза и эмбрионального развития.
- Оттепель и равновесие до комнатной температуры замороженных аликвоты SDB (буфер спермы разведения) для трансплантации дня, оттепель высокой скорости извлечения и место на льду, и подготовить 100mM MgCl 2 решения.
- Убирайтесь-йэлектронной агарозном инъекции блюд и залейте MMR / Ficoll решения, а также создать и предварительно запустить инфузионный насос для стабилизации потока.
- Убедитесь, что самка лягушки укладки и яйца имеют высокое качество. Оптимально, яйца должны иметь твердую кору (удерживать форму после де-jellying).
- Настройка трансгенез реакции:
- Очень осторожно (с помощью пипетки обрезанный кончик) смесь ядер акций и объединить в тюбике 1,5 мл Eppendorf:
4μl ядер (~ 4-8х10 5 ядер)
2μl линеаризованной плазмиды (100ng/μl)
Инкубировать 5 минут при комнатной температуре. - в то время как инкубационный идет, развести 0.5μl ограничения фермента в 4.5μl H 2 O и добавить 1 мкл из разбавленного фермента 18μl СКБ, 2μl из MgCl 2 и 2μl высокой скорости извлечения. Добавить эту смесь для ядер-плазмиды реакции. Инкубируйте 10 минут для набухания ядра.
- Во время этой инкубации, выжать яиц от 2-3 лягушек и де-желе в цистеин решение. Вымойте их хорошо (5X) с 1XMMR, а также использовать широкий отверстие пипетки перенести 400-500 dejellied яйца каждый агарозы и блюдо с 0,2 x MMR +4% Ficoll. Это обычно занимает около 10 минут, поэтому, как только яичные блюда готовятся реакции, как правило, готовы разбавлять.
- Примерно через 15-20 минут после начала шаг, осторожно перемешать реакции (ядра / выписка / ДНК) с подрезанными наконечник и добавить около 5 мкл до 150 мкл СКБ при комнатной температуре. Ядра в этой разбавленной смеси стабильны в течение приблизительно 1 час., Тогда как они не сохраняют трансплантации мощности до тех пор, когда оставил в концентрированной смеси.
- Очень осторожно (с помощью пипетки обрезанный кончик) смесь ядер акций и объединить в тюбике 1,5 мл Eppendorf:
- Нагрузки иглы: смешать разбавленный реакция полученного выше очень нежно с широким кончиком пипетки отверстие, а затем загрузить иглы быстро, как ядер будет быстро урегулировать в трубке. Для backload иглу, место кусок тонкой трубки Tygon на конец обрезанный кончик пипетки 200 мкл. Нарисуйте раствора в наконечник пипетки, затем прикрепите трубку к игле и позволяют решение ввести иглу под действием силы тяжести или слегка удручает пипетки поршень.
- Прикрепить иглы для перекачки труб и начать трансплантации ядер. Инъекции должны быть быстрыми, мелкими и приблизительно перпендикулярным плазматическую мембрану яйца делать, чтобы избежать повреждений. На скорость потока предложил (10nl/sec), держите иглу в яйце в течение ~ 0,5 секунды. Вы должны заполнить 1-2 блюд трансплантации в течение 20-30 минут.
После инъекции, оставьте блюда на 16-20 ° С до эмбрионов достигли стадии 4-8 клеток. Сортировать рассекая эмбрионы от их не рассекая соседей путем передачи (со стеклянной пипетки Пастера с наконечником примерно того же диаметра, яйцо) для свежего большое блюдо из 0.2XMMR +4% Ficoll. Разделите расщепления эмбрионов в небольших группах (10-15 эмбрионов / лунку 6-луночный планшет) и культуры в 0.2XMMR (без Ficoll) +100 мкг / мл гентамицина за счет раннего развития. Эмбрионы должны быть проверены во время гаструляции с любой умирающей эмбрионов удалены быстро и средств массовой информации меняется по мере необходимости.
Устранение неполадок:
- Игла заблокирована: раствор поток от иглы должно быть очевидно, во время пересадки. Если игла становится заблокирован видимых твердых частиц, изменение иглы или попытаться удалить мусор, закрепляя кончик щипцами и толкая раствор через иглу.
- Нет рассекая яйца получаются: проверьте, что разведениях ядер сперматозоидов и объемом впрыска являются подходящими и, что игла не была заблокирована во время пересадки. Если инъекция объем слишком велик, яйца также могут не сольются и вместо этого показать обесцвеченные пигментации или повреждения.
- Многие эмбрионов умирают во время гаструляции. Ряд факторов может увеличить эмбриона выживания:
- будьте осторожны с ядрами в период подготовки и ферментативной реакции. Деконденсированных ядер являются хрупкими и требуют пересадки использованием график выше. Не храните их на льду.
- Хромосомные ущерб, понесенный спермы ядер в ходе реакции ферментов и переноса ядра влияет как на частоте трансгенеза и нормальное развитие эмбрионов. Хромосомные повреждения ядра повышает эффективность трансгенеза но и отрицательно влияет на выживание / нормального развития. Уменьшение или пропуск рестрикции во время инкубации фермента может повысить скорость нормального развития, но может уменьшить частоту трансгенеза или плазмиды числа копий введена в эмбрион генома.
- Если поздней бластулы через эмбрионов гаструлы проявлять признаки обесцвечивания или гибель клеток это также возможно, что реагенты, используемые для трансплантации был токсичен для яиц. Кроме того, если яйцоы не имеют твердой коры, они могут пройти exogastrulation и не в состоянии генерировать нормальные пост-гаструлы эмбрионов.
- Количество эмбрионов выражения трансгенной является низким. Увеличение количества рестрикции.
Представитель трансгенных эмбрионов Результаты
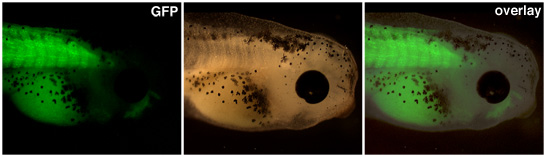
Трансгенные эмбрионы в результате ядерных передач должны быть подняты до выражения из промоутер интерес видна. На рисунке 1 выше, промоутер мышце актин диски выражение зеленого флуоресцентного белка в сомитов этого трансгенных головастика.
Обсуждение
Для каждого трансгенного построить для тестирования, мы, как правило пересадки ядер в 500-1000 яиц, в этом масштабе, мы можем создать трансгенных эмбрионов выражении до 10 различных конструкций в сутки, в зависимости от того, сколько женщин индуцированные чтобы отложить яйца. Из этих трансп?...
Раскрытие информации
Эксперименты на животных были проведены в соответствии с руководящими принципами и правилами, установленными уходу за животными и использование комитета в Вашингтонском университете в Школе медицины.
Благодарности
Финансирование для нашей работы обеспечивается NIH, март Dimes, и американского Общества рака.
Материалы
А. спермы ядер подготовки
Реагенты:
- 1X MMR (2 мМ CaCl 2, 5 мМ HEPES, pH7.5, 2 мМ KCl, 1 мМ MgCl 2, 100 мм NaCl).
- 0,1% Tricaine метансульфонат (MS222, аминобензойной кислоты этиловый эфир, Sigma-5040), 0,1% бикарбоната натрия. Растворите в воде.
- 2X ядерной Масло Подготовка (НПБ). В день подготовки ядер сперматозоидов, составляют 30 мл 2 раза НПБ от аликвоты растворы хранят в замороженном виде: 500 мМ сахарозы (1,5 м запасов), 30 мМ HEPES (1M состава; титруйте КОН так, чтобы рН 7,7 находится на 15 мм), 1 мМ спермидина тригидрохлорид (Sigma S-2501, 10 мМ акций), 0,4 мМ спермина tetrahydrochloride (Sigma S-1141, 10 мМ акций), 2 мМ дитиотреитол (Sigma D-0632, 100 мМ акций), 2 мМ ЭДТА (500 мМ ЭДТА, рН 8,0).
- Используйте 2XNPB сделать a. 30мл 1X НПБ, b. 10мл 1XNPB +3% BSA (фракция V, Sigma-7906), c. 5 мл 1XNPB 0,3% BSA.
- Лизолецитина: 100 мкл 10 мг / мл L-α-lyso-лецитин, яичный желток (Calbiochem, 440154); растворяются при комнатной температуре непосредственно перед употреблением. Магазин солидный запас при 20 ° C. Отменить фондовой порошок, если он становится липким.
- Бычий сывороточный альбумин (BSA): 10% (м / о) BSA (фракция V, Sigma-7906) Макияж 5 мл воды в день подготовки ядер сперматозоидов.
- Сперма хранения буфера (1 мл) 1X НПБ, 30% глицерина, 0,3% BSA.
- Сперма разбавления буфера: 250 мМ сахарозы, 75 мМ KCl, 0,5 мМ спермидина тригидрохлорид, 0,2 мМ спермина tetrahydrochloride. Титровать до рН 7.3-7.5 и хранить 0,5-1 мл аликвот при 20 ° C.
- Hoechst номер 33342 (Sigma B-2261): 10 мг / мл акций дН 2 O, магазин в светонепроницаемый сосуд при 20 ° C.
Оборудование:
- Размахивая ротора ведро и центрифуга
- марля
- рассечение инструментов (щипцы и ножницы)
- флуоресцентный микроскоп
- воронка
- перчатки
- гемоцитометра
- иглы (26 калибра)
- бумажные полотенца
- чашки Петри (60 мм)
- пипетки
- пластиковые (5 и 10 мл)
- Pipetman советы (1 мл и 200 мкл)
- Шприцы (1 мл)
- Трубы (14 мл; Falcon, 2059)
- труб
- микроцентрифужных (1,5 мл)
В. Подготовка Высокая скорость извлечения
Реагенты:
- 1X Марка изменения Ringer (MMR): 100 мМ NaCl, 2 мМ KCl, 1 мМ MgCl 2, 2 мМ CaCl 2, 5 мМ HEPES, рН 7,5. Подготовка 10X акции и корректировать рН с NaOH до 7,5.
- Извлечение 20X буфер (ВБ) соль складе: 2 M KCl, 20 мМ MgCl 2, 2 мМ CaCl 2, фильтр-стерилизовать и хранить при 4 ° C.
- Извлечение буферов (ВБ; свежеприготовленной и хранится на льду): 1X XB соли, 50 мМ сахарозы, 10 мМ HEPES (1 М акции, титруемая с КОН, чтобы рН 7,7 при разведении до 15 мм; фильтр-стерилизовать и хранить в аликвот при 20 ° С). Подготовка около 100 мл.
- 2% (м / о) L-цистеин гидрохлорида 1-гидрат: Сделано в 1X XB соли перед употреблением и титруют до рН 7,8 с помощью NaOH. Подготовка около 300 мл.
- CSF-XB: 1X XB соли, 1 мМ MgCl 2 (в дополнение к MgCl 2 присутствует в XB соли; конечной концентрации 2 мМ), 10 мМ HEPES, рН 7,7, 50 мМ сахарозы, 5 мМ EGTA, рН 7,7. Подготовка 50 мл.
- Ингибиторы протеазы: Смесь leupeptin, химостатина и пепстатина, каждый растворенный в конечной концентрации 10 мг / мл в диметилсульфоксид (ДМСО). Хранить в небольшой порции при 20 ° C.
- 1 М CaCl 2.
- Структура энергобаланса: 150 мМ креатинфосфата, 20 мМ АТФ, 20 мМ MgCl 2.
- Беременные Маре Сыворотка гонадотропин (PMSG): 100 Ед / мл PMSG (PG600 ®, Интервет, Inc, 021 825). Растворите в воде и хранить при температуре 20 ° C.
- Хорионического гонадотропина человека (ХГЧ): 1000 ед / мл ХГЧ (CHORULON ®, Интервет, Inc, 057 176). Растворите в воде и хранили при 4 ° C.
Оборудование:
- Xenopus laevis женщин
- Игл (18 и 26 калибра)
- Пипетки Пастера
- широкое отверстие
- Шприцы (1 мл)
- Трубы, микроцентрифужных (0,5 мл)
- Трубы, толстые поликарбоната (Beckman, 349622)
- Трубы, ultraclear (14 х 95 мм; Бекман, 344060)
- Ультрацентрифуге и роторов (например, Beckman TL-100 с роторами SW 40 Ti и TLA-100,3)
- Стаканы для сбора яиц
- Ведра и контейнеры для хранения женский лягушек (например, 4-L пластиковых стаканах с сеткой крышками).
С. ядерной трансплантации.
Реагенты:
- 2,5% агарозы в 0.1XMMR (для приготовления инъекций блюда)
- 2,5% цистеина в 1XMMR, PH8.0, подготовленный на день использования
- Ficoll
- 10 мг / мл гентамицина (1000X акций)
- высокая скорость извлечения яйца (см. выше)
- 100 MgCl 2
- 10X MMR (см. выше)
- Ограничение фермента (например, NotI из Новой Англии Биолабс)
- Сперма буфером для разведения (SDB, см. выше) и спермы ядер (см. выше)
- Человеческий хорионический гонадотропин (ХГЧ), что и выше
- минерального масла (Sigma, M8410)
- Линеаризованные плазмиды быть введен в качестве трансгенов: Подготовка линеаризованной плазмиды в концентрации примерно 100 нг / мкл в стерильные, нуклеазы без воды (мы избегаем Трис и ЭДТА-содержащие буферов, которые несколько токсичны для эмбрионов). Рестрикции используется для линеаризации плазмиды не должен быть тем же, что используется в ядерной реакции передачи. Мы обычно используем NotI для всех реакций, независимо от того, плазмиды линеаризуется с. Некоторые калибровки фермента разбавления используемого в реакции могут оказаться необходимыми, так как слишком много фермента может оказывать вредное воздействие на пост-гаструлы развития. Плазмиды могут быть очищены различными способами: мы обычно используем Qiagen Qiaquick ПЦР очистки комплект в соответствии с производителями направлениях; очистку одной полосы из геля не требуется. Если плазмиды очищают, используя фенол / хлороформ экстракции и осаждения этанолом, убедитесь, чтобы удалить все следы органики и этанола.
Оборудование:
Агарозном блюда для инъекций: В 60 мм пластиковые чашки Петри, лежал небольшой 35mmX35mm вес лодки на расплавленный 2,5% агарозы в 0.1XMMR воды, чтобы создать депрессии с агарозном покрытием дна для заполнения с яйцами. После агарозном затвердеет, заверните в парафильмом и хранить при температуре 4 ° С до использования. Сделать 2-3 блюда заранее для каждого трансгенного реакции вы планируете делать.
Инфузионных насосов: Мы используем один насос вливания шприцем из аппарата Гарварде, оснащен 3 шприца куб.см / иглы заполнена минеральным маслом (Sigma M-8410). Блант кончике иглы шприца (чтобы сохранить его от перфорации трубы) и приложите тонкой трубки Tygon. Запустите насос при ~ 10nl/sec; это предполагает, что время игла находится в каждое яйцо будет не больше, чем за 1 сек. Насос должен быть предварительно поработать несколько минут до начала трансгенез за день, чтобы убедиться, что поршень шприца на одном уровне с поршнем и что устойчивый положительный поток нефти из трубы происходит.
Иглы для ядерных передач. Использование съемника микропипетки, генерировать с длинными иглами, покатая советы. Клип с этими forcep при вскрытии микроскоп с окулярного микрометра для получения ~ 80 микрон открытия с скошенной формы.
Другое оборудование: Xenopus laevis женщин, стереомикроскоп, инкубатор, микроманипулятора, микроинъекции иглы съемник (например, модель P-87, Sutter), шприц иглы (26 калибра), иглы стекла микроинъекции, окулярного микрометра для калиброванных отсечения микроинъекции иглы советы 80μm диаметре, чашки Петри, весят лодки 35 мм, Tygon трубы (ID = 1 / 32 дюйма, OD = 3 / 32 дюйма)
Ссылки
- Kroll, K. L., Amaya, E. Transgenic Xenopus embryos from sperm nuclear transplantations reveal FGF signaling requirements during gastrulation. Development. 122, 3173-3183 (1996).
- Amaya, E., Kroll, K. L. A method for generating transgenic frog embryos. Methods Mol Biol. 97, 393-414 (1999).
- Murray, A. W. Cell cycle extracts. Methods Cell Biol. 36, 581-605 (1991).
- Hartley, K. O., Hardcastle, Z., Friday, R. V., Amaya, E., Papalopulu, N. Transgenic Xenopus embryos reveal that anterior neural development requires continued suppression of BMP signaling after gastrulation. Developmental Biology. 238, 168-184 (2001).
- Karaulanov, E., Knöchel, W., Niehrs, C. Transcriptional regulation of BMP4 synexpression in transgenic Xenopus. EMBO J. 23, 844-856 (2004).
- Ogino, H., Fisher, M., Grainger, R. M. Convergence of a head-field selector Otx2 and Notch signaling: a mechanism for lens specification. Development. 135, 249-2458 (2008).
- Taylor, J. J., Wang, T., Kroll, K. L. Tcf- and Vent-binding sites regulate neural-specific geminin expression in the gastrula embryo. Developmental Biology. 289, 494-506 (2006).
- Marsh-Armstrong, N., Huang, H., Berry, D. L., Brown, D. D. Germ-line transmission of transgenes in Xenopus laevis. Proceedings of the National Academy of Sciences of the United States of America. 96, 14389-14393 (1999).
- Offield, M. F., Hirsch, N., Grainger, R. M. The development of Xenopus tropicalis transgenic lines and their use in studying lens developmental timing in living embryos. Development. 127, 1789-1797 (2000).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеThis article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены