É necessária uma assinatura da JoVE para visualizar este conteúdo. Faça login ou comece sua avaliação gratuita.
Method Article
Produção de transgênicos Xenopus laevis Por Restrição Integração Mediada por Enzima e Transplante Nuclear
Neste Artigo
Resumo
Este protocolo de vídeo demonstra um método para a geração de transgênicos Xenopus laevis Por introdução de transgenes em núcleos do esperma seguida de transplante nuclear em ovos não fertilizados.
Resumo
Integração estável dos produtos gene clonado no genoma Xenopus é necessário para controlar o tempo e lugar de expressão, para expressar genes em fases posteriores do desenvolvimento embrionário, e para definir como potenciadores e promotores de regular a expressão de genes no interior do embrião. O protocolo demonstrado aqui pode ser usado para produzir de forma eficiente embriões transgênicos Xenopus laevis. Esta abordagem transgenia envolve três partes: 1. Núcleos espermáticos são isolados do adulto X. testículo laevis pelo tratamento com lysolecithin, que permeabilizes da membrana plasmática de espermatozóides. 2. Extrato de ovo é preparado por centrifugação de baixa velocidade, além de cálcio para causar o extrato para avançar para a interfase do ciclo celular, e uma centrifugação de alta velocidade para isolar citosol interfase. 3. Nuclear transplante: os núcleos e extrato são combinados com o DNA do plasmídeo linearizado para ser apresentado como o transgene e uma pequena quantidade da enzima de restrição. Durante uma reação de curto, extrato de ovo parcialmente decondenses a cromatina de espermatozóides ea enzima de restrição gera quebras cromossômicas que promovem a recombinação do transgene no genoma. Os núcleos de espermatozóides tratados são então transplantados para ovos não fertilizados. Integração do transgene geralmente ocorre antes da primeira clivagem embrionária de tal forma que os embriões resultantes não são quiméricos. Esses embriões podem ser analisados sem qualquer necessidade de raça para a próxima geração, permitindo a geração eficiente e rápida de embriões transgênicos para análises de promotor e função do gene. Adulto X. laevis resultante deste procedimento também propagar o transgene através da linha germinativa e pode ser usado para gerar linhas de animais transgénicos para fins múltiplos.
Protocolo
Versões modificadas deste abordagem transgênese foram inicialmente descritas em 1 e 2.
A. preparação núcleos do esperma
Este método de preparação núcleos é adaptado de Murray 3, mas os inibidores da protease foram omitidos como elas interferem com o desenvolvimento subseqüente de ovos transplantado com núcleos de esperma. Alíquotas são congeladas a -80 ° C e podem ser usados para transplantes por aproximadamente 6 meses.
Todas as soluções devem ser preparadas e colocadas no gelo antes de começar a preparação.
- Anestesiar 1-2 adultos do sexo masculino X. laevis por imersão em tricaina por pelo menos 20 min seguido por mielotomia; remover os testículos.
- Rolar os testículos em uma toalha de papel para remover o sangue, vasos sangüíneos e gordura corporal, lavá-los brevemente em uma placa de Petri contendo 60 milímetros 1XMMR, e remover quaisquer peças adicionais de gordura corporal. Tome cuidado para não furar os testículos, já que este libera o esperma.
- Transferência testículos a uma placa de Petri e seco de 60 mm e testículos macerar com uma pinça até que não haja pedaços visíveis. Maceração deve ser feito tanto quanto possível para obter altos rendimentos de núcleos.
- Adicionar tampão preparação 2mls frio nuclear (NPB; 1X de ações) para o macerado e gentilmente pipeta cima e para baixo.
- Squirt macerar por cerca de quatro espessuras de gaze em um funil, a coleta em um tubo de 15 mL (Falcon por exemplo, 2059); Lavar prato com 8mLs do NPB e colocar este lavar através da gaze, recolhendo-a do tubo. Com as mãos enluvadas espremer a gaze para coletar líquido restante no tubo.
- Pellet o esperma a 3.000 rpm por 10 min. a 4 ° C em um rotor de caçamba móvel (1480g por exemplo, em um rotor Sorvall HB-4 ou equivalente) com os adaptadores de tubo apropriada. NPB 8ml adicionar a este tubo e pipetar cima e para baixo com uma pipeta de 10 mL para ressuspender pellet;; sobrenadante decantar girar novamente como sobrenadante acima e decantar. Equilibrar 1mL de NPB à temperatura ambiente durante o spin.
- Ressuspender pellet em 1mL NPB temperatura ambiente usando a 1 mL pipetteman ponta, adicionar 50μl de 10mg/mL lysolecithin preparados na hora, misture delicadamente e incubar por 5 min. à temperatura ambiente.
- Adicionar 10 mL BSA 1XNPB frio +3% ao tubo para parar a reação lysolecithin, misture delicadamente, e spin down por 10 min a 3000 rpm em um rotor de caçamba móvel. Sobrenadante decantar. O pellet lysolecithin tratados deve olhar um pouco mais translúcido (branco opaco menos) do que tinha antes do tratamento lysolecithin.
- Decantar o sobrenadante e ressuspender sedimento em 5 mL frio NPB BSA 0,3%, misture delicadamente com uma pipeta de 10 mL e spin down por 10 minutos a 3000rpm como acima.
- Decantar o sobrenadante e ressuspender pellet em 500μl de tampão de espermatozóides de armazenamento e transferência para um tubo de 1,5 mL. Este é agora o seu estoque núcleos. Loja no gelo enquanto você verificar o rendimento dos núcleos.
- Para verificar o rendimento dos núcleos, coloque 98 mL de tampão de diluição do esperma (SDB), 1 ml do estoque nuclear e 1μl de diluição 1:100 do estoque Hoechst em um tubo Eppendorf 1,5 ml. Misture o estoque nuclear muito bem usando um razor-cortada (ou grande abertura) ponteira pouco antes de retirar o mL 1. Misture a SDB diluído / Hoechst / núcleos muito bem e deixe uma pequena quantidade de fluxo para a câmara de um hemocitômetro de Neubauer melhorada por ação capilar. Contagem de núcleos em uma praça do hemocitômetro sob um microscópio composto. De um homem, você deve obter a contagem de pelo menos 100-200 (X10 4 células / mL) para esta diluição de 1:100 do estoque para uma concentração de ações sem diluição de 1-5 2X10 células / ml. Se o seu estoque é menos concentrada, vamos resolver os núcleos por várias horas, remover alguns dos sobrenadante, e recontagem. Deixe os núcleos a 4 ° C durante a noite para permitir que o glicerol para penetrar melhor para a criopreservação; em seguida, misture o estoque nuclear bem com um grande orifício da ponta da pipeta, prepare alíquotas 20μl, e congelar em nitrogênio líquido.
B. Elaboração de Extrato de Alta Velocidade
Este método é adaptado de Murray 3 e produz um extrato interfase citosólica que irá promover a descondensação da cromatina inchaço e parcial dos núcleos espermáticos acrescentou. Extrato pode ser congelada em pequenas alíquotas a -80 ° C e descongeladas antes de usar.
- 3-5 dias antes da injeção de HCG, primeiro 12/08 fêmea adulta X. laevis pela injeção de 50 U de PMSG no saco linfático dorsal. A noite antes da preparação extrair, injetar cada sapo com 500 unidades HCG e coloque 2 rãs / recipiente em 2 1XMMR litros. Uma vez que um sapo com lise ou ativar os ovos podem comprometer a preparação do extracto, é conveniente separar as rãs em pares para a ovulação.
- Na manhã seguinte, prepare e chill todas as soluções antes de iniciar a preparação. Suavemente, manualmente expulsar os ovos de cada sapo em grande beakers contendo 1X MMR. Tela os ovos em cada recipiente e omitir qualquer lotes de ovos com sinais de lise mottling, ou a activação (visualizada pela contração da pigmentação no hemisfério animal) do procedimento. Coleta de ovos ininterrupta, mesmo com a pigmentação. Ovos bons também podem ser coletados a partir do MMR 1X nos baldes sapo. O volume total de ovos deve ser> 100 mL da 8-12 fêmeas.
- De-jelly os ovos. Para fazer isso, remova MMR, tanto quanto possível, adicione uma pequena quantidade de solução de cisteína, e agite os ovos. Substituir com solução de cisteína fresco várias vezes durante de-gelatinizante. De-geléia cada lote de ovos separadamente e descartar lotes com quebra ou a ativação do ovo. Combine o restante dos ovos.
- Lave os ovos quatro vezes em 35 ~ mL de tampão extract (XB), e depois duas vezes em 25 mL de CSF-XB com os inibidores da protease.
- Para embalar os ovos: transferência dos ovos em tubos de Beckman UltraClear. Permitir que os ovos para resolver. Remover o máximo CSF-XB possível. Centrifugar os ovos usando um Beckman SW 40 Ti rotor (rotor ou similar) a 1000 rpm (150g) de ~ 60 seg a 4 ° C. Retire o excesso de solução a partir do topo dos ovos embalados.
- Para esmagar os ovos e gerar citoplasmática extrair: centrifugar os ovos em 10.000 rpm (16.000 g) por 10 min a 4 ° C. Os ovos devem separar em três camadas: lipídica (top), citoplasma (centro), e gema (parte inferior). Coletar a camada citoplasmática de cada tubo com uma agulha de calibre 18, inserindo a agulha através do tubo na base da camada de citoplasma. Transferência de citoplasma de um novo tubo de Beckman UltraClear no gelo.
- Adicionar inibidores da protease para o citoplasma isolado para uma concentração final de 1X. Recentrifuge o citoplasma a 16.000 g por 10 min a 4 ° C. Recolher o citoplasma esclareceu como descrito acima. Esperam obter 0,75-1 citoplasma mL / sapo.
- Adicione 1 / 20 do volume de extrato de mix de energia para a amostra. Transferência de citoplasma em tubos de paredes espessas de policarbonato para o TL-100 ultracentrífuga Beckman. Tubos de armazenar cerca de 3 mL cada um e deve ser pelo menos metade.
- Adicionar 1 M CaCl 2 a cada tubo a uma concentração final de 0,4 mM. Incubar os tubos durante 15 min à temperatura ambiente. Este inativa CSF e empurra o extrato em interfase.
- Balanço dos tubos e centrifugar-los em um TL-100 ultracentrífuga Beckman usando um TLA-100,3 rotor em 70.000 rpm (200.000 g) por 1,5 horas a 4 ° C. O citoplasma se fracionar em quatro camadas, de cima para baixo: lipídico, citosol membrana, / mitocôndrias e glicogênio / ribossomos.
- Remover a camada citosólica de cada tubo (~ 1 se mL 2-3 mL foi carregado para dentro do tubo) através da inserção de uma seringa no topo do tubo através da camada lipídica. Alienar a fração citosólica de tubos fresco e recentrifuge as amostras a 70.000 rpm (200.000 g) por 20 min a 4 ° C.
- Alíquota do sobrenadante em 25 mL em alíquotas de 0,5 mL tubos. Quick-congelar as alíquotas em nitrogênio líquido e armazenar a -80 ° C até o uso. Para determinar se o extrato é eficaz, os núcleos do esperma pode ser incubadas no extrato e corados com Hoechst para determinar se os núcleos visivelmente swell (engrossar e alongar) dentro de 10 min da adição à temperatura ambiente.
C. reação Transgénese e transferência nuclear
Importante: Verifique se soluções, equipamentos e rãs estão todos prontos antes de começar uma reação. Uma vez que você começar, você deve proceder com a reação utilizando o calendário aproximado descrito a seguir, já que muitos componentes não permanecer estável por> 30 minutos. Enquanto o estoque núcleos do esperma é mantido em gelo, reações transgênese (ambos diluído e concentrado) deve ser mantido em temperatura ambiente.
- Primeiro-rãs do sexo feminino. À noite antes de transgênese, vários injetar (3-5) sapo adulto do sexo feminino com 800 unidades de HCG no saco linfático dorsal para obter ovos frescos início no dia seguinte.
- O dia do procedimento transgênese, preparar ou trazer a temperatura das soluções necessárias para a transgênese:
- Cisteína feita recentemente (2,5% em 1XMMR, pH8.0). Você vai precisar de várias centenas de mililitros para ser usado naquele dia.
- 0.2XMMR Ficoll 6% para os pratos de transplante e recuperação de embriões transgênicos e 0.2XMMR 100 mcg / mL de gentamicina (sem Ficoll) para a criação de embriões. Soluções não devem ser mais quente do que 18-21 ° C e embriões transgênicos devem ser levantados através de clivagens início a temperaturas entre 16 e 21 ° C, já que temperaturas mais altas afetar tanto a freqüência de transgênese e desenvolvimento embrionário.
- Descongelar e atingir a temperatura ambiente alíquotas congeladas de DRS (tampão de diluição do esperma) para transplantes do dia, descongelar o extrato de alta velocidade e colocar no gelo, e preparar um 100mM MgCl 2 solução.
- Sair ªagarose e pratos de injeção e preencher com MMR / Ficoll solução, e configurar e executar o pré-bomba de infusão para estabilizar o fluxo.
- Verifique se as rãs do sexo feminino são poedeiras e ovos são de alta qualidade. Idealmente, os ovos devem ter um córtex empresa (manter a forma depois de-gelatinizante).
- Configurar uma reação transgenia:
- Muito delicadamente (usando uma ponteira cortada) misturar o estoque núcleos e combinam em um tubo Eppendorf 1,5 ml:
Núcleos 4μl (~ 4 8X10-5 núcleos)
2μl linearizada plasmídeo (100ng/μl)
Incubar 5 minutos à temperatura ambiente. - enquanto processo de incubação é, diluir 0.5μl da enzima de restrição em 4.5μl H 2 O e adicione 1μl da enzima diluída para 18μl da SDB, 2μl de MgCl 2 e 2μl de extrato de alta velocidade. Adicione esta mistura para a reação de núcleos de plasmídeo. Incubar mais 10 minutos para inchar os núcleos.
- Durante esta incubação, squeeze ovos 2-3 sapos e geléia de-cisteína em solução. Lave-os bem (5x) com 1XMMR, e usar uma pipeta de largura deu a transferência de 400-500 ovos dejellied para cada prato bem agarose contendo 0,2 X Ficoll MMR 4%. Isso normalmente leva cerca de 10 minutos, então quando pratos de ovos são preparados a reação é geralmente pronto para diluir.
- Cerca de 15-20 minutos após o início do passo, misture delicadamente a reação (núcleos extrair / / DNA) com uma ponta cortada e adicionar cerca de 5μl a 150 SDB mL à temperatura ambiente. Núcleos nesta mistura diluída é estável por cerca de 1h., Enquanto eles não retêm a capacidade de transplante, desde quando saiu da mistura concentrada.
- Muito delicadamente (usando uma ponteira cortada) misturar o estoque núcleos e combinam em um tubo Eppendorf 1,5 ml:
- Carga a agulha: Misture a reação diluída, preparada acima muito delicadamente com uma ponta de largura orifício pipeta, em seguida, carregar a agulha rapidamente, como núcleos resolverão rapidamente no tubo. Para protelar o agulha, coloque um pedaço de tubo de Tygon bem no final de uma ponteira cortada 200μl. Desenhe a solução para a ponta da pipeta, em seguida, conectar o tubo à agulha e deixar a solução para inserir a agulha por gravidade ou levemente pressionando o êmbolo da pipeta.
- Anexar agulha para começar a tubulação e bomba de transplantes de núcleos. Injecções devem ser rápidas, rasas e aproximadamente perpendicular à membrana do óvulo plasma para evitar fazer danos. A uma taxa de fluxo sugerido (10nl/sec), manter a agulha dentro do ovo para ~ 0,5 segundos. Você deve concluir 1-2 pratos de transplantes dentro de 20-30 minutos.
Após as injeções, deixe os pratos em 16-20 ° C até embriões atingiram o estágio de célula 4-8. Classificar os embriões cleaving longe de seus vizinhos não-clivagem, transferindo (com um copo de pipeta Pasteur com ponta de aproximadamente o mesmo diâmetro de um ovo) para um prato grande de doce 0.2XMMR Ficoll 4%. Subdividir a clivagem de embriões em grupos menores (10-15 embriões / poço de uma placa de 6 poços) e cultura em 0.2XMMR (sem Ficoll) 100 mcg / mL de gentamicina através do desenvolvimento precoce. Embriões devem ser verificados durante a gastrulação com qualquer embriões morrendo removidas imediatamente e os meios de comunicação mudado quando necessário.
Solução de problemas:
- Agulha é bloqueado: fluxo de solução da agulha deve ser aparente durante os transplantes. Se a agulha for bloqueada por partículas visíveis, alterar agulhas ou tentar remover os destroços por corte a ponta com uma pinça e empurrando solução através da agulha.
- Sem ovos clivagem são obtidos: verifique se diluições de núcleos de esperma e de volume de injeção são adequadas e que a agulha não foi bloqueado durante o transplante. Se o volume de injeção é muito alto, os ovos também podem não decompor e, em vez mostrar pigmentação descoloridos ou danos.
- Embriões morrem durante a gastrulação. Vários fatores podem aumentar a sobrevivência embrionária:
- tomar cuidado com os núcleos durante a preparação ea reação enzimática. Núcleos descondensada são frágeis e precisam ser transplantados usando o calendário acima. Não colocá-los no gelo.
- O dano cromossômico sustentada pelos núcleos do esperma durante a reação enzimática e transferência nuclear afeta tanto a freqüência de transgênese e o desenvolvimento normal dos embriões. Danos cromossômicos para os núcleos aumenta a eficiência da transgenia, mas afeta negativamente a sobrevivência / desenvolvimento normal. Diminuindo ou omitindo enzima de restrição durante a incubação da enzima podem aumentar a taxa de desenvolvimento normal, mas pode diminuir a freqüência de transgênese ou número de cópias do plasmídeo introduzido no genoma do embrião.
- Se o atraso for blástula através de embriões gástrula mostrar sinais de descoloração ou morte celular, também é possível que um reagente utilizado para os transplantes era tóxico para os ovos. Além disso, se ovos não têm um córtex empresa, eles podem sofrer exogastrulation e não para gerar normais de pós-gástrula embriões.
- O número de embriões expressando o transgene é baixa. Aumentar a quantidade de enzima de restrição.
Representante Transgênicos Resultados Embrião
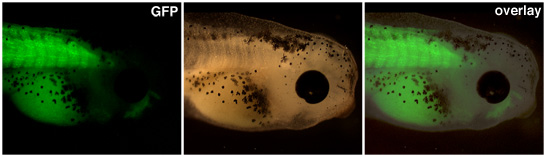
Embriões transgênicos resultantes de transferências nuclear deve ser levantada até a expressão do promotor de interesse é visível. Na Figura 1 acima, um promotor de actina de músculo drives expressão da proteína verde fluorescente no somitos deste girino transgênicos.
Access restricted. Please log in or start a trial to view this content.
Discussão
Para cada construção de transgênicos a serem testados, geralmente transplante de núcleos em 500-1000 ovos; nessa escala, podemos gerar embriões transgênicos expressando até 10 construções diferentes por dia, dependendo de quantas mulheres são induzidas a pôr ovos. Desses transplantes, cerca de um terço do cleave ovos e 60-80% destes embriões cleaving proceder através gastrulação normalmente. Dependendo das condições de reação utilizadas, entre 10-50% desses embriões expressar o transgene de interess...
Access restricted. Please log in or start a trial to view this content.
Divulgações
Experimentos em animais foram realizados de acordo com as diretrizes e regulamentos estabelecidos pela Animal Care e Use Comité na Washington University School of Medicine.
Agradecimentos
Financiamento para o nosso trabalho é fornecido pelo NIH, a March of Dimes, ea Sociedade Americana do Câncer.
Access restricted. Please log in or start a trial to view this content.
Materiais
A. preparação núcleos do esperma
Reagentes:
- 1X MMR (2mM CaCl 2, HEPES 5mM, pH 7,5, 2mM KCl, 1 mM MgCl 2, 100mM NaCl).
- 0,1% tricaina metanosulfanato (MS222, ácido aminobenzóico etil éster, Sigma A-5040), bicarbonato de sódio a 0,1%. Dissolvem na água.
- Manteiga Preparação 2X Nuclear (NPB). No dia da preparação núcleos espermáticos, compõem 30 ml de NPB 2X de alíquotas das soluções estoque armazenado congelado: 500 mM de sacarose (1,5 M de ações), 30 mM HEPES (stock 1M; titular com KOH para que pH 7,7 é de 15 mM), 1 trihydrochloride espermidina mM (Sigma S-2501, 10 ações mM), 0,4 mM tetrahidrocloreto espermina (Sigma S-1141, 10 ações mM), 2 mM ditiotreitol (Sigma D-0632, 100 ações mM), 2 mM EDTA (500 mM EDTA, pH 8,0).
- Use o 2XNPB para fazer a. 30ml 1X NPB, b. 10ml 1XNPB +3% BSA (fração V, Sigma A-7906), c. BSA 1XNPB 5ml 0,3%.
- Lysolecithin: 100 l de 10 mg / ml L-α-LYSO-lecitina, gema de ovo (Calbiochem, 440154); dissolver à temperatura ambiente imediatamente antes da utilização. Loja de ações sólida a 20 ° C. Descartar o pó de ações se torna-se pegajosa.
- Albumina sérica bovina (BSA), 10% (w / v) BSA (fração V, Sigma A-7906) Maquiagem 5 ml na água no dia da preparação núcleos do esperma.
- Esperma de armazenamento de buffer (1 ml) 1X NPB, glicerol 30%, BSA 0,3%.
- Tampão de diluição do esperma: 250 mM de sacarose, 75 mM KCl, 0,5 mM trihydrochloride espermidina, espermina tetrahidrocloreto 0,2 mM. Titular de pH 7,3-7,5 e 0,5-1 loja alíquotas ml a 20 ° C.
- Hoechst No. 33342 (Sigma B-2261): 10 ações mg / ml em dH 2 O, armazenar em um recipiente apertado luz a 20 ° C.
Equipamento:
- Rotor de caçamba móvel e centrifugar
- gaze
- instrumentos de dissecação (pinças e tesouras)
- microscópio de fluorescência
- funil
- luvas
- hemocitômetro
- agulhas (26 gauge)
- toalhas de papel
- placas de Petri (60 mm)
- pipetas
- plástico (5 e 10 ml)
- Pipetman dicas (1 ml e 200μl)
- Seringas (1 ml)
- tubos (14 ml; Falcon, 2059)
- tubos
- microcentrífuga (1,5 ml)
B. Elaboração de Extrato de Alta Velocidade
Reagentes:
- Modificado 1X Marc da campainha (MMR): 100 mM NaCl, 2 mM KCl, 1 mM MgCl 2, 2 mM CaCl 2, 5 mM HEPES, pH 7.5. Prepare um estoque de 10X, e ajustar o pH com NaOH para 7,5.
- 20X tampão Extract (XB) estoque de sal: 2 M KCl, 20 mM MgCl 2, 2 mM CaCl 2, filtram-esterilizar e armazenar a 4 ° C.
- Extrato de buffer (XB; recém-preparados e armazenados em gelo): 1X sais XB, 50 mM de sacarose, HEPES 10 mM (1 M de ações, titulada com KOH de modo que o pH é de 7,7 quando diluído a 15 mM; filtro de esterilizar e armazenar em alíquotas a 20 ° C). Prepare cerca de 100 ml.
- 2% (w / v) L-Cisteína cloridrato de 1-hidrato: Formada em 1X sais XB antes de usar e titulada até pH 7,8 com NaOH. Prepare cerca de 300 ml.
- CSF-XB: 1X sais XB, 1 mM MgCl 2 (além de MgCl 2 apresentam em sais XB; concentração final 2 mM), 10 mM HEPES, pH 7,7, 50 mM de sacarose, 5 mM EGTA, pH 7.7. Prepare 50 ml.
- Inibidores da protease: Mistura de leupeptin, chymostatin e pepstatin, cada dissolvido para uma concentração final de 10 mg / ml em dimetil sulfóxido (DMSO). Loja em pequenas alíquotas a 20 ° C.
- 1 M CaCl 2.
- Cabaz energético: 150 fosfato de creatina mM, 20 mM ATP, 20 mM MgCl 2.
- Pregnant Mare Serum Gonadotropin (PMSG): 100 U / ml PMSG (PG600 ®, Intervet, Inc., 021.825). Dissolver em água e armazenadas a 20 ° C.
- Gonadotrofina Coriônica Humana (HCG): 1000 U / ml HCG (CHORULON ®, Intervet, Inc., 057.176). Dissolver em água e armazenadas a 4 ° C.
Equipamento:
- Xenopus laevis fêmeas
- Agulhas (18 e 26 gauge)
- Pipeta Pasteur
- ampla furo
- Seringas (1 mL)
- Tubos de microcentrífuga (0,5 mL)
- Tubos, espessura de parede de policarbonato (Beckman, 349622)
- Tubos, UltraClear (14 x 95 mm; Beckman, 344060)
- Ultracentrífuga e rotores (por exemplo, Beckman TL-100 com rotores SW 40 Ti e TLA-100,3)
- Copos para coleta de ovos
- Baldes ou recipientes para a realização de rãs do sexo feminino (por exemplo, 4-L copos de plástico com tampa mesh).
C. Nuclear transplante.
Reagentes:
- Agarose 2,5% em 0.1XMMR (para fazer pratos de injeção)
- Cisteína 2,5% em 1XMMR, PH8.0, preparado no dia de uso
- Ficoll
- 10 mg / ml de gentamicina (estoque 1000X)
- extrato de ovos de alta velocidade (veja acima)
- 100 MgCl 2
- MMR 10X (veja acima)
- Enzima de restrição (por exemplo, NotI de New England Biolabs)
- Tampão de diluição do esperma (SDB; veja acima) e núcleos de espermatozóides (veja acima)
- Gonadotrofina Coriônica Humana (HCG) como acima
- óleo mineral (Sigma, M8410)
- Plasmídeo linearizado para ser apresentado como o transgene: Prepare plasmídeo linearizado em uma concentração de cerca de 100 ng / mL em estéril, livre de nuclease água (evitamos Tris EDTA e contendo buffers, que são pouco tóxicos para os embriões). A enzima de restrição usado para linearizar o plasmídeo não tem que ser o mesmo que o utilizado na reação de transferência nuclear. Nós usamos geralmente NotI para todas as reações, independentemente do que é plasmídeo linearizado com. Alguns calibração da diluição enzima usada na reação pode ser necessário, como enzimas em excesso pode causar efeitos adversos sobre a pós-gástrula desenvolvimento. Plasmídeo pode ser purificado de várias maneiras diferentes: costumamos usar o kit de purificação QIAquick Qiagen PCR de acordo com as instruções do fabricante; purificação de uma única faixa de um gel não é necessário. Se plasmídeo é purificado usando fenol / clorofórmio e precipitação extrações de etanol, a certeza de remover todos os vestígios de orgânicos e etanol.
Equipamento:
Pratos de agarose injectável: Em uma placa de Petri 60 milímetros de plástico, colocar uma pequena 35mmX35mm pesar de barco no fundido agarose 2,5% em 0.1XMMR água para criar uma depressão com um fundo revestido agarose para o preenchimento com os ovos. Uma vez agarose endureceu wrap, em parafilme e armazenar a 4 ° C até o uso. Faça 2-3 pratos com antecedência para cada reação transgênico você pretende fazer.
Bomba de infusão: Nós usamos uma bomba de infusão única seringa do Aparelho Harvard, equipado com uma seringa de 3 cc / agulha cheia de óleo mineral (Sigma M-8410). Blunt a ponta da agulha da seringa (para mantê-lo de perfurar a tubulação) e conectar o tubo tygon bem. Funcionar a bomba em ~ 10nl/sec; isso pressupõe que o tempo a agulha é em cada ovo haverá seg maior que 1. Bomba deve ser pré-run por vários minutos antes de transgênese de partida para o dia para garantir que o êmbolo da seringa para fique nivelada com o pistão e esse fluxo constante positiva de óleo para fora do tubo está ocorrendo.
Agulhas para a transferência nuclear. Utilizando um extrator de micropipeta, gerar agulhas com comprimento, dicas inclinada. Clipe estes com um fórceps sob um microscópio de dissecação equipado com um micrômetro ocular para obter uma abertura ~ micron 80 com uma forma chanfrada.
Outros equipamentos: Xenopus laevis fêmeas, estereomicroscópio, incubadora, micromanipulador, puxador de microinjeção agulha (por exemplo, modelo P-87, Sutter), agulhas de seringa (26 gauge), agulhas microinjeção de vidro, micrômetro ocular calibrada para recorte de dicas microinjeção agulha de diâmetro 80μm, placas de Petri, pesar barcos 35mm, tubos de Tygon (ID = 1 / 32 pol, OD = 3 / 32 pol)
Referências
- Kroll, K. L., Amaya, E. Transgenic Xenopus embryos from sperm nuclear transplantations reveal FGF signaling requirements during gastrulation. Development. 122, 3173-3183 (1996).
- Amaya, E., Kroll, K. L. A method for generating transgenic frog embryos. Methods Mol Biol. 97, 393-414 (1999).
- Murray, A. W. Cell cycle extracts. Methods Cell Biol. 36, 581-605 (1991).
- Hartley, K. O., Hardcastle, Z., Friday, R. V., Amaya, E., Papalopulu, N. Transgenic Xenopus embryos reveal that anterior neural development requires continued suppression of BMP signaling after gastrulation. Developmental Biology. 238, 168-184 (2001).
- Karaulanov, E., Knöchel, W., Niehrs, C. Transcriptional regulation of BMP4 synexpression in transgenic Xenopus. EMBO J. 23, 844-856 (2004).
- Ogino, H., Fisher, M., Grainger, R. M. Convergence of a head-field selector Otx2 and Notch signaling: a mechanism for lens specification. Development. 135, 249-2458 (2008).
- Taylor, J. J., Wang, T., Kroll, K. L. Tcf- and Vent-binding sites regulate neural-specific geminin expression in the gastrula embryo. Developmental Biology. 289, 494-506 (2006).
- Marsh-Armstrong, N., Huang, H., Berry, D. L., Brown, D. D. Germ-line transmission of transgenes in Xenopus laevis. Proceedings of the National Academy of Sciences of the United States of America. 96, 14389-14393 (1999).
- Offield, M. F., Hirsch, N., Grainger, R. M. The development of Xenopus tropicalis transgenic lines and their use in studying lens developmental timing in living embryos. Development. 127, 1789-1797 (2000).
Access restricted. Please log in or start a trial to view this content.
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados