A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
إعداد مصفوفات شكوى لقياس تقلص الخليوي
In This Article
Summary
في هذا الفيديو ، ونحن لشرح التقنيات المستخدمة لصنع التجريبية ، متوافقة مع المصفوفة خارج الخلية (ECM) ركائز مغلفة مناسبة لزراعة الخلايا ، والتي هي قابلة للالمجهري قوة الجر ومراقبة الآثار المترتبة على تصلب ECM على سلوك الخلية.
Abstract
تنظيم التصاق الخليوي الى المصفوفة خارج الخلية (ECM) ضروري للهجرة الخلايا وإعادة تصميم ECM. الالتصاقات البؤرية والجمعيات الجزيئات أن الزوجين مقلص F - أكتين الهيكل الخلوي للECM. يسمح هذا الصدد لنقل القوات الميكانيكية داخل الخلايا عبر غشاء الخلية إلى الركيزة الأساسية. وقد أظهرت الأعمال الأخيرة الخصائص الميكانيكية للالتصاق ECM تنظيم الاتصال والتشكل F - أكتين فضلا عن العديد من العمليات الفسيولوجية ، بما في ذلك تمايز الخلايا والانقسام ، والانتشار والهجرة. وهكذا ، أصبح استخدام خلايا من ركائز الثقافة السائدة وسيلة للسيطرة على وجه التحديد على نحو متزايد وتعدل الخصائص الميكانيكية ECM.
لقياس قوى الشد في الالتصاقات البؤرية في زنزانة ملتصقة ، يتم استخدام ركائز متوافقة بالتزامن مع التصوير ذات الدقة العالية والتقنيات الحاسوبية في أسلوب يطلق عليه قوة الجر المجهري (TFM). هذه التقنية تعتمد على قياسات لحجم واتجاه المحلية التشوهات الناجمة عن الانكماش الركيزة الخلوية. بالاشتراك مع عالية الدقة المجهر مضان من البروتينات الموسومة fluorescently ، فمن الممكن ربط تنظيم هيكل الخلية وإعادة عرض مع قوات الجر.
هنا نقدم بروتوكول مفصلة تجريبية لإعداد مصفوفات ، ثنائي الأبعاد متوافقة لغرض خلق ركيزة الثقافة الخلية مع صلابة جيدة تتميز ميكانيكية الانضباطي ، الذي هو مناسبة لقياس الانكماش الخلوية. هذه البروتوكولات تتضمن تصنيع بولي أكريلاميد الهلاميات المائية ، وطلاء للبروتينات ECM على هذه المواد الهلامية ، وخلايا الطلاء على المواد الهلامية ، وعالية الدقة باستخدام المجهر مبائر غرفة الارواء. بالإضافة إلى ذلك ، ونحن نقدم عينة تمثيلية من بيانات تظهر موقع وحجم القوات واستشهد الخلوية باستخدام بروتوكولات TFM.
Protocol
1. تفعيل سطح ساترة
- Coverslips (# 1.5 ، 22x40 ملم) يتم تنظيفها باستخدام سلسلة من يغسل الصابون والايثانول في بروتوكول سبق وصفها (واترمان - Storer ، 1998) لتنظيف وإزالة الغبار.
- coverslips مكان في رفوف الفولاذ المقاوم للصدأ حامل ، متباعدة بحيث coverslips بصرف النظر واللمس لا.
- هود الكيميائية في الدخان (قفازات ونظارات واقية النتريل مستحسن) ، تمييع كامل قوتها 3 aminopropyltrimethoxysilane في الأيزوبروبانول لتركيز النهائي من 2 ٪ (2ml سيلاني / 100 مل الأيزوبروبانول) لملء طبق زجاج مربع (~ 350ml حجم). بسبب التفاعل مع البلاستيك ، واستخدام الزجاج ماصة باستور لتطبيق 3 - aminopropyltrimethoxysilane إلى الأيزوبروبانول.
- coverslips بالكامل تزج من 1.2 إلى هذا الحل لمدة 10 دقيقة مع التحريك بلطف على طبق من ضجة في غطاء الدخان.
- غسل coverslips بغمر في DDH 2 O (4 التبادلات من الماء). سماح 10 دقيقة تمرغ الوقت لتبادل النهائي ، مع التحريك. يجب التخلص من الأميني سيلاني الحلول التي تحتوي على نفايات خطرة.
- coverslips الجافة في الحاضنة في درجة حرارة دافئة (~ 37 درجة مئوية) لمدة 10 دقائق الغبار في بيئة حرة.
- تبرد لدرجة حرارة الغرفة.
- في غطاء الدخان ، coverslips اغمس في محلول غلوتارالدهيد 1 ٪ في DDH 2 O في طبق زجاج مربع على تحريك لوحة لمدة 30 دقيقة.
- غسل بنسبة 3 تبادل DDH 2 O لمدة 10 دقيقة في الصرف ، مع التحريك. التخلص من غلوتارالدهيد كنفايات خطرة.
- الجاف في درجة حرارة الغرفة ، وتغطي بورق الألمنيوم لتجنب الغبار من التمسك coverslips.
- تخزينها في مكان جاف بعيدا عن الغبار ، لتصل إلى 2 أشهر.
2. إعداد بولي أكريلاميد (PAA) هلام
- إعداد حلول المخزون من مادة الأكريلاميد / مكرر الأكريلاميد مزيج من مادة الأكريلاميد 40 ٪ و 2 ٪ مكرر الأكريلاميد ، وبعد الجدول رقم 1. نحافظ على عدة حلول الأسهم التي هي الأمثل لصلابة المواد الهلامية PAA مختلفة ، يتم سرد الأمثلة في الجدول رقم 1 و 2. يمكن أن تظل الحلول الأسهم لعدة سنوات ، طالما يتم الاحتفاظ بها في زجاجة مظلمة في 4 جيم
- ويتم الحصول على حلول العمل التي تحتوي على تركيزات النهائية المرجوة من الأكريلاميد / مكررا من مادة الأكريلاميد ، حلول المخزون. على سبيل المثال ، نحن نستعد حل العاملة 7.5 ٪ acrylamide/0.10 ٪ مكرر الأكريلاميد في DDH 2 O لصنع المواد الهلامية 2.8kPa PAA.
- ديغا حل الأكريلاميد في فراغ الغرفة لمدة 20 دقيقة ، للحد من الأوكسجين داخل الحل الذي يمنع PAA البلمرة.
- إعداد الأمونيوم 10 ٪ بيرسلفات (APS) حل (0.5g/5mL). استخدام الطازجة الأسهم العمل في غضون 3 أيام. بدلا من ذلك ، يمكن تجميد الأرصدة لاستخدامها في مواعيد لاحقة.
- في حين أن مادة الأكريلاميد والتفريغ ، 1x3 مسح على الزجاج المجهر "الشريحة مع المطر - X مناديل بقوة لجعل سطح الزجاج مسعور الشريحة. لإزالة الزائدة أمطار - X ، مسح الزجاج مع الشريحة Kimwipe رطبة. تعيين شريحة زجاجية جانبا ، وتغطيتها.
- إزالة حل الأكريلاميد من فراغ الغرفة وإضافة الخرز الفلورسنت (1 ٪ من حيث الحجم ، 5 ميكرولتر العمل من أجل حل المدرجة في الجدول 1). إضافة 0.75μl TEMED و 2.5 ميكرولتر وكالة الأنباء الجزائرية 10 ٪ ، والتي سوف تبدأ البلمرة هلام. مزيج جيد من قبل لpipetting ثوانى 5 ~ ، للتقليل من إدخال فقاعات ،
- تطبيق 10-12 ميكرولتر من محلول مادة الأكريلاميد لشريحة المجهر مسعور (المعد في الخطوة 2.4) ومكان يمكنهم ساترة 22x40mm على رأس الحبرية. وينبغي حل هلام معطف ساترة بأكمله. تذليل أي فقاعات التي قد تظهر في الحل. يسمح الحل هلام لتتبلمر في درجة حرارة الغرفة ل10 دقيقة ~.
- ويمكن تقييم الانتهاء من حل عن طريق البلمرة عكس بقية العاملين في أنبوب microcentrifuge. أيضا ، قد جل بلمرة سحب بعيدا عن الحواف ساترة. ويلاحظ على الفور بعد البلمرة العيانية ، فصل ساترة من الشريحة الزجاجية. غرامة استخدام غيض من زوج من ملاقط أو على حافة شفرة حلاقة ، إزالة بعناية ساترة ، مع تولي جل من السطح شريحة المجهر وهلام تزج في DDH 2 O ، للحفاظ على الترطيب.
3. اقتران المصفوفة خارج الخلية (ECM) البروتينات إلى هلام PAA
ويمكن استخدام ثلاث طرق مختلفة لنعلق ECM البروتين إما إلى السطح العلوي للهلام PAA (3.1 و 3.2) ، أو دمج البروتين داخل ECM حجم هلام (3.3). هنا ، نحن نناقش اقتران فبرونيكتين إلى المواد الهلامية PAA أن يؤدي إلى سطح كثافة يجند أن يعادل المبلغ كثف على الزجاج بعد الحضانة مع 10 ميكروغرام / مل حل فبرونيكتين لمدة 1 ساعة. وترد تفاصيل الاعتبارات لاختيار الأسلوب في المناقشة.
- عبر ربط ECM البروتين على سطح هلام PAA بواسطة سلفو - SANPAH الأمينات رد الفعل على البروتينات هي التي تعلق تساهمي إلى السطح من هلام PAA heterobifunctional عبر رابط سلفو - SANPAH
- إعداد 40 ميكرولتر aliquots عمل سلفو - SANPAH بحل S ulfo - SANPAH المسحوق في سلفوكسيد ثنائي ميثيل اللامائية (DMSO) (20 ملغ من ميكرولتر في سلفو - SANPAH). تجميد أرصدة فلاش في النيتروجين السائل وتخزينه في -80 درجة مئوية لاستخدامها لاحقا.
- إزالة DDH 2 O من سطح هلام باستخدام الدوار ساترة (<2sec). تجنب تجفيف هلام.
- تمييع سلفو - SANPAH - DMSO aliquots في DDH 2 O (2mg/ml ، ودرجة الحموضة 7) مباشرة قبل الاستعمال ومعطف سطح هلام (~ 200 ميكرولتر). علما بأن التفاعل نصف حياة سلفو - SANPAH قصيرة (~ 5 دقائق) في درجة حرارة الغرفة في الماء ، وبالتالي ، ينبغي القيام بهذه الخطوات في وتيرة سريعة.
- يعرض سطح هلام لضوء الأشعة فوق البنفسجية في فرن عبر رابط الأشعة فوق البنفسجية (8W ، والطول الموجي 254 نانومتر على مسافة 2-3 بوصة مقابل 1.5 دقيقة). سوف سلفو - SANPAH تغير لونها من البرتقالي إلى البني.
- تراجع coverslips المعالجة بالأشعة فوق البنفسجية في كوب مع الطازجة O 2 DDH وإزالة الماء الزائد من سطح هلام باستخدام الدوار ساترة (<2sec).
- ماصة ~ 50 ميكرولتر من [فيبرونكتين] 1mg/ml الباردة (FN) (في برنامج تلفزيوني ، ودرجة الحموضة 7.4) في وعاء على طبق Parafilm بيتري. عكس ساترة على أعلى انخفاض FN ، هلام الجانب تتعرض لFN.
- تتفاعل في درجة حرارة الغرفة لمدة 1-2 ساعات أو عند 4 درجات مئوية خلال الليل.
- coverslips مكان في 6 سم أطباق زراعة الأنسجة التي تحتوي على برنامج تلفزيوني (الرقم الهيدروجيني 7.4) ، وهو ما يكفي لتغطية ساترة ، تحت ظروف معقمة في هود زراعة الأنسجة.
- غسل يغسل نطاق واسع مع العديد من (3-5) في برنامج تلفزيوني (الرقم الهيدروجيني 7.4) ، تحت ظروف معقمة.
- تعقيم coverslips باستخدام مصباح مبيد للجراثيم في هود زراعة الأنسجة لمدة 30 دقيقة.
- احتضان coverslips الخلية في وسائل الإعلام عن 30-45 دقيقة قبل خلايا الطلاء.
- عبر ربط ECM إلى السطح هلام PAA الجماعات هيدرات الهيدرازين الكربوهيدرات على البروتينات تتأكسد وبالإضافة إلى استخدام هلام هيدرات الهيدرازين.
- تعد المواد الهلامية بولي أكريلاميد كما هو موضح في القسم 2.
- مكان PAA coverslips هلام في طبق بتري البلاستيكية في غطاء الدخان وقفازات تستخدم ماصة حوالي 1 مل من هيدرات الهيدرازين مخفف على سطح كل هلام PAA واحتضان لمدة ساعتين على الأقل ، ولكن لا تزيد عن 24 ساعة
- إضافة DDH 2 O إلى طبق بيتري ؛ إزالة هيدرات الهيدرازين الحل والتخلص منها كنفايات خطرة.
- إضافة حامض الخليك بنسبة 5 ٪ في صحن بيتري أن تزج ساترة. تغطية واحتضان لمدة ساعة.
- إزالة حمض الخليك ، ويغسل مع DDH 2 O. في احتضان DDH 2 O لمدة ساعة. تنشط الآن coverslips وعلى استعداد للأكسدة عبر الرابط [فيبرونكتين] (الجبهة الوطنية).
- تمييع 10 ميكروليتر من 1 ملغ / مل حل FN في ميكرولتر 940 من 50 ملي خلات الصوديوم العازلة (الرقم الهيدروجيني 4.5) في أنبوب الطرد المركزي الصغيرة المظلمة ، مما يجعل تركيز النهائي من 10 ميكروغرام / مل.
- جعل المخزون من 20X الصوديوم الفوقية بريودات بإضافة 80 ملغ من الصوديوم الفوقية بريودات إلى 1 مل من 50 ملي خلات الصوديوم العازلة (الرقم الهيدروجيني 4.5).
- إضافة 50 20X ميكرولتر من الصوديوم الفوقية بريودات الأسهم إلى حل FN أعد 3.2.6 ، مثل أن تركيز العمل النهائية هي 10 ميكروغرام / مل FN و 4 ميكروغرام / مل الصوديوم الفوقية بريودات. احتضان الظلام في الأنبوب في درجة حرارة الغرفة لمدة 30 دقيقة.
- إزالة الزائدة DDH 2 O من سطح هلام تنشيط أعد 3.2.5 باستخدام الدوار ساترة (<2 ثانية). تجنب تجفيف هلام.
- الماصة ~ 500 ميكرولتر من محلول FN على سطح هلام المنشط واحتضان لمدة 1 ساعة في درجة حرارة الغرفة.
- coverslips مكان في الأطباق التي تحتوي على برنامج تلفزيوني (الرقم الهيدروجيني 7.4) ، وهو ما يكفي لتغطية ساترة.
- غسل يغسل نطاق واسع مع العديد من (3-5) في برنامج تلفزيوني (الرقم الهيدروجيني 7.4).
- تعقيم coverslips باستخدام مصباح مبيد للجراثيم في هود زراعة الأنسجة لمدة 30 دقيقة.
- احتضان coverslips الخلية في وسائل الإعلام عن 30-45 دقيقة قبل خلايا الطلاء.
- تصريف الجزء الأكبر من البروتين ECM في هلام PAA بواسطة Acryloyl - X ، succinimidyl استر يتم هذا البروتوكول قبل 2.5. تقترن الأمينات رد الفعل على البروتينات إلى مونومر الأكريلاميد مع NHS استر الكيمياء ثم شارك في بلمرة في الجزء الأكبر من هلام PAA.
- المتقارن ECM البروتين من خيار لAcryloyl - X في تعليمات الشركة الصانعة. يجب أن يتم تخزين المخزون من البروتين حلول مترافق في 4 درجات مئوية.
- حساب حجم العمل المطلوب حل PAA لتصنيع هلام (على سبيل المثال 10 في ساترة UL).
- طرح 50 ميكرولتر (على سبيل المثال حجم 10 ٪) من المياه من المبلغ المدرجة في حل صفة العمل في الجدول (1) والشروع في البلمرة.
- إزالة حجم المحسوبة في 3.3.2 وإضافة ECM / Acryloyl - X حل لحجم 10 ٪. (على سبيل المثال 1 ميكرولتر من ECM / Acryloyl - X إلى 9 ميكرولتر من محلول PAA). يجب أن يتم تنفيذ هذه الخطوة بشكل سريع ، كما هو جل البلمرة.
- استكمال الخطوات 2.6 و 2.7 كما هو موضح سابقا.
- غسل يغسل نطاق واسع مع العديد من (3-5) في برنامج تلفزيوني (الرقم الهيدروجيني 7.4) ، تحت ظروف معقمة.
- تعقيم coverslips باستخدام مصباح مبيد للجراثيم في هود زراعة الأنسجة لمدة 30 دقيقة.
- احتضان coverslips الخلية في وسائل الإعلام عن 30-45 دقيقة قبل خلايا الطلاء.
وتجرى هذه الخطوات بعد أن سمح لنشر الخلايا على الركيزة هلام ECM المغلفة (~ ساعات 6-12). لتجميع غرفة التصوير مبائر (RC - 30WA) ، من المفيد الاطلاع على الموقع الآلات وارنر للاسترشاد بها.
- خلية الإعلام الدافئة و 0.5 ٪ أو 0.25 ٪ التربسين وتحميلها الى 5ml أو حقنة 10ML.
- تحميل ساترة 22x30mm على حامل ساترة الأعلى لآلات التصوير وارنر غرفة مبائر (RC - 30WA) باستخدام الشحوم فراغ للحفاظ على ساترة في المكان.
- المكان غرفة تشكيل المطاط طوقا على رأس ساترة ، مما يتيح الوصول إلى كل مدخل ومخرج أنابيب البولي ايثيلين. هذا وسوف تسمح لتباعد بين 150-1000 ميكرون ساترة العلوي وساترة هلام المغلفة 22x40mm ، اعتمادا على حجم طوقا المستخدمة.
- المحاقن تحميل على مدخل أنابيب عبر عدة الموصل ، والتحقق من أن وسائل الإعلام ويتدفق عبر الأنابيب على ساترة الأعلى وليس فقاعات واضحة في خطوط التدفق.
- تطبيق الشحوم فراغ على قاعدة من غرفة وتحميل هلام المغلفة ساترة 22x40mm ، حتى من جانب الخلية. تطبيق وسائل الاعلام الحارة إلى الخلايا.
- صاحب مكان ساترة الأعلى على قاعدة الغرفة ، مع غرفة طوقا فصله عن ساترة هلام المغلفة. تأكد من أن تحديد موقع دبابيس داخل غرفة الجلوس قاعدة داخل ثقوب في تحديد موقع ساترة الأعلى.
- تطبيق الضغط بلايت الى قاعدة الغرفة واستخدام مفتاح لوحة الضغط على المسمار في لوحة وتأمين الضغط.
- التحقق من تدفق وسائل الاعلام من خلال أنابيب وغرفة لمراقبة أي تسرب محتمل داخل الغرفة والقضاء على أية مناطق خالية من وسائل الاعلام على سطح الخلية. ملاحظة : باستخدام إبرة صغيرة لقياس رسم الفراغ طفيفة بينما غرس مع وسائل الإعلام يمكن أن تساعد في القضاء على وسائل الاعلام مناطق خالية.
- تطبيق غرفة التصوير مبائر إلى المرحلة التي تقع داخل محول حامل المجهر للتصوير.
- صورة fluorescently البروتين المسمى والخرز الفلورسنت المدمجة ضمن الركيزة الجل على مجهر مضان مبائر.
- للحصول على صورة من المناصب داخل حبة غير عنيد هلام ، يروي التربسين لفصل الالتصاقات الخليوي من هلام ، والتقاط صورة من الخرز الفلورسنت في مجال التصوير نفسه حيث انضمت الخلية. المقارنة بين المواقف المتوترة وغير عنيد حبة يسمح لتقدير حجم النزوح الركيزة الجل تحت الانكماش.
ممثل النتائج :
بروتوكول أعلاه يصف الإجراء التجريبي لإعداد المواد الهلامية متوافقة PAA لدراسة الخلايا وانقباض هو مبين في الشكل 1. جل الحصول على السطح مع هذا البروتوكول هو مسطح نسبيا وعلى نحو سلس ، مع حبات الفلورسنت المدمجة بالتساوي في جميع أنحاء (الشكل 2A).
إذا كان ينبغي قياس الانكماش هلام في الموقع من الالتصاقات البؤرية ، والتصوير من الخلية (الشكل 3A) وسطح هلام (الشكل 3B) ينبغي القيام به في الطائرة الضوئية مبائر من الالتصاقات البؤرية. يمكن أن تقلص من هلام يمكن تصور من النزوح من الخرز الفلورسنت المدمجة (الشكل 3B) على سطح الخلايا عندما هلام ملتصق (توتر) مقابل منفصلة (غير عنيد). يمكن استخدام الخوارزميات الحسابية العائد الجر الضغوط المرتبطة التشريد حبة ومعامل مرونة المقابلة من هلام (الشكل 3C و 3D) (Sabass وآخرون ، 2008). إذا كان التصوير تأخذ مكان أعمق في هلام ، ثم سوف يكون أصغر حبة التشريد وليس ممثل القوات الجر المبذولة في الالتصاقات البؤرية.
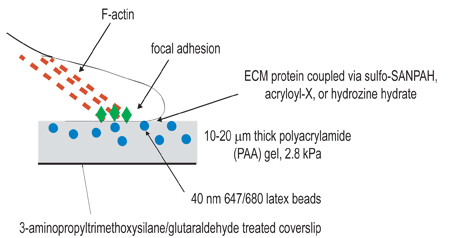
الشكل 1. توضيح تخطيطي من الإعداد التجريبية. الهدف العام من هذا الإجراء هو لإنشاء مصفوفات متوافقة لغرض دراسة انكماش الخلوية. الخطوة الأولى لإجراء التجريبي هو تنشيط coverslips عن طريق العلاج amino-silane/glutaraldehyde لغرض ترسيخ بلمرة المواد الهلامية. الخطوة الثانية هي تتبلمر هلام بولي أكريلاميد ، تحتوي على حبات الفلورسنت ، وعلى تنشيط وساترة. الخطوة الثالثة تتضمن هذه المادة الكيميائية عبر ربط يجند خارج الخلية إلى السطح من هلام بولي أكريلاميد ، وذلك باستخدام أحد الأساليب الثلاثة المذكورة في اقتران الخطوة 3. ومطلي ثم الخلايا على الجل وسمح للانضمام وانتشارها. تحت انكماش الخلوية نشطة ، جزءا لا يتجزأ من الخرز في هلام تهجير.

الشكل 2. شريحة مبائر البصرية السطح العلوي من هلام PAA ، كما تصور الخرز (أ) 40nm الفلورسنت المدمجة داخل الجل و (باء) فبرونيكتين المناعي.

الشكل 3. الممثل نتيجة لقوة الجر التجربة. (أ) التنسيق التصاقات في خلية عظمية U2OS الإنسان مarked بواسطة GFP - paxillin و (باء) مواقف من الخرز الفلورسنت المدمجة في هلام PAA الكامنة التصاقات في ولايات محورية (الحمراء) توترت (الأخضر) ، وغير عنيد. تشير الأسهم أمثلة التشرد حبة. يؤكد المستمدة (C.) ناقلات الضغط الجر و (د) المقابلة للحرارة مقياس الخريطة الجر من الانكماش من هلام ، وذلك باستخدام خوارزميات الحسابية (Sabass وآخرون ، 2008). مقياس شريط = 5 ميكرون.
الجدول رقم 1 :
(تم الحصول على بيانات لأول مرة في الجدول 1 من يونغ وآخرون ، وأكدت بشكل مستقل في المختبرات لدينا.) ألبوم سبيل المثال العامل وحلول PAA
| الأسهم PAA الحل | ||||
| معامل القص جل PAA (باسكال) | 230 | 2833 | 8640 | 16344 |
| 40 ٪ الأكريلاميد (مل) | 1.25 | 3.12 | 2.34 | 2.50 |
| 2 ٪ مكرر الأكريلاميد (مل) | 0.50 | 0.83 | 1.88 | 0.60 |
| الماء (مل) | 3.25 | 1.04 | 0.78 | 1. 90 |
| اجمالى حجم التداول (مل) : | 5 | 5 | 5 | 5 |
| العمل PAA الحل | ||||
| الأسهم مستعملة محلول (باسكال) | 230 | 2833 | 8640 | 16344 |
| حجم المخزون محلول (ميكرولتر) | 150 | 150 | 200 | 300 |
| المياه (ميكرولتر) | 341.75 | 341.75 | 291.75 | 191.75 |
| الخرز (ميكرولتر) | 5 | 5 | 5 | 5 |
| TEMED (ميكرولتر) | 0.75 | 0.75 | 0.75 | 0.75 |
| 10 ٪ وكالة الأنباء الجزائرية (ميكرولتر) | 2.5 | 2.5 | 2.5 | 2.5 |
| اجمالى حجم التداول (ميكرولتر) : | 500 | 500 | 500 | 500 |
| نهائي الأكريلاميد ٪ | 3 | 7.5 | 7.5 | 12 |
| نهائي مكرر الأكريلاميد ٪ | 0.06 | 0.1 | 0.3 | 0.15 |
الجدول 2 :
معامل القص من ركائز PAA من الأكريلاميد النهائية المختلفة ونسب مكرر الأكريلاميد
| 12 ٪ الأكريلاميد | 7.5 ٪ الأكريلاميد | |||
| ٪ مكرر الأكريلاميد | معامل القص (باسكال) | ٪ مكرر الأكريلاميد | معامل القص (باسكال) | |
| 0،145 | 16344 | 0.01 | 689 | |
| 0.28 | 30067 | 0.03 | 1535 | |
| 0.45 | 34263 | 0.05 | 2286 | |
| 0.55 | 42375 | 0،075 | 2833 | |
| 0،575 | 50873 | 0.1 | 4069 | |
| 0.6 | 55293 | 0.2 | 5356 | |
| 0.3 | 8640 | |||
| 5 ٪ الأكريلاميد | 3 ٪ الأكريلاميد | |||
| ٪ مكرر الأكريلاميد | معامل القص (باسكال) | ٪ مكرر الأكريلاميد | معامل القص (باسكال) | |
| 0.05 | 430 | 0.02 | 1.3 | |
| 0،075 | 600 | 0.04 | 54 | |
| 0.1 | 1431 | |||
Discussion
الإجراء الموضح هنا للحصول على الإعداد لقوة الجر المجهري (TFM) تجربة ، جنبا إلى جنب مع تنفيذ إجراءات تتبع الحسابية (Sabass وآخرون ، 2008) ، ويسمح لتقدير حجم القوات الخليوي مع ميكرون النطاق المكاني القرار. لتحسين بروتوكول تجريبي ، فمن الأهمية بمكان أن تشكل الركيزة هلام نق...
Disclosures
Acknowledgements
نشكر مختبر شفارتز اولريش لتتبع البرامج الحاسوبية المستخدمة في القياس الكمي للقوات الجر الخلوية (Sabass وآخرون ، 2008). وأيد هذا العمل من قبل شهادة بوروز ويلكوم جائزة وجائزة مدير معاهد الصحة القومية في بايونير (DP10D00354) لغارديل ML القومي للبحوث الطبية والعلماء جائزة الخدمة (5 GM07281 T32) ليرة سورية الشتوية.
Materials
| Name | Company | Catalog Number | Comments |
| 3-aminopropyltrimethyoxysilane | Aldrich | 28, 177-8 | |
| 40% Acrylamide | Bio-Rad | 161-0140 | |
| 2% Bis-acrylamide | Fisher Scientific | BP1404 | |
| TEMED | Fisher Scientific | BP 150-20 | |
| Ammonium persulfate | Fisher Scientific | BP179 | |
| 40nm fluorescent micro-spheres | Invitrogen | F8789 | |
| Sulfo-SANPAH | Pierce, Thermo Scientific | 22589 | |
| Confocal imaging chamber (RC-30) | Warner Instruments | 64-0320 | |
| Coverslip spinner | Home made | NA | |
| Ultraviolet lamp CL1000 | UVP Inc. | 95-0228-01 | |
| Stainless steel rack | Electron Microscopy Sciences | 72239-04 | |
| acryloyl-X, SE (6-((acryloyl)amino)hexanoic acid) | Invitrogen | A-20770 | |
| Hydrazine hydrate | Sigma-Aldrich | 225819 | |
| Sodium meta-periodate | Thermo Fisher Scientific, Inc. | 20504 | |
| Isopropanol | Fisher Scientific | A416-4 | |
| Fibronectin | Sigma-Aldrich | F2006 | |
| Collagen | BD Biosciences | 354236 | |
| Coverslips (#1.5) | Corning | 2940‐224 | |
| Glutaraldehyde | Electron Microscopy Sciences | 16120 | |
| Rain-X | SOPUS Products | www.rainx.com | |
| Acetic Acid | Acros Organics | 64-19-7 |
References
- Damljanovic, V., Lajerholm, B. C., Jacobson, K. Bulk and micropatterned conjugation of extracellular matrix proteins to characterized polyacrylamid substrates for cell mechanotransduction assays. Biotechniques. 39 (6), 847-851 (2005).
- Engler, A., Bacakova, L. N. e. w. m. a. n., Hategan, C., Griffin, A., M, D. D. i. s. c. h. e. r. Substrate compliance versus ligand in cell on gel responses. Biophys J. 86 ((1 Pt 1)), 617-628 (2004).
- Gardel, M. L., Sabass, B., Ji, L., Danuser, G., Schwarz, U. S., Waterman, C. M. Traction stress in focal adhesions correlates biphasically with actin retrograde flow speed. J Cell Biol. 183, 999-1005 (2008).
- Rajagopalan, P., Marganski, W. A., Brown, X. Q., Wong, J. Y. Direct comparison of the spread area, contractility, and migration of balb/c 3T3 fibroblasts adhered to fibronectin- and RGD-modified substrata. Biophys J. 87 (4), 2818-2827 (2004).
- Reinhart-King, C. A., Dembo, M., Hammer, D. A. The dynamics and mechanics of endothelial cell spreading. Biophys J. 89, 676-689 (2005).
- Stricker, J., Sabass, B., Schwarz, U. S., Gardel, M. L. Optimization of traction force microscopy for micron-sized focal adhesions. J. Phys: Condensed Matter. 22, 194104-194114 (2010).
- Sabass, B., Gardel, M. L., Waterman, C. M., Schwarz, U. S. High resolution traction force microscopy based on experimental and computational advances. Biophys J. 94, 207-220 (2008).
- Yeung, T. Effects of substrate stiffness on cell morphology, cytoskeletal structure, and adhesion. Cell Motil Cytoskeleton. 60 (1), 24-34 (2005).
- Waterman-Storer, C. M. Microtubule/organelle motility assays. Curr Protoc Cell Biol. , 13.1.1-13.1.21 (1998).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved