JoVE 비디오를 활용하시려면 도서관을 통한 기관 구독이 필요합니다. 전체 비디오를 보시려면 로그인하거나 무료 트라이얼을 시작하세요.
Method Article
세포 수축을 Quantifying에 대한 불만 사항 매트릭스의 준비
요약
이 비디오에서는, 우리는 세포 배양에 적합 규격, 세포외 매트릭스 (ECM) 코팅 기판을 조작하는 데 사용되는 실험 기법을 설명하고, 견인 힘 현미경 의무가 있으며, 세포 행동 ECM의 강성의 영향을 관찰하는.
초록
세포외 매트릭스 (ECM)에 세포 부착의 조절은 세포 마이 그 레이션 및 ECM의 리모델링을 위해 필수적입니다. 초점 adhesions은 macromolecular 어셈블리 그 부부 ECM에 수축성 F - 굴지의 cytoskeleton을하고 있습니다. 이 연결은 세포막에 걸쳐 기본 기판에 세포 기계 병력의 전송을 허용합니다. 최근 작품은 ECM의 기계적 성질은 초점 접착력 및 F - 굴지의 형태뿐만 아니라, 세포 분화, 분열, 증식 및 마이 그 레이션 등 다양한 생리 과정을 조절 표시하고 있습니다. 따라서, 세포 배양 기판의 사용이 정확하게 제어 및 ECM 기계적 특성을 조절하기 위해 점점 더 널리 사용 방법이되었습니다.
자기편 세포에 초점 adhesions의 견인 세력을 계량하기 위해 준수 기판은 고해상도 이미지와 방법 칭했다 견인 힘 현미경 (TFM)에서 전산 기술과 함께 사용됩니다. 이 기술은 세포의 수축에 의해 유도 기판 deformations의 로컬 크기와 방향의 측정에 의존하고 있습니다. 찬란 태그 단백질의 고해상도 형광 현미경와 함께, 그것은 견인 세력과 cytoskeletal 조직 및 개조를 상호 연관시킬 수 있습니다.
여기 우리는 세포 수축 측정에 적합합니다 잘 특징, 조정할 수있는 기계 강성과 세포 배양 기판을 만들 목적으로 2 차원, 호환 매트릭스의 준비에 대한 자세한 실험 프로토콜을 제시한다. 이러한 프로토콜은 polyacrylamide의 hydrogels의 제조 등 젤에서 ECM의 단백질 코팅, 젤에 도금 세포 및 재관류 챔버를 사용하여 고해상도 공촛점 현미경을 포함합니다. 또한, 우리는 인용 TFM 프로토콜을 사용하여 세포 세력의 위치와 크기를 보여주는 데이터의 대표 샘플을 제공합니다.
프로토콜
1. coverslip 표면을 활성화
- Coverslips는 (# 1.5, 22x40 ㎜) 먼지를 청소하고 제거하는 이전에 설명한 프로토콜 (워터맨 - 스톨러, 1998)에 비누와 에탄올 세척 일련의를 사용하여 청소합니다.
- 스테인레스 스틸 홀더 랙에 장소 coverslips은 같은 그 coverslips는 분리 간격과 감동을하지 않습니다.
- 화학 펌 후드 (nitrile 장갑 및 권장 고글)에서 정사각형 유리 접시를 (~ 350ml 볼륨) 작성 (2ml 실란 / 100 ML 이소프로판올) 2 %의 최종 농도에 대한 이소프로판올 3 - aminopropyltrimethoxysilane 전체 강도를 희석. 플라스틱과 반응으로 인해, 이소프로판올 3 - aminopropyltrimethoxysilane 적용할 유리 파스퇴르 피펫을 사용합니다.
- 10 분이 솔루션에 1.2에서 완전히 젖어 coverslips 부드럽게 퓸 후드에 저어 접시에 감동하면서.
- ddH 2 O (물 4 교류)에 immersing로 coverslips 씻으십시오. 10 분 교반과 함께 최종 교환 시간을 몸을 담글 수 있습니다. 아미노 실란이 포함된 솔루션은 유해 폐기물로 처리되어야합니다.
- 따뜻한 온도에서 인큐베이터에 드라이 coverslips (~ 37 ° C) 먼지없는 환경에서 10 분.
- 실내 온도 쿨.
- 펌 모자에 유리 사각 접시에 ddH 2 O의 1 % 글루 타 알데히드 용액에 담가의 coverslips 30 분 동안 접시를 저어.
- 감동과 교류 당 10 분 ddH 2 O 3 교환하여 씻으십시오. 유해 폐기물로 글루 타 알데히드의 배출.
- coverslips를 지키는에서 먼지를 피하기 위해 알루미늄 호일로 덮고, 실온에서 건조.
- 최대 2 개월, 떨어져 먼지, 건조한 장소에 보관하십시오.
2. polyacrylamide의 준비 (PAA) 겔
- 표 1 다음 40 % 아크릴 아미드와 2% 비스 - 아크릴 아미드에서 아크릴 아미드 / 비스 - 아크릴 아미드 믹스 재고 솔루션을 준비합니다. 우리는 서로 다른 강성의 PAA의 젤에 최적화된 여러 주식 솔루션을 유지, 예제 표 1과 2에 나열되어 있습니다. 주식 솔루션들은이 4 C.에 어두운 병에 유지만큼, 몇 년 동안 보관 가능
- 아크릴 아미드 / 비스 - 아크릴 아미드의 마지막 원하는 농도를 포함하는 작업 솔루션은 재고 솔루션에서 얻을 수 있습니다. 예를 들어, 우리는 2.8kPa PAA의 젤을 만들기위한 ddH 2 O에서 7.5 % acrylamide/0.10 % 비스 - 아크릴 아미드의 작업 솔루션을 준비합니다.
- 20 분위한 진공 챔버에 데가스은 아크릴 아미드 솔루션, PAA의 중합을 방지 솔루션 내에서 산소를 줄일 수 있습니다.
- 10 % 암모늄 persulfate (APS) 솔루션 (0.5g/5mL)를 준비합니다. 3 일 이내에 새로운 작업을 주식을 사용합니다. 또는, 주식은 나중에 날짜에 사용되는 냉동 수 있습니다.
- 아크릴 아미드는 degassing이지만, 유리 슬라이드 표면 소수성를 만들기 위해 적극적으로 비 - X 잎사귀와 1x3 "현미경 유리 슬라이드를 닦아냅니다. 덮인, 옆으로 젖은 Kimwipe와 함께 유리 슬라이드를 닦아냅니다., 설정 유리 슬라이드를 초과하는 비 - X를 제거하려면 다음과 같이하십시오.
- 진공 챔버에서 아크릴 아미드의 솔루션을 제거하고 (볼륨을 1 %, 표 1에 나열된 작업 솔루션을 5 μl) 형광 구슬을 추가합니다. 0.75μl가 TEMED 추가 겔 중합을 시작합니다 2.5 μl 10 % APS. 거품의 도입을 최소화하기 위해, ~ 5 초에 대한 pipetting으로 잘 섞어서
- 비말 위에 22x40mm coverslip을 활성화 소수성 현미경 슬라이드 (단계 2.4 준비)과 장소에 아크릴 아미드 솔루션의 10-12 μl을 적용합니다. 젤 솔루션은 외투 전체 coverslip해야합니다. 솔루션 내에 나타날 수있는 거품을 부드럽게. ~ 10 분 상온에서 중합에 겔 솔루션을 허용합니다.
- 중합의 완성은 microcentrifuge 관에서 반전 나머지 작업 솔루션 평가하실 수 있습니다. 또한, polymerized 젤 멀리 coverslip의 가장자리에서 끌어 수 있습니다. 매크로 중합이 지켜지는 즉시, 유리 슬라이드로부터 coverslip를 구분한다. 족집게 한 켤레 또는 면도날 가장자리의 좋은 팁을 사용하면, 신중하게 수화를 유지하기 위해, ddH 2 O의 현미경 슬라이드 표면 담가 겔에서 젤 첨부와 coverslip을 제거하십시오.
3. PAA 젤로 세포외 매트릭스 (ECM) 단백질 커플링
세 개의 서로 다른 방법은 가기 PAA 젤의 표면 (3.1 및 3.2) 또는 겔 볼륨 (3.3) 내에서 ECM 단백질을 포함하는 하나 ECM 단백질을 첨부하는 데 사용할 수 있습니다. 여기, 우리는 1 시간에 10 μg / ML의 fibronectin 솔루션 부화 후 유리에 adsorbed 금액에 해당되는 표면 리간드 밀도 결과 PAA의 젤에 fibronectin의 결합에 대해 설명합니다. 방법을 선택을위한 고려 사항은 토론에 상세한 있습니다.
- 가교 단백질에 Sulfo - SANPAH 대응 아민의 PAA의 겔 표면에 ECM 단백질 것은 covalently heterobifunctional 가교제 Sulfo - SANPAH하여 PAA의 겔 표면에 부착
- S를 용해하여 Sulfo - SANPAH 40 μl aliquots 작업 준비 무수 디메틸 sulfoxide에 ulfo - SANPAH 파우더 (DMSO) (Sulfo - SANPAH의 MG 당 20 μl). -80에서 액체 질소와 저장소에 플래시 동결 주식 ° C 나중에 사용하기 위해.
- coverslip 회전자를 (<2sec)를 사용하여 겔 표면에서 ddH 2 O를 제거합니다. 겔 건조하지 마십시오.
- 즉시 사용할 수와 코트 겔 표면 (~ 200 μl) 전에 ddH 2 O (2mg/ml, 산도 7)에 Sulfo - SANPAH - DMSO의 aliquots을 희석. Sulfo - SANPAH의 반응 반감기가 물에 실온에서 (~ 5 분) 짧은됩니다, 따라서 다음 단계는 빠른 속도로 수행되어야합니다.
- UV 크로스 링커 오븐 (1.5 분, 2-3 인치의 거리에서 8W, 254 nm의 파장)에 자외선에 겔 표면을 쉽게받을 수 있습니다. Sulfo - SANPAH 오렌지에서 갈색으로 색상이 변화됩니다.
- 딥 UV - 대우 신선한 ddH 2 O와 비커에 coverslips하고 coverslip 회전자를 (<2sec)를 사용하여 겔 표면에서 초과 물을 제거합니다.
- 피펫 ~ 페트리 접시 컨테이너에 Parafilm에 차가운 1mg/ml의 Fibronectin (FN) (PBS, pH를 7.4에서) 50 μL. FN 드롭 위에 coverslip 반전, 젤 사이드 FN에 노출.
- 1-2시간 또는 4 ° C에서 하룻밤 실온에서 반응.
- PBS를 (산도 7.4)이 포함된 6cm 조직 문화 요리 플레이스 coverslips는 충분한 조직 문화 후드에서 무균 조건 하에서, coverslip을 커버합니다.
- 무균 조건 하에서 PBS (산도 7.4) 여러 세척 (3-5)와 함께 광범위하게 씻으십시오.
- 30 분 조직 문화 후드에 살균 램프를 이용하여 coverslips를 소독.
- 도금 세포 전에 30-45 분 셀 미디어 coverslips을 품어.
- 가교 단백질에 히드 라진 수화물의 탄수화물 그룹에 의해 PAA의 겔 표면에 ECM하면 산화 및 히드 라진 수화물을 사용하여 겔로 결합됩니다.
- 로 제 2의 설명에 polyacrylamide의 젤을 준비합니다.
- 펌 모자 플라스틱 페트리 접시 및 사용 장갑에 넣어 PAA 겔 coverslips 적어도 두 시간 동안 각 PAA 젤과 부화의 표면에 undiluted 히드 라진 수화물의 약 1 ML을 피펫 없지만, 24시간보다 더 이상
- 페트리 접시에 ddH 2 O를 추가, 히드 라진 수화물 솔루션을 제거하고 유해 폐기물로 폐기.
- coverslip 젖어에 페트리 접시 5 % 초산을 추가합니다. 커버 한 시간 동안 부화.
- 초산를 제거하고 ddH 2 O.로 세척 한 시간 만이라도 ddH 2 O에서 알을 품다. coverslips는 현재 활성화되고 상호 연결 Fibronectin (FN)를 산화 준비가 된 것입니다.
- 10 μg / ML의 최종 농도를하고, 어두운 마이크로 원심 분리기 튜브 50 MM의 아세트산 나트륨 버퍼 (산도 4.5)의 940 μl 1 MG / ML FN 솔루션 10 μl를 희석.
- 50 MM의 아세트산 나트륨 버퍼 (산도 4.5) 1 ML에 나트륨 메타 periodate의 80 밀리그램을 추가하여 20X 나트륨 메타 periodate의 재고를 확인하십시오.
- 3.2.6에서 준비한 FN 솔루션에 메타 periodate 주식 20X 나트륨의 50 μl를 추가, 그러한 것을 최종 작업 농도는 10 μg / ML FN 4 μg / ML 나트륨 메타 periodate 있습니다. 30 분 상온에서 어두운 튜브에 품어.
- coverslip 회전자를 (<2 초)를 사용하여 3.2.5의 준비가 활성화 겔 표면에서 초과 ddH 2 O를 제거합니다. 겔 건조하지 마십시오.
- Pipet ~ 실온에서 1 시간에 대한 활성화 겔 표면에 품어 FN 솔루션 500 μl.
- PBS를 (산도 7.4)이있는 요리 플레이스 coverslips 충분한 coverslip을 커버합니다.
- PBS 여러 세척 (3-5) (산도 7.4)에 광범위하게 씻으십시오.
- 30 분 조직 문화 후드에 살균 램프를 이용하여 coverslips를 소독.
- 도금 세포 전에 30-45 분 셀 미디어 coverslips을 품어.
- Acryloyl - X로 PAA 겔에서 ECM 단백질의 대량 활용은 succinimidyl 에스테르이 프로토콜은 2.5 이전에 이루어집니다. 단백질에 대한 반응 아민은 NHS 에스테르 화학있는 아크릴 아미드의 단량체로 결합된 다음 PAA 젤의 대량으로 공동 polymerized 있습니다.
- 제조 업체의 지침에 따라 Acryloyl - X로 선택의 공액 ECM 단백질. 복합 단백질의 주식 솔루션은 4 보관해야 ° C.
- 겔 제조 (coverslip 당 예 : 10 UL)에 필요한 PAA 작업 솔루션의 볼륨을 계산합니다.
- 표 1에서 작업 솔루션 조리법에 나와있는 금액의 물 50 μL (예 : 10 % 볼륨) 빼기와 중합을 시작합니다.
- 3.3.2 계산 볼륨을 제거하고 10 % 볼륨 ECM / Acryloyl - X 솔루션을 추가합니다. (예 : PAA 솔루션 9 μL에 ECM / Acryloyl - X 1 μL). 젤 polymerizing므로이 단계는 신속하게 수행하여야한다.
- 작성 단계 2.6 및 2.7과 같은 이전에 설명했다.
- 무균 조건 하에서 PBS (산도 7.4) 여러 세척 (3-5)와 함께 광범위하게 씻으십시오.
- 30 분 조직 문화 후드에 살균 램프를 이용하여 coverslips를 소독.
- 도금 세포 전에 30-45 분 셀 미디어 coverslips을 품어.
세포가 ECM - 코팅 겔 기판 (~ 6-12시)에 확산 수 후에이 단계를 실시하고 있습니다. 공촛점 이미징 챔버 (RC - 30WA)를 조립하기 위해서는지도를위한 워너 인스 트루먼 트의 웹 사이트를 참조하는 데 유용합니다.
- 따뜻한 세포 미디어와 0.5 % 또는 0.25 %의 5ml 또는 10ml의 주사기에 트립신 및로드합니다.
- 장소에 coverslip을 유지하기 위해 진공 그리스를 사용하여 워너먼트 공촛점 이미징 챔버 (RC - 30WA)의 상위 Coverslip 홀더에 22x30mm coverslip을로드합니다.
- 입구와 출구의 폴리에틸렌 튜브에 모두 접근을 허용함으로써, coverslip 위에 고무 가스켓을 형성 챔버를 놓습니다. 이것은 최고 coverslip 및 사용 가스켓의 크기에 따라 겔 - 코팅 22x40mm coverslip 사이 150-1000 μm의의 간격을 수 있습니다.
- 커넥터 키트, 그리고 미디어가 튜브를 통해과 최고 Coverslip에 흐름과 전혀 거품이 흐름 라인에서 뚜렷한 없습니다 있는지 확인하십시오를 통해 유입 튜브에로드 주사기.
- 챔버의 기지와 셀 사이드 실어 젤 - 코팅 22x40mm coverslip,에 진공 그리스를 적용합니다. 세포에 따뜻한 미디어를 적용합니다.
- 상공 회의소 데려간이 젤 - 코팅 coverslip에서 분리와 챔버베이스에 플레이스 톱 Coverslip 홀더. 챔버베이스 내에서 찾기 핀이 위로 Coverslip에서 찾기 구멍 안에 앉아 있는지 확인합니다.
- 챔버베이스에 압력 플레이트를 적용 및 나사와 압력 플레이트를 확보하기 위해 압력 플레이트 렌치를 사용합니다.
- 챔버 내의 잠재적인 누수를 모니터링하는 튜브와 챔버를 통해 미디어의 흐름을 확인하고 세포 표면에있는 모든 미디어에없는 영역을 제거합니다. 참고 : 미디어 일으키는 동안 약간의 진공을 그릴 수있는 작은 게이지 바늘을 사용하면 미디어가없는 영역을 제거하는 데 도움이 될 수 있습니다.
- 이미지에 대한 현미경 홀더 내에 위치한 무대 어댑터에 공촛점 이미징 챔버를 적용합니다.
- 이미지 찬란 - 라벨 단백질과 공촛점 형광 현미경에서 젤 기판 내에 포함된 형광 구슬.
- 겔 내에서 거르지 않은 비드 위치의 이미지를 얻으려면, 겔에서 세포 adhesions를 분리 트립신을 perfuse하고, 세포가 준수 같은 이미징 분야에서 형광 구슬의 이미지를 가져가라. 긴장과 거르지 않은 비드 위치의 비교 수축에 따라 겔 기판 변위의 부량 수 있도록합니다.
대표 결과 :
위의 프로토콜은 세포 수축성을 공부에 대한 준수 PAA의 젤 준비를위한 실험 절차를 설명하고 그림 1에서 그림입니다. 이 프로토콜과 함께 얻은 겔 표면 전체에 골고루 포함된 형광 구슬 (그림 2A)와, 비교적 평평하고 부드럽게합니다.
초점 adhesions의 위치, 세포의 이미징 (그림 3A)와 겔 표면 (그림 3B)에서 겔 수축을 측정하는 것은 초점 adhesions의 공촛점 광학 비행기에서 수행되어야하는 경우. 세포 (거르지 않은) 자기편 (긴장) 대 떨어뜨려 때 젤의 수축은 겔 표면에서 임베디드 형광 구슬의 변위 (그림 3B)에 의해 시각하실 수 있습니다. 전산 알고리즘의 사용은 젤의 비드 변위 및 해당 탄성 계수 (그림 3C 및 3D) (Sabass 외., 2008)과 관련된 견인 스트레스를 얻을 수 있습니다. 영상은 겔 안에 깊이 이루어진다면, 비드 변위는 초점 adhesions에서 끼쳤다 견인 세력의 대표 작아 및되지 않습니다.
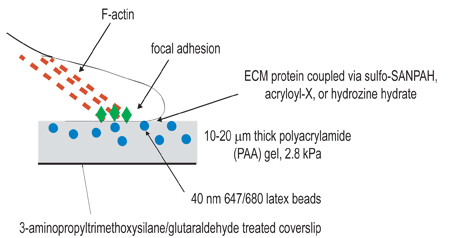
그림 1. 실험 설정의 도식 그림. 이 절차의 전반적인 목표는 세포 수축을 공부하기위한 목적으로 호환 매트릭스를 만드는 것입니다. 실험 절차의 첫 단계는 polymerized 젤을 고정하기위한 목적으로 amino-silane/glutaraldehyde 치료에 의해 coverslips를 활성화하는 것입니다. 두 번째 단계는 활성화 coverslip에, 형광 구슬을 포함, polyacrylamide 젤을 중합하는 것입니다. 세 번째 단계는 화학 물질을 포함 가교 3 단계에 나열된 세 커플링 기법 중 하나를 사용하여 polyacrylamide 젤의 표면에 세포 리간드니다. 세포는 다음 겔에 도금 및 준수하고 확산하기 위해 사용할 수 있습니다. 활성화된 세포 수축에서 젤에 포함된 구슬이 치환.

그림 2. PAA 젤 상단 표면의 광학 공촛점 슬라이스가로 (A.) 형광 40nm 겔 내에 내장된 구슬과 (B.) fibronectin의 immunofluorescence에 의해 시각.

그림 3. 견인 강제 실험 결과 대표. (A.) 인간 osteosarcoma의 U2OS 세포에 초점 adhesions는 M 아르GFP - paxillin 및 긴장 (녹색) 및 거르지 않은 (빨간색) 상태에 초점 adhesions을 기본 PAA 젤에 포함된 형광 구슬 (B.) 위치로 arked. 화살표는 구슬 변위의 예를 나타냅니다. (C.) 트랙션 스트레스 벡터와 견인의 (D.) 해당 열 규모의지도 (Sabass 외., 2008) 계산 알고리즘을 사용하여 젤의 수축에서 파생된 강조합니다. 스케일 바 = 5 μm의.
표 1 :
예를 들어 주식과 PAA 솔루션 작업은 (표 1의 데이터 첫번째 Yeung 동부 표준시. 알로부터 얻은. 독립적으로 우리 연구실에 확인되었습니다.)
| 주식 PAA 솔루션 | ||||
| PAA 젤의 전단 계수 (PA) | 230 | 2833 | 8640 | 16,344 |
| 40 % 아크릴 아미드 (ML) | 1.25 | 3.12 | 2.34 | 2.50 |
| 2퍼센트 비스 - 아크릴 아미드 (ML) | 0.50 | 0.83 | 1.88 | 0.60 |
| 워터 (ML) | 3.25 | 1.04 | 0.78 | 1. 90 |
| 총 볼륨 (ML) : | 5 | 5 | 5 | 5 |
| 작업 PAA 솔루션 | ||||
| 증권 솔루션 사용 (PA) | 230 | 2833 | 8640 | 16,344 |
| 주식 솔루션 볼륨 (μL) | 150 | 150 | 200 | 300 |
| 워터 (μL) | 341.75 | 341.75 | 291.75 | 191.75 |
| 비즈 (μL) | 5 | 5 | 5 | 5 |
| TEMED (μL) | 0.75 | 0.75 | 0.75 | 0.75 |
| 10 % APS (μL) | 2.5 | 2.5 | 2.5 | 2.5 |
| 총 볼륨 (μL) | 500 | 500 | 500 | 500 |
| 최종 아크릴 아미드의 % | 3 | 7.5 | 7.5 | 12 |
| 최종 비스 - 아크릴 아미드의 % | 0.06 | 0.1 | 0.3 | 0.15 |
표 2 :
다양한 최종 아크릴 아미드와 비스 - 아크릴 아미드 비율의 PAA 기판의 전단 계수
| 12 % 아크릴 아미드 | 7.5 % 아크릴 아미드 | |||
| % 비스 - 아크릴 아미드 | 전단 계수 (PA) | % 비스 - 아크릴 아미드 | 전단 계수 (PA) | |
| 0.145 | 16,344 | 0.01 | 689 | |
| 0.28 | 30,067 | 0.03 | 1535 | |
| 0.45 | 34,263 | 0.05 | 2286 | |
| 0.55 | 42,375 | 0.075 | 2833 | |
| 0.575 | 50,873 | 0.1 | 4069 | |
| 0.6 | 55,293 | 0.2 | 5356 | |
| 0.3 | 8640 | |||
| 5 % 아크릴 아미드 | 3 % 아크릴 아미드 | |||
| % 비스 - 아크릴 아미드 | 전단 계수 (PA) | % 비스 - 아크릴 아미드 | 전단 계수 (PA) | |
| 0.05 | 430 | 0.02 | 1.3 | |
| 0.075 | 600 | 0.04 | 54 | |
| 0.1 | 1431 | |||
토론
절차는 전산 추적 루틴 (Sabass 외., 2008)의 구현과 함께, 견인 힘 현미경 (TFM) 실험의 설정을 위해 여기에서 설명한, 마이크론 규모의 공간 해상도 세포 세력의 부량 수 있도록합니다. 실험 프로토콜을 최적화하기 위해서는 ECM의 리간드의 균일한 코팅을 가진 순수하고 균일한 겔 기판을 형성하는 것이 중요합니다. 우리는 아래의 잠재적인 함정을 논의 :
비 균일한 겔 표면 ?...
공개
감사의 말
우리는 셀룰러 견인 세력 (Sabass 외., 2008)의 부량에 사용되는 전산 추적 소프트웨어 울리히 슈바르츠의 실험실을 감사드립니다. 이 작품은 버로우즈 웰컴 경력 수상과 ML Gardel 의료 과학 국립 연구소 서비스 어워드 (5 T32 GM07281) SP 겨울에하는 NIH 원장의 파이 오니아 수상 (DP10D00354)에 의해 지원되었다.
자료
| Name | Company | Catalog Number | Comments |
| 3-aminopropyltrimethyoxysilane | Aldrich | 28, 177-8 | |
| 40% Acrylamide | Bio-Rad | 161-0140 | |
| 2% Bis-acrylamide | Fisher Scientific | BP1404 | |
| TEMED | Fisher Scientific | BP 150-20 | |
| Ammonium persulfate | Fisher Scientific | BP179 | |
| 40nm fluorescent micro-spheres | Invitrogen | F8789 | |
| Sulfo-SANPAH | Pierce, Thermo Scientific | 22589 | |
| Confocal imaging chamber (RC-30) | Warner Instruments | 64-0320 | |
| Coverslip spinner | Home made | NA | |
| Ultraviolet lamp CL1000 | UVP Inc. | 95-0228-01 | |
| Stainless steel rack | Electron Microscopy Sciences | 72239-04 | |
| acryloyl-X, SE (6-((acryloyl)amino)hexanoic acid) | Invitrogen | A-20770 | |
| Hydrazine hydrate | Sigma-Aldrich | 225819 | |
| Sodium meta-periodate | Thermo Fisher Scientific, Inc. | 20504 | |
| Isopropanol | Fisher Scientific | A416-4 | |
| Fibronectin | Sigma-Aldrich | F2006 | |
| Collagen | BD Biosciences | 354236 | |
| Coverslips (#1.5) | Corning | 2940‐224 | |
| Glutaraldehyde | Electron Microscopy Sciences | 16120 | |
| Rain-X | SOPUS Products | www.rainx.com | |
| Acetic Acid | Acros Organics | 64-19-7 |
참고문헌
- Damljanovic, V., Lajerholm, B. C., Jacobson, K. Bulk and micropatterned conjugation of extracellular matrix proteins to characterized polyacrylamid substrates for cell mechanotransduction assays. Biotechniques. 39 (6), 847-851 (2005).
- Engler, A., Bacakova, L. N. e. w. m. a. n., Hategan, C., Griffin, A., M, D. D. i. s. c. h. e. r. Substrate compliance versus ligand in cell on gel responses. Biophys J. 86 ((1 Pt 1)), 617-628 (2004).
- Gardel, M. L., Sabass, B., Ji, L., Danuser, G., Schwarz, U. S., Waterman, C. M. Traction stress in focal adhesions correlates biphasically with actin retrograde flow speed. J Cell Biol. 183, 999-1005 (2008).
- Rajagopalan, P., Marganski, W. A., Brown, X. Q., Wong, J. Y. Direct comparison of the spread area, contractility, and migration of balb/c 3T3 fibroblasts adhered to fibronectin- and RGD-modified substrata. Biophys J. 87 (4), 2818-2827 (2004).
- Reinhart-King, C. A., Dembo, M., Hammer, D. A. The dynamics and mechanics of endothelial cell spreading. Biophys J. 89, 676-689 (2005).
- Stricker, J., Sabass, B., Schwarz, U. S., Gardel, M. L. Optimization of traction force microscopy for micron-sized focal adhesions. J. Phys: Condensed Matter. 22, 194104-194114 (2010).
- Sabass, B., Gardel, M. L., Waterman, C. M., Schwarz, U. S. High resolution traction force microscopy based on experimental and computational advances. Biophys J. 94, 207-220 (2008).
- Yeung, T. Effects of substrate stiffness on cell morphology, cytoskeletal structure, and adhesion. Cell Motil Cytoskeleton. 60 (1), 24-34 (2005).
- Waterman-Storer, C. M. Microtubule/organelle motility assays. Curr Protoc Cell Biol. , 13.1.1-13.1.21 (1998).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유