É necessária uma assinatura da JoVE para visualizar este conteúdo. Faça login ou comece sua avaliação gratuita.
Method Article
Preparação de Matrizes Reclamação para Quantificar contração celular
Neste Artigo
Resumo
Neste vídeo, demonstramos as técnicas experimentais usadas para fabricar compliant, matriz extracelular (ECM) substratos revestidos adequado para cultura de células, e que são passíveis de microscopia de força de tração e observando os efeitos da rigidez ECM no comportamento de células.
Resumo
A regulação da adesão celular à matriz extracelular (ECM) é essencial para a migração celular e remodelação ECM. Aderências focais são conjuntos macromoleculares que o casal o citoesqueleto de actina F-contrátil ao ECM. Esta conexão permite a transmissão de forças mecânicas intracelular através da membrana celular ao substrato subjacente. Trabalho recente mostrou as propriedades mecânicas do ECM regular de adesão focal e F-actina morfologia, bem como numerosos processos fisiológicos, incluindo a diferenciação celular, divisão, proliferação e migração. Assim, o uso de substratos de cultura de células tem se tornado um método cada vez mais prevalente para controlar com precisão e modular as propriedades mecânicas ECM.
Para quantificar as forças de tração em aderências focal em uma célula aderente, compatível substratos são usados em conjunto com imagens de alta resolução e técnicas computacionais em um método denominado microscopia de força de tração (TFM). Esta técnica se baseia em medições da magnitude local e direção de deformações do substrato induzida pela contração celular. Em combinação com alta resolução da microscopia de fluorescência de proteínas fluorescentes marcados, é possível correlacionar organização do citoesqueleto e remodelação com as forças de tração.
Aqui apresentamos um protocolo experimental detalhado para a preparação de duas dimensões, matrizes compatíveis com a finalidade de criar um substrato de cultura celular com um bem caracterizados, rigidez ajustável mecânica, que é adequado para medir a contração celular. Estes protocolos incluem a fabricação de hidrogéis de poliacrilamida, revestimento de proteínas em gel de ECM como, células de revestimento em gel, e de alta resolução da microscopia confocal usando uma câmara de perfusão. Além disso, oferecemos uma amostra representativa de dados demonstrando localização e magnitude das forças de celulares utilizando protocolos citados TFM.
Protocolo
1. Ativando a superfície lamela
- Lamelas (# 1.5, 22x40 mm) são limpos usando uma série de lavagens e sabão de etanol em um protocolo previamente descrito (Waterman-Storer, 1998) para limpar e remover o pó.
- Lamínulas lugar em um rack de aço inoxidável titular, de tal forma que as lamínulas são espaçadas e não tocar.
- Em química coifa (luvas de borracha nitrílica e óculos de proteção recomendado), diluir a força total de 3 aminopropyltrimethoxysilane em isopropanol para uma concentração final de 2% (2ml silano / 100 ml de isopropanol) para encher um prato de vidro quadrado (~ 350 ml de volume). Devido à reatividade com plástico, use um copo pipeta Pasteur para aplicar 3-aminopropyltrimethoxysilane ao isopropanol.
- Lamínulas mergulhe totalmente de 1,2 para essa solução por 10 minutos agitando moderadamente em um prato misture a capela.
- Lavar lamínulas por imersão em DDH 2 O (4 trocas de água). Permitem 10 min de imersão tempo para a troca final, com agitação. Amino-silano contendo soluções devem ser eliminados como resíduos perigosos.
- Lamínulas seca em estufa a temperatura quente (~ 37 ° C) por 10 minutos em um ambiente livre de poeira.
- Arrefecer à temperatura ambiente.
- Na capela, lamínulas mergulhe em solução de glutaraldeído 1% em DDH 2 O em um prato de vidro quadrado na placa agitar por 30 minutos.
- Lavar por 3 trocas de DDH 2 O por 10 minutos por troca, com agitação. Dispor de glutaraldeído como resíduos perigosos.
- Seco à temperatura ambiente, cobrindo com papel alumínio para evitar a poeira grude as lamelas.
- Armazenar em local seco, longe da poeira, por até 2 meses.
2. Preparação de poliacrilamida (PAA) em gel
- Preparar soluções estoque de acrilamida / bis-acrilamida mix de acrilamida 40% e 2% bis acrilamida, o quadro 1. Mantemos estoque várias soluções que são otimizadas para géis PAA de rigidez diferentes; exemplos são listados na Tabela 1 e 2. As soluções de reserva podem ser mantidos por vários anos, desde que sejam mantidos em um frasco escuro a 4 C.
- Soluções de trabalho contendo a concentração final desejada de acrilamida / bis-acrilamida são obtidos a partir de soluções estoque. Por exemplo, nós preparamos uma solução de trabalho de 7,5% acrylamide/0.10% bis acrilamida em DDH 2 O para a tomada de géis 2.8kPa PAA.
- Degas solução de acrilamida em uma câmara de vácuo por 20 min, para reduzir o oxigênio dentro da solução que impede a polimerização PAA.
- Prepare persulfato de amônio 10% da solução (APS) (0.5g/5mL). Use o estoque trabalhando fresco dentro de 3 dias. Alternativamente, os estoques podem ser congelados para ser usado em datas posteriores.
- Embora a acrilamida é desgaseificação, limpe um 1x3 "lâmina de vidro de microscópio com chuva X-wipes vigorosamente para tornar o vidro hidrofóbico superfície da lâmina. Para remover o excesso de Rain-X, limpe lâmina de vidro com Kimwipe úmido. Lâmina de vidro Reserve, coberto.
- Remoção da solução de acrilamida da câmara de vácuo e adicionar partículas fluorescentes (1% em volume, 5 mL de solução de trabalho listados na Tabela 1). Adicionar 0.75μl Temed e 2,5 mL APS 10%, o que irá iniciar a polimerização do gel. Misture bem, pipetando para ~ 5 segundos, para minimizar a introdução de bolhas,
- Aplicar 10-12 mL da solução de acrilamida a lâmina de microscópio hidrofóbica (preparado no passo 2.4) e coloque ativado lamínula 22x40mm em cima da gota. Solução de gel coat deve lamela inteiro. Suavizar as bolhas que podem aparecer dentro da solução. Permitir a solução de gel para polimerizar em temperatura ambiente por ~ 10 min.
- A conclusão de polimerização pode ser avaliada por solução restante invertendo trabalhando em tubo de microcentrífuga. Além disso, o gel polimerizado pode se afastar das bordas da lamínula. Imediatamente após a polimerização macroscópica é observada, separadas as lamelas da lâmina de vidro. Usando a ponta fina de um par de pinças ou uma lâmina de barbear, remova cuidadosamente a lamínula, com gel em anexo, a partir da superfície do microscópio de slides e gel imerso em DDH 2 O, para manter a hidratação.
3. Acoplamento da matriz extracelular (ECM) proteínas do gel PAA
Três métodos distintos pode ser usado para anexar proteína ECM quer à superfície superior do gel PAA (3.1 e 3.2) ou incorporação de proteínas ECM dentro do volume de gel (3.3). Aqui, discutimos o acoplamento de fibronectina para géis PAA para resultar em uma densidade de ligante superfície que é equivalente à quantidade adsorvida no vidro após incubação com 10 mg / mL solução de fibronectina por 1 hora. Considerações para a escolha de um método são detalhados na discussão.
- Ligação cruzada de proteínas ECM para PAA superfície gel por sulfo-SANPAH aminas reativas em proteínas são covalentemente ligados à superfície gel PAA pela heterobifunctional cross-linker sulfo-SANPAH
- Prepare 40 mL alíquotas de trabalho de sulfo-SANPAH dissolvendo S ulfo-SANPAH pó em dimetilsulfóxido anidro (DMSO) (20 mL por mg de sulfo-SANPAH). Stocks congelar Flash em nitrogênio líquido e armazenar a -80 ° C para uso posterior.
- Remover DDH 2 O gel da superfície usando um spinner lamela (<2seg). Evitar a secagem do gel.
- Diluir sulfo-SANPAH-DMSO alíquotas em DDH 2 O (2mg/ml, pH 7) imediatamente antes do uso e da superfície da camada de gel (~ mL 200). Note-se que a reatividade meia-vida de sulfo-SANPAH é curto (~ 5 min) à temperatura ambiente em água e, portanto, estas etapas devem ser feitas em um ritmo rápido.
- Expõem a superfície do gel à luz UV em um forno de cross-linker UV (8W, comprimento de onda 254 nm a uma distância de 2-3 polegadas por 1,5 min). Sulfo-SANPAH vai mudar de cor de laranja a marrom.
- Dip lamínulas UV-tratados em um copo com frescos DDH 2 O e remover o excesso de água da superfície do gel utilizando um spinner lamela (<2seg).
- Pipeta ~ 50 mL de fibronectina 1mg/ml frio (FN) (em PBS, pH 7,4) em Parafilm no Petri recipiente prato. Inverter lamela em cima de queda FN, lado gel expostos a FN.
- Reagem à temperatura ambiente por 1-2 horas ou a 4 ° C durante a noite.
- Lamínulas lugar em seis centímetros pratos de cultura de tecidos contendo PBS (pH 7,4), o suficiente para cobrir lamela, em condições estéreis em capa de cultura de tecidos.
- Lavar exaustivamente com várias lavagens (3-5) de PBS (pH 7,4), em condições estéreis.
- Esterilizar as lamelas com o uso de lâmpada germicida na capa da cultura de tecidos para 30 min.
- Incubar lamínulas na mídia celular por 30-45 min antes de as células de revestimento.
- Cross-linking ECM para a superfície gel PAA por grupos hidrazina hidratar carboidratos em proteínas são oxidados e acoplado ao gel com hidrato de hidrazina.
- Prepare géis de poliacrilamida como descrito na seção 2.
- Lamínulas lugar PAA gel em placa de Petri de plástico em uma capela e luvas usando pipeta aproximadamente 1 ml de hidrato de hidrazina não diluído sobre a superfície de cada gel PAA e incubar por pelo menos duas horas, mas não mais que 24 horas
- Adicionar DDH 2 O para a placa de Petri; Remover solução de hidrazina hidratar e eliminar de resíduos perigosos.
- Adicionar 5% de ácido acético para a placa de Petri para mergulhar lamela. Cobrir e incubar durante uma hora.
- Remover o ácido acético e lave com DDH 2 O. Incubar em DDH 2 O durante uma hora. As lamelas estão ativos e prontos para cross-link oxidado fibronectina (FN).
- Diluir 10 ml de 1 mg / ml solução FN em 940 mL de tampão acetato 50 mM de sódio (pH 4,5) em um tubo de centrífuga de escuros micro, fazendo uma concentração final de 10 mcg / ml.
- Fazer estoque de 20X de sódio meta-periodato, adicionando 80 mg de sódio meta-periodato de 1 ml de 50 mM tampão acetato de sódio (pH 4,5).
- Adicionar 50 ul de 20X de sódio meta-periodato de ações para a solução FN preparadas em 3.2.6, que tal concentração final de trabalho é de 10 mg / ml FN e 4 mg / ml de sódio meta-periodato. Incubar no tubo escuro à temperatura ambiente por 30 minutos.
- Remover o excesso de DDH 2 O gel ativado a partir da superfície preparada em 3.2.5 usando um spinner lamela (<2 seg). Evitar a secagem do gel.
- Pipeta ~ 500 mL de solução FN na superfície gel ativado e incubar por 1 hora à temperatura ambiente.
- Lamínulas lugar em pratos contendo PBS (pH 7,4), o suficiente para cobrir lamela.
- Lavar exaustivamente com várias lavagens (3-5) de PBS (pH 7,4).
- Esterilizar as lamelas com o uso de lâmpada germicida na capa da cultura de tecidos para 30 min.
- Incubar lamínulas na mídia celular por 30-45 min antes de as células de revestimento.
- Conjugação grosso do MEC de proteínas em gel pelo PAA Acryloyl-X, éster succinimidyl Este protocolo é feito antes de 2.5. Aminas reativas em proteínas são acoplados a um monômero de acrilamida com NHS éster de química e, em seguida, co-polimerizado na maior parte do gel PAA.
- Conjugado de proteína ECM de escolha para Acryloyl-X por instruções do fabricante. As soluções de reserva de proteína conjugada deve ser armazenado a 4 ° C.
- Calcular o volume de solução de PAA de trabalho necessárias para a fabricação de gel (por exemplo, 10 uL por lamela).
- Subtrair 50 mL (volume de 10%, por exemplo) de água de valor listados na receita solução de trabalho na Tabela 1 e iniciar a polimerização.
- Remover volume calculado em 3.3.2 e adicionar ECM / Acryloyl-X solução para o volume de 10%. (Por exemplo, 1 mL de ECM / Acryloyl-X a 9 mL de solução de PAA). Esta etapa deve ser realizada rapidamente, como gel é polimerização.
- Conclua as etapas 2.6 e 2.7, conforme descrito anteriormente.
- Lavar exaustivamente com várias lavagens (3-5) de PBS (pH 7,4), em condições estéreis.
- Esterilizar as lamelas com o uso de lâmpada germicida na capa da cultura de tecidos para 30 min.
- Incubar lamínulas na mídia celular por 30-45 min antes de as células de revestimento.
Estas etapas são realizadas após as células foram autorizados a se espalhar sobre ECM-revestido substrato gel (h ~ 6-12). Para montar a câmara de imagem confocal (RC-30WA), é útil consultar o site da Warner Instrumentos para orientação.
- Quente mídia celular e 0,5% ou 0,25% de tripsina e de carga em uma seringa de 10 ml ou 5 ml.
- Carregar uma lamela 22x30mm para o titular de um Coverslip Top Instruments Warner confocal imagem câmara (RC-30WA), utilizando graxa de vácuo para manter a lamela no lugar.
- Coloque uma câmara de formação de junta de borracha em cima da lamela, permitindo o acesso a ambos os tubos de polietileno de entrada e saída. Isto irá permitir um espaçamento de 150-1000 mM entre o topo ea lamela lamela gel revestido 22x40mm, dependendo do tamanho da junta utilizada.
- Seringas de carga em tubulação de entrada, via conector de kit, e verificar que a mídia passa por tubulações e em Coverslip Top e sem bolhas são visíveis nas linhas de fluxo.
- Aplique graxa de vácuo para base de câmara e lamínula carga gel revestido 22x40mm, celular voltado para cima. Aplicação de um meio quente para as células.
- Coloque titular Coverslip Top em base da câmara, com a Câmara Junta que a separa da lamela gel revestido. Certifique-se que a pinos de localização dentro da base da câmara se sentar dentro do Holes Localizando no Coverslip Top.
- Aplicar a placa de pressão à base de câmara e use a chave de placa de pressão para aparafusar e fixar a placa de pressão.
- Verifique o fluxo de mídia através do tubo e câmara para monitorar qualquer vazamento em potencial dentro da câmara e para eliminar todas as zonas de mídia livre na superfície da célula. Nota: usando uma agulha de calibre pequeno para traçar um ligeiro vazio, enquanto a infusão com a mídia pode ajudar a eliminar zonas livres de mídia.
- Aplicar a câmara de imagem confocal para o adaptador Stage situado dentro de um porta-microscópio para a imagem latente.
- Imagem fluorescente marcado com proteínas e partículas fluorescentes embutidas dentro do substrato gel em um microscópio de fluorescência confocal.
- Para obter uma imagem de unstrained posições talão dentro do gel, perfundir tripsina destacar adesões celulares a partir do gel, e ter uma imagem das esferas fluorescentes no campo de imagem mesmo onde a célula aderida. Comparação de tensas e unstrained posições talão permite a quantificação do deslocamento de substrato gel sob contração.
Resultados representativos:
O protocolo acima descreve o procedimento experimental para preparar géis compatível PAA para estudar a contratilidade celular e é ilustrada na Figura 1. A superfície gel obtido com este protocolo é relativamente plana e suave, com grânulos fluorescentes embutidas uniformemente ao longo (Figura 2A).
Se medir a contração de gel no local de aderências focal, a imagem da célula (Figura 3A) e superfície gel (Figura 3B) deve ser feito no plano óptico confocal de aderências focal. A contração de um gel pode ser visualizado pelo deslocamento de partículas fluorescentes embutidas (Figura 3B) na superfície gel quando as células são aderente (tensa) versus isolada (unstrained). O uso de algoritmos computacionais pode render tração estresse associado com o deslocamento de esferas e correspondente módulo de elasticidade do gel (Figura 3C e 3D) (Sabass et al., 2008). Se imagem tem lugar mais profundo dentro do gel, então deslocamentos talão será menor e não representativa das forças de tração exercida no aderências focal.
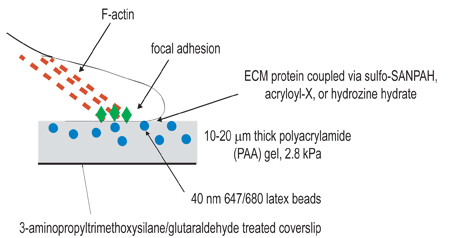
Figura 1. Ilustração esquemática da instalação experimental. O objetivo geral deste procedimento é a criação de matrizes compatíveis com a finalidade de estudar a contração celular. O primeiro passo do procedimento experimental é ativar lamínulas pelo tratamento amino-silane/glutaraldehyde com a finalidade de ancoragem géis polimerizados. A segunda etapa é para polimerizar um gel de poliacrilamida, contendo partículas fluorescentes, para a lamela ativado. A terceira etapa envolve a química cross-linking do ligante extracelular para a superfície do gel de poliacrilamida, usando uma das três técnicas de acoplamento listadas no passo 3. As células são, então, banhado no gel e permitiu a aderir e se espalhar. Sob a contração celular ativo, contas incorporados no gel deslocar.

Figura 2. Fatia confocal óptica de superfície superior do PAA gel, como visualizado por (A.) fluorescentes contas 40nm embutido dentro gel e (B.) imunofluorescência fibronectina.

Figura 3. Resultado Representante para um experimento de força de tração. (A.) aderências Focal em uma célula humana U2OS osteossarcoma são marked por GFP-paxillin e (b) posições de partículas fluorescentes embutidas no gel PAA aderências subjacentes focal na tensas (verde) e unstrained (vermelho) estados. Setas indicam exemplos de deslocamento talão. (C.) vetores de tensão e de tração (D.) mapa de calor em escala correspondente de tração tensões derivadas da contração do gel, usando algoritmos computacionais (Sabass et al., 2008). Barra de escala = 5 mm.
Tabela 1:
Ações exemplo e de Trabalho PAA Solutions (dados da Tabela 1 foi obtido a partir de Yeung et. Al. E independentemente confirmou em nosso laboratório.)
| Solução estoque PAA | ||||
| Módulo de cisalhamento PAA Gel (Pa) | 230 | 2833 | 8640 | 16344 |
| 40% de acrilamida (mL) | 1,25 | 3,12 | 2,34 | 2,50 |
| 2% Bis-Acrilamida (mL) | 0,50 | 0,83 | 1,88 | 0,60 |
| Água (mL) | 3,25 | 1,04 | 0,78 | 1. 90 |
| Volume Total (ml): | 5 | 5 | 5 | 5 |
| Working Solution PAA | ||||
| Solução estoque Usado (Pa) | 230 | 2833 | 8640 | 16344 |
| Volume de ações da solução (mL) | 150 | 150 | 200 | 300 |
| Água (mL) | 341,75 | 341,75 | 291,75 | 191,75 |
| Contas (mL) | 5 | 5 | 5 | 5 |
| Temed (mL) | 0,75 | 0,75 | 0,75 | 0,75 |
| APS 10% (mL) | 2,5 | 2,5 | 2,5 | 2,5 |
| Volume total (mL): | 500 | 500 | 500 | 500 |
| % De acrilamida finais | 3 | 7,5 | 7,5 | 12 |
| % Bis acrilamida-de-final | 0,06 | 0,1 | 0,3 | 0,15 |
Tabela 2:
Módulo de cisalhamento PAA substratos de acrilamida finais diferentes e bis-acrilamida percentagens
| A acrilamida 12% | A acrilamida 7,5% | |||
| % Bis-acrilamida | Módulo de cisalhamento (Pa) | % Bis-acrilamida | Módulo de cisalhamento (Pa) | |
| 0,145 | 16344 | 0,01 | 689 | |
| 0,28 | 30067 | 0,03 | 1535 | |
| 0,45 | 34263 | 0,05 | 2286 | |
| 0,55 | 42375 | 0,075 | 2833 | |
| 0,575 | 50873 | 0,1 | 4069 | |
| 0,6 | 55293 | 0,2 | 5356 | |
| 0,3 | 8640 | |||
| A acrilamida 5% | A acrilamida 3% | |||
| % Bis-acrilamida | Módulo de cisalhamento (Pa) | % Bis-acrilamida | Módulo de cisalhamento (Pa) | |
| 0,05 | 430 | 0,02 | 1,3 | |
| 0,075 | 600 | 0,04 | 54 | |
| 0,1 | 1431 | |||
Discussão
O procedimento descrito aqui para a instalação de uma microscopia de força de tração (TFM) experimento, juntamente com a implementação de rotinas de monitoramento computacional (Sabass et al., 2008), permite a quantificação das forças celulares com resolução de micro-escala espacial. Para otimizar o protocolo experimental, é fundamental para formar um substrato de gel puro e uniforme, com revestimento uniforme do ligante ECM. Discutimos potenciais armadilhas abaixo:
Não u...
Divulgações
Agradecimentos
Agradecemos ao laboratório de Ulrich Schwarz para software de monitoramento computacional usado em quantificação das forças de tração celular (Sabass et al., 2008). Este trabalho foi financiado por um Prémio Carreira Burroughs Wellcome e Prêmio NIH Director da Pioneer (DP10D00354) para ML Gardel e cientista médico Prêmio Nacional de Serviço de Investigação (5 GM07281 T32) para inverno SP.
Materiais
| Name | Company | Catalog Number | Comments |
| 3-aminopropyltrimethyoxysilane | Aldrich | 28, 177-8 | |
| 40% Acrylamide | Bio-Rad | 161-0140 | |
| 2% Bis-acrylamide | Fisher Scientific | BP1404 | |
| TEMED | Fisher Scientific | BP 150-20 | |
| Ammonium persulfate | Fisher Scientific | BP179 | |
| 40nm fluorescent micro-spheres | Invitrogen | F8789 | |
| Sulfo-SANPAH | Pierce, Thermo Scientific | 22589 | |
| Confocal imaging chamber (RC-30) | Warner Instruments | 64-0320 | |
| Coverslip spinner | Home made | NA | |
| Ultraviolet lamp CL1000 | UVP Inc. | 95-0228-01 | |
| Stainless steel rack | Electron Microscopy Sciences | 72239-04 | |
| acryloyl-X, SE (6-((acryloyl)amino)hexanoic acid) | Invitrogen | A-20770 | |
| Hydrazine hydrate | Sigma-Aldrich | 225819 | |
| Sodium meta-periodate | Thermo Fisher Scientific, Inc. | 20504 | |
| Isopropanol | Fisher Scientific | A416-4 | |
| Fibronectin | Sigma-Aldrich | F2006 | |
| Collagen | BD Biosciences | 354236 | |
| Coverslips (#1.5) | Corning | 2940‐224 | |
| Glutaraldehyde | Electron Microscopy Sciences | 16120 | |
| Rain-X | SOPUS Products | www.rainx.com | |
| Acetic Acid | Acros Organics | 64-19-7 |
Referências
- Damljanovic, V., Lajerholm, B. C., Jacobson, K. Bulk and micropatterned conjugation of extracellular matrix proteins to characterized polyacrylamid substrates for cell mechanotransduction assays. Biotechniques. 39 (6), 847-851 (2005).
- Engler, A., Bacakova, L. N. e. w. m. a. n., Hategan, C., Griffin, A., M, D. D. i. s. c. h. e. r. Substrate compliance versus ligand in cell on gel responses. Biophys J. 86 ((1 Pt 1)), 617-628 (2004).
- Gardel, M. L., Sabass, B., Ji, L., Danuser, G., Schwarz, U. S., Waterman, C. M. Traction stress in focal adhesions correlates biphasically with actin retrograde flow speed. J Cell Biol. 183, 999-1005 (2008).
- Rajagopalan, P., Marganski, W. A., Brown, X. Q., Wong, J. Y. Direct comparison of the spread area, contractility, and migration of balb/c 3T3 fibroblasts adhered to fibronectin- and RGD-modified substrata. Biophys J. 87 (4), 2818-2827 (2004).
- Reinhart-King, C. A., Dembo, M., Hammer, D. A. The dynamics and mechanics of endothelial cell spreading. Biophys J. 89, 676-689 (2005).
- Stricker, J., Sabass, B., Schwarz, U. S., Gardel, M. L. Optimization of traction force microscopy for micron-sized focal adhesions. J. Phys: Condensed Matter. 22, 194104-194114 (2010).
- Sabass, B., Gardel, M. L., Waterman, C. M., Schwarz, U. S. High resolution traction force microscopy based on experimental and computational advances. Biophys J. 94, 207-220 (2008).
- Yeung, T. Effects of substrate stiffness on cell morphology, cytoskeletal structure, and adhesion. Cell Motil Cytoskeleton. 60 (1), 24-34 (2005).
- Waterman-Storer, C. M. Microtubule/organelle motility assays. Curr Protoc Cell Biol. , 13.1.1-13.1.21 (1998).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados