Для просмотра этого контента требуется подписка на Jove Войдите в систему или начните бесплатную пробную версию.
Method Article
Подготовка жалобы матриц для Количественная Сотовая Сокращение
В этой статье
Резюме
В этом видео мы продемонстрируем экспериментальные методы, используемые для изготовления совместимый, внеклеточного матрикса (ECM), покрытых субстратов пригодны для культуры клеток, и которые поддаются тяги силовой микроскопии и наблюдая последствия жесткости ECM на поведение клеток.
Аннотация
Регуляции клеточной адгезии к внеклеточного матрикса (ECM), имеет важное значение для миграции клеток и ECM ремоделирования. Фокусное спайки макромолекулярных сборок, пару сократительной F-актин цитоскелета в ECM. Эта связь позволяет передачу внутриклеточных механическими силами через клеточную мембрану к основной субстрат. Последние исследования показали, механические свойства ECM регулировать координационный адгезии и F-актин морфологии, а также многочисленные физиологические процессы, в том числе дифференцировки клеток, деление, пролиферацию и миграцию. Таким образом, использование подложки клеточной культуры становится все более распространенным методом точно контролировать и модулировать ECM механические свойства.
Для количественной оценки тяговых усилий в фокальных спайки в приверженцем клетки, совместимые подложки используются в сочетании с высокой разрешающей способностью и вычислительной техники в метод называется микроскопии тяговое усилие (TFM). Этот метод основан на измерении местных величину и направление деформации подложки индуцированных сотовой сокращения. В сочетании с высоким разрешением флуоресцентной микроскопии флуоресцентно меткой белков, можно соотнести цитоскелета организации и ремоделирования с тягой сил.
Здесь мы представляем подробный экспериментальный протокол для подготовки двумерным, совместимый матриц для того, чтобы создать подложку культуре клеток с хорошо характеризуется, перестраиваемый механическую жесткость, которая подходит для измерения сотовой сокращения. Эти протоколы включают изготовление полиакриламидных гидрогелей, покрытие белков ECM на таких гелей, покрытие клеток на гели и высоким разрешением конфокальной микроскопии с использованием перфузионной камере. Кроме того, мы предоставляем репрезентативной выборки данных, свидетельствующих о местоположении и величине сотового сил использованием привел TFM протоколов.
протокол
1. Активация поверхности покровного
- Покровные стекла (# 1,5, 22x40 мм) чистить с помощью серии мыла и этанола моется в описанных ранее протокол (Waterman-Сторера, 1998) для очистки и удаления пыли.
- Место в покровных выдвижная полка из нержавеющей стали владельцем, например, что покровные расположены на расстоянии друг от друга и не соприкасаются.
- В химической вытяжного шкафа (нитриловые перчатки и защитные очки рекомендуется), развести полную силу 3-aminopropyltrimethoxysilane в изопропаноле для конечной концентрации 2% (2 мл силана / 100 мл изопропанола), чтобы заполнить площадь стеклянной посуде (~ 350 мл объема). Из-за реакции с пластиком, использовать стеклянную пипетку Пастера применять 3-aminopropyltrimethoxysilane для изопропанола.
- Полностью погрузиться покровные с 1,2 в этот раствор на 10 минут, осторожно помешивая на мешалки в вытяжном шкафу.
- Вымойте покровные путем погружения в DDH 2 O (4 обмен воды). Разрешить 10 мин выдержки для окончательного обмена, при перемешивании. Amino-силана, содержащие решения должны быть утилизированы как опасные отходы.
- Сухие покровные в инкубаторе при теплой температуре (~ 37 ° C) в течение 10 минут в пыли окружающей среды.
- Остудить до комнатной температуры.
- В вытяжной шкаф, погрузите покровных в 1% глутаральдегида решение в DDH 2 O в стеклянной квадратной блюдо на мешалки в течение 30 минут.
- Вымойте на 3 обмены DDH 2 O в течение 10 минут в обмен, при перемешивании. Утилизировать глутаральдегида как опасные отходы.
- Сухой при комнатной температуре, покрытие с алюминиевой фольгой, чтобы избежать пыли от прилипания к покровные.
- Хранить в сухом месте, вдали от пыли, на срок до 2 месяцев.
2. Подготовка полиакриламида (ПАА) гель
- Подготовка исходных растворов акриламида / бис-акриламида смесь из 40% акриламида и 2%-бис-акриламид, следуя таблице 1. Мы поддерживаем несколько решений акций, которые оптимизированы для гелей ПАА различной жесткости; примеры приведены в таблице 1 и 2. Исходные растворы можно хранить в течение нескольких лет, пока они сохраняются в темной бутылке при 4 С.
- Рабочие растворы, содержащие окончательный желаемый концентрация акриламида / бис-акриламида получены со склада решений. Например, мы готовим рабочий раствор 7,5% acrylamide/0.10% бис-акриламида в DDH 2 O для изготовления 2.8kPa гелей ПАА.
- Дега акриламида решение в вакуумной камере в течение 20 мин, для уменьшения кислорода в раствор, который предотвращает ПАА полимеризации.
- Подготовка 10% персульфат аммония (APS) решение (0.5g/5mL). Используйте свежие рабочие запасы в течение 3 дней. Кроме того, акции могут быть заморожены, которые будут использоваться в более поздние сроки.
- Хотя акриламида дегазации, протрите 1x3 "предметное стекло микроскопа с дождем-X салфетки энергично, чтобы сделать стекло поверхности гидрофобной. Чтобы удалить лишнюю Дождь-X, протрите стекло влажной Kimwipe. Слайд Установить стекло в сторону, покрыты.
- Удалить акриламида решение от вакуумной камеры и добавить флуоресцентного бисера (1% по объему, 5 мкл для рабочего раствора, перечисленных в таблице 1). Добавить 0.75μl TEMED и 2,5 мкл 10% APS, которая будет инициировать гель полимеризации. Хорошо перемешать с помощью пипетки на ~ 5 сек, чтобы свести к минимуму введение пузырьков,
- Применяют 10-12 мкл акриламида решение гидрофобные микроскопический слайд (подготовлен в шаге 2.4) и место активированный 22x40mm покровное на вершине капли. Гель решение должно пальто всей покровное. Сглаживать любые пузыри, которые могут появиться в решении. Разрешить гель решение полимеризуются при комнатной температуре в течение ~ 10 мин.
- Завершения полимеризации могут быть оценены путем обращения оставшиеся рабочего раствора в микроцентрифужных трубки. Кроме того, гель полимеризованного может оторваться от покровного края. Сразу же после макроскопических полимеризации наблюдается, отдельные из покровного стекла слайда. Использование тонких кончике пинцета или край лезвия бритвы, осторожно удалите покровное, с гелем прилагается, с микроскопом поверхности скольжения и погрузиться геля в DDH 2 O, для поддержания гидратации.
3. Муфта внеклеточного матрикса (ECM), белки геля ПАА
Три различных методов можно использовать для присоединения ECM белка либо к верхней поверхности ПАА геля (3.1 и 3.2) или включения ECM белка в геле объема (3,3). Здесь мы обсудим связь фибронектина ПАА гелях приводит к поверхностной плотности лиганда, что эквивалентно сумме адсорбированных на стекле после инкубации с 10 мкг / мл раствора фибронектина в течение 1 часа. Соображения по выбору метода подробно описаны в дискуссии.
- Перекрестное связывание ECM белка на поверхность геля ПАА по сульфо-SANPAH Реактивная аминов на белки ковалентно прикреплен к поверхности геля ПАА по гетеробифункциональных поперечных связей сульфо-SANPAH
- Подготовка 40 мкл рабочего аликвоты сульфо-SANPAH путем растворения S ulfo-SANPAH порошок в безводной диметилсульфоксид (ДМСО) (20 мкл на мг сульфо-SANPAH). Flash Freeze запасов в жидком азоте и хранят при температуре -80 ° C для дальнейшего использования.
- Удалить DDH 2 O из геля поверхность с помощью покровного счетчик (<2 сек). Избегайте высыхания геля.
- Развести сульфо-SANPAH-ДМСО аликвоты в DDH 2 O (2mg/ml, рН 7) непосредственно перед употреблением и пальто поверхность геля (около 200 мкл). Обратите внимание, что реактивность полураспада сульфо-SANPAH короткая (~ 5 мин) при комнатной температуре в воде, поэтому, эти шаги надо делать в быстром темпе.
- Expose поверхность геля УФ-света в УФ-поперечных связей печи (8 Вт, 254 нм, длина волны, на расстоянии 2-3 дюймов в течение 1,5 мин). Сульфо-SANPAH будет изменение цвета от оранжевого до коричневого цвета.
- Dip УФ-покровных рассматриваться в стакан со свежим DDH 2 O и удалить избыток воды из геля поверхность с помощью покровного счетчик (<2 сек).
- Внесите ~ 50 мкл холодного Фибронектин 1mg/ml (FN) (в PBS, рН 7,4), на парафильмом в контейнер чашке Петри. Обратить покровное сверху капля FN, гель сторона подвергается FN.
- Реагировать при комнатной температуре в течение 1-2 часов или при температуре 4 ° С в течение ночи.
- Место покровные 6 см в культуре ткани блюд, содержащих PBS (рН 7,4), достаточно, чтобы покрыть покровным, в стерильных условиях в ткани капот культуры.
- Вымойте экстенсивно с нескольких промывок (3-5) ФСБ (рН 7,4), в стерильных условиях.
- Стерилизовать покровные с помощью бактерицидных ламп в ткани капот культуры в течение 30 мин.
- Инкубируйте покровных в ячейке СМИ за 30-45 мин до покрытия клеток.
- Перекрестное связывание ECM на поверхность ПАА геля гидразин гидрат углеводов группы на белки окисляются, и в сочетании с использованием геля гидразин гидрат.
- Подготовка полиакриламидном геле, как описано в разделе 2.
- Место ПАА гель покровных в пластиковых чашках Петри в вытяжной шкаф и используя перчатки пипеткой примерно 1 мл неразбавленной гидрата гидразина на поверхности каждого ПАА гель и инкубировать в течение не менее двух часов, но не более чем за 24 часа
- Добавить DDH 2 O в чашке Петри; Удалить гидразингидрат решения и распоряжаться как опасные отходы.
- Добавьте 5% уксусной кислоты в чашке Петри, чтобы погрузить покровное. Накрыть крышкой и инкубировать в течение одного часа.
- Удалить уксусную кислоту и промыть DDH 2 O. Инкубируйте в DDH 2 O в течение одного часа. Покровные теперь активирована и готова к поперечной связи окисленных Фибронектин (FN).
- Развести 10 мкл 1 мг / мл FN решение в 940 мкл 50 мМ буферного раствора ацетата натрия (рН 4,5) в темном микро трубки центрифуги, делая конечной концентрации 10 мкг / мл.
- Сделайте запас 20X натрия мета-периодатом путем добавления 80 мг натрия мета-периодатом по 1 мл 50 мМ буферного раствора ацетата натрия (рН 4,5).
- Добавить 50 мкл 20X натрия мета-периодатом акции к решению FN подготовлен в 3.2.6, такие, что окончательный рабочий концентрация 10 мкг / мл FN и 4 мкг / мл натрия мета-периодатом. Инкубировать в темноте трубки при комнатной температуре в течение 30 минут.
- Удалите излишки DDH 2 O из активированного геля поверхности, подготовленной в использовании 3.2.5 покровное счетчик (<2 сек). Избегайте высыхания геля.
- Внесите ~ 500 мкл FN раствор на активированной поверхности геля и инкубировать в течение 1 часа при комнатной температуре.
- Место в покровных блюд, содержащих PBS (рН 7,4), достаточно, чтобы покрыть покровным стеклом.
- Вымойте экстенсивно с нескольких промывок (3-5) ФСБ (рН 7,4).
- Стерилизовать покровные с помощью бактерицидных ламп в ткани капот культуры в течение 30 мин.
- Инкубируйте покровных в ячейке СМИ за 30-45 мин до покрытия клеток.
- Массовая сопряжения ЭВМ белка в ПАА геля акрилоил-X, сукцинимидил эфир Этот протокол сделано до 2,5. Реактивная аминов на белках соединены с акриламида мономера с NHS эфир химии, а затем совместно полимеризованного в объем геля ПАА.
- Сопряженных ECM белка выбор акрилоил-X в соответствии с инструкциями производителя. Исходные растворы сопряженных белка следует хранить при температуре 4 ° C.
- Рассчитайте объем рабочего раствора ПАА, необходимых для изготовления геля (например, 10 мкл на покровное).
- Вычтите 50 мкл (например, 10% объема) воды из суммы, перечисленные в рабочий раствор рецепт в таблице 1 и инициировать полимеризацию.
- Удалить объеме рассчитываются в 3.3.2 и добавить ECM / акрилоил-X решение до 10% объема. (Например, 1 мкл ECM / акрилоил-X до 9 мкл раствора ПАА). Этот шаг должен быть выполнен быстро, как гель полимеризации.
- Выполните шаги с 2.6 и 2.7, как описано выше.
- Вымойте экстенсивно с нескольких промывок (3-5) ФСБ (рН 7,4), в стерильных условиях.
- Стерилизовать покровные с помощью бактерицидных ламп в ткани капот культуры в течение 30 мин.
- Инкубируйте покровных в ячейке СМИ за 30-45 мин до покрытия клеток.
Эти меры проводятся после клетки было разрешено выкладывать на ECM-покрытием геля подложки (~ 6-12 часов). Чтобы собрать конфокальной камеры изображений (RC-30WA), полезно проконсультироваться сайте Warner инструменты для руководства.
- Теплый СМИ клетки и 0,5%, или на 0,25% трипсина и загрузить в 5 мл или 10 мл шприца.
- Нагрузка 22x30mm покровное на Top держатель покровное из Warner инструменты конфокальной микроскопии камеры (РК-30WA) с помощью вакуумной смазки держать покровное на месте.
- Место камере формирования резиновую прокладку сверху покровное, предоставляя доступ к обоим входе и выходе трубы из полиэтилена. Это позволит расстоянии 150-1000 мкм между верхним покровным и гель-покрытием 22x40mm покровное, в зависимости от размера прокладки используются.
- Нагрузка шприцы на входе трубы, через разъем комплект, и проверьте, что средства массовой информации проходит через трубы и на Top покровное и никаких пузырей видны в поточных линиях.
- Применение вакуумной смазки на базе камеры и загрузки гель-покрытием 22x40mm покровное, сотовые стороной вверх. Применяют теплые СМИ к клеткам.
- Место Top держатель покровное на камеру базы, с камерным Прокладка отделяя ее от геля покрытием покровное. Убедитесь, что штифты в камере сидеть в базу Поиск отверстия в верхней покровное.
- Применить Нажимной в камеру базу и использовать ключ Нажимной под резьбу и безопасной нажимного диска.
- Проверьте поток средств массовой информации через трубы и камеры для наблюдения за любыми потенциальными утечками в камере и устранить любые средства массовой информации зон, свободных от поверхности клетки. Примечание: с помощью небольшой иглой сделать небольшой вакуум в то время как вливания со средствами массовой информации может помочь устранить медиа-свободных зон.
- Применение конфокальной камеры изображения в рабочей области адаптер расположен в микроскоп держатель для работы с изображениями.
- Изображение флуоресцентно меченых белков и люминесцентные бусины встроенные в гелевой основе по конфокальной флуоресцентной микроскопии.
- Чтобы получить изображение ненапряженных бусинка должности в гель, заливать трипсина отделить сотовой спайки из геля, и принять образ люминесцентные бусины в той же области изображения, где ячейка присоединилась. Сравнение напряженными и ненапряженных бусинка позиций позволяет количественное гель перемещение подложки под сокращение.
Представитель Результаты:
Выше протокол описывает экспериментальные процедуры для подготовки совместимых гелей ПАА для изучения ячейки сократимость и показано на рисунке 1. Геля поверхность, полученная с этим протоколом относительно ровной и гладкой, с люминесцентными бисером встроенных равномерно в течение (рис. 2А).
При измерении гель сокращения по месту нахождения координационного спаек, визуализации ячейки (рис. 3А) и гель поверхности (рис. 3В) должно быть сделано в конфокальной оптической плоскости координационных спаек. Сокращение геля могут быть визуализированы смещением встроенные люминесцентные бусины (рис. 3В) на поверхность геля, когда клетки приверженцем (напряженные) по сравнению с отдельностоящий (ненапряженных). Использования вычислительных алгоритмов может дать тягу стрессы, связанные с бисером смещения и соответствующие модули упругости геля (рис. 3C и 3D) (Sabass и соавт., 2008). Если изображение имеет место в глубине гель, то шарик перемещениях будет меньше, а не представитель тяговых сил, действующих в фокальных спаек.
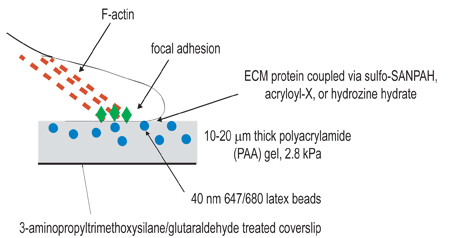
Рисунок 1. Схематическое изображение экспериментальной установки. Общая цель этой процедуры заключается в создании совместимых матрицы для целей изучения сотовой сокращения. Первый этап экспериментальной методики состоит в активизации покровные по amino-silane/glutaraldehyde лечения с целью закрепления полимеризованного гели. Второй шаг заключается в полимеризации полиакриламидном геле, содержащие флуоресцентные бусы, на активированный покровное. Третий этап включает в себя химического сшивания внеклеточного лиганд к поверхности полиакриламидном геле, используя один из трех связи методов, перечисленных в пункте 3. Затем клетки высевали на гель и позволило придерживаться и распространяться. Под активной клеточной сокращения, бусы, встроенные в гель вытеснять.

Рисунок 2. Оптический конфокальной кусочек верхней поверхности ПАА гель, как визуализируется (А.) люминесцентные 40-нм бисером встроенные в гель и (б) фибронектина иммунофлюоресценции.

Рисунок 3. Представителю результат для эксперимента сила тяги. (А.) Фокусное спайки в человеческой клетке остеосаркома U2OS являются мarked по GFP-паксиллина и (б) должностях флуоресцентных бисером встроенные в гель ПАА основного координационного спайки в напряженной (зеленый) и ненапряженных (красный) состояний. Стрелки показывают примеры из бисера перемещения. (C) тяговые векторов напряжений и (Д.), соответствующая тепловой масштаб карты тягового напряжения происходит от сокращения геля, с помощью вычислительных алгоритмов (Sabass и соавт., 2008). Шкала бар = 5 мкм.
Таблица 1:
Пример сток и рабочих ПАА Solutions (данные в таблице 1 был впервые получен из Юнг и др.. Др.. И независимо подтверждено в нашей лаборатории.)
| Сток ПАА решения | ||||
| Модуль сдвига ПАА гель (Па) | 230 | 2833 | 8640 | 16344 |
| 40% акриламида (мл) | 1,25 | 3,12 | 2,34 | 2,50 |
| 2% бис-акриламид (мл) | 0,50 | 0,83 | 1,88 | 0,60 |
| Вода (мл) | 3,25 | 1,04 | 0,78 | 1. 90 |
| Общий объем (мл): | 5 | 5 | 5 | 5 |
| Рабочие ПАА решения | ||||
| Маточного раствора Используется (Па) | 230 | 2833 | 8640 | 16344 |
| Маточного раствора Объем (мкл) | 150 | 150 | 200 | 300 |
| Вода (мкл) | 341,75 | 341,75 | 291,75 | 191,75 |
| Бусы (мкл) | 5 | 5 | 5 | 5 |
| TEMED (мкл) | 0,75 | 0,75 | 0,75 | 0,75 |
| 10% APS (мкл) | 2,5 | 2,5 | 2,5 | 2,5 |
| Общий объем (мкл): | 500 | 500 | 500 | 500 |
| Заключительные% Акриламид | 3 | 7,5 | 7,5 | 12 |
| Заключительные бис-акриламида% | 0,06 | 0,1 | 0,3 | 0,15 |
Таблица 2:
Модуль сдвига ПАА подложках различных окончательного акриламида и бис-акриламида проценты
| 12% акриламида | 7,5% Акриламид | |||
| % Бис-акриламида | Модуль сдвига (Па) | % Бис-акриламида | Модуль сдвига (Па) | |
| 0,145 | 16344 | 0,01 | 689 | |
| 0,28 | 30067 | 0,03 | 1535 | |
| 0,45 | 34263 | 0,05 | 2286 | |
| 0,55 | 42375 | 0,075 | 2833 | |
| 0,575 | 50873 | 0,1 | 4069 | |
| 0,6 | 55293 | 0,2 | 5356 | |
| 0,3 | 8640 | |||
| 5% Акриламид | 3% Акриламид | |||
| % Бис-акриламида | Модуль сдвига (Па) | % Бис-акриламида | Модуль сдвига (Па) | |
| 0,05 | 430 | 0,02 | 1,3 | |
| 0,075 | 600 | 0,04 | 54 | |
| 0,1 | 1431 | |||
Обсуждение
Процедура, описанная здесь для настройки микроскопии тяговое усилие (TFM) эксперимента, а также реализация вычислительной процедуры отслеживания (Sabass и соавт., 2008), дает возможность количественного клеточного силы с микронных пространственным разрешением. Для оптимизации эксперим...
Раскрытие информации
Благодарности
Мы благодарим лаборатории Ульриха Шварца для вычислительных отслеживания программного обеспечения, используемых в количественной оценке сотовых силы тяги (Sabass и соавт., 2008). Эта работа была поддержана Карьера Burroughs Wellcome премии и премии Pioneer NIH директора (DP10D00354) для ML Гардель и научный медицинский Национальный исследовательский Service Award (5 T32 GM07281) для зимних SP.
Материалы
| Name | Company | Catalog Number | Comments |
| 3-aminopropyltrimethyoxysilane | Aldrich | 28, 177-8 | |
| 40% Acrylamide | Bio-Rad | 161-0140 | |
| 2% Bis-acrylamide | Fisher Scientific | BP1404 | |
| TEMED | Fisher Scientific | BP 150-20 | |
| Ammonium persulfate | Fisher Scientific | BP179 | |
| 40nm fluorescent micro-spheres | Invitrogen | F8789 | |
| Sulfo-SANPAH | Pierce, Thermo Scientific | 22589 | |
| Confocal imaging chamber (RC-30) | Warner Instruments | 64-0320 | |
| Coverslip spinner | Home made | NA | |
| Ultraviolet lamp CL1000 | UVP Inc. | 95-0228-01 | |
| Stainless steel rack | Electron Microscopy Sciences | 72239-04 | |
| acryloyl-X, SE (6-((acryloyl)amino)hexanoic acid) | Invitrogen | A-20770 | |
| Hydrazine hydrate | Sigma-Aldrich | 225819 | |
| Sodium meta-periodate | Thermo Fisher Scientific, Inc. | 20504 | |
| Isopropanol | Fisher Scientific | A416-4 | |
| Fibronectin | Sigma-Aldrich | F2006 | |
| Collagen | BD Biosciences | 354236 | |
| Coverslips (#1.5) | Corning | 2940‐224 | |
| Glutaraldehyde | Electron Microscopy Sciences | 16120 | |
| Rain-X | SOPUS Products | www.rainx.com | |
| Acetic Acid | Acros Organics | 64-19-7 |
Ссылки
- Damljanovic, V., Lajerholm, B. C., Jacobson, K. Bulk and micropatterned conjugation of extracellular matrix proteins to characterized polyacrylamid substrates for cell mechanotransduction assays. Biotechniques. 39 (6), 847-851 (2005).
- Engler, A., Bacakova, L. N. e. w. m. a. n., Hategan, C., Griffin, A., M, D. D. i. s. c. h. e. r. Substrate compliance versus ligand in cell on gel responses. Biophys J. 86 ((1 Pt 1)), 617-628 (2004).
- Gardel, M. L., Sabass, B., Ji, L., Danuser, G., Schwarz, U. S., Waterman, C. M. Traction stress in focal adhesions correlates biphasically with actin retrograde flow speed. J Cell Biol. 183, 999-1005 (2008).
- Rajagopalan, P., Marganski, W. A., Brown, X. Q., Wong, J. Y. Direct comparison of the spread area, contractility, and migration of balb/c 3T3 fibroblasts adhered to fibronectin- and RGD-modified substrata. Biophys J. 87 (4), 2818-2827 (2004).
- Reinhart-King, C. A., Dembo, M., Hammer, D. A. The dynamics and mechanics of endothelial cell spreading. Biophys J. 89, 676-689 (2005).
- Stricker, J., Sabass, B., Schwarz, U. S., Gardel, M. L. Optimization of traction force microscopy for micron-sized focal adhesions. J. Phys: Condensed Matter. 22, 194104-194114 (2010).
- Sabass, B., Gardel, M. L., Waterman, C. M., Schwarz, U. S. High resolution traction force microscopy based on experimental and computational advances. Biophys J. 94, 207-220 (2008).
- Yeung, T. Effects of substrate stiffness on cell morphology, cytoskeletal structure, and adhesion. Cell Motil Cytoskeleton. 60 (1), 24-34 (2005).
- Waterman-Storer, C. M. Microtubule/organelle motility assays. Curr Protoc Cell Biol. , 13.1.1-13.1.21 (1998).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены