Se requiere una suscripción a JoVE para ver este contenido. Inicie sesión o comience su prueba gratuita.
Method Article
Preparación de las matrices de demanda para la cuantificación de la contracción celular
En este artículo
Resumen
En este vídeo, que muestran las técnicas experimentales utilizadas para la fabricación de cumplimiento, la matriz extracelular (ECM) sustratos recubiertos adecuadas para el cultivo celular, y que son susceptibles de microscopía de fuerza de tracción y observando los efectos de la rigidez de ECM en el comportamiento celular.
Resumen
La regulación de la adhesión celular a la matriz extracelular (MEC) es esencial para la migración celular y la remodelación de ECM. Adhesiones focales son conjuntos macromoleculares que la pareja contráctil F-actina del citoesqueleto a la matriz extracelular. Esta conexión permite la transmisión intracelular de las fuerzas mecánicas a través de la membrana celular al sustrato subyacente. Trabajos recientes han demostrado las propiedades mecánicas de la ECM regular de adhesión focal y la morfología de la F-actina, así como numerosos procesos fisiológicos, como la diferenciación celular, la división, proliferación y migración. Por lo tanto, el uso de sustratos de cultivo celular se ha convertido en un método cada vez más frecuente para controlar con precisión y modulan las propiedades mecánicas de ECM.
Para cuantificar las fuerzas de tracción en las adhesiones focales en células adherentes, sustratos compatibles se utilizan en combinación con imágenes de alta resolución y las técnicas de cómputo en un método llamado microscopio de fuerza de tracción (TFM). Esta técnica se basa en la medición de la magnitud local y dirección de las deformaciones inducidas por la contracción del sustrato celular. En combinación con la alta resolución de la microscopía de fluorescencia de las proteínas de marcado con fluorescencia, es posible correlacionar la organización del citoesqueleto y remodelación con las fuerzas de tracción.
Aquí se presenta un protocolo experimental detallado para la preparación de dos dimensiones, matrices cumplen con el propósito de crear un sustrato de cultivo de células con un bien caracterizado, la rigidez mecánica ajustable, lo que es adecuado para medir la contracción celular. Estos protocolos incluyen la fabricación de hidrogeles de poliacrilamida, capa de proteínas ECM en tales geles, las células de revestimiento de gel, de alta resolución y microscopía confocal utilizando una cámara de perfusión. Además, ofrecemos una muestra representativa de los datos que demuestran la ubicación y magnitud de las fuerzas celular utilizando protocolos citados TFM.
Protocolo
1. La activación de la superficie cubreobjetos
- Cubreobjetos (# 1.5, 22x40 mm) se limpian con una serie de lavados de jabón y el etanol en un protocolo previamente descrito (Waterman-Storer, 1998) para limpiar y quitar el polvo.
- Cubreobjetos lugar en un estante de acero inoxidable de soporte, de tal manera que cubreobjetos están separados y sin tocarse.
- En campana para vapores químicos (guantes de nitrilo y gafas de protección recomendado), diluir la fuerza total de 3 aminopropiltrimetoxisilano en isopropanol para una concentración final de 2% (2 ml de silano / 100 ml de isopropanol) para llenar un recipiente de vidrio cuadrados (~ 350 ml de volumen). Debido a la reactividad con el plástico, use un vaso pipeta Pasteur para aplicar 3-aminopropiltrimetoxisilano el isopropanol.
- Totalmente inmerso cubreobjetos de 1,2 en esta solución durante 10 minutos con agitación suave en una placa de agitación en la campana extractora de humos.
- Lave cubreobjetos mediante la inmersión en ddH2O (4 bolsas de agua). Espere 10 minutos del tiempo de remojo para el intercambio final, con agitación. Amino-silano soluciones que contienen deben ser eliminados como residuos peligrosos.
- Cubreobjetos secos en la incubadora a una temperatura caliente (~ 37 ° C) durante 10 minutos en un ambiente libre de polvo.
- Enfriar a temperatura ambiente.
- En la campana extractora de humos, cubreobjetos inmersión en solución de glutaraldehído al 1% en ddH2O en un plato de cristal cuadrado en remover la placa durante 30 minutos.
- Lave por tres intercambios de ddH2O por 10 minutos por el intercambio, con agitación. Disponer de glutaraldehído como residuos peligrosos.
- Secar a temperatura ambiente, cubriendo con papel de aluminio para evitar que el polvo se adhiera a la cubreobjetos.
- Conservar en un lugar seco, lejos del polvo, para un máximo de 2 meses.
2. Preparación de poliacrilamida (PAA) en gel
- Preparar soluciones madre de la mezcla de acrilamida / bis-acrilamida de 40% de acrilamida y el 2% bis-acrilamida, según el cuadro 1. Mantenemos varias soluciones de archivo que están optimizadas para los geles de PAA de la rigidez de diferentes ejemplos se muestran en la Tabla 1 y 2. Las soluciones de reserva pueden mantenerse por varios años, mientras que se mantienen en una botella oscura a 4 º C.
- Las soluciones de trabajo que contiene la concentración final deseada de acrilamida / bis-acrilamida se obtienen a partir de soluciones madre. Por ejemplo, podemos preparar una solución de trabajo de 7,5% acrylamide/0.10% bis-acrilamida en ddH2O para la fabricación de geles 2.8kPa PAA.
- Degas acrilamida solución en una cámara de vacío durante 20 minutos, para reducir el oxígeno dentro de la solución que evita la polimerización PAA.
- Prepare un 10% de persulfato de amonio (APS) solución (0.5g/5mL). El uso de valores de trabajo nueva en 3 días. Por otra parte, las acciones pueden ser congelados para ser utilizados en fechas posteriores.
- Mientras que la acrilamida es desgasificación, limpie un 1x3 "portaobjetos de vidrio de microscopio con toallitas X de lluvia con fuerza para hacer portaobjetos de vidrio hidrofóbico de la superficie. Para eliminar el exceso de lluvia-X, limpie portaobjetos de vidrio con Kimwipe húmedo. Conjunto de diapositivas de vidrio de lado, cubierto.
- Retire la solución de acrilamida a partir de la cámara de vacío y agregar cuentas fluorescentes (1% en volumen, 5 l de la solución de trabajo que figuran en la Tabla 1). Añadir 0.75μl TEMED y 2,5 l 10% de APS, que inician la polimerización del gel. Mezclar bien con la pipeta de ~ 5 segundos, para reducir al mínimo la introducción de burbujas,
- Aplicar 10-12 l de la solución de acrilamida al portaobjetos hidrofóbica (preparada en el paso 2.4) y el lugar activado cubreobjetos 22x40mm en la parte superior de la gota. Solución de gel debe cubreobjetos capa entera. Suavizar las burbujas que pueden aparecer dentro de la solución. Deje que la solución de gel para polimerizar a temperatura ambiente durante aproximadamente 10 min.
- La finalización de polimerización puede ser evaluado mediante la inversión solución que queda de trabajo en el tubo de microcentrífuga. Además, el gel polimerizado pueden separarse de los bordes cubreobjetos. Inmediatamente después de la polimerización macroscópico se observa, por separado el cubreobjetos de los portaobjetos. Con la punta fina de un par de pinzas o una hoja de filo de la navaja, retire con cuidado el cubreobjetos, con gel adjunto, de la superficie del portaobjetos del microscopio y el gel de sumergirse en ddH2O, para mantener la hidratación.
3. Acoplamiento de la matriz extracelular (ECM) de proteínas en el gel de PAA
Tres métodos distintos puede ser utilizado para fijar las proteínas ECM o bien a la superficie superior del gel de PAA (3.1 y 3.2) o la incorporación de proteínas ECM en el volumen del gel (3.3). En este caso, hablamos de la unión de la fibronectina a los geles PAA como resultado una densidad de ligando de superficie que es equivalente a la cantidad adsorbida en el vidrio después de la incubación con 10 mg / ml de solución de fibronectina durante 1 hora. Consideraciones para la elección de un método se detallan en la discusión.
- El entrecruzamiento de proteínas ECM a la superficie de gel de PAA por sulfo-SANPAH aminas reactivas en las proteínas se une covalentemente a la superficie del gel de PAA por la heterobifuncionales entrecruzador sulfo-SANPAH
- Preparar alícuotas de 40 l de trabajo de sulfo-SANPAH disolviendo S ulfo-SANPAH polvo en dimetilsulfóxido anhidro (DMSO) (20 l por mg de sulfo-SANPAH). Acciones de Flash congelar en nitrógeno líquido y almacenar a -80 ° C para su uso posterior.
- Quitar ddH2O de la superficie de gel con un spinner cubreobjetos (<2 segundos). Evitar que se seque el gel.
- Diluir Sulfo-SANPAH-DMSO alícuotas en ddH2O (2mg/ml, pH 7) inmediatamente antes del uso y la superficie de la capa del gel (~ 200 l). Tenga en cuenta que la reactividad de la vida media de sulfo-SANPAH es corto (~ 5 minutos) a temperatura ambiente en el agua, por lo tanto, estas medidas deben hacerse a un ritmo rápido.
- Exponer la superficie de gel a la luz ultravioleta UV en un horno de reticulación (8W, 254 nm de longitud de onda a una distancia de 2.3 pulgadas por 1.5 min). Sulfo-SANPAH se puede cambiar de color naranja al marrón.
- Dip cubreobjetos con tratamiento UV en un vaso con agua fresca O ddH 2 y quitar el exceso de agua de la superficie de gel con un spinner cubreobjetos (<2 segundos).
- Pipeta ~ 50 L de frío 1mg/ml fibronectina (FN) (en PBS, pH 7,4) en Parafilm en el contenedor placa de Petri. Invertir cubreobjetos en la parte superior de la caída de FN, el gel expuesto a la FN.
- Reaccionar a temperatura ambiente durante 1-2 horas oa 4 ° C durante la noche.
- Cubreobjetos a cabo en seis placas de cultivo cm tejido que contiene PBS (pH 7,4), suficiente para cubrir cubreobjetos, en condiciones estériles en una campana de cultivo de tejidos.
- Lave intensamente con varios lavados (3-5) de PBS (pH 7,4), bajo condiciones estériles.
- Esterilizar el cubreobjetos por el uso de la lámpara germicida en la campana de cultivo de tejido durante 30 minutos.
- Incubar cubreobjetos en los medios de comunicación celular durante 30-45 minutos antes de las células de revestimiento.
- La reticulación de ECM para la superficie del gel de PAA por los grupos de hidratos de carbono hidrato de hidracina en las proteínas se oxidan y, junto con el gel con hidrato de hidrazina.
- Preparar geles de poliacrilamida como se describe en la sección 2.
- Lugar PAA cubreobjetos gel en placa Petri de plástico en una campana de humos y los guantes con una pipeta aproximadamente 1 ml de hidrato de hidrazina sin diluir sobre la superficie de cada gel de PAA y se incuba durante al menos dos horas, pero no más de 24 horas
- Añadir ddH2O a la placa de Petri; Quitar solución de hidracina hidratar y eliminar como residuos peligrosos.
- Añadir 5% de ácido acético a la placa de Petri para sumergir a tapar. Cubrir e incubar durante una hora.
- Eliminar el ácido acético y lavar con ddH 2 O. Incubar en ddH2O durante una hora. Los cubreobjetos se han activado y listo para reticular oxida fibronectina (FN).
- Diluir 10 l de 1 mg / ml de solución de FN en l 940, de 50 mM de tampón acetato de sodio (pH 4.5) en un tubo de centrífuga de micro oscuro, por lo que una concentración final de 10 mg / ml.
- Hacer un balance de 20X de sodio meta-peryodato mediante la adición de 80 mg de sodio meta-peryodato a 1 ml de 50 mM de tampón acetato de sodio (pH 4,5).
- Añadir 50 l de 20X de sodio meta-peryodato acciones para la solución de FN preparada en 3.2.6, de modo que la concentración final de trabajo es de 10 mg / ml FN y 4 mg / ml de sodio meta-peryodato. Incubar en el tubo de oscuridad a temperatura ambiente durante 30 minutos.
- Eliminar el exceso de ddH2O de la superficie de gel activado preparados en 3.2.5 utilizando una ruleta cubreobjetos (<2 segundos). Evitar que se seque el gel.
- Pipeta de ~ 500 l de solución de FN en la superficie de gel activado y se incuba durante 1 hora a temperatura ambiente.
- Cubreobjetos lugar en platos que contienen PBS (pH 7,4), suficiente para cubrir cubreobjetos.
- Lave intensamente con varios lavados (3-5) de PBS (pH 7,4).
- Esterilizar el cubreobjetos por el uso de la lámpara germicida en la campana de cultivo de tejido durante 30 minutos.
- Incubar cubreobjetos en los medios de comunicación celular durante 30-45 minutos antes de las células de revestimiento.
- Conjugación mayor parte de las proteínas ECM en el PAA gel acriloil-X, éster de succinimidilo Este protocolo se realiza antes de la 2.5. Aminas reactivas en las proteínas se unen a un monómero de acrilamida con NHS éster de la química y co-polimerizado en la mayor parte del gel de PAA.
- Conjugado de proteínas ECM de elección para acriloil-X por las instrucciones del fabricante. Disponibilidad de soluciones de proteína conjugada se deben almacenar a 4 ° C.
- Calcular el volumen de la solución de PAA de trabajo necesario para la fabricación de gel (por ejemplo, 10 uL por cubreobjetos).
- Restar 50 L (volumen 10%) del agua de cantidad indicada en la receta de solución de trabajo en la Tabla 1 e iniciar la polimerización.
- Retire el volumen calculado en el punto 3.3.2 y añadir ECM / acriloil-X solución a 10% en volumen. (Por ejemplo, una L de ECM / acriloil-X a 9 l de la solución de PAA). Este paso debe realizarse con rapidez, como el gel se polimeriza.
- Complete los pasos 2.6 y 2.7 como se describió anteriormente.
- Lave intensamente con varios lavados (3-5) de PBS (pH 7,4), bajo condiciones estériles.
- Esterilizar el cubreobjetos por el uso de la lámpara germicida en la campana de cultivo de tejido durante 30 minutos.
- Incubar cubreobjetos en los medios de comunicación celular durante 30-45 minutos antes de las células de revestimiento.
Estos pasos se realizan después de las células se les ha permitido difundir en el sustrato de gel ECM-revestidos (~ hrs 6-12). Para montar la cámara de imagen confocal (RC-30WA), es útil consultar el sitio web de Warner instrumentos de orientación.
- Los medios de comunicación cálida celular y el 0,5% o 0,25% de tripsina y la carga en una jeringa de 10 ml o 5 ml.
- Cargar un cubreobjetos 22x30mm en el soporte superior de un cubreobjetos Warner Instrumentos microscopía confocal de cámara (RC-30WA) con grasa de vacío para mantener el cubreobjetos en su lugar.
- Colocar una cámara de la formación de junta de goma en la parte superior del cubreobjetos, permitiendo el acceso tanto de entrada y salida de tubería de polietileno. Esto permitirá a una distancia de 150-1000 m entre el cubre la parte superior y el cubreobjetos 22x40mm gel-revestido, en función del tamaño de la junta usada.
- Jeringas de carga en la tubería de entrada, a través de kit de conexión, y comprobar que los medios de comunicación fluye a través de la tubería y en Cubreobjetos superior y no hay burbujas son evidentes en las líneas de flujo.
- Aplicar grasa de vacío en la base de la cámara y la carga de gel recubierto cubreobjetos 22x40mm, celular hacia arriba. Aplicar los medios de comunicación cálida para las células.
- Lugar titular Cubreobjetos superior sobre la base de cámara, con la Cámara de juntas que lo separa de la cubreobjetos recubiertos de gel. Asegúrese de que los pasadores de posicionamiento dentro de la base de la cámara se sientan dentro de los agujeros en la localización Cubreobjetos superior.
- Aplicar la placa de presión a la base de la cámara y utilice la llave de presión Placa para atornillar y fijar la placa de presión.
- Compruebe el flujo de los medios de comunicación a través del tubo y la cámara para controlar las fugas potenciales dentro de la cámara y para eliminar cualquier zona de los medios de comunicación libres en la superficie celular. Nota: el uso de una aguja de calibre pequeño como para establecer un pequeño vacío, mientras que la infusión con los medios de comunicación pueden ayudar a eliminar los medios de comunicación de zonas libres.
- Aplicar la cámara de imagen confocal para el adaptador de la etapa situada dentro de un titular de microscopio en busca de imágenes.
- Imagen fluorescente marcada con la proteína y granos fluorescentes incrustados en el sustrato de gel en un microscopio de fluorescencia confocal.
- Para obtener una imagen de unstrained posiciones de cuentas dentro del gel, perfundir tripsina para separar las adherencias celulares del gel, y saca una foto de las bolas fluorescentes en el campo de la imagen misma de la célula donde se adhirió. La comparación de las posiciones de cuentas tensa y sin forzar permite la cuantificación de los desplazamientos gel sustrato en contracción.
Los resultados representativos:
El protocolo anterior se describe el procedimiento experimental para la preparación de geles compatible PAA para el estudio de la contractilidad celular y se ilustra en la Figura 1. La superficie del gel obtenido con este protocolo es relativamente plana y lisa, con los granos fluorescentes incrustados uniformemente a lo largo (Figura 2).
Si la medición de la contracción de gel en el lugar de las adhesiones focales, las imágenes de la célula (Figura 3) y la superficie del gel (Figura 3B) se debe hacer en el plano confocal óptica de las adhesiones focales. La contracción de un gel puede ser visualizado por el desplazamiento de incrustada de esferas fluorescentes (Figura 3B) en la superficie del gel cuando las células están adheridas (tensa) frente a independiente (sin tensión). El uso de algoritmos computacionales pueden generar tensiones de tracción con el desplazamiento de cuentas y el correspondiente módulo de elasticidad del gel (Figura 3C y 3D) (Sabass et al., 2008). Si las imágenes se lleva a cabo más profundo dentro del gel, a continuación, los desplazamientos de cuentas serán más pequeñas y no representativas de las fuerzas de tracción ejercida en las adhesiones focales.
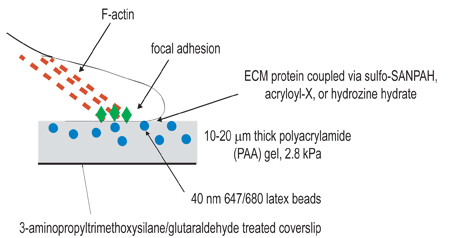
Figura 1. Esquema del montaje experimental. El objetivo general de este procedimiento es la creación de matrices cumple con el propósito de estudiar la contracción celular. El primer paso del procedimiento experimental consiste en activar cubreobjetos por el tratamiento amino-silane/glutaraldehyde con el propósito de anclar geles polimerizados. El segundo paso consiste en polimerizar un gel de poliacrilamida, que contienen perlas fluorescentes, en el cubreobjetos activado. El tercer paso implica el entrecruzamiento químico del ligando extracelular de la superficie del gel de poliacrilamida, utilizando una de las tres técnicas de acoplamiento que figuran en el paso 3. Células se sembraron en el gel y permite que se adhieran y se propague. En virtud de la contracción celular activo, cuentas incrustado en el gel de desplazar.

Figura 2. Rebanada óptica confocal de la superficie superior del PAA gel, tal como puede verse en (A.) perlas fluorescentes 40nm integrado en gel y (b) de inmunofluorescencia fibronectina.

Figura 3. Representante resultado de un experimento de la fuerza de tracción. (A.) las adhesiones focales en un osteosarcoma de células humanas U2OS son marked por GFP-paxillin y (b) de las posiciones de perlas fluorescentes incrustados en el gel de PAA subyacente adhesiones focales en la tensión (verde) y sin tensión (rojo) los estados. Las flechas indican ejemplos de los desplazamientos de cuentas. (C) Los vectores de tensión y tracción (D.) correspondiente al calor de la escala del mapa de tracción tensiones derivadas de la contracción del gel, mediante algoritmos computacionales (Sabass et al., 2008). Barra de escala = 5 micras.
Tabla 1:
Foto ejemplo de trabajo y soluciones de PAA (datos en la tabla 1 se obtuvo por primera vez desde Yeung et. Al. Y confirmado de forma independiente en nuestro laboratorio.)
| Solución de archivo PAA | ||||
| Módulo de corte de la PAA Gel (Pa) | 230 | 2833 | 8640 | 16344 |
| 40% de acrilamida (ml) | 1.25 | 3.12 | 2.34 | 2.50 |
| 2% Bis-acrilamida (ml) | 0.50 | 0.83 | 1.88 | 0.60 |
| Agua (ml) | 3.25 | 1.04 | 0.78 | 1. 90 |
| Volumen total (ml): | 5 | 5 | 5 | 5 |
| Solución de trabajo PAA | ||||
| Solución madre Usado (Pa) | 230 | 2833 | 8640 | 16344 |
| Archivo de volumen de la solución (l) | 150 | 150 | 200 | 300 |
| Agua (l) | 341,75 | 341,75 | 291,75 | 191,75 |
| Beads (l) | 5 | 5 | 5 | 5 |
| TEMED (l) | 0.75 | 0.75 | 0.75 | 0.75 |
| 10% de APS (l) | 2.5 | 2.5 | 2.5 | 2.5 |
| Volumen total (l): | 500 | 500 | 500 | 500 |
| % De acrilamida final | 3 | 7.5 | 7.5 | 12 |
| Final de Bis-acrilamida% | 0.06 | 0.1 | 0.3 | 0.15 |
Tabla 2:
Módulo de corte de la PAA sustratos de acrilamida varios finales y porcentajes de acrilamida bis-
| 12% de acrilamida | 7,5% de acrilamida | |||
| % Bis-acrilamida | Módulo de cizalla (Pa) | % Bis-acrilamida | Módulo de cizalla (Pa) | |
| 0.145 | 16344 | 0.01 | 689 | |
| 0.28 | 30067 | 0.03 | 1535 | |
| 0.45 | 34263 | 0.05 | 2286 | |
| 0.55 | 42375 | 0.075 | 2833 | |
| 0.575 | 50873 | 0.1 | 4069 | |
| 0.6 | 55293 | 0.2 | 5356 | |
| 0.3 | 8640 | |||
| 5% de acrilamida | 3% de acrilamida | |||
| % Bis-acrilamida | Módulo de cizalla (Pa) | % Bis-acrilamida | Módulo de cizalla (Pa) | |
| 0.05 | 430 | 0.02 | 1.3 | |
| 0.075 | 600 | 0.04 | 54 | |
| 0.1 | 1431 | |||
Discusión
El procedimiento descrito aquí para la instalación de un microscopio de fuerza de tracción (TFM) experimento, junto con la implementación de rutinas de seguimiento de cálculo (Sabass et al., 2008), permite la cuantificación de las fuerzas de celulares con escala micrométrica resolución espacial. Para optimizar el protocolo experimental, es fundamental para formar un sustrato de gel puro y uniforme con capa uniforme de ligando ECM. Se discuten posibles escollos a continuación:
...
Divulgaciones
Agradecimientos
Damos las gracias al laboratorio de Ulrich Schwarz para el software de seguimiento de cálculo utilizados en la cuantificación de las fuerzas de tracción celular (Sabass et al., 2008). Este trabajo fue apoyado por una concesión de carrera Burroughs Wellcome y el premio el director del NIH de Pioneer (DP10D00354) a ML Gardel y Médico Investigador Científico del Premio Nacional de Servicio (5 T32 GM07281) de invierno SP.
Materiales
| Name | Company | Catalog Number | Comments |
| 3-aminopropyltrimethyoxysilane | Aldrich | 28, 177-8 | |
| 40% Acrylamide | Bio-Rad | 161-0140 | |
| 2% Bis-acrylamide | Fisher Scientific | BP1404 | |
| TEMED | Fisher Scientific | BP 150-20 | |
| Ammonium persulfate | Fisher Scientific | BP179 | |
| 40nm fluorescent micro-spheres | Invitrogen | F8789 | |
| Sulfo-SANPAH | Pierce, Thermo Scientific | 22589 | |
| Confocal imaging chamber (RC-30) | Warner Instruments | 64-0320 | |
| Coverslip spinner | Home made | NA | |
| Ultraviolet lamp CL1000 | UVP Inc. | 95-0228-01 | |
| Stainless steel rack | Electron Microscopy Sciences | 72239-04 | |
| acryloyl-X, SE (6-((acryloyl)amino)hexanoic acid) | Invitrogen | A-20770 | |
| Hydrazine hydrate | Sigma-Aldrich | 225819 | |
| Sodium meta-periodate | Thermo Fisher Scientific, Inc. | 20504 | |
| Isopropanol | Fisher Scientific | A416-4 | |
| Fibronectin | Sigma-Aldrich | F2006 | |
| Collagen | BD Biosciences | 354236 | |
| Coverslips (#1.5) | Corning | 2940‐224 | |
| Glutaraldehyde | Electron Microscopy Sciences | 16120 | |
| Rain-X | SOPUS Products | www.rainx.com | |
| Acetic Acid | Acros Organics | 64-19-7 |
Referencias
- Damljanovic, V., Lajerholm, B. C., Jacobson, K. Bulk and micropatterned conjugation of extracellular matrix proteins to characterized polyacrylamid substrates for cell mechanotransduction assays. Biotechniques. 39 (6), 847-851 (2005).
- Engler, A., Bacakova, L. N. e. w. m. a. n., Hategan, C., Griffin, A., M, D. D. i. s. c. h. e. r. Substrate compliance versus ligand in cell on gel responses. Biophys J. 86 ((1 Pt 1)), 617-628 (2004).
- Gardel, M. L., Sabass, B., Ji, L., Danuser, G., Schwarz, U. S., Waterman, C. M. Traction stress in focal adhesions correlates biphasically with actin retrograde flow speed. J Cell Biol. 183, 999-1005 (2008).
- Rajagopalan, P., Marganski, W. A., Brown, X. Q., Wong, J. Y. Direct comparison of the spread area, contractility, and migration of balb/c 3T3 fibroblasts adhered to fibronectin- and RGD-modified substrata. Biophys J. 87 (4), 2818-2827 (2004).
- Reinhart-King, C. A., Dembo, M., Hammer, D. A. The dynamics and mechanics of endothelial cell spreading. Biophys J. 89, 676-689 (2005).
- Stricker, J., Sabass, B., Schwarz, U. S., Gardel, M. L. Optimization of traction force microscopy for micron-sized focal adhesions. J. Phys: Condensed Matter. 22, 194104-194114 (2010).
- Sabass, B., Gardel, M. L., Waterman, C. M., Schwarz, U. S. High resolution traction force microscopy based on experimental and computational advances. Biophys J. 94, 207-220 (2008).
- Yeung, T. Effects of substrate stiffness on cell morphology, cytoskeletal structure, and adhesion. Cell Motil Cytoskeleton. 60 (1), 24-34 (2005).
- Waterman-Storer, C. M. Microtubule/organelle motility assays. Curr Protoc Cell Biol. , 13.1.1-13.1.21 (1998).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados