このコンテンツを視聴するには、JoVE 購読が必要です。 サインイン又は無料トライアルを申し込む。
Method Article
細胞収縮を定量化するための苦情の行列の準備
要約
このビデオでは、我々は細胞培養に適した準拠、細胞外マトリックス(ECM)コーティングされた基材を作製するために使用される実験技術を実証し、牽引力顕微鏡に適していると、細胞の挙動にECMの剛性の影響を観察している。
要約
細胞外マトリックス(ECM)に対する細胞接着の調節は、細胞遊走およびECMリモデリングに不可欠です。接着斑は、そのECMに結合収縮F -アクチンの細胞骨格の高分子アセンブリです。この接続は、基礎となる基板に細胞膜を通過する細胞内の機械的な力の伝達が可能になります。最近の研究は、ECMの機械的性質は、接着斑とF -アクチンの形態だけでなく、細胞の分化、分裂、増殖と移動を含む多くの生理学的プロセスを調節示している。従って、細胞培養基板の使用は、正確に制御し、ECMの機械的特性を調節することがますます普及している方法となっている。
接着細胞の接着斑での牽引力を定量化するために、準拠した基板は、高分解能イメージングと法と呼ばれるトラクション力顕微鏡(TFM)の計算手法と組み合わせて使用されています。この手法は、細胞の収縮によって誘発される基板の変形の局所大きさと方向の測定値に依存しています。蛍光標識タンパク質の高分解能蛍光顕微鏡と組み合わせることで、それは牽引力と細胞骨格の組織とリモデリングを相関させることが可能です。
ここでは、細胞収縮を測定するのに適している十分に特徴付け、調整可能な機械的剛性、ある細胞培養基板を作成する目的のための二次元、準拠したマトリックスの調製のための詳細な実験プロトコルを提示する。これらのプロトコルは、ポリアクリルアミドハイドロゲルの製造、そのようなゲル上にECMタンパク質のコーティング、ゲル上のめっきセル、および灌流チャンバーを用いた高分解能共焦点顕微鏡などがあります。さらに、我々は引用TFMプロトコルを使用して、細胞の力の位置と大きさを示すデータの代表的なサンプルを提供しています。
プロトコル
1。カバーの表面のアクティブ化
- カバースリップ(#1.5、22x40 mm)が埃を掃除したり削除したり、前述のプロトコル(ウォーターマン-ストアラー、1998)で石鹸とエタノール洗浄のシリーズを使って掃除している。
- ステンレス製のホルダーのラックに配置しカバーガラスは、そのようなそのカバーグラスを離間し、触れていない。
- 化学ヒュームフード(ニトリル手袋とゴーグルが推奨)で、正方形のガラス皿を(〜350ミリリットルボリューム)埋めるために2%(シラン2ミリリットル/ 100 mlのイソプロパノール)の最終濃度のためにイソプロパノールで3 - アミノプロピルトリメトキシフル強度を希釈する。プラスチックとの反応性のために、イソプロパノールに3 - アミノプロピルトリメトキシシランを適用するためにガラスパスツールピペットを使用してください。
- 優しくドラフト内で撹拌プレート上で撹拌しながら完全に10分間この溶液中に1.2からカバースリップを浸す。
- のddH 2 O(水の4取引所)に浸漬することにより、カバーグラスを洗ってください。 10分は攪拌しながら、最終的な交換のために時間を浸すことができます。アミノシランを含む溶液は危険廃棄物として廃棄してください。
- ホコリのない環境で10分間暖かい温度で培養器で乾燥したカバースリップ(〜37 ° C)。
- 室温まで冷却。
- ドラフトでは、上のガラス正方形の皿でのddH 2 Oで1%グルタルアルデヒド溶液に浸すのカバースリップは、30分間プレートをかき混ぜる。
- 攪拌しながら、交換ごとに10分間のddH 2 O 3の取引所で洗ってください。有害廃棄物としてグルタルアルデヒドを処分。
- カバーガラスに付着するほこりを避けるために、アルミホイルで覆い、室温で乾燥させる。
- 最大2ヶ月間、離れて塵から、乾燥した場所に保管してください。
2。ポリアクリルアミドの調製(PAA)ゲル
- 表1以下の40%のアクリルアミドと2%ビスアクリルアミド、からアクリルアミド/ビスアクリルアミド混合のストック溶液を準備します。我々は、さまざまな剛性のPAAゲル用に最適化されているいくつかのストック溶液を維持することの例を表1及び2に記載されています。ストック溶液は、それらは4℃で暗いボトルで維持されている限り、数年間は保つことができます
- アクリルアミド/ビスアクリルアミドの最終的な所望の濃度を含むワーキングソリューションは、ストック溶液から得られる。例えば、我々は2.8kPa PAAゲルを作るためのddH 2 O 7.5%acrylamide/0.10%ビスアクリルアミドのワーキング溶液を調製。
- 20分間真空チャンバー内の脱気は、アクリルアミド溶液、PAAの重合を防止するソリューション内の酸素を削減する。
- 10%の過硫酸アンモニウム(APS)溶液(0.5g/5mL)を準備する。 3日以内に新鮮な作業用ストックを使用してください。また、株式は後の日付で使用されることを凍結することができます。
- アクリルアミドが脱ガスされている間、スライドグラスの表面を疎水性にするために精力的に雨- Xのワイプと1 × 3"顕微鏡のスライドガラスを拭いてください。湿らせたキムワイプでスライドガラスを拭き、雨- X過剰削除するには。覆わ脇のガラススライドには、。
- 真空チャンバからアクリルアミド溶液を除去し、蛍光ビーズを(体積1重量%、表1に記載されている実用的なソリューションのための5μl)を加える。 0.75μlのTEMED追加し、ゲルの重合を開始する2.5μlの10%APS、。気泡の発生を最小限に抑えるため、約5秒間ピペッティングでよく混ぜ、
- 疎水性の顕微鏡スライドにアクリルアミド溶液(ステップ2.4で調製したもの)10〜12μLを適用し、液滴の上に活性化さ22x40mmカバースリップを配置。ゲル溶液は、コート全体をカバーすべき。ソリューション内に表示される可能性のある泡を滑らかに。ゲル溶液が〜10分間室温で重合することができます。
- 重合の完了は、マイクロ遠心チューブに反転残存勤務ソリューションによって評価することができる。また、重合のゲルは、離れてカバースリップの端から引っ張ることができる。巨視的な重合が観察された直後に、スライドガラス、カバースリップを分離。ピンセットやカミソリの刃のエッジの細かいチップを用いて、慎重に水分補給を維持するために、のddH 2 Oの顕微鏡スライドの表面と浸すゲルから、ゲル添付して、カバースリップを削除します。
3。 PAAゲルに細胞外マトリックス(ECM)タンパク質をカップリング
三つの別々のメソッドは、(3.3)ゲルのボリューム内のいずれかのPAAゲル(3.1および3.2)または組み込んだECMタンパク質の上面にECMタンパク質を接続するのに使用できます。ここで、我々は1時間10μg/ mLのフィブロネクチンのソリューションとのインキュベーション後にガラス上に吸着量に相当する表面のリガンド密度をもたらすためにPAAゲルにフィブロネクチンの結合を議論する。方法を選択するための考慮事項は、議論に記載されています。
- 共有結合ヘテロ架橋剤スルホ- SANPAHでPAAゲルの表面に付着しているタンパク質でスルホ- SANPAH反応性アミンによってPAAゲル表面へのECMタンパク質を架橋
- Sを溶解することによりスルホ- SANPAHの40μlの作業アリコートを準備無水ジメチルスルホキシド(DMSO)(スルホ- SANPAH mg当たり20μlの)でulfo - SANPAHはパウダー。 -80℃で液体窒素とストア内のフラッシュの凍結貯蔵° C、後で使用するために。
- カバースリップスピナー(<2秒)を用いてゲルの表面からのddH 2 Oを削除します。ゲルを乾燥は避けてください。
- すぐに使用し、コートゲル表面(〜200μl)を前のddH 2 O(2mg/ml、pH7)にスルホ- SANPAH - DMSOのアリコートを希釈する。スルホ- SANPAHの反応の半減期は、水で室温(〜5分)短くなることに注意してください。従って、これらの手順は、急速なペースで行われる必要があります。
- UVクロスリンカーオーブン(1.5分間2-3インチの距離で8W、254nmの波長)の紫外線にゲル面を公開。スルホ- SANPAHはオレンジ色から茶色まで色が変化します。
- ディップUV処理された新鮮なのddH 2 Oとビーカーでカバースリップとは、カバースリップスピナーを(<2秒)を用いてゲルの表面から余分な水分を取り除く。
- ピペット〜ペトリ皿の容器にパラフィルム上に冷たい1mg/mlのフィブロネクチン(FN)(PBS、pH7.4中)の50μL。 FNのドロップ、FNにさらされるゲルの側面の上にカバースリップを反転。
- 1〜2時間または4℃で一晩室温で反応する。
- PBSを(pH7.4)を含む6 cmの組織培養皿に置き、カバースリップは、十分な組織培養フードに無菌条件下で、カバースリップをカバーする。
- 無菌条件下で、PBSの数回の洗浄(3-5)(pH7.4)で広範囲に洗ってください。
- 30分間組織培養フードの殺菌灯を使用してカバーグラスを滅菌する。
- プレーティング前の細胞に30〜45分のための細胞培地にカバースリップをインキュベートする。
- タンパク質のヒドラジン水和物の炭水化物のグループによってPAAゲル表面にECMを架橋酸化及びヒドラジン水和物を使用してゲルに結合されている。
- として第2節で説明されているポリアクリルアミドゲルを準備します。
- ドラフト内でプラスチックシャーレ内の場所PAAゲルのカバースリップをし、手袋を使用して、少なくとも2時間ごとにPAAゲルとインキュベートの表面に原液ヒドラジン水和物の約1 mlをピペットではありませんが、24時間よりもはや
- ペトリ皿にのddH 2 Oを追加し、ヒドラジン水和物溶液を除去し、有害廃棄物として処分する。
- カバースリップを浸すためにシャーレに5%酢酸を追加。カバーと一時間インキュベートします。
- 酢酸を取り除くとのddH 2 Oで洗浄一時間のddH 2 Oでインキュベートする。カバースリップは、現在活性化し、クロスリンクフィブロネクチン(FN)を酸化する準備がされています。
- 10μg/ mlの終濃度を作り、暗いマイクロ遠心チューブに50 mM酢酸ナトリウム緩衝液(pH4.5)の940μlの1 mg / mLのFNの溶液10μlを希釈する。
- 50 mM酢酸ナトリウム緩衝液(pH4.5)1ml中にナトリウムメタ過ヨウ80mgを追加することにより、20Xナトリウムメタ過ヨウの株式を行います。
- 3.2.6で調製されたFNのソリューションに20X酸ナトリウムメタ過ヨウ株式の50μl加えて、そのようなその最終的な作業濃度は10μg/ mlのFNと4μg/ mlのナトリウムメタ過ヨウです。室温で30分間暗所管内でインキュベートする。
- カバースリップスピナー(<2秒)を使用して、3.2.5で調製した活性化ゲルの表面から過剰のddH 2 Oを削除します。ゲルを乾燥は避けてください。
- ピペットで〜室温で1時間、活性化ゲルの表面とインキュベートへFN溶液500μl。
- PBSを含む皿の場所のカバースリップ(pH7.4)に、十分にカバースリップをカバーする。
- PBSのいくつかの洗浄(3-5)(pH7.4)で広範囲に洗ってください。
- 30分間組織培養フードの殺菌灯を使用してカバーグラスを滅菌する。
- プレーティング前の細胞に30〜45分のための細胞培地にカバースリップをインキュベートする。
- アクリロイル- X、スクシンイミジルエステルによるPAAゲルのECM蛋白質のバルク接合は、このプロトコルは、2.5より前に行われます。タンパク質上の反応性アミンは、NHSエステル化学とアクリルアミドのモノマーに結合し、PAAゲルのバルク中に共重合されています。
- メーカーの指示に従ってアクリロイル- Xへの選択肢の共役ECMタンパク質。共役タンパク質のストック溶液は4℃で保存してください。
- ゲル加工(カバースリップあたり例えば10 UL)のために必要なPAAワーキング溶液の体積を計算する。
- 表1にワーキングソリューションのレシピに記載されている量から水50μL(例えば10%の体積)を減算し、重合を開始する。
- 3.3.2で計算されたボリュームを削除し、10%の容積にECM /アクリロイル- Xソリューションを追加します。 (例:PAA溶液を9μLにECM /アクリロイル- Xの1μL)。このステップは、ゲルが重合されると、急速に実行する必要があります。
- 完全なステップ2.6および2.7は、前述のように。
- 無菌条件下で、PBSの数回の洗浄(3-5)(pH7.4)で広範囲に洗ってください。
- 30分間組織培養フードの殺菌灯を使用してカバーグラスを滅菌する。
- プレーティング前の細胞に30〜45分のための細胞培地にカバースリップをインキュベートする。
細胞はECMでコーティングされたゲル基材(〜6-12時間)に広めるために許可された後にこれらのステップは実施しています。共焦点イメージング室(RC - 30WA)を組み立てるために、それは指導のためのワーナーインスツルメンツのWebサイトを参照すると便利です。
- 温かい細胞培地と0.5%または0.25%の5ミリリットルまたは10mlのシリンジにトリプシンと負荷。
- 場所にカバースリップを保つために真空グリースを使用して、ワーナーインスツルメンツ共焦点イメージング室(RC - 30WA)のトップカバースリップホルダーに22x30mmカバースリップをロードします。
- 入口と出口のポリエチレンチューブの両方へのアクセスを許可する、カバースリップの上にゴム製のガスケットを形成するチャンバーを配置。これは、使用されるガスケットのサイズに応じて、トップカバーとジェルでコーティングされた22x40mmカバーの間に150から1000ミクロンの間隔をできるようになります。
- コネクタキットを経由して、インレットチューブに注射器をロードし、メディアがチューブを通ってトップカバースリップ上に流れる気泡が流線に明らかにないことを確認してください。
- 上室と負荷ゲルでコーティング22x40mmカバースリップ、細胞側のベースの上に真空グリースを塗布してください。細胞に暖かいメディアを適用します。
- チャンバーガスケットがゲルでコーティングされたカバースリップからそれを分離するとチャンバーベース上にプレーストップカバースリップホルダー、。チャンバーベース内の位置決めピンがトップカバースリップの位置決め穴の中で座っていることを確認してください。
- チャンバーベースにプレッシャープレートを適用するとのネジとプレッシャープレートを固定するためにプレッシャープレートのレンチを使用してください。
- チャンバー内の任意の潜在的なリークを監視するためのチューブとチャンバーを介してメディアの流れをチェックし、細胞表面上の任意のメディアフリーゾーンを排除する。注:メディアを注入しながらわずかな真空を描画するための小さなゲージの針を使用して、メディアフリーゾーンを排除できます。
- イメージングのための顕微鏡のホルダー内に位置するステージアダプタに共焦点イメージングチャンバーを適用します。
- 画像蛍光標識タンパク質と共焦点蛍光顕微鏡を用いたゲル基板内に埋め込まれた蛍光ビーズ。
- ゲル内の無歪みビーズの位置の画像を取得するには、ゲルから細胞の癒着を切断するトリプシンを灌流し、細胞が付着した同じイメージング分野での蛍光ビーズの像を取る。緊張と無歪みビーズの位置を比較すると、収縮の下でゲルの基板の変位の定量化が可能になります。
代表的な結果:
上記のプロトコルは、細胞収縮性を研究するために準拠したPAAゲルを製造するための実験手順を説明し、図1に図示されています。このプロトコルで得られたゲルの表面は全体に均等に埋め込まれた蛍光ビーズ(図2A)と、比較的平らでスムーズです。
接着斑の位置でゲルの収縮を測定する場合、セル(図3A)とゲルの表面(図3B)のイメージングは、接着斑の共焦点光学面で行われる必要があります。細胞は(和らいだ)付着(歪み)対デタッチされたときにゲルの収縮は、ゲル表面に埋め込まれた蛍光ビーズの変位(図3B)によって可視化することができる。計算アルゴリズムの使用は、ゲルのビーズの変位と対応する弾性率(図3Cおよび3D)(Sabass ら 、2008)に関連付けられている牽引ストレスをもたらすことができる。イメージングは、ゲル内の深い場所を取る場合、ビーズの変位は、接着斑で加わる牽引力の代表小さくなるとしません。
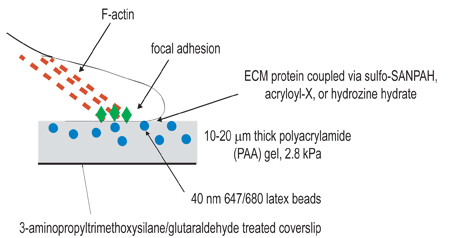
図1実験装置の模式図。この手順の全体的な目標は、細胞の収縮を研究の目的のために準拠した行列を作成することです。実験手順の最初のステップは、重合したゲルを固定する目的でamino-silane/glutaraldehydeの治療によってカバースリップをアクティブにすることです。第二段階は、活性化カバースリップの上に、蛍光ビーズを含む、ポリアクリルアミドゲルを重合させることです。第三段階は、化学物質を含む架橋ステップ3で示した3つのカップリング技術のいずれかを使用して、ポリアクリルアミドゲルの表面に細胞外リガンドの。次いで、細胞をゲル上に播種し、付着して広がって許可されています。アクティブな細胞収縮の下に、ゲルに埋め込まれたビーズが変位する。

図2。PAAゲルの上面の光共焦点スライスは、として(A.)蛍光40nmのゲル内に埋め込 まれたビーズと(B.)フィブロネクチンの免疫蛍光により可視化。

図3。牽引力の実験の代表的な結果。 (A.)ヒト骨肉腫U2OS細胞の接着斑はmです。GFP -パキシリンとひずみ(緑)と無歪み(赤)の状態で接着斑の基礎となるPAAゲルに埋め込まれた蛍光ビーズの(B.)の位置によってarked。矢印は、ビーズの変位の例を示している。トラクションの(℃)トラクションストレスベクトルと(D.)、対応する熱規模なマップでは、(Sabass ら 、2008)計算アルゴリズムを用いて、ゲルの収縮から派生したと強調。スケールバー= 5ミクロン。
表1:
例えばストックとPAAソリューションをワーキングは(表1のデータ第一Yeungさんらから入手。と独立して我々の研究室で確認された。)
| 株式PAAソリューション | ||||
| PAAゲルのずり弾性率(Pa)の | 230 | 2833 | 8640 | 16344 |
| 40%アクリルアミド(ML) | 1.25 | 3.12 | 2.34 | 2.50 |
| 2%ビスアクリルアミド(ML) | 0.50 | 0.83 | 1.88 | 0.60 |
| 水(mL)を | 3.25 | 1.04 | 0.78 | 1。 90 |
| 総体積(ml): | 5 | 5 | 5 | 5 |
| ワーキングPAAソリューション | ||||
| ストック溶液は(Pa)を使用 | 230 | 2833 | 8640 | 16344 |
| ストック溶液の量(μL) | 150 | 150 | 200 | 300 |
| 水(μL) | 341.75 | 341.75 | 291.75 | 191.75 |
| ビーズ(μL) | 5 | 5 | 5 | 5 |
| TEMED(μL) | 0.75 | 0.75 | 0.75 | 0.75 |
| 10%APS(μL) | 2.5 | 2.5 | 2.5 | 2.5 |
| 合計量(μL): | 500 | 500 | 500 | 500 |
| 最後のアクリルアミドの% | 3 | 7.5 | 7.5 | 12 |
| 最終的なビスアクリルアミド% | 0.06 | 0.1 | 0.3 | 0.15 |
表2:
様々な最終アクリルアミドとビスアクリルアミドの割合のPAA基板のせん断弾性係数
| 12%アクリルアミド | 7.5%アクリルアミド | |||
| %ビスアクリルアミド | せん断弾性率(Pa)の | %ビスアクリルアミド | せん断弾性率(Pa)の | |
| 0.145 | 16344 | 0.01 | 689 | |
| 0.28 | 30067 | 0.03 | 1535 | |
| 0.45 | 34263 | 0.05 | 2286 | |
| 0.55 | 42375 | 0.075 | 2833 | |
| 0.575 | 50873 | 0.1 | 4069 | |
| 0.6 | 55293 | 0.2 | 5356 | |
| 0.3 | 8640 | |||
| 5%のアクリルアミド | 3%のアクリルアミド | |||
| %ビスアクリルアミド | せん断弾性率(Pa)の | %ビスアクリルアミド | せん断弾性率(Pa)の | |
| 0.05 | 430 | 0.02 | 1.3 | |
| 0.075 | 600 | 0.04 | 54 | |
| 0.1 | 1431 | |||
ディスカッション
手順は、計算追跡ルーチン(Sabass ら 、2008)の実装と共に、トラクション力顕微鏡(TFM)の実験のセットアップのためにここで説明する、ミクロンスケールの空間分解能での細胞の力の定量化が可能になります。実験的なプロトコルを最適化するために、それはECMの配位子の均一なコーティングで、純粋で均一なゲル基材を形成することが重要です。我々は、以下の潜在的な落とし穴?...
開示事項
謝辞
我々は、細胞牽引力の定量化(Sabass ら 、2008)で使用されている計算ソフトウェアを追跡するためのウルリッヒシュワルツの研究室に感謝。この作業は、SPの冬にMLガルデルとメディカルサイエンティストナショナルリサーチサービス賞(5 T32 GM07281)にバローズウェルカムのキャリア賞とNIH Directorのパイオニア賞(DP10D00354)によってサポートされていました。
資料
| Name | Company | Catalog Number | Comments |
| 3-aminopropyltrimethyoxysilane | Aldrich | 28, 177-8 | |
| 40% Acrylamide | Bio-Rad | 161-0140 | |
| 2% Bis-acrylamide | Fisher Scientific | BP1404 | |
| TEMED | Fisher Scientific | BP 150-20 | |
| Ammonium persulfate | Fisher Scientific | BP179 | |
| 40nm fluorescent micro-spheres | Invitrogen | F8789 | |
| Sulfo-SANPAH | Pierce, Thermo Scientific | 22589 | |
| Confocal imaging chamber (RC-30) | Warner Instruments | 64-0320 | |
| Coverslip spinner | Home made | NA | |
| Ultraviolet lamp CL1000 | UVP Inc. | 95-0228-01 | |
| Stainless steel rack | Electron Microscopy Sciences | 72239-04 | |
| acryloyl-X, SE (6-((acryloyl)amino)hexanoic acid) | Invitrogen | A-20770 | |
| Hydrazine hydrate | Sigma-Aldrich | 225819 | |
| Sodium meta-periodate | Thermo Fisher Scientific, Inc. | 20504 | |
| Isopropanol | Fisher Scientific | A416-4 | |
| Fibronectin | Sigma-Aldrich | F2006 | |
| Collagen | BD Biosciences | 354236 | |
| Coverslips (#1.5) | Corning | 2940‐224 | |
| Glutaraldehyde | Electron Microscopy Sciences | 16120 | |
| Rain-X | SOPUS Products | www.rainx.com | |
| Acetic Acid | Acros Organics | 64-19-7 |
参考文献
- Damljanovic, V., Lajerholm, B. C., Jacobson, K. Bulk and micropatterned conjugation of extracellular matrix proteins to characterized polyacrylamid substrates for cell mechanotransduction assays. Biotechniques. 39 (6), 847-851 (2005).
- Engler, A., Bacakova, L. N. e. w. m. a. n., Hategan, C., Griffin, A., M, D. D. i. s. c. h. e. r. Substrate compliance versus ligand in cell on gel responses. Biophys J. 86 ((1 Pt 1)), 617-628 (2004).
- Gardel, M. L., Sabass, B., Ji, L., Danuser, G., Schwarz, U. S., Waterman, C. M. Traction stress in focal adhesions correlates biphasically with actin retrograde flow speed. J Cell Biol. 183, 999-1005 (2008).
- Rajagopalan, P., Marganski, W. A., Brown, X. Q., Wong, J. Y. Direct comparison of the spread area, contractility, and migration of balb/c 3T3 fibroblasts adhered to fibronectin- and RGD-modified substrata. Biophys J. 87 (4), 2818-2827 (2004).
- Reinhart-King, C. A., Dembo, M., Hammer, D. A. The dynamics and mechanics of endothelial cell spreading. Biophys J. 89, 676-689 (2005).
- Stricker, J., Sabass, B., Schwarz, U. S., Gardel, M. L. Optimization of traction force microscopy for micron-sized focal adhesions. J. Phys: Condensed Matter. 22, 194104-194114 (2010).
- Sabass, B., Gardel, M. L., Waterman, C. M., Schwarz, U. S. High resolution traction force microscopy based on experimental and computational advances. Biophys J. 94, 207-220 (2008).
- Yeung, T. Effects of substrate stiffness on cell morphology, cytoskeletal structure, and adhesion. Cell Motil Cytoskeleton. 60 (1), 24-34 (2005).
- Waterman-Storer, C. M. Microtubule/organelle motility assays. Curr Protoc Cell Biol. , 13.1.1-13.1.21 (1998).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved