Zum Anzeigen dieser Inhalte ist ein JoVE-Abonnement erforderlich. Melden Sie sich an oder starten Sie Ihre kostenlose Testversion.
Method Article
Vorbereitung der Beschwerde Matrizen zur Quantifizierung von Cellular Kontraktion
In diesem Artikel
Zusammenfassung
In diesem Video zeigen wir die experimentelle Techniken verwendet, um konform, extrazellulären Matrix (ECM) beschichtete Substrate für Zellkulturen herzustellen, und die durchaus in Zugkraft Mikroskopie und Beobachten Auswirkungen der ECM Steifigkeit auf das Verhalten der Zelle.
Zusammenfassung
Die Regulation der zellulären Adhäsion an die extrazelluläre Matrix (ECM) ist von wesentlicher Bedeutung für die Zell-Migration und ECM Umbau. Fokalen Adhäsionen sind makromolekulare Baugruppen, die Kopplung der kontraktilen F-Aktin-Zytoskelett der ECM. Diese Verbindung ermöglicht die Übertragung von intrazellulären mechanischen Kräfte durch die Zellmembran mit dem darunterliegenden Substrat. Neuere Arbeiten haben gezeigt, die mechanischen Eigenschaften der ECM regulieren fokale Adhäsion und F-Aktin-Morphologie sowie zahlreiche physiologische Prozesse, einschließlich der Zelldifferenzierung, Division, Proliferation und Migration. So hat der Einsatz von Zellkultursubstraten zu einem immer vorherrschende Methode zur präzisen Steuerung und modulieren ECM mechanischen Eigenschaften.
Zur Quantifizierung Zugkräfte an fokalen Adhäsionen in einer adhärenten Zelle, entsprechen Substraten in Verbindung mit hochauflösenden Bildgebung und rechnergestützte Techniken in einem Verfahren genannt Traction Force Mikroskopie (TFM) verwendet. Diese Technik beruht auf Messungen der lokalen Größe und Richtung der Substrat Verformungen durch zelluläre Kontraktion induziert. In Kombination mit hochauflösenden Fluoreszenzmikroskopie von fluoreszenzmarkierten Proteinen ist es möglich, Zytoskelett-Organisation und Umbau mit Zugkräften zu korrelieren.
Hier präsentieren wir Ihnen ein ausführliches Versuchsprotokoll für die Herstellung von zweidimensionalen, konforme Matrizen für die Zwecke der Schaffung einer Zellkultur Substrat mit einem gut charakterisierten, abstimmbaren mechanische Steifigkeit, die für die Messung zellulärer Kontraktion ist. Diese Protokolle umfassen die Herstellung von Polyacrylamid-Hydrogele, Beschichtung von ECM-Proteine auf solche Gele, Plattieren Zellen auf Gele und hochauflösenden konfokalen Mikroskopie mit einem Perfusionskammer. Darüber hinaus bieten wir eine repräsentative Stichprobe von Daten, die zeigen Lage und das Ausmaß der zellulären Kräfte mit angeführt TFM-Protokolle.
Protokoll
1. Die Aktivierung der Oberfläche Deckglas
- Deckgläser (# 1.5, 22x40 mm) gereinigt werden mit einer Reihe von Seife und Ethanol wäscht in einem zuvor beschriebenen Protokoll (Waterman-Storer, 1998) zu reinigen und zu entstauben.
- Legen Sie Deckgläser in einer Edelstahl-Halterung Rack, sind derart, dass Deckgläser beabstandet und berühren sich nicht.
- In Laborabzug (Nitril-Handschuhe und Schutzbrille empfohlen), verdünnte voller Stärke 3-aminopropyltrimethoxysilan in Isopropanol zu einer Endkonzentration von 2% (2 ml Silan / 100 ml Isopropanol) zu einem Quadrat Glasschale (~ 350ml Volumen) füllen. Aufgrund Reaktivität mit Kunststoff, mit einem Glas Pasteur Pipette 3-Aminopropyltrimethoxysilan gelten für die Isopropanol.
- Voll eintauchen Deckgläser von 1,2 in diese Lösung für 10 min unter leichtem Rühren auf einer Rührplatte im Abzug.
- Wash Deckgläser durch Eintauchen in ddH 2 O (4 Austausch von Wasser). Lassen Sie 10 min Einwirkzeit für die endgültige Austausch unter Rühren. Amino-Silan-haltigen Lösungen sollte als Sondermüll entsorgt werden.
- Dry Deckgläser in Brutschrank bei warmen Temperaturen (~ 37 ° C) für 10 Minuten in einer staubfreien Umgebung.
- Auf Raumtemperatur abkühlen.
- In der Abzugshaube, rühren tauchen Deckgläser in 1% Glutaraldehyd-Lösung in ddH 2 O in einem Glas Quadrat Gericht auf Platte für 30 Minuten.
- Wash von 3 Austausch von ddH 2 O für 10 Minuten pro Austausch unter Rühren. Entsorgen von Glutaraldehyd als gefährlicher Abfall.
- Trocken bei Raumtemperatur, Abdecken mit Alufolie, um Staub vom Kleben an den Deckgläschen zu vermeiden.
- An einem trockenen Ort, geschützt vor Staub, für bis zu 2 Monaten.
2. Vorbereitung von Polyacrylamid (PAA)-Gel
- Stammlösungen von Acrylamid / Bisacrylamid-Mix aus 40% Acrylamid und 2% Bisacrylamid, folgende Tabelle 1. Wir unterhalten mehrere Lager-Lösungen, die für die PAA-Gele unterschiedlicher Steifigkeit optimiert werden; Beispiele sind in Tabelle 1 und 2 aufgeführt. Stammlösungen kann für mehrere Jahre aufbewahrt werden, solange sie in einem abgedunkelten Flasche bei 4 C gehalten
- Working-Lösungen mit den endgültigen gewünschten Konzentrationen von Acrylamid / Bisacrylamid sind ab Lager Lösungen erhalten. Zum Beispiel bereiten wir eine funktionierende Lösung von 7,5% acrylamide/0.10% Bisacrylamid in ddH 2 O für die Herstellung 2.8kPa PAA-Gelen.
- Degas Acrylamid-Lösung in einer Vakuumkammer für 20 min, um Sauerstoff in die Lösung, die PAA Polymerisation verhindert zu reduzieren.
- Bereiten Sie 10% Ammoniumpersulfat (APS)-Lösung (0.5g/5mL). Verwenden Sie frische arbeiten lieferbar innerhalb von 3 Tagen. Alternativ können Aktien eingefroren werden, um zu späteren Zeitpunkten verwendet werden.
- Während Acrylamid Entgasung, wischen einem 1x3 "Mikroskop Objektträger aus Glas mit Regen-X wischt energisch auf Objektträger aus Glas Oberfläche hydrophob zu machen. Um überschüssige Regen-X zu entfernen, wischen Glasträger mit feuchten Kimwipe. Set Glasträger beiseite, abgedeckt.
- Entfernen Acrylamid-Lösung aus der Vakuumkammer und fügen fluoreszierende Kügelchen (1 Vol-%, 5 ul für die funktionierende Lösung in Tabelle 1 aufgeführt). Add 0.75μl TEMED und 2,5 ul 10% APS, die Gel-Polymerisation zu initiieren wird. Gut mischen durch Pipettieren für ~ 5 sec, um die Einführung von Blasen zu minimieren,
- Bewerben 10-12 ul des Acrylamid-Lösung von hydrophoben Objektträger (hergestellt in Schritt 2,4) und Platz aktiviert 22x40mm Deckglas auf der Oberseite des Tropfens. Gel-Lösung sollte Mantel gesamte Deckglas. Glätten Sie alle Blasen, die in der Lösung enthalten sein können. Lassen Sie das Gel-Lösung bei Raumtemperatur für ~ 10 min polymerisieren.
- Der Abschluss der Polymerisation kann durch Umdrehen verbleibende Lösung in Mikrozentrifugenröhrchen beurteilt werden. Auch kann der polymerisierten Gel entfernt Deckglas Kanten ziehen. Unmittelbar nach dem makroskopischen Polymerisation beobachtet wird, trennen Sie die Deckglas vom Objektträger aus Glas. Mit der feinen Spitze einer Pinzette oder einer Rasierklinge Rand, entfernen Sie vorsichtig Deckglas, mit Gel angebracht, von Objektträger Oberfläche und tauchen Gel in ddH 2 O, um die Hydrierung zu erhalten.
3. Coupling extrazellulären Matrix (ECM)-Proteine an die PAA-Gel
Drei verschiedene Methoden verwendet, um ECM-Protein entweder Wert auf die Oberseite des PAA-Gel (3,1 und 3,2) oder die Aufnahme ECM-Protein im Gel Volumen (3,3) werden. Hier diskutieren wir die Kopplung von Fibronectin zu PAA-Gele in einer Oberfläche Ligandendichte das entspricht der Menge an Glas nach Inkubation adsorbiert mit 10 pg / mL Fibronektin-Lösung für 1 Stunde ist das Ergebnis. Überlegungen für die Wahl einer Methode sind in der Diskussion erläutert.
- Die Vernetzung ECM-Protein auf PAA-Gel Oberfläche durch Sulfo-SANPAH reaktiven Amine auf Proteine kovalent an die PAA-Gel Oberfläche durch die hetero-Cross-Linker Sulfo-SANPAH befestigt
- Bereiten Sie 40 ul arbeiten Aliquots von Sulfo-SANPAH durch Auflösen von S ulfo-SANPAH Pulver in wasserfreiem Dimethylsulfoxid (DMSO) (20 ul pro mg Sulfo-SANPAH). Flash-Freeze Aktien in flüssigem Stickstoff eingefroren und bei -80 ° C für eine spätere Verwendung.
- Entfernen ddH 2 O aus Gel Oberfläche mit einem Deckglas spinner (<2 Sek.). Vermeiden Sie das Trocknen des Gels.
- Verdünnen Sulfo-SANPAH-DMSO-Aliquots in ddH 2 O (2mg/ml, pH 7) unmittelbar vor dem Gebrauch und Fell Geloberfläche (~ 200 ul). Beachten Sie, dass die Reaktivität Halbwertszeit von Sulfo-SANPAH kurz ist (~ 5 min) bei Raumtemperatur in Wasser, daher diese Schritte sollten in einem rasanten Tempo durchgeführt werden.
- Expose Geloberfläche mit UV-Licht in einem UV-Crosslinker Backofen (8W, 254 nm Wellenlänge, bei einem Abstand von 2-3 cm für 1,5 min). Sulfo-SANPAH wird in der Farbe von orange bis braun wechseln.
- Dip UV-behandelten Deckgläschen in ein Becherglas mit frischem ddH 2 O, und entfernen Sie überschüssiges Wasser aus Gel-Oberfläche mit einem Deckglas spinner (<2 Sek.).
- Pipette ~ 50 ul kalten 1mg/ml Fibronektin (FN) (in PBS, pH 7,4) auf Parafilm in Petrischale Container. Invert Deckglas auf der FN fallen, ausgesetzt Gelseite zu FN.
- Reagieren bei Raumtemperatur für 1-2 Stunden oder bei 4 ° C über Nacht.
- Legen Sie Deckgläser in 6 cm Gewebekulturschalen mit PBS (pH 7,4), reicht zur Deckung Deckglas, unter sterilen Bedingungen in Zellkultur Kapuze.
- Wash ausführlich mit mehreren Wäschen (3-5) von PBS (pH 7,4), unter sterilen Bedingungen.
- Sterilisieren der Deckgläser durch die Verwendung von Entkeimungslampe in Gewebekultur Haube für 30 min.
- Inkubieren Deckgläser in Zelle Medien für 30-45 min vor dem Beschichten Zellen.
- Die Vernetzung ECM der PAA-Gel Oberfläche von Hydrazinhydrat Kohlenhydrate Gruppen auf Proteinen oxidiert werden und mit dem Gel unter Verwendung von Hydrazinhydrat.
- Bereiten Polyacrylamidgelen, wie in Abschnitt 2 beschrieben.
- Legen Sie PAA-Gel Deckgläser in Kunststoff-Petrischale in einem Abzug und mit Handschuhen Pipette ca. 1 ml der unverdünnten Hydrazinhydrat auf die Oberfläche eines jeden PAA-Gel und Inkubation für mindestens zwei Stunden, aber nicht länger als 24 Stunden
- Add ddH 2 O auf die Petrischale entfernen Hydrazinhydrat-Lösung und als gefährlicher Abfall zu entsorgen.
- Add 5% Essigsäure auf die Petrischale auf Deckglas einzutauchen. Cover und inkubieren für eine Stunde.
- Entfernen Sie die Essigsäure und wäscht mit ddH 2 O. Inkubieren in ddH 2 O für eine Stunde. Die Deckgläser sind nun aktiviert und bereit zu vernetzen Fibronektin (FN) oxidiert.
- Verdünnen Sie 10 ul 1 mg / ml FN-Lösung in 940 ul 50 mM Natriumacetat-Puffer (pH 4,5) in einem dunklen Mikro-Zentrifugenröhrchen, so dass eine Endkonzentration von 10 ug / ml.
- Machen Bestand von 20X Natrium-meta-Perjodat durch Zugabe von 80 mg Natrium-meta-Perjodat zu 1 ml 50 mM Natriumacetat-Puffer (pH 4,5).
- Add 50 ul 20fach Natrium-meta-Perjodat Lager an die FN-Lösung in 3.2.6 vorbereitet, so dass endgültige Arbeitskonzentration 10 pg / ml FN und 4 pg / ml Natrium-meta-Perjodat. Inkubieren im Dunkeln Röhrchen bei Raumtemperatur für 30 Minuten.
- Entfernen Sie überschüssiges ddH 2 O aus aktivierten Gel-Oberfläche in 3.2.5 unter Verwendung eines Deckglases spinner (<2 Sek.). Vermeiden Sie das Trocknen des Gels.
- Pipet ~ 500 ul der FN-Lösung auf aktivierte Gel-Oberfläche und Inkubation für 1 Stunde bei Raumtemperatur.
- Legen Sie Deckgläser in Schalen mit PBS (pH 7,4), genug, um Deckglas abdecken.
- Wash ausführlich mit mehreren Wäschen (3-5) von PBS (pH 7,4).
- Sterilisieren der Deckgläser durch die Verwendung von Entkeimungslampe in Gewebekultur Haube für 30 min.
- Inkubieren Deckgläser in Zelle Medien für 30-45 min vor dem Beschichten Zellen.
- Bulk-Konjugation von ECM-Protein in PAA-Gel durch Acryloyl-X, Succinimidylester Dieses Protokoll wird vor 2.5 getan. Reaktiven Amine auf Proteine sind eine Acrylamidmonomer mit NHS-Ester-Chemie gekoppelt und dann in den Hauptteil der PAA-Gel co-polymerisiert.
- Konjugat ECM-Protein der Wahl, um Acryloyl-X pro Anweisungen des Herstellers. Stammlösungen von konjugierten Protein bei 4 ° C gelagert werden
- Berechnen Sie das Volumen des PAA funktionierende Lösung für Gel-Herstellung (z. B. 10 uL pro Deckglas) erforderlich.
- Subtrahieren 50 ul (zB 10% Volumen) von Wasser aus Menge in der Arbeitslösung Rezept in Tabelle 1 aufgelistet und die Polymerisation.
- Entfernen Sie Volumen in 3.3.2 berechnet und fügen ECM / Acryloyl-X-Lösung zu 10% Volumen. (Z. B. 1 ul ECM / Acryloyl-X 9 ul PAA-Lösung). Dieser Schritt sollte zügig durchgeführt werden, wie Gel polymerisiert.
- Führen Sie die Schritte 2,6 und 2,7, wie vorher beschrieben.
- Wash ausführlich mit mehreren Wäschen (3-5) von PBS (pH 7,4), unter sterilen Bedingungen.
- Sterilisieren der Deckgläser durch die Verwendung von Entkeimungslampe in Gewebekultur Haube für 30 min.
- Inkubieren Deckgläser in Zelle Medien für 30-45 min vor dem Beschichten Zellen.
Diese Schritte werden durchgeführt, nachdem die Zellen haben es bereits auf ECM-beschichteten Substrat-Gel (~ 6-12 Uhr) zu verbreiten. Zur Montage der konfokalen Imaging-Kammer (RC-30WA), ist es sinnvoll, die Warner Instruments Website zu Rate ziehen.
- Warm Zelle Medien-und 0,5% oder 0,25% Trypsin und laden zu einem 5ml oder 10ml Spritze.
- Laden Sie ein 22x30mm Deckglas auf die Top Deckglas Inhaber eines Warner Instruments konfokalen Imaging-Kammer (RC-30WA) mit Vakuum-Fett auf das Deckglas in Position zu halten.
- Legen Sie eine Kammer bilden, Gummidichtung auf der Oberseite des Deckglases, wodurch der Zugriff auf Ein-und Austritt PE-Rohre. Damit können in einem Abstand von 150-1000 um zwischen dem oberen Deckglas und der Gel-beschichteten 22x40mm Deckglas, abhängig von der Größe der Dichtung verwendet.
- Laden Spritzen auf Zulaufschlauch über Anschluss-Kit, und überprüfen Sie, dass Medien durch Schläuche und auf Top Deckglas fließt und keine Blasen in den Stromlinien sichtbar.
- Bewerben Vakuumfett auf Basis der Kammer-und Last-Gel-beschichteten 22x40mm Deckglas, Zell-Seite nach oben. Bewerben warme Medien Zellen.
- Legen Sie Top Deckglas den Halter an die Kammer Basis, mit Kammer Dichtung trennt sie vom Gel-beschichteten Deckglas. Stellen Sie sicher, dass die Zentrierstifte in der Kammer Basis innerhalb der Aufnahmebohrungen in den Top Deckglas sitzen.
- Übernehmen Sie die Druckplatte in die Kammer Basis und die Druckplatte Schraubenschlüssel die Schraube in und sichern Sie die Druckplatte.
- Überprüfen Sie den Fluss der Medien durch den Schlauch und Kammer, um mögliche Leckagen innerhalb der Kammer zu überprüfen und sämtliche Medien-freie Zonen auf der Zelloberfläche zu beseitigen. Hinweis: mit einem kleinen Nadel, um ein leichtes Vakuum ziehen, während die Infusion mit Medien helfen bei der Vermeidung Medien-freie Zonen.
- Übernehmen Sie die konfokale Bildgebung Kammer auf die Bühne Adapter in einem Mikroskop Halter für die Bildgebung entfernt.
- Bild fluoreszenzmarkierten Protein und fluoreszierende Kügelchen innerhalb des Gels Substrat auf einem konfokalen Fluoreszenzmikroskop eingebettet.
- Um ein Bild des unbelasteten Sicke Positionen innerhalb des Gels, perfuse Trypsin, zelluläre Adhäsionen aus dem Gel zu lösen, und nehmen Sie ein Bild der fluoreszierende Kügelchen in die gleiche Bildfeld, wo die Zelle eingehalten werden. Vergleich von gespannten und ungespannten bead Positionen ermöglicht die Quantifizierung von Gelsubstrat Verschiebung unter Kontraktion.
Repräsentative Ergebnisse:
Das obige Protokoll beschreibt die experimentellen Verfahren zur Herstellung konform PAA-Gele zur Untersuchung von Zell Kontraktilität und ist in Abbildung 1 dargestellt. Die Gel-Oberfläche mit diesem Protokoll erhalten ist relativ flach und glatt, mit fluoreszierenden Beads gleichmäßig eingebettet sind (Abbildung 2A).
Wenn die Messung Gel Kontraktion an der Stelle des fokalen Adhäsionen, die Abbildung der Zelle (Abb. 3a) und Gel-Oberfläche (Abbildung 3B) sollte bei der konfokalen optischen Ebene der fokalen Adhäsionen durchgeführt werden. Die Kontraktion eines Gels kann durch Verschieben der embedded fluoreszierende Kügelchen (Abbildung 3B) visualisiert an der Gel-Oberfläche, wenn die Zellen adhärent (angespannte) versus freistehende (spannungsfreie) sind. Der Einsatz von Computer-Algorithmen können Ertrag Traktion betont mit Sicke Verschiebung und entsprechende Elastizitätsmodul des Gels (Abb. 3C und 3D) (Sabass et al., 2008) verbunden. Wenn Bildgebung erfolgt tiefer in das Gel, dann bead Verschiebungen werden kleiner und nicht repräsentativ für Zugkräfte an fokalen Adhäsionen ausgeübt.
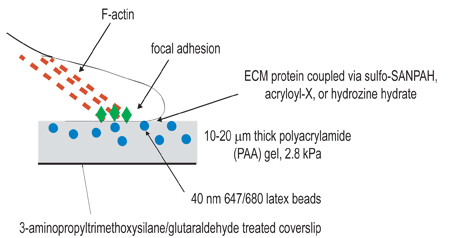
Abbildung 1. Schematische Darstellung des experimentellen Aufbaus. Das übergeordnete Ziel dieses Verfahrens ist es, kompatible Matrizen für die Zwecke des Studiums zellulären Kontraktion zu erzeugen. Der erste Schritt der experimentellen Verfahrens ist es, Deckgläser von amino-silane/glutaraldehyde Behandlung zum Zwecke der Verankerung polymerisierten Gels zu aktivieren. Der zweite Schritt ist, um ein Polyacrylamidgel polymerisieren, enthält fluoreszierende Kügelchen, auf die aktivierte Deckglas. Der dritte Schritt beinhaltet die chemische Vernetzung der extrazellulären Liganden an der Oberfläche der Polyacrylamidgel mit einem der drei Kopplungstechniken in Schritt 3 aufgeführt. Die Zellen werden dann auf das Gel überzogen und erlaubt zu haften und zu verbreiten. Unter aktiven zellulären Kontraktion verdrängen Perlen in das Gel eingebettet.

Abbildung 2. Optical konfokalen Scheibe Oberseite PAA-Gel, wie visualisiert (A.) fluoreszierende 40nm Perlen im Gel eingebettet und (B) Fibronektin Immunfluoreszenz.

Abbildung 3. Repräsentatives Ergebnis für eine Zugkraft Experiment. (A.) fokalen Adhäsionen in einer menschlichen Osteosarkom U2OS Zelle marked von GFP-Paxillin und (B) Positionen der fluoreszierende Kügelchen in die PAA-Gel zugrunde liegenden fokalen Adhäsionen in der angespannten (grün) und ungedehnten (rot) Staaten eingebettet. Die Pfeile zeigen die Beispiele von bead Verschiebung. (C) Traction Spannungsvektoren und (D.) entsprechende Wärme-Karte im Maßstab von Traktion Spannungen aus der Kontraktion des Gels abgeleitet, mit Computer-Algorithmen (Sabass et al., 2008). Balken = 5 um.
Tabelle 1:
Beispiel Lager-und Arbeitsbedingungen PAA-Lösungen (Data in Tabelle 1 wurde erstmals von Yeung et. Al. Und unabhängig in unserem Labor bestätigt werden.)
| Lager PAA-Lösung | ||||
| Schubmodul der PAA-Gel (Pa) | 230 | 2833 | 8640 | 16344 |
| 40% Acrylamid (ml) | 1,25 | 3,12 | 2,34 | 2,50 |
| 2% Bisacrylamid (ml) | 0,50 | 0,83 | 1,88 | 0,60 |
| Wasser (ml) | 3,25 | 1,04 | 0,78 | 1. 90 |
| Gesamtvolumen (ml): | 5 | 5 | 5 | 5 |
| Working PAA-Lösung | ||||
| Stammlösung verwendet (Pa) | 230 | 2833 | 8640 | 16344 |
| Stammlösung Volume (ul) | 150 | 150 | 200 | 300 |
| Water (ul) | 341,75 | 341,75 | 291,75 | 191,75 |
| Perlen (ul) | 5 | 5 | 5 | 5 |
| TEMED (ul) | 0,75 | 0,75 | 0,75 | 0,75 |
| 10% APS (ul) | 2,5 | 2,5 | 2,5 | 2,5 |
| Gesamtvolumen (ul): | 500 | 500 | 500 | 500 |
| Finale Acrylamid% | 3 | 7,5 | 7,5 | 12 |
| Abschließende Bis-Acrylamid% | 0,06 | 0,1 | 0,3 | 0,15 |
Tabelle 2:
Schubmodul der PAA Substrate verschiedener letzten Acrylamid und Bisacrylamid Prozentsätze
| 12% Acrylamid | 7,5% Acrylamid | |||
| % Bis-Acrylamid | Schubmodul (Pa) | % Bis-Acrylamid | Schubmodul (Pa) | |
| 0,145 | 16344 | 0,01 | 689 | |
| 0,28 | 30067 | 0,03 | 1535 | |
| 0,45 | 34263 | 0,05 | 2286 | |
| 0,55 | 42375 | 0,075 | 2833 | |
| 0,575 | 50873 | 0,1 | 4069 | |
| 0,6 | 55293 | 0,2 | 5356 | |
| 0,3 | 8640 | |||
| 5% Acrylamid | 3% Acrylamid | |||
| % Bis-Acrylamid | Schubmodul (Pa) | % Bis-Acrylamid | Schubmodul (Pa) | |
| 0,05 | 430 | 0,02 | 1,3 | |
| 0,075 | 600 | 0,04 | 54 | |
| 0,1 | 1431 | |||
Diskussion
Das hier beschriebene Verfahren für den Aufbau einer Zugkraft-Mikroskopie (TFM) Experiment, zusammen mit der Umsetzung der Computational Tracking-Routinen (Sabass et al., 2008), ermöglicht die Quantifizierung von zellulären Kräfte mit Mikrometer-Skala räumlicher Auflösung. Zur Optimierung der experimentellen Protokoll, ist es entscheidend, eine reine und gleichmäßige Gelsubstrat mit gleichmäßigen Beschichtung von ECM-Liganden zu bilden. Wir diskutieren mögliche Fallstricke unter:
Offenlegungen
Danksagungen
Wir danken dem Labor von Ulrich Schwarz für Computational Tracking-Software in die Quantifizierung von zellulären Zugkräfte (Sabass et al., 2008) verwendet. Diese Arbeit wurde durch ein Burroughs Wellcome Career Award und NIH Director der Pioneer Award (DP10D00354) zu ML Gardel und Medical Scientist National Research Service Award (5 T32 GM07281) auf SP Winter unterstützt.
Materialien
| Name | Company | Catalog Number | Comments |
| 3-aminopropyltrimethyoxysilane | Aldrich | 28, 177-8 | |
| 40% Acrylamide | Bio-Rad | 161-0140 | |
| 2% Bis-acrylamide | Fisher Scientific | BP1404 | |
| TEMED | Fisher Scientific | BP 150-20 | |
| Ammonium persulfate | Fisher Scientific | BP179 | |
| 40nm fluorescent micro-spheres | Invitrogen | F8789 | |
| Sulfo-SANPAH | Pierce, Thermo Scientific | 22589 | |
| Confocal imaging chamber (RC-30) | Warner Instruments | 64-0320 | |
| Coverslip spinner | Home made | NA | |
| Ultraviolet lamp CL1000 | UVP Inc. | 95-0228-01 | |
| Stainless steel rack | Electron Microscopy Sciences | 72239-04 | |
| acryloyl-X, SE (6-((acryloyl)amino)hexanoic acid) | Invitrogen | A-20770 | |
| Hydrazine hydrate | Sigma-Aldrich | 225819 | |
| Sodium meta-periodate | Thermo Fisher Scientific, Inc. | 20504 | |
| Isopropanol | Fisher Scientific | A416-4 | |
| Fibronectin | Sigma-Aldrich | F2006 | |
| Collagen | BD Biosciences | 354236 | |
| Coverslips (#1.5) | Corning | 2940‐224 | |
| Glutaraldehyde | Electron Microscopy Sciences | 16120 | |
| Rain-X | SOPUS Products | www.rainx.com | |
| Acetic Acid | Acros Organics | 64-19-7 |
Referenzen
- Damljanovic, V., Lajerholm, B. C., Jacobson, K. Bulk and micropatterned conjugation of extracellular matrix proteins to characterized polyacrylamid substrates for cell mechanotransduction assays. Biotechniques. 39 (6), 847-851 (2005).
- Engler, A., Bacakova, L. N. e. w. m. a. n., Hategan, C., Griffin, A., M, D. D. i. s. c. h. e. r. Substrate compliance versus ligand in cell on gel responses. Biophys J. 86 ((1 Pt 1)), 617-628 (2004).
- Gardel, M. L., Sabass, B., Ji, L., Danuser, G., Schwarz, U. S., Waterman, C. M. Traction stress in focal adhesions correlates biphasically with actin retrograde flow speed. J Cell Biol. 183, 999-1005 (2008).
- Rajagopalan, P., Marganski, W. A., Brown, X. Q., Wong, J. Y. Direct comparison of the spread area, contractility, and migration of balb/c 3T3 fibroblasts adhered to fibronectin- and RGD-modified substrata. Biophys J. 87 (4), 2818-2827 (2004).
- Reinhart-King, C. A., Dembo, M., Hammer, D. A. The dynamics and mechanics of endothelial cell spreading. Biophys J. 89, 676-689 (2005).
- Stricker, J., Sabass, B., Schwarz, U. S., Gardel, M. L. Optimization of traction force microscopy for micron-sized focal adhesions. J. Phys: Condensed Matter. 22, 194104-194114 (2010).
- Sabass, B., Gardel, M. L., Waterman, C. M., Schwarz, U. S. High resolution traction force microscopy based on experimental and computational advances. Biophys J. 94, 207-220 (2008).
- Yeung, T. Effects of substrate stiffness on cell morphology, cytoskeletal structure, and adhesion. Cell Motil Cytoskeleton. 60 (1), 24-34 (2005).
- Waterman-Storer, C. M. Microtubule/organelle motility assays. Curr Protoc Cell Biol. , 13.1.1-13.1.21 (1998).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten