Un abonnement à JoVE est nécessaire pour voir ce contenu. Connectez-vous ou commencez votre essai gratuit.
Method Article
Préparation des matrices plainte pour quantifier la contraction cellulaire
Dans cet article
Résumé
Dans cette vidéo, nous démontrons les techniques expérimentales utilisées pour fabriquer conforme, la matrice extracellulaire (ECM) substrats recouverts adapté à la culture cellulaire, et qui se prêtent à la microscopie à force de traction et en observant les effets de la rigidité d'ECM sur le comportement cellulaire.
Résumé
La régulation de l'adhésion cellulaire à la matrice extracellulaire (MEC) est essentielle pour la migration cellulaire et remodelage de la MEC. Adhésions focales sont des assemblages macromoléculaires qui couplent les contractiles F-cytosquelette d'actine à l'ECM. Cette connexion permet la transmission de forces mécaniques intracellulaire à travers la membrane cellulaire au substrat sous-jacent. Des travaux récents ont montré les propriétés mécaniques de l'ECM et de réguler adhésion focale F-actine la morphologie ainsi que de nombreux processus physiologiques, y compris la différenciation cellulaire, la division, la prolifération et la migration. Ainsi, l'utilisation de substrats de culture cellulaire est devenu une méthode de plus en plus répandue pour contrôler avec précision et de moduler les propriétés mécaniques d'ECM.
Afin de quantifier les forces de traction au adhésions focales dans une cellule adhérente, substrats compatibles sont utilisés en conjonction avec l'imagerie haute résolution et des techniques de calcul dans une méthode de traction microscopie à force appelée (TFM). Cette technique repose sur des mesures de l'ampleur et la direction locale des déformations induites par la contraction du substrat cellulaire. En combinaison avec haute résolution de la microscopie par fluorescence des protéines par fluorescence marqués, il est possible de corréler l'organisation du cytosquelette et le remodelage des forces de traction.
Nous présentons ici un protocole expérimental détaillé pour la préparation de deux dimensions, les matrices conformes pour le but de créer un substrat de culture cellulaire avec une bien caractérisés, rigidité mécanique accordable, ce qui est convenable pour mesurer la contraction cellulaire. Ces protocoles comprennent la fabrication d'hydrogels de polyacrylamide, le revêtement des protéines de la MEC sur des gels tels, les cellules de placage sur des gels, et à haute résolution microscopie confocale en utilisant une chambre de perfusion. De plus, nous fournissons un échantillon représentatif de données démontrant l'emplacement et l'ampleur des forces cellulaires en utilisant des protocoles cité TFM.
Protocole
1. Activer la surface lamelle
- Lamelles (# 1.5, 22x40 mm) sont nettoyés à l'aide d'une série de lavages au savon et à l'éthanol dans un protocole décrit précédemment (Waterman-Storer, 1998) pour nettoyer et enlever la poussière.
- Placez des lamelles dans un rack support en acier inoxydable, tels que les lamelles sont espacées et ne pas toucher.
- En chimiques hotte (gants en nitrile et des lunettes recommandé), diluer pleine force 3-aminopropyltriméthoxysilane dans l'isopropanol pour une concentration finale de 2% (2 ml de silane / 100 ml d'isopropanol) pour remplir un plat en verre carré (~ 350ml de volume). En raison de la réactivité avec le plastique, utiliser une pipette Pasteur en verre à appliquer 3-aminopropyltriméthoxysilane à l'isopropanol.
- Entièrement lamelles plonger de 1,2 dans cette solution pendant 10 min en agitant doucement sur une plaque d'agitation dans la hotte.
- Lavez lamelles en plongeant dans le trou DDH 2 O (4 échanges d'eau). Laisser tremper 10 min de temps pour l'échange final, avec agitation. Amino-silane solutions contenant doivent être éliminés comme des déchets dangereux.
- Lamelles à sec dans une étuve à température chaude (~ 37 ° C) pendant 10 minutes dans un environnement exempt de poussière.
- Laisser refroidir à température ambiante.
- Dans la hotte, des lamelles de plonger dans une solution de glutaraldéhyde à 1% dans le trou DDH 2 O dans un plat en verre carré sur la plaque remuez pendant 30 minutes.
- Laver par 3 des échanges de ddH 2 O pendant 10 minutes par l'échange, avec agitation. Jeter de glutaraldéhyde comme déchets dangereux.
- Sec à température ambiante, couvrant avec du papier aluminium pour éviter la poussière de coller à la lamelle.
- Conserver dans un endroit sec, loin de la poussière, pour un maximum de 2 mois.
2. Préparation de polyacrylamide (PAA) de gel
- Préparer des solutions étalons d'acrylamide / bis-acrylamide mélange d'acrylamide à 40% et 2% de bis-acrylamide, suivant le tableau 1. Nous maintenons des solutions stock plusieurs qui sont optimisés pour des gels AAP de rigidité différentes, des exemples sont présentés au tableau 1 et 2. Les solutions mères peuvent être conservés pendant plusieurs années, aussi longtemps qu'ils sont maintenus dans une bouteille sombre à 4 ° C.
- Les solutions de travail contenant les concentrations finales désirées d'acrylamide / bis-acrylamide sont obtenus à partir de solutions stock. Par exemple, nous préparons une solution de travail de 7,5% acrylamide/0.10% bis-acrylamide dans le trou DDH 2 O pour faire 2.8kPa gels AAP.
- Solution d'acrylamide Degas dans une chambre à vide pendant 20 minutes, pour réduire l'oxygène dans la solution qui empêche la polymérisation de l'AAP.
- Préparer 10% de persulfate d'ammonium (APS) solution (0.5g/5mL). Utilisez fraîche stock de travail dans les 3 jours. Alternativement, les stocks peuvent être congelés pour être utilisés à des dates ultérieures.
- Bien acrylamide est dégazage, essuyer un 1x3 "plaque en verre de microscope avec Rain-x lingettes vigoureusement à faire surface en verre hydrophobe diapositive. Pour enlever l'excès de pluie-x, essuyez plaque en verre avec Kimwipe humide. Plaque en verre Mettre de côté, couvert.
- Retirer solution d'acrylamide de la chambre à vide et ajouter des perles fluorescentes (1% en volume, 5 ul pour la solution de travail figurant dans le tableau 1). Ajouter 0.75μl TEMED et 2,5 APS ul de 10%, ce qui va amorcer la polymérisation du gel. Mélangez bien par pipetage pour ~ 5 sec, afin de minimiser l'introduction de bulles,
- Appliquer de 10 à 12 pl de la solution d'acrylamide à la lame de microscope hydrophobe (préparé à l'étape 2.4) et placer la lamelle activée 22x40mm sur le dessus de la gouttelette. Solution de gel coat doit lamelle entière. Lisser les bulles qui peuvent apparaître au sein de la solution. Laisser la solution de gel de polymériser à température ambiante pendant environ 10 min.
- L'achèvement de la polymérisation peut être évaluée en inversant la solution de travail restant dans le tube à centrifuger. En outre, le gel polymérisé peut se détacher des bords lamelle. Immédiatement après polymérisation macroscopique est observée, séparer la lamelle de la lame de verre. Utilisation de la pointe fine d'une paire de pince à épiler ou un bord de lame de rasoir, retirez délicatement la lamelle, avec un gel ci-joint, de la surface de lame de microscope et gel plonger dans ddH 2 O, pour maintenir l'hydratation.
3. Couplage de la matrice extracellulaire (ECM) de protéines sur le gel de l'AAP
Trois méthodes distinctes peuvent être utilisées pour fixer des protéines ECM soit à la surface supérieure du gel AAP (3.1 et 3.2) ou en incorporant des protéines ECM au sein du volume de gel (3,3). Ici, nous discutons de l'accouplement de la fibronectine à des gels de l'AAP d'aboutir à une densité de ligand de surface qui est équivalent à la quantité adsorbée sur le verre après incubation avec 10 ug / ml solution fibronectine pendant 1 heure. Considérations pour le choix d'une méthode sont détaillés dans la discussion.
- Réticulation des protéines ECM à la surface de gel de l'AAP par Sulfo-SANPAH amines réactives sur les protéines sont fixés par covalence à la surface du gel par l'AAP hétérobifonctionnels réticulant Sulfo-SANPAH
- Préparer 40 ul aliquotes de travail de Sulfo-SANPAH en dissolvant S ulfo-SANPAH poudre dans le diméthylsulfoxyde (DMSO) anhydre (20 pi par mg de Sulfo-SANPAH). Un gel rapide des stocks dans l'azote liquide et conserver à -80 ° C pour une utilisation ultérieure.
- Retirer ddH 2 O de la surface de gel en utilisant un fileur lamelle (<2s). Évitez de faire sécher le gel.
- Diluer Sulfo-SANPAH-DMSO aliquotes dans le trou DDH 2 O (2mg/ml, pH 7) immédiatement avant l'utilisation et la surface du gel coat (~ 200 pi). Notez que la réactivité demi-vie de Sulfo-SANPAH est courte (~ 5 minutes) à température ambiante dans de l'eau, par conséquent, ces mesures devrait être fait à un rythme rapide.
- Exposer surface du gel à la lumière UV dans une UV réticulant four (8W, 254 nm, à une distance de 2-3 cm pour 1,5 min). Sulfo-SANPAH va changer de couleur de l'orange au brun.
- Trempez lamelles UV-traitée dans un bécher avec des produits frais O 2 et retirez ddH l'excès d'eau de surface du gel en utilisant un fileur lamelle (<2s).
- Pipeter ~ 50 uL de 1mg/ml fibronectine froid (FN) (en PBS, pH 7,4) sur le Parafilm dans un récipient boîte de Pétri. Inverser la lamelle sur le dessus de la chute FN, côté exposé au gel de FN.
- Réagir à température ambiante pendant 1-2 heures ou à 4 ° C pendant la nuit.
- Placer dans des lamelles de boîtes de 6 cm de culture de tissu contenant du PBS (pH 7,4), assez pour couvrir la lamelle, dans des conditions stériles dans la hotte de culture de tissus.
- Laver abondamment avec plusieurs lavages (3-5) de PBS (pH 7,4), dans des conditions stériles.
- Stériliser les lamelles par l'utilisation de lampes germicides dans la hotte de culture tissulaire pendant 30 min.
- Incuber lamelles dans les médias cellulaire pendant 30-45 min avant de cellules de placage.
- Réticulation ECM à la surface du gel AAP par des groupes hydrate d'hydrazine hydrate de carbone sur les protéines sont oxydées et couplé à du gel en utilisant l'hydrate d'hydrazine.
- Préparer des gels de polyacrylamide comme décrit dans la section 2.
- Placez AAP lamelles de gel dans une boîte de Petri en plastique dans une hotte et des gants en utilisant une pipette environ 1 ml d'hydrate d'hydrazine non dilué sur la surface de chaque gel AAP et incuber pendant au moins deux heures, mais pas plus de 24 heures
- Ajouter ddH 2 O pour la boîte de Pétri; enlever la solution de l'hydrate d'hydrazine et de disposer comme un déchet dangereux.
- Ajouter 5% d'acide acétique à la boîte de Pétri pour immerger lamelle. Couvrir et laisser incuber pendant une heure.
- Retirer de l'acide acétique et laver avec ddH 2 O. Incuber dans le trou DDH 2 O pendant une heure. Les lamelles sont désormais activées et prêtes à réticuler oxydé fibronectine (FN).
- Diluer 10 ul de 1 mg / ml solution dans FN ul 940 de tampon acétate 50 mM de sodium (pH 4,5) dans un tube de centrifugeuse micro sombre, faisant une concentration finale de 10 ug / ml.
- Faire le bilan de 20X de sodium méta-periodate en ajoutant 80 mg de sodium méta-periodate à 1 ml de tampon acétate 50 mM de sodium (pH 4,5).
- Ajouter 50 ul de 20X de sodium méta-periodate de stock à la solution FN préparés en 3.2.6, telles que la concentration de travail finale de 10 pg / ml FN et 4 ug / ml de sodium méta-periodate. Incuber dans le tube noir à température ambiante pendant 30 minutes.
- Enlever l'excès ddH 2 O de la surface du gel activé préparé en 3.2.5 en utilisant un fileur lamelle (<2 sec). Évitez de faire sécher le gel.
- Pipet ~ 500 pi de solution de FN sur la surface du gel activé et incuber pendant 1 h à température ambiante.
- Lamelles placer dans des boîtes contenant du PBS (pH 7,4), assez pour couvrir lamelle.
- Laver abondamment avec plusieurs lavages (3-5) de PBS (pH 7,4).
- Stériliser les lamelles par l'utilisation de lampes germicides dans la hotte de culture tissulaire pendant 30 min.
- Incuber lamelles dans les médias cellulaire pendant 30-45 min avant de cellules de placage.
- Conjugaison vrac de protéines ECM dans l'AAP gel par acryloyle-X, l'ester succinimidyle Ce protocole est effectué avant à 2,5. Amines réactives sur les protéines sont couplées à un monomère d'acrylamide avec NHS ester chimie et ensuite co-polymérisé dans la masse du gel de l'AAP.
- Conjugué ECM protéine de choix pour acryloyle X par les instructions du fabricant. Les solutions mères de protéines conjuguées devraient être conservés à 4 ° C.
- Calculez le volume de solution de PAA de travail nécessaire pour la fabrication du gel (par exemple 10 ul par lamelle).
- Soustraire 50 uL (par exemple 10% du volume) d'eau à partir du montant figurant dans la recette solution de travail dans le tableau 1 et amorcer la polymérisation.
- Retirer volume calculé au point 3.3.2 et d'ajouter ECM / acryloyle X solution à 10% du volume. (Par exemple, 1 pl de l'ECM / acryloyle-X à 9 uL de solution AAP). Cette étape doit être effectuée rapidement, que le gel est de polymérisation.
- Suivez les étapes 2.6 et 2.7, comme décrit précédemment.
- Laver abondamment avec plusieurs lavages (3-5) de PBS (pH 7,4), dans des conditions stériles.
- Stériliser les lamelles par l'utilisation de lampes germicides dans la hotte de culture tissulaire pendant 30 min.
- Incuber lamelles dans les médias cellulaire pendant 30-45 min avant de cellules de placage.
Ces étapes sont effectuées après que les cellules ont été autorisés à se répandre sur le substrat de gel ECM-couché (~ h 6-12). Pour assembler la chambre d'imagerie confocale (RC-30WA), il est utile de consulter le site Web de Warner Instruments pour des conseils.
- Les médias cellules chaudes et de 0,5% ou 0,25% de trypsine et de la charge dans une seringue de 5ml ou 10ml.
- Charger une lamelle 22x30mm sur le support d'une lamelle Haut Warner Instruments de chambre d'imagerie confocale (RC-30WA) en utilisant de la graisse sous vide pour maintenir la lamelle en place.
- Placez une chambre formant joint en caoutchouc sur le dessus de la lamelle, permettant l'accès à la fois d'entrée et de sortie de tuyaux en polyéthylène. Cela permettra un espacement de 150-1000 um entre la lamelle supérieure et la lamelle de gel-enduit 22x40mm, selon la taille du joint utilisé.
- Seringues charger sur tuyauterie d'entrée, via kit de connexion, et vérifiez que les médias flux à travers des tubes et sur lamelle du haut et pas de bulles sont apparentes dans les lignes de flux.
- Appliquer de la graisse sous vide sur base de la chambre et de la charge de gel-enduit lamelle 22x40mm, la cellule vers le haut. Appliquer les médias chauds pour les cellules.
- Détenteur de la Place de lamelle supérieure sur base de la chambre, avec joint de chambre qui la sépare de la lamelle de gel-enduit. Assurez-vous que les goupilles de positionnement au sein de la base de la chambre siègent au sein de l'trous de positionnement dans le Top lamelle.
- Appliquer la plaque de pression à la base de chambre et utiliser la clé plateau presseur à vis et fixez la plaque de pression.
- Vérifiez le flux de médias à travers le tube et la chambre pour surveiller les fuites possibles dans la chambre et à éliminer toutes les zones des médias libres à la surface cellulaire. Remarque: en utilisant une aiguille de petit calibre de tirer un léger vide tout en infusant avec les médias peuvent aider à éliminer les médias des zones exemptes.
- Appliquer la chambre d'imagerie confocale à l'adaptateur scène située dans un porte-microscope pour l'imagerie.
- Image marqués à la fluorescence des protéines et des perles fluorescentes incorporées dans le substrat de gel sur un microscope confocal à fluorescence.
- Pour obtenir une image de unstrained positions billes dans le gel, perfuser la trypsine pour détacher les adhérences cellulaires à partir du gel, et de prendre une image des perles fluorescentes dans le domaine de l'imagerie même où la cellule respectées. Comparaison des positions tendues et sans contrainte billes permet la quantification du déplacement substrat gel sous la contraction.
Les résultats représentatifs:
Le protocole ci-dessus décrit la procédure expérimentale pour la préparation de gels conforme AAP pour l'étude de la contractilité des cellules et est illustrée dans la Figure 1. La surface du gel obtenu avec ce protocole est relativement plat et lisse, avec des perles fluorescentes intégrées uniformément à travers (figure 2A).
Si la mesure de la contraction du gel à l'endroit des adhésions focales, l'imagerie de la cellule (figure 3A) et la surface du gel (figure 3B) devrait être fait dans le plan optique confocal des adhésions focales. La contraction d'un gel peut être visualisée par le déplacement des billes fluorescentes intégrées (figure 3B) à la surface du gel lorsque les cellules sont adhérentes (tendues) par rapport à détacher (sans contrainte). L'utilisation d'algorithmes de calcul peut donner une traction stress associé aux déplacements correspondants de perles et module d'élasticité du gel (figure 3C et 3D) (Sabass et al., 2008). Si l'imagerie a lieu plus profond au sein du gel, puis les déplacements billes sera plus petit et n'est pas représentatif des forces de traction exercée au adhésions focales.
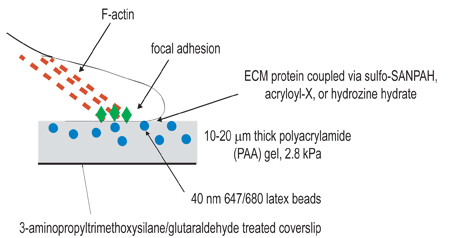
Figure 1. Illustration schématique du dispositif expérimental. L'objectif global de cette procédure est de créer des matrices conformes pour le but d'étudier la contraction cellulaire. La première étape de la procédure expérimentale consiste à activer des lamelles par un traitement amino-silane/glutaraldehyde dans le but de l'ancrage des gels polymérisés. La deuxième étape consiste à polymériser un gel de polyacrylamide, contenant des billes fluorescentes, sur la lamelle activée. La troisième étape implique la réticulation chimique du ligand extracellulaire à la surface du gel de polyacrylamide, en utilisant l'une des trois techniques de couplage répertoriées à l'étape 3. Les cellules sont ensuite étalées sur le gel et a permis d'adhérer et de se propager. Sous la contraction cellulaire active, perles intégrées dans le gel déplacer.

Figure 2. Tranche optique confocale de la surface supérieure de l'AAP gel, comme visualisé par (A.) fluorescentes perles 40nm intégré au sein du gel et de la fibronectine immunofluorescence (B.).

Figure 3. Résultat représentatif pour une expérience de force de traction. (A.) adhésions focales dans un ostéosarcome U2OS cellule humaine sont marked par la GFP-paxilline et (B.) postes de billes fluorescentes intégrées dans le gel sous AAP adhésions focales dans le tendues (vert) et non contraint (en rouge) des États. Les flèches indiquent des exemples de déplacements de billes. (C) des vecteurs de stress et de traction (D.), correspondant à la chaleur échelle de la carte de la traction souligne dérivé de la contraction du gel, en utilisant des algorithmes de calcul (Sabass et al., 2008). Barre d'échelle = 5 um.
Tableau 1:
Exemple Stock et Solutions de l'AAP (données dans le tableau 1 a été obtenu à partir de Yeung et al. Coll. Et confirmée de source indépendante dans notre laboratoire.)
| Stock AAP Solution | ||||
| Module de cisaillement du gel AAP (Pa) | 230 | 2833 | 8640 | 16344 |
| 40% d'acrylamide (ml) | 1,25 | 3,12 | 2,34 | 2,50 |
| 2% de bis-acrylamide (ml) | 0,50 | 0,83 | 1,88 | 0,60 |
| Eau (ml) | 3,25 | 1,04 | 0,78 | 1. 90 |
| Volume total (ml): | 5 | 5 | 5 | 5 |
| Solution de travail AAP | ||||
| Solution mère d'occasion (Pa) | 230 | 2833 | 8640 | 16344 |
| Volume de la solution stock (uL) | 150 | 150 | 200 | 300 |
| Eau (uL) | 341,75 | 341,75 | 291,75 | 191,75 |
| Perles (uL) | 5 | 5 | 5 | 5 |
| TEMED (uL) | 0,75 | 0,75 | 0,75 | 0,75 |
| APS 10% (uL) | 2.5 | 2.5 | 2.5 | 2.5 |
| Volume total (ul): | 500 | 500 | 500 | 500 |
| % D'acrylamide finale | 3 | 7.5 | 7.5 | 12 |
| Finale bis-acrylamide% | 0,06 | 0.1 | 0.3 | 0,15 |
Tableau 2:
Module de cisaillement des AAP substrats d'acrylamide finales différentes et de bis-acrylamide pourcentages
| 12% d'acrylamide | L'acrylamide 7,5% | |||
| % Bis-acrylamide | Module de cisaillement (Pa) | % Bis-acrylamide | Module de cisaillement (Pa) | |
| 0,145 | 16344 | 0,01 | 689 | |
| 0,28 | 30067 | 0,03 | 1535 | |
| 0,45 | 34263 | 0,05 | 2286 | |
| 0,55 | 42375 | 0,075 | 2833 | |
| 0,575 | 50873 | 0.1 | 4069 | |
| 0.6 | 55293 | 0.2 | 5356 | |
| 0.3 | 8640 | |||
| L'acrylamide 5% | L'acrylamide 3% | |||
| % Bis-acrylamide | Module de cisaillement (Pa) | % Bis-acrylamide | Module de cisaillement (Pa) | |
| 0,05 | 430 | 0,02 | 1.3 | |
| 0,075 | 600 | 0,04 | 54 | |
| 0.1 | 1431 | |||
Discussion
La procédure décrite ici pour l'installation d'un microscope à force de traction (TFM) expérience, avec la mise en œuvre des routines de suivi informatique (Sabass et al., 2008), permet la quantification des forces cellulaire avec l'échelle du micron résolution spatiale. Afin d'optimiser le protocole expérimental, il est essentiel de former un substrat gel pur et uniforme avec un revêtement uniforme de ligand ECM. Nous discutons de pièges potentiels ci-dessous:
Déclarations de divulgation
Remerciements
Nous remercions le laboratoire d'Ulrich Schwarz pour un logiciel de suivi informatique utilisée dans la quantification des forces de traction cellulaire (Sabass et al., 2008). Ce travail a été soutenu par une bourse de carrière Burroughs Wellcome et Pioneer Award NIH directeur (DP10D00354) à ML Gardel et Scientifique médical Prix national de services de recherche (5 T32 GM07281) au SP Winter.
matériels
| Name | Company | Catalog Number | Comments |
| 3-aminopropyltrimethyoxysilane | Aldrich | 28, 177-8 | |
| 40% Acrylamide | Bio-Rad | 161-0140 | |
| 2% Bis-acrylamide | Fisher Scientific | BP1404 | |
| TEMED | Fisher Scientific | BP 150-20 | |
| Ammonium persulfate | Fisher Scientific | BP179 | |
| 40nm fluorescent micro-spheres | Invitrogen | F8789 | |
| Sulfo-SANPAH | Pierce, Thermo Scientific | 22589 | |
| Confocal imaging chamber (RC-30) | Warner Instruments | 64-0320 | |
| Coverslip spinner | Home made | NA | |
| Ultraviolet lamp CL1000 | UVP Inc. | 95-0228-01 | |
| Stainless steel rack | Electron Microscopy Sciences | 72239-04 | |
| acryloyl-X, SE (6-((acryloyl)amino)hexanoic acid) | Invitrogen | A-20770 | |
| Hydrazine hydrate | Sigma-Aldrich | 225819 | |
| Sodium meta-periodate | Thermo Fisher Scientific, Inc. | 20504 | |
| Isopropanol | Fisher Scientific | A416-4 | |
| Fibronectin | Sigma-Aldrich | F2006 | |
| Collagen | BD Biosciences | 354236 | |
| Coverslips (#1.5) | Corning | 2940‐224 | |
| Glutaraldehyde | Electron Microscopy Sciences | 16120 | |
| Rain-X | SOPUS Products | www.rainx.com | |
| Acetic Acid | Acros Organics | 64-19-7 |
Références
- Damljanovic, V., Lajerholm, B. C., Jacobson, K. Bulk and micropatterned conjugation of extracellular matrix proteins to characterized polyacrylamid substrates for cell mechanotransduction assays. Biotechniques. 39 (6), 847-851 (2005).
- Engler, A., Bacakova, L. N. e. w. m. a. n., Hategan, C., Griffin, A., M, D. D. i. s. c. h. e. r. Substrate compliance versus ligand in cell on gel responses. Biophys J. 86 ((1 Pt 1)), 617-628 (2004).
- Gardel, M. L., Sabass, B., Ji, L., Danuser, G., Schwarz, U. S., Waterman, C. M. Traction stress in focal adhesions correlates biphasically with actin retrograde flow speed. J Cell Biol. 183, 999-1005 (2008).
- Rajagopalan, P., Marganski, W. A., Brown, X. Q., Wong, J. Y. Direct comparison of the spread area, contractility, and migration of balb/c 3T3 fibroblasts adhered to fibronectin- and RGD-modified substrata. Biophys J. 87 (4), 2818-2827 (2004).
- Reinhart-King, C. A., Dembo, M., Hammer, D. A. The dynamics and mechanics of endothelial cell spreading. Biophys J. 89, 676-689 (2005).
- Stricker, J., Sabass, B., Schwarz, U. S., Gardel, M. L. Optimization of traction force microscopy for micron-sized focal adhesions. J. Phys: Condensed Matter. 22, 194104-194114 (2010).
- Sabass, B., Gardel, M. L., Waterman, C. M., Schwarz, U. S. High resolution traction force microscopy based on experimental and computational advances. Biophys J. 94, 207-220 (2008).
- Yeung, T. Effects of substrate stiffness on cell morphology, cytoskeletal structure, and adhesion. Cell Motil Cytoskeleton. 60 (1), 24-34 (2005).
- Waterman-Storer, C. M. Microtubule/organelle motility assays. Curr Protoc Cell Biol. , 13.1.1-13.1.21 (1998).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon