A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
تحديد وتحليل الأسلاف محمر ماوس باستخدام CD71/TER119 التدفق cytometric الفحص
In This Article
Summary
وهناك طريقة التدفق cytometric لتحديد وتحليل الجزيئي للتمايز في مرحلة معينة الأسلاف محمر الفئران والسلائف ، ومباشرة في طازجة تحصد الماوس نخاع العظم والطحال أو الكبد الجنين. في مقايسة يعتمد على سطح الخلية علامات CD71 ، Ter119 ، وحجم الخلية.
Abstract
دراسة تكون الكريات الحمر يهدف إلى فهم الكيفية التي تتشكل الخلايا الحمراء من الأسلاف في وقت سابق للدم ومحمر. على وجه التحديد ، وينظم معدل تكوين الخلايا الحمراء التي إرثروبويتين هرمون (EPO) ، التي يتم تشغيلها بواسطة التوليف نقص الأكسجة الأنسجة. وثمة تهديد لائق نتائج الأوكسجين في الأنسجة من الزيادة السريعة في المكتب ، والقيادة زيادة في معدل الكريات الحمر ، وهي عملية تعرف باسم الاجهاد استجابة الكريات الحمر. الزيادة الناتجة في عدد خلايا الدم الحمراء المنتشرة يحسن نسيج تسليم الأوكسجين. فعال الاجهاد استجابة الكريات الحمر وبالتالي حاسمة بالنسبة لبقاء والتعافي من الظروف الفسيولوجية والمرضية مثل علو شاهق ، وفقر الدم ، والنزف ، والعلاج الكيميائي أو زرع الخلايا الجذعية.
الفأر هو مفتاح نموذجا لدراسة تكون الكريات الحمر وردها الإجهاد. تكون الكريات الحمر الماوس النهائي (للبالغين من نوع) يأخذ مكان في كبد الجنين بين أيام الجنينية 12.5 و 15.5 ، في الطحال حديثي الولادة ، والكبار في الطحال ونخاع العظام. الطرق التقليدية لتحديد الأسلاف محمر في الأنسجة تعتمد على قدرة هذه الخلايا أن يؤدي إلى نشوء مستعمرات الخلايا الحمراء في وسائل الاعلام عندما مطلي شبه الصلبة المحتوية على المكتب. ويتم تحديد ذريتها السلائف محمر على أساس معايير شكلية. أيا من هذه الأساليب الكلاسيكية تسمح بالوصول إلى أعداد كبيرة من الخلايا محمر تمايز في مرحلة محددة للدراسة الجزيئية. نقدم هنا طريقة تدفق cytometric لتحديد ودراسة التمايز المرحلة الخاصة الأسلاف محمر والسلائف ، ومباشرة في سياق نسيج الماوس معزولة حديثا. في مقايسة يعتمد على علامات سطح الخلية CD71 ، Ter119 ، وعلى تدفق cytometric المعلمة 'إلى الأمام مبعثر" ، والتي هي وظيفة من حجم الخلية. يمكن استخدام مقايسة CD71/Ter119 لدراسة الأسلاف محمر خلال استجابتها لإجهاد الكريات الحمر في الجسم الحي ، على سبيل المثال ، أو فقر الدم في الفئران الفئران الموجودة في ظروف انخفاض الأكسجين. ويمكن أيضا أن تستخدم لدراسة الأسلاف محمر مباشرة في أنسجة الفئران المعدلة وراثيا أو الأجنة ، بغية تقييم الدور المحدد للمسار الجزيئية تكون الكريات الحمر في تعديل.
Protocol
1. حصاد الأنسجة
- إعداد أنابيب تحتوي على 2-5 العازلة مل تلطيخ الباردة (الفوسفات مخزنة المالحة (PBS) مع جيش صرب البوسنة وأضاف 0.2 ٪ والجلوكوز 5mM). إبقاء الأنابيب على الجليد قبل الحصاد الأنسجة.
- اعدام الفئران وفقا لبروتوكول المناسبة وافق (على سبيل المثال استنشاق أول أكسيد الكربون 2 تليها خلع عنق الرحم).
- سحب الدم من خلال ثقب في القلب أو EDTA الهيبارين أنابيب جمع الدم لتحليلها في وقت لاحق ، على سبيل المثال من الهيماتوكريت ، عد الخلايا الشبكية أو تحليل CBC.
- الحصاد والطحال والعظام ، ووضع كل من الأنسجة الماوس في أنبوب منفصل ، الذي أعد في الخطوة 1. سهولة الوصول إلى الطحال هو من الجانب الأيسر. للحصاد ، نقي العظم واحد أو femurs على حد سواء. إبقاء النسيج المقطوع على الجليد.
- إذا رغبت في ذلك ، ويزن الطحال. الفئران التي تمر استجابة الإجهاد الكريات الحمر من المرجح أن تظهر زيادة كبيرة في وزن الطحال.
2. إعداد خلايا الطحال
- باستخدام قبل مبلل 3 مل حقنة الغواص ، برفق والطحال ، أو جزء من الطحال (مثالي ، 0.1 غرام أو أقل ، أي ما يعادل حوالي 10 8 خلايا) من خلال مصفاة ميكرومتر 40 خلية العقيمة (Fisherbrand رقم الكتالوج 22363547 أو غيرها) وضعت على رأس أنبوب مخروطي 50 مل. إبقاء الأنبوب على الجليد خلال هذا الإجراء. غسل الخلايا من خلال مصفاة مع ما مجموعه 2 مل العازلة تلطيخ.
- ماصة بلطف تعليق خلية توتر لتفتيت أي تكتلات صغيرة. إذا لزم الأمر ، وإعادة سلالة الخلايا.
- غسل الخلايا بواسطة الطرد المركزي ، ومرتين في المخزن البارد إعادة تعليق.
- عد الخلايا باستخدام عدادة الكريات. غلة النموذجية هي 1-2 × 10 8 خلايا / الطحال. عن التدفق الخلوي التحليل ، aliquote 1-2000000 الخلايا في العينة ، وإما في أنابيب تلطيخ FACS دينار بحريني (فالكون البوليسترين جولة القاع مواسير 352008) أو U - 96 لوحة أسفل جيدا دينار بحريني (353910 فالكون). حجم العينة هو 200 ميكرولتر تلوين ، لتركيز الخلية النهائي 0،5-1 7 × 10 خلية / مل أو 1-2 × 10 6 خلية / 200 عينة ميكرولتر.
3. إعداد خلايا نخاع العظم
- إعداد 1 أو 3 مل المحاقن مع إبرة an 26G المرفقة ، قبل مليئة العازلة تلطيخ الباردة.
- إزالة عضلات الفخذ التي تعلق على ذلك لتصور واضح العظم.
- باستخدام مقص حاد الجراحية ، قص قبالة طرفي عظم الفخذ ، في أقرب وقت ممكن إلى نهايات العظام. هذا يجب أن تكشف عن وجود ثقب صغير في نهاية كل قطع ، مما يؤدي الى تجويف نخاع العظم ، والذي يمر على طول عظم الفخذ.
- باستخدام محاقن معبأة سلفا في الخطوة 1 ، أدخل الإبرة من خلال واحدة من هذه الثقوب ، وتدفق برفق نخاع من خلال ثقب في الطرف الآخر ، في أنبوب.
- فصل الخلايا عن طريق مسح pipetting لطيف ، والضغط من خلال مصفاة 40 ميكرومتر بالنسبة للالطحال أعلاه (انظر القسم 2.1).
- تغسل مرتين الخلايا بواسطة الطرد المركزي في تلوين العازلة الباردة
- عدد الخلايا وresuspend في الفرع 2.4. غلة النموذجية هي حوالي 10 7 خلايا في عظم الفخذ.
4. إعداد خلايا الكبد الجنين
- لإعداد التوقيت على إناث الفئران الحوامل ، وإنشاء لتزاوج الفئران في المساء ؛ دراسة عن المقابس المهبل قبل 10 من صباح اليوم التالي ، ويعتبر اليوم الذي يتم الكشف عن المكونات المهبلية اليوم 0.5. يمكن للموظفين البيطري تكون قادرة على مساعدة المحققين الذين لم يعتادوا على هذا الأسلوب لتحديد الإناث الحوامل. الحمل ويمكن أيضا أن تحدد حسب الوزن الماوس الرصد.
- يتم التخلص من توقيت - إناث الفئران الحوامل في الأيام 12،5-14،5 من الحمل. تتم إزالة قرون الرحم الى صحن بتري تحتوي على الجليد الباردة المتوسطة الثقافة أو تلطيخ العازلة.
- تتم إزالة كل الأجنة من الرحم ويتم تشريح الكبد الجنين. مطلوب مجهر تشريح لليوم الجنينية 12.5 (E12.5) أو أقل.
- قد كبد يمكن فصلها ميكانيكيا بواسطة pipetting في المخزن ، وتتم معالجتها بشكل فردي في 96 لوحات جيدا ، أو مجمعة معا ، اعتمادا على متطلبات التجريبية.
- والجنين في الكبد وE13.5 ~ 10 7 الخلايا. يتم غسلها مرتين في خلايا تلطيخ العازلة ومعلق في الخلايا 1-2 س 6 10 / 200 عينة لتحليل تدفق ميكرولتر cytometric.
5. تلوين الأجسام المضادة لالتدفق الخلوي
- إعداد الأجسام المضادة الأولية تلطيخ قبل المزيج لاستخدامها في جميع العينات ، باستثناء عينات السيطرة ، يحتوي على ما يلي :
- ChromePure أرنب مفتش (جاكسون ، 015-000-003) ، إلى التركيز النهائي لل200μg/ml. تحقق من التركيز على الأسهم الزجاجة (يمكن أن تختلف). ويستخدم هذا لمنع مستقبلات القطعة Fc في خلايا فأر والأنواع البديلة التي يمكن استخدامها لهذا الماوس ومفتش أو مفتش الفئران. ويتحدد اختيار الأنواع بسبب وجود محتمل في بروتوكول تلوين الأجسام المضادة الثانوية الموجهة ضد الجرذان الأولية / الماوس / الأرنب الأضداد ، وفي هذه الحالة تلك الأنواع لا يمكن استخدامد الأضداد كما حظر. بدلا من ذلك ، يمكن أيضا 5 ٪ مصل الأرنب يمكن استخدامها في مكان مفتش المنقى. وثمة بديل آخر يتمثل في استخدام الاجسام المضادة أو شظايا فاب التي تستهدف مستقبلات القطعة Fc الماوس. بروتوكول الأساسية أدناه لا تتضمن أي أضداد الثانوية وهكذا يمكن استخدام مفتش الحكومة من أي من الأنواع الثلاثة.
- CD71 - FITC ، 1:200 المخفف (الأسهم 0.5mg/ml ، BD - العلوم البيولوجية ، 553266)
- Ter119 - PE ، 1:200 المخفف (الأسهم 0.2mg/ml ، BD - العلوم البيولوجية ، 553673)
- أي الأجسام المضادة التي تستهدف إضافية الحواتم سطح الفائدة ، مثل الأجسام المضادة التي تستهدف فاس أو فصل المقال (انظر 1،2). مزيج الحل الضد بلطف بواسطة أنبوب عكس 2-3 مرات.
- إضافة 200 ميكرولتر من المزيج قبل كل عينة إلى الخلية وبلطف اعادة تعليق الخلايا.
- إعداد عينات الخلايا السيطرة على النحو التالي :
- "غير ملوثين' : يتم ترك هذه الخلايا في تلطيخ العازلة وتوفير خلفية تألق ذاتي للخلايا.
- "لون واحد" الضوابط : مطلوب عنصر تحكم واحد عن كل هذه الأضداد / الألوان المستخدمة في البروتوكول. هي ملطخة الخلايا في هذه الضوابط سواء مع الأجسام المضادة الأولية مترافق مباشرة ، أو مع الأجسام المضادة على حد سواء الأولية والثانوية مترافق الأضداد. وتستخدم هذه الضوابط لتصحيح التداخل بين القنوات الطيفية.
- 'الإسفار ناقص واحد" (FMO) الضوابط : مطلوب عنصر تحكم واحد عن كل هذه الأضداد / اللون في بروتوكول : هي الخلايا الملون بألوان جميع / الأضداد في البروتوكول باستثناء اللون / الأضداد التي تحكم هذا هو FMO. التحكم FMO لقناة معينة توفر الخلفية الحقيقية لهذه القناة. قد تشمل غير محددة الضد من isotype نفسه ، ومترافق مع علامة مضان نفس اختبار الأجسام المضادة (مراقبة isotype).
- عينات احتضان والضوابط ذات الصلة في الضد الابتدائي وصمة عار على الجليد لمدة 45 'إلى 1 ساعة في الظلام (وضع غطاء الألومنيوم احباط دلو على الجليد).
- في نهاية الحضانة ، وغسل الخلايا بإضافة 3ml العازلة من تلطيخ كل أنبوب العينة وتدور لمدة 3 'إلى 5' في حوالي 400 XG في 4 درجات مئوية. إذا باستخدام 96 لوحات جيدا ، وغسل الخلايا ثلاث مرات في مجلد من 200 ميكرولتر.
- إذا كان ذلك مناسبا ، وتطبيق الضد الثانوية وصمة عار. كما تطبق وغسل للجسم first صمة عار.
- إذا كان ذلك مناسبا ، ويطبق وصمة مع Annexin الخامس في نهاية الحضانة ، وذلك باستخدام hepes العازلة كما هو الحال في تعليمات الشركة الصانعة. يتم تطبيق هذه البقعة لمدة 15 دقيقة في درجة حرارة الغرفة ، أو لمدة 1 ساعة على الجليد.
- هي خلايا اعادة مع وقف التنفيذ لتحليل تدفق الخلوي في تلطيخ محلول يحتوي على صبغة الحمض النووي الخلوي كتيمة ، لاستبعاد الخلايا الميتة. الأصباغ الحمض النووي عدة متاحة ، بما في ذلك التأيد Propidium ، 7 - D أكتينوميسين الأميني (7AAD) ، أو دابي. الاختيار من بين هذه تعتمد على القنوات المتاحة ، نظرا لقنوات تناولها لتلوين الأجسام المضادة المحددة ، والقنوات المتاحة في عداد الكريات التدفق. يتم الحصول عليها من 7AAD BD - العلوم البيولوجية (559925) واستخدامها وفقا لتعليمات الشركة الصانعة. لتلطيخ دابي ، وجعل من الأسهم في 1mg/ml ثنائي ميثيل الفورماميد (DMF) من مسحوق (روش ، القط # 236276) ، والحفاظ على -20 درجة مئوية ، وتمييع 1:10،000 إلى 1:15،000 في تلطيخ العازلة.
6. تدفق cytometric الفرز
- وصفت الخلايا مع أجسام مضادة ضد CD71 ، Ter119 ، علامات النسب ، وصبغة الجدوى كما هو موضح لتحليل تدفق cytometric (القسم 5). ويمكن زيادة تركيز الخلية خلال وضع العلامات إلى 5 × 10 / 7 مل.
- مزيج حجم مساو من كل واحد من الأضداد التالية لجعل المزيج الرئيسي النسب :
- FITC الجرذ المضادة للماوس CD41 MWReg30 ، BD Pharmingen 553848
- FITC الجرذ المضادة للماوس CD45R/B220 RA3 - 6B2 ، BD Pharmingen 553087
- FITC الهامستر المضادة للماوس CD3e 145 2C11 ، BD Pharmingen 553061
- FITC الجرذ المضادة للماوس CD11b/Mac-1 M1/70 ، BD Pharmingen 557396
- FITC مكافحة الجرذ الفأر لي - 6G و Ly - 6C (GR - 1) RB6 - 8C5 ، BD Pharmingen 553126
- استخدام مزيج الرئيسي في 1:80 (وهذا يعادل 1:400 تمييع كل الأضداد الأسهم الفردية ، وهي كلها 0،5 ملغ / مل).
- شروط استخدام الفرز الضغط المنخفض وفتحات واسعة. لاريا دينار بحريني (العلوم البيولوجية) ونحن استخدام 100 فوهة μ ، 20 رطل ضغط.
- جمع العازلة : برنامج تلفزيوني مع إضافة 20 ٪ مصل بقري جنيني.
- للتحقق من درجات نقاء السكان فرزها وإعادة تشغيل قسامة صغيرة من كل عينة في مخزن يحتوي على صبغة الجدوى (7AAD أو ما شابه ذلك).
7. ممثل النتائج :
CD71/Ter119 تلطيخ من البالغين نخاع العظم أو الطحال ويحدد تسلسل التنموية من أربع مجموعات فرعية ، ProE المسمى ، EryA ، وEryB EryC (الشكل 1) +1. شكليا ، وهذه تقابل erythroblasts تنضج على نحو متزايد. الشكل 1 يوضح تسلسل تبوب في مرحلة تحليل البيانات ، والذي يتجاهل حدث صغير جدا (بما في ذلك الخلايا والنواة الحمراء) ، والخلايا مجمعة والخلايا الميتة.
ويمكن قياس التعبير عن بروتينات سطح الخلية في وقت واحد لكل من هذه المجموعات الفرعية ، وذلك بإضافة الأجسام المضادة ذات الصلة في نفس الوقت الذي Ter119 وتلطيخ CD71. ويظهر الشكل 1 مثالا على سطح الخلية المستقبلة التعبير عن الموت فاس 1. وأجري هذا القياس في فئران حقنت مع المكتب الأوروبي للبراءات ، أو التحكم في الفئران حقن مع المالحة. فمن الواضح أن يقمع التعبير EPO فاس في عدد السكان في الجسم الحي EryA 1.
ويمكن أيضا التعبير عن البروتينات داخل الخلايا أو الخلية دورة تقاس الحالة للخلايا في كل مجموعة فرعية. الشكل 2 يوضح ممثل تحليل دورة الخلية من المقطوع حديثا خلايا نخاع العظام. هذه القياسات تتطلب ، بالإضافة إلى تلطيخ مع سطح الخلية وTer119 CD71 ، وتثبيت وpermeabilization من الخلايا داخل الخلايا لوصفها (انظر القسم مناقشة).
في كبد الجنين ، يتم استبعاد الأول غير محمر الخلايا النابضة على خلايا "لين" التي هي سلبية على CD41 ، ماك - 1 ، مج 1 ، B220 وCD3 (الشكل 3). الخلايا الباقية تنقسم إلى 6 مجموعات فرعية ، S0 إلى S5. نمط محدد من الخلايا في الكبد الجنين يعتمد على العمر الجنيني (انظر القسم مناقشة). ويبين تحليل دورة الخلية ممثل لمجموعة فرعية في S3 E13.5 كبد الجنين (الشكل 4).
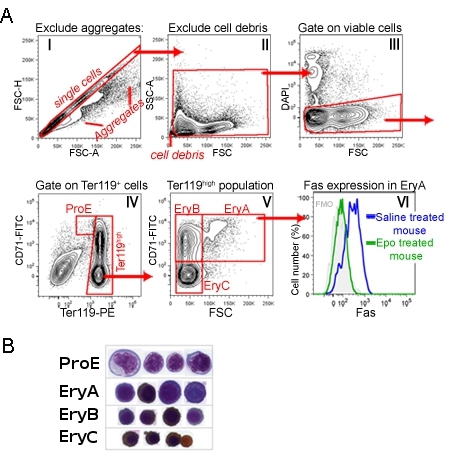
الرقم (1) مجموعات فرعية CD71/Ter119 محمر في الطحال الماوس ألف استراتيجية المحاصرة : تمت معالجة خلايا الطحال والمسمى مع الأجسام المضادة التي تستهدف Ter119 ، CD71 وفاس. هذا الرقم يدل على استراتيجية تحليل الخطوة التالية للحصول على البيانات. الرسم البياني الأول يبين أحداث حصلت جميع. البوابة قطري تمثل الأحداث التي من المحتمل أن تكون خلايا واحدة ، باستثناء doublets أو أكبر المجاميع. ويجري تحليل المزيد من الخلايا في هذه البوابة الثانية في الرسم البياني. وتستبعد الأحداث هنا صغيرة جدا ، أو نوى المرجح الانقاض. وتظهر الخلايا المغلقة في المدرج الثالث ، حيث يتم استبعاد دابي إيجابية الخلايا ، والتي يرجح نفاذية غشاء الخلايا أفكارك ، من مزيد من التحليل. رابعا رسم بياني يبين عدد السكان الناتجة من خلايا الطحال قابلة للحياة. البوابة ProE يحتوي CD71 عالية Ter119 الخلايا المتوسطة. ويجري تحليل المزيد من الخلايا Ter119 عالية في الرسم البياني خامسا تنقسم الخلايا CD71 هنا عالية في الكبيرة وأقل نضجا erythroblasts 'EryA' (CD71 Ter119 عالية عالية عالية FSC) ، وأصغر حجما ، وأكثر نضجا "EryB' erythroblasts (CD71 Ter119 ارتفاع منخفض عالية FSC) . أرومة الحمراء فرعية هي الأكثر نضجا EryC (CD71 Ter119 عالية منخفضة منخفضة FSC). سادسا الرسم البياني يظهر سطح الخلية التعبير فاس ، وتحديدا في EryA فرعية ، في الفئران في الدولة القاعدية (حقنها بمحلول ملحي) ، وحقن الفئران بجرعة واحدة من المكتب الأوروبي للبراءات. تلطيخ مع الضد فاس نفذت في وقت واحد مع التلوين CD71/Ter119. باء الاستعدادات Cytospin من الخلايا مرتبة من كل مجموعة من المجموعات الفرعية المشار إليها. تم صبغ الخلايا مع بالغيمزا ومع Diaminobenzidine ، وهذا الأخير بإنشاء البني وصمة عار مع الهيموغلوبين. نشرت أصلا في البيانات Cytospin ليو وآخرون ، في الدم. 1 يوليو 2006 ، 108 (1) :123 - 33. 9 مارس 2006 EPUB.
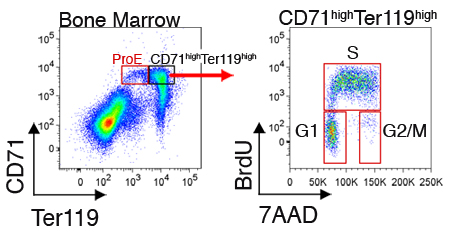
الشكل 2. تم حقن خلية تحليل دورة CD71 erythroblasts Ter119 ارتفاع عال في نخاع العظم الماوس. intraperitoneally مع BrdU الفئران ، وكانت تحصد الطحال أو نقي العظم - 30 إلى 60 دقيقة في وقت لاحق. تم إصلاح الخلايا وpermeabilized وبالإضافة إلى كونه والملون لCD71 Ter119 ، تم صبغ لإدراجها في BrdU عينات من الحمض النووي تكرار مع ريتوكسيماب الموجهة BrdU (التثبيت ، وpermeabilization BrdU تلطيخ ، وفقا لبروتوكول تم بتعليمات الشركة الصانعة) BrdU إيجابية الخلايا في مرحلة - S للدورة. خلايا الطور البيني هي BrdU سلبية ، ويمكن حلها في مراحل G1 أو G2 / M ، وذلك باستخدام الحمض النووي صبغ 7AAD.
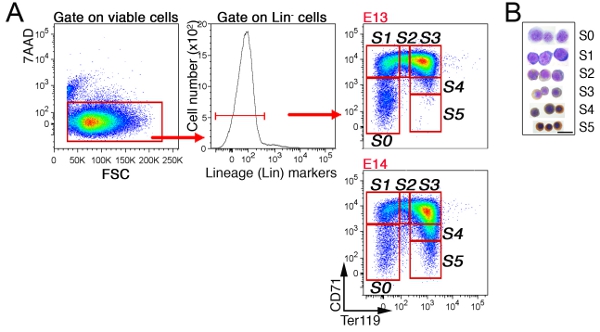
الشكل 3 مجموعات فرعية CD71/Ter119 محمر في كبد الفأر الجنينية ألف استراتيجية المحاصرة : وصفت لخلايا الكبد الجنين Ter119 ، CD71 ، ومزيج من FITC المسمى الأجسام المضادة التي تستهدف علامات النسب غير محمر ('لين'). وقد تم تحليل خلايا قابلة للحياة (7AAD السلبية) للتعبير عن لين ، وكذلك تنقسم الخلايا لين في الفئات محمر S0 إلى S5. أصغر سنا ، ويتكون الجنين من الكبد E13 erythroblasts أقل نضجا ، كما يظهر من عدم وجود الخلايا في مجموعات فرعية S4/S5 ناضجة. باء الاستعدادات Cytospin من الخلايا مرتبة من كل مجموعة من المجموعات الفرعية المشار إليها. تم صبغ الخلايا مع بالغيمزا ومع Diaminobenzidine ، وهذا الأخير بإنشاء البني وصمة عار مع الهيموغلوبين. وكان في الأصل البيانات Cytospin عublished في البوب وآخرون ، بلوس بيول 8 (9) : e1000484. دوى : 10.1371/journal.pbio.1000484.
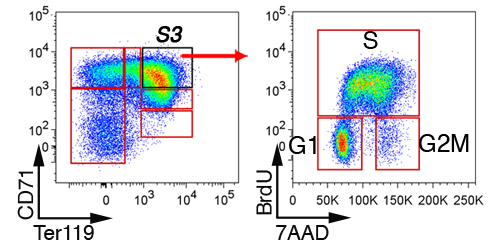
الشكل 4. تحليل دورة الخلية الجنينية من الكبد فرعية محمر. حقنت الفئران الحوامل مع BrdU ، وكان حصاد كبد الجنين 30 الى 60 دقيقة في وقت لاحق ، والثابتة ، permeabilized ، وملطخة أجسام مضادة ضد Ter119 ، وBrdU CD71. ويظهر الوضع دورة الخلية من الخلايا S3.
Discussion
منهجية تدفق cytometric التحقيق في وقت واحد يسمح لأي وظيفة الخلوية التي قد يتم الكشف عن الأجسام المضادة مع مضان ، مترافق محددة أو يجند ، بما في ذلك علامات سطح الخلية ، والتعبير من البروتين ، وبقاء الخلية ، مما يشير إلى الخلية باستخدام الفوسفات محددة الأجسام المضادة (3)...
Disclosures
وقد أجريت تجارب على الحيوانات وفقا للمبادئ التوجيهية واللوائح التي وضعتها جامعة ماساتشوستس اللجنة الطبية IACUC المدرسة.
Acknowledgements
نشكر التدفق الخلوي UMass الأساسية : ريتشارد Konz ، Giehl تيد غوسلين باربرا ، قو أوجدتها وKrupoch تامي. وقد تم تمويل هذا العمل من قبل المعاهد الوطنية للصحة / NHLBI RO1 HL084168 (MS) ، والمعاهد الوطنية للصحة CA - T32 130807 (JRS). كما استخدمت الموارد الأساسية التي تدعمها أبحاث الغدد الصماء السكري DK32520 منح المركز.
Materials
| Name | Company | Catalog Number | Comments |
| اسم كاشف | شركة | فهرس العدد | |
|---|---|---|---|
| فاس ، البيوتين | دينار بحريني Pharmingen | 554256 | |
| Streptavidin - APC | المسابر الجزيئية | S868 | |
| 40 ميكرومتر مصفاة الخلية معقمة | Fisherbrand | 22363547 | |
| البوليسترين جولة القاع أنابيب لتلطيخ FACS | فالكون دينار بحريني | 352008 | |
| U - 96 لوحة أسفل جيدا | فالكون دينار بحريني | 353910 | |
| ChromePure أرنب مفتش | جاكسون ImmunoResearch | 015-000-003 | |
| CD71 - FITC (الأسهم 0.5mg/ml) | BD - العلوم البيولوجية | 553266 | |
| Ter119 - PE (الأسهم 0.2mg/ml) | BD - العلوم البيولوجية | 553673 | |
| 7AAD | BD - العلوم البيولوجية | 559925 | |
| دابي مسحوق | روش | 236276 | |
| FITC الجرذ المضادة للماوس CD41 MWReg30 | دينار بحريني Pharmingen | 553848 | |
| FITC الجرذ المضادة للماوس CD45R/B220 RA3 - 6B2 | دينار بحريني Pharmingen | 553087 | |
| FITC الجرذ المضادة للماوس CD411b/Mac-1 M1/70 | دينار بحريني Pharmingen | 557396 | |
| FITC مكافحة الجرذ الفأر لي - 6G و Ly - 6C (GR - 1) RB6 - 8C5 | دينار بحريني Pharmingen | 553126 | |
| FITC الهامستر المضادة للماوس CD3e 145 2C11 | دينار بحريني Pharmingen | 553061 | |
| APC BrdU تدفق طقم | دينار بحريني Pharmingen | 557892 | |
| Annexin V - البيوتين | دينار بحريني Pharmingen | 556418 |
References
- Liu, Y. Suppression of Fas-FasL coexpression by erythropoietin mediates erythroblast expansion during the erythropoietic stress response in. 108, 123-133 (2006).
- Socolovsky, M. Negative Autoregulation by FAS Mediates Robust Fetal Erythropoiesis. PLoS Biol. 5, e252-e252 (2007).
- Krutzik, P. O., Hale, M. B., Nolan, G. P. Characterization of the murine immunological signaling network with phosphospecific flow cytometry. J Immunol. 175, 2366-2373 (2005).
- Socolovsky, M. Ineffective erythropoiesis in Stat5a(-/-)5b(-/-) mice due to decreased survival of early erythroblasts. Blood. 98, 3261-3273 (2001).
- Guihard, S. The MAPK ERK1 is a negative regulator of the adult steady-state splenic erythropoiesis. Blood. 115, 3686-3694 (2010).
- Yu, X. An erythroid chaperone that facilitates folding of alpha-globin subunits for hemoglobin synthesis. J Clin Invest. 117, 1856-1865 (2007).
- Chen, M. L. Erythroid dysplasia, megaloblastic anemia, and impaired lymphopoiesis arising from mitochondrial dysfunction. Blood. 114, 4045-4053 (2009).
- Chen, K. Resolving the distinct stages in erythroid differentiation based on dynamic changes in membrane protein expression during erythropoiesis. Proc Natl Acad Sci U S A. 106, 17413-17418 (2009).
- McGrath, K. E., Bushnell, T. P., Palis, J. Multispectral imaging of hematopoietic cells: where flow meets morphology. J Immunol Methods. 336, 91-97 (2008).
- Pop, R. A key commitment step in erythropoiesis is synchronized with the cell cycle clock through mutual inhibition between PU.1 and S-phase progression. PLoS Biol. 8, (2010).
- Borsook, H., Lingrel, J. B., Scaro, J. L., Millette, R. L. Synthesis of haemoglobin in relation to the maturation of erythroid cells. Nature. 196, 347-350 (1962).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved