このコンテンツを視聴するには、JoVE 購読が必要です。 サインイン又は無料トライアルを申し込む。
Method Article
CD71/TER119フローサイトメトリーアッセイを用いてマウス赤血球前駆細胞の同定と解析
要約
直接収穫したてのマウスの骨髄、脾臓や胎児の肝臓における分化段階特異的マウス赤血球前駆細胞と前駆体の同定と分子解析のためのフローサイトメトリー法。アッセイは、細胞表面マーカーCD71、TER119、およびセルサイズに依存しています。
要約
赤血球生成の研究は、以前の造血および赤芽球前駆細胞から形成される方法を赤血球を理解することを目指しています。具体的には、赤血球の形成の速度は、その合成組織低酸素によって引き起こされるホルモンのエリスロポエチン(EPO)、によって制御されている。エポの急速な増加に適切な組織の酸素化の結果、赤芽球率の増加を駆動への脅威、赤芽球ストレス応答と呼ばれるプロセス。循環赤血球数の結果の増加は、組織の酸素運搬を改善します。効率的な赤血球産生のストレス反応は、それゆえ生存とそのような高高度、貧血、出血、化学療法または幹細胞移植などの生理学的および病理学的状態からの回復に重要です。
マウスは、赤血球とそのストレス応答の研究のための重要なモデルです。マウス決定的な(成人型)赤血球産生が新生児脾臓で、そして成人の脾臓および骨髄で、胚日12.5と15.5の間に胎児の肝臓で行われます。組織内の赤血球前駆細胞を識別するための古典的な方法は、EPOを含む半固体培地に播種すると、赤色の細胞コロニーを生じさせるために、これらの細胞の能力に依存しています。彼らの赤血球前駆子孫は、形態学的基準に基づいて識別されます。どちらもこれらの古典的な方法のは、分子研究のための分化段階特異的赤血球系細胞の多数へのアクセスを許可しません。ここでは、直接、新たに分離したマウスの組織のコンテキスト内で分化段階特異的赤血球前駆細胞と前駆体を、識別し、勉強のフローサイトメトリー法を提示する。アッセイは、細胞表面マーカーCD71、TER119上、およびセルサイズの関数であるフローサイトメトリー"前方散乱"パラメータに依存しています。 CD71/Ter119アッセイは低酸素の条件に収容された貧血マウスまたはマウスでは、例えば、in vivoでのエリスロポエチンストレスへの応答中に赤芽球前駆細胞を研究するために使用することができます。また、赤血球内の変更された分子経路の特定の役割を評価するために、遺伝子組み換え成体マウスや胚の組織に直接赤血球前駆細胞を研究するために使用されることがあります。
プロトコル
1。組織の収穫
- (0.2%BSA及び5mMのグルコースを付加したリン酸緩衝生理食塩水(PBS))2〜5ミリリットル冷染色バッファーを含むチューブを準備します。前の組織の収穫にチューブを氷中に保管してください。
- カリングマウス適切な承認のプロトコルに従って(例えば、CO 2吸入頸椎脱臼が続く)。
- 後で分析、ヘマトクリット値の例、網状赤血球数またはCBC分析のためにEDTAまたはヘパリン血液コレクションチューブに心臓穿刺により血液を描く。
- ステップ1で調製した別のチューブにそれぞれのマウスから採取した組織を置くこと、脾臓、骨を収穫。脾臓への容易なアクセスは、左側からです。骨髄、収穫一方または両方の大腿骨用。氷の上で収穫した組織をしてください。
- 必要に応じて、脾臓の重量を量る。エリスロポエチンストレス応答を受けているマウスは、脾臓重量の有意な増加を示す可能性があります。
2。脾臓細胞の調製
- ウェットタイプの3ミリリットルシリンジプランジャを使用して、ゆっくりと40μmの滅菌セルストレーナー(Fisherbrandカタログ番号22363547またはその他)を介して脾臓、または脾臓の一部を(理想的に、0.1グラム以下、約10 8細胞に相当)をプッシュ50 mlコニカルチューブの上に配置。この手順の実行中にチューブを氷上にしてください。 2 mlの染色バッファーの合計とストレーナを介して細胞を洗浄する。
- 優しくどんな小さな塊を分割するために緊張した細胞懸濁液をピペットで。必要に応じて、細胞を再び引っ張る。
- 遠心により細胞を2回洗浄し、冷緩衝液に再懸濁する。
- 血球計算板を用いて細胞を数える。典型的な収量は1〜2 × 10 8細胞/脾臓です。フローサイトメトリー解析のための、aliquoteどちらFACS染色チューブにサンプル当たり1〜2万セル、(BDファルコンのポリスチレンは丸底チューブ、352008)またはU底96ウェルプレート(BDファルコン353910)。サンプルの染色液は、最終的な細胞濃度0.5〜1 × 10 7細胞/ mlまたは1〜2 × 10 6細胞/200μlの試料に、200μlのです。
3。骨髄細胞の調製
- 付属の26G針、冷染色用緩衝液であらかじめ入力して1または3 mLシリンジを準備します。
- 明らかに骨を視覚化するように大腿骨に接続された筋肉を取り外します。
- できるだけ近い骨の両端に鋭い外科はさみ、大腿骨の両端チョキンと切るを、使用する。これは大腿骨の長さによって実行される骨髄の空洞、につながる、各カットの端に小さな穴を明らかにする必要があります。
- ステップ1のプレフィルドシリンジを使用して、これらの穴のいずれかを使用して針を挿入し、ゆっくりとチューブに、もう一方の端で穴から骨髄を洗い流す。
- 上記脾臓用として40μmのストレーナー(セクション2.1参照)を介してフラッシュされた穏やかなピペッティングにより細胞、およびひずみを取り除きます。
- コールド染色バッファーで遠心分離によって細胞を2回洗浄する
- 細胞をカウントし、2.4節のように再懸濁します。典型的な収量は、大腿骨あたり約10 7個の細胞です。
4。胎児肝細胞の調製
- タイムアウトした妊娠雌マウスを準備するには、夕方には交配のためのマウスの設定、10前に膣栓のために調べ、次の日午前、膣栓が検出されている日は一日0.5とみなされます。獣医スタッフが妊娠した雌を識別するために、この手法に不慣れな研究者を支援することができるかもしれません。妊娠はまた監視のマウスの体重により決定することができる。
- 時限妊娠雌マウスは妊娠の14.5日から12.5にカリングされます。子宮角を氷冷した培養液または染色バッファーを含むペトリ皿に削除されます。
- 胚はそれぞれの子宮から削除され、胎児の肝臓を切除している。解剖顕微鏡は、胎生12.5(12.5日)や若いが必要です。
- 肝臓は、バッファ内にピペッティングすることにより機械的に解離可能性があります、そして96ウェルプレートで個別にいずれかの処理、または実験的な要件に応じて、一緒にプールされています。
- E13.5胎仔肝臓は、〜10 7細胞を持っています。細胞は、バッファを染色で2回洗浄し、フローサイトメトリー解析において、1〜2 × 10 6細胞/200μlのサンプルで再懸濁する。
5。フローサイトメトリー用抗体染色
- 以下を含む、コントロールサンプルを除いて、すべてのサンプルに使用するプレミックスを染色一次抗体を準備します。
- 200μg/mlの最終濃度にChromePureウサギIgG(ジャクソン、015-000-003)、。ボトルのストック濃度を確認してください(それは異なる場合があります)。これは、マウスの細胞でのFc受容体をブロックするために使用され、このために使用される代替種はマウスIgGまたはラットIgGです。種の選択は、それらの種を使用することはできませんその場合には、初代ラット/マウス/ウサギ抗体に対して向けられた二次抗体の染色プロトコールの潜在的な存在によって決定されます。ブロッキング抗体としてD。また、5%ウサギ血清は、精製IgGの代わりに使用することもできます。さらに別の方法として、マウスFc受容体に向けられたモノクローナル抗体またはFabフラグメントを使用することです。下記の基本的なプロトコルは、どんな二次抗体は含まれていませんので、3種のいずれかのIgGを使用できます。
- CD71 - FITC、希釈1:200(株0.5mg/ml、BD - Biosciences社、553266)
- TER119 - PE、1:200(株0.2mg/ml、BD - Biosciences社、553673)を希釈
- 追加の抗体は興味の表面エピトープに向け、例えば、抗体はFasやFasLを(1,2を参照)に向け。チューブを反転させて穏やかに2-3回の抗体溶液を混ぜる。
- 各セルのサンプルにプレミックスの200μlを加え、穏やかに細胞を再懸濁する。
- 次のようにコントロールの細胞サンプルを準備します。
- "染色":これらの細胞は、バッファを染色に残され、セルの背景の自家蛍光を提供しています。
- "シングルカラー"コントロール:そのような制御は、プロトコルで使用される各抗体/色のために必要です。これらのコントロールのセルに直接結合した一次抗体で、または一次抗体と結合した二次抗体の両方のいずれかで染色されています。これらのコントロールは、チャネル間のスペクトルの重なりを補正するために使用されます。
- "蛍光マイナス1"(FMO)コントロール:そのようなコントロールは、プロトコル内の各抗体/色のために必要です。細胞は、これはFMOの制御となっているカラー/抗体を除くプロトコルのすべての色/抗体で染色されています。特定のチャネルのためのFMOのコントロールは、そのチャネルの真のバックグラウンドを提供します。それは、非特異的に同じアイソタイプの抗体、およびテストの抗体(アイソタイプコントロール)と同じ蛍光マークとコンジュゲートが含まれる場合があります。
- 45'暗闇の中で1時間(アイスバケットにアルミ箔の蓋を置く)に氷上で染色一次抗体のサンプルと関連するコントロールをインキュベートします。
- インキュベーションの終了時に、4℃で約400 × gで℃で3'から5'のために各サンプルチューブやスピンに染色バッファーの3ミリリットルを追加することで細胞を洗浄96ウェルプレートを使用している場合は、200μlの容量で細胞を3回洗浄する。
- 該当する場合、二次抗体染色適用されます。適用し、一次抗体染色のために洗ってください。
- 該当する場合は、アネキシンVによる染色は、製造者の指示のようにHEPES緩衝液を使用して、インキュベーションの終了時に適用されます。この染色は室温で15分間、または氷上で1時間適用されます。
- 細胞が死細胞を除外するために、細胞非透過性のDNAの染料を含む溶液を染色でフローサイトメトリー分析のために再懸濁している。いくつかのDNAの染料は、ヨウ化プロピジウム、7 - アミノ - アクチノマイシンD(7AAD)、またはDAPIを含む、利用可能です。これらの中から選択は、特定の抗体染色に取り上げチャンネルを与えられた利用可能なチャネル、およびフローサイトメーターで使用可能なチャネルに依存する。 7AADは、BD - Biosciences社(559925)から入手し、製造元の指示に従って使用されます。 DAPI染色の場合は、、(ロシュ、カタログ番号236276)粉末からジメチルホルムアミド(DMF)に1mg/mlのストックをして-20℃に維持し、バッファを染色で1:15,000に1:10,000の希釈。
6。フローサイトメトリー選別
- 細胞は、CD71に対する抗体、TER119、系統マーカー、およびなどのフローサイトメトリー分析(セクション5)で説明可能性の色素で標識されています。ラベリング時の細胞濃度を5 × 10 7 / mlに増加させることができる。
- 系統のマスターミックスを作るために以下の抗体のそれぞれの等量を混合:
- FITCのラット抗マウスCD41 MWReg30、BD Pharmingen社553848
- FITCのラット抗マウスCD45R/B220 RA3 - 6B2、BD Pharmingen社553087
- FITCハムスター抗マウスCD3e 145 - 2C11、BD Pharmingen社553061
- FITCラット抗マウスCD11b/Mac-1 M1/70、BD Pharmingen社557396
- FITCラット抗マウスのLy - 6GとLy - 6C(GR - 1)RB6 - 8C5、BD Pharmingen社553126
- 1:80でマスターミックスを使用(これはすべて0.5 mg / mlのある個々の抗体の株式の1:400希釈、と等価です)。
- 低圧ソート条件と広いノズルを使用してください。アリア(BD Biosciences社)のために我々は、100μノズル、20 psiの圧力を使用してください。
- コレクションバッファー:PBSは、20%ウシ胎児血清を加えた。
- ソートされた集団の純度を確認するには、(7AADまたは類似の)実行可能性の染料を含むバッファーで各サンプルから小アリコートを再実行します。
7。代表的な結果:
成人の骨髄や脾臓のCD71/Ter119染色は、標識ProE、爾雅、EryBとEryC(図1)1、4つのサブセットの発達順序を識別します。形態学的に、これらはますます成熟赤芽球に対応しています。図1は、非常に小さなイベント(核、赤血球を含む)、凝集細胞と死細胞を破棄するデータ分析の段階、でゲーティングシーケンスを示しています。
細胞表面タンパク質の発現は、TER119およびCD71染色と同時に、関連する抗体を添加することにより、これらのサブセットのそれぞれについて同時に測定することができる。図1は死受容体Fasの1の細胞表面発現の例を示しています。この測定は、EPOを注射したマウスで、または生理食塩水を注射したコントロールマウスで実施した。それは、EPOは生体 1 の爾雅集団におけるFas発現を抑制することは明らかである。
細胞内のタンパク質や細胞周期の状態の発現は、各サブセットのセルに対して測定することができる。図2は、新鮮な収穫骨髄細胞の代表的な細胞周期の分析を示しています。これらの測定は、CD71およびTER119と細胞表面の染色、細胞内の標識用細胞の固定と透過(ディスカッションのセクションを参照)に加えて、必要とする。
胎児の肝臓では、非赤血球細胞は、最初の"林 - "CD41陰性の細胞は、Mac - 1、GR - 1、B220およびCD3(図3)にゲートで除外されています。残りの細胞は6サブセット、S5にS0に分割されています。胎児肝臓の細胞の正確なパターンは(ディスカッションのセクションを参照)胎齢に依存しています。 E13.5胎児肝臓におけるS3の部分集合の代表的な細胞周期の解析では(図4)示されています。
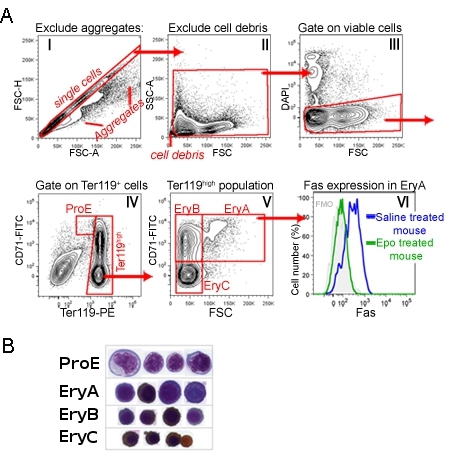
図1マウスの脾臓におけるCD71/Ter119赤芽球サブセットA.ゲーティング戦略:。。脾臓細胞が処理され、CD71、TER119およびFasに特異的な抗体で標識された。この図は、データ取得ステップは、次の分析の戦略を示しています。ヒストグラムは、私はすべての取得したイベントを示しています。斜めのゲートは、二重線またはより大きな凝集体を除く、単一セル、であると思われるイベントを表します。このゲート内の細胞は、さらにヒストグラムIIで分析されます。ここに非常に小さなイベントが、おそらく核や破片は、除外されます。ゲート細胞は、膜透過性アポトーシス細胞可能性が高いDAPI陽性細胞は、さらなる分析から除外されているヒストグラムIII、に示されています。ヒストグラムIVは、実行可能な脾臓細胞の結果としての人口を示しています。 ProEのゲートは、CD71 の高 TER119 中間細胞が含まれています。 TER119 高い細胞は、さらにヒストグラムで分析しているV.ここでCD71 high細胞は、成熟度の低い、大きな"爾雅"赤芽球(CD71 高 TER119 高 FSC 高 )と小さく、より成熟した"EryB"赤芽球(CD71 高 TER119 ハイ FSC ロー )に分割されています。最も成熟した赤芽球のサブセットは、EryC(CD71 低 TER119 ハイ FSC ロー )です。ヒストグラムVIは、基底状態でマウスの爾雅サブセット、(生理食塩水を注入)で特異的、細胞表面のFas発現を示し、そしてEPOの単回投与を注射したマウス。 Fas抗体で染色することCD71/Ter119染色と同時に実施した。示された部分集合のそれぞれから選別された細胞のB.サイトスピンの準備が。細胞はギムザで染色し、ジアミノベンジジンで、後者は茶色がヘモグロビンで染色される生成されました。サイトスピンデータは、もともとLiu らに掲載されました。、ブラッド。 2006年07月1、108(1):123 - 33。 EPUB 2006年03月9。
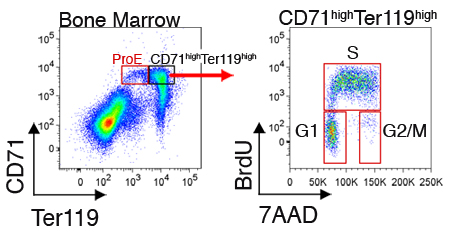
図2マウスの骨髄のCD71 高 TER119 高い赤芽球の細胞周期分析。マウスにBrdUを腹腔内に注射した、と脾臓または骨髄は30〜60分後に回収した。細胞を固定、膜透過と加えてCD71およびTER119のために染色されているために、BrdUを(固定、透過処理とのBrdU染色プロトコールは、メーカーの指示にしたがっていた)に向けられたモノクローナル抗体との複製DNAへのBrdUの取り込みのために染色した。れましたBrdU陽性細胞は、周期のS期にある。間期細胞はBrdU陰性であり、DNA色素7AADを使用して、G1またはG2 / M期に分解されることがあります。
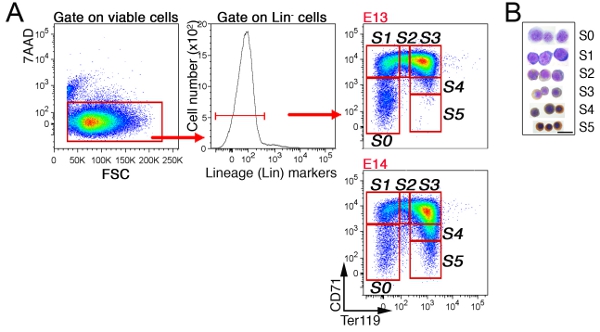
図3マウス胎仔肝臓におけるCD71/Ter119赤芽球サブセットA.ゲーティング戦略:。。胎児肝細胞は、CD71、TER119のために標識され、非赤血球系統マーカー('林')に向けFITC標識抗体のカクテル。生存細胞は、(7AAD陰性)林の発現について分析した、と林 - 細胞はさらにS0へS5赤芽球サブセットに分割されています。若い、E13胎児肝臓は、成熟したS4/S5サブセットの細胞の欠如によって示される成熟度の低い赤芽球、から構成されます。示された部分集合のそれぞれから選別された細胞のB.サイトスピンの準備が。細胞はギムザで染色し、ジアミノベンジジンで、後者は茶色がヘモグロビンで染色される生成されました。サイトスピンデータは、もともとPだポップら ublished、PLoSのBiol 8(9):e1000484が。土井:10.1371/journal.pbio.1000484。
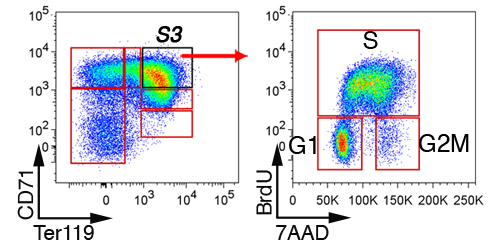
図4。胎児肝赤血球のサブセットの細胞周期分析。妊娠マウスにBrdUを注射し、胎児の肝臓を浸透化、固定、30〜60分後に収穫し、CD71、TER119およびBrdUに対する抗体で染色した。 S3細胞の細胞周期の状態が表示されます。
ディスカッション
フローサイトメトリーの方法論は、リン酸化特異的抗体3と細胞周期の状態を用いて細胞表面マーカー、タンパク質発現、細胞生存、細胞内シグナル伝達を含む、蛍光標識特異的抗体またはリガンド、と検出されても細胞機能の同時調査が可能になります。これらの測定は、新たに単離した赤血球生成組織のコンテキストで、分化段階の特定のサブセットの数の各々に行うことができ?...
開示事項
動物実験は、マサチューセッツ大学医学部IACUC委員会の大学が定めるガイドラインおよび規則に従って行った。
謝辞
リチャードKonz、テッドGiehl、バーバラGosselinは、月華区とタミーKrupoch:我々は、ユーマスフローサイトメトリーコアに感謝。この作品は、NIH / NHLBI RO1 HL084168(MS)およびNIH CA T32 - 130807(JRS)によって賄われていた。糖尿病内分泌学研究センター助成金DK32520でサポートされているコアのリソースも使用した。
資料
| Name | Company | Catalog Number | Comments |
| 試薬の名前 | 会社 | カタログ番号 | |
|---|---|---|---|
| FAS -ビオチン | BD Pharmingen社 | 554256 | |
| ストレプトアビジン- APC | 分子プローブ | S868 | |
| 40μmの滅菌セルストレーナー | Fisherbrand | 22363547 | |
| FACS染色のためのポリスチレン丸底チューブ | BDファルコン | 352008 | |
| U底96ウェルプレート | BDファルコン | 353910 | |
| ChromePureウサギIgG | ジャクソンイムノ | 015-000-003 | |
| CD71 - FITC(株0.5mg/ml) | BD -バイオサイエンス | 553266 | |
| TER119 - PE(株0.2mg/ml) | BD -バイオサイエンス | 553673 | |
| 7AAD | BD -バイオサイエンス | 559925 | |
| DAPI粉 | ロッシュ | 236276 | |
| FITCのラット抗マウスCD41 MWReg30 | BD Pharmingen社 | 553848 | |
| FITCラット抗マウスCD45R/B220 RA3 - 6B2 | BD Pharmingen社 | 553087 | |
| FITCのラット抗マウスCD411b/Mac-1 M1/70 | BD Pharmingen社 | 557396 | |
| FITCラット抗マウスのLy - 6GとLy - 6C(GR - 1)RB6 - 8C5 | BD Pharmingen社 | 553126 | |
| FITCハムスター抗マウスCD3e 145 - 2C11 | BD Pharmingen社 | 553061 | |
| APCのBrdUフローキット | BD Pharmingen社 | 557892 | |
| アネキシンV -ビオチン | BD Pharmingen社 | 556418 |
参考文献
- Liu, Y. Suppression of Fas-FasL coexpression by erythropoietin mediates erythroblast expansion during the erythropoietic stress response in. 108, 123-133 (2006).
- Socolovsky, M. Negative Autoregulation by FAS Mediates Robust Fetal Erythropoiesis. PLoS Biol. 5, e252-e252 (2007).
- Krutzik, P. O., Hale, M. B., Nolan, G. P. Characterization of the murine immunological signaling network with phosphospecific flow cytometry. J Immunol. 175, 2366-2373 (2005).
- Socolovsky, M. Ineffective erythropoiesis in Stat5a(-/-)5b(-/-) mice due to decreased survival of early erythroblasts. Blood. 98, 3261-3273 (2001).
- Guihard, S. The MAPK ERK1 is a negative regulator of the adult steady-state splenic erythropoiesis. Blood. 115, 3686-3694 (2010).
- Yu, X. An erythroid chaperone that facilitates folding of alpha-globin subunits for hemoglobin synthesis. J Clin Invest. 117, 1856-1865 (2007).
- Chen, M. L. Erythroid dysplasia, megaloblastic anemia, and impaired lymphopoiesis arising from mitochondrial dysfunction. Blood. 114, 4045-4053 (2009).
- Chen, K. Resolving the distinct stages in erythroid differentiation based on dynamic changes in membrane protein expression during erythropoiesis. Proc Natl Acad Sci U S A. 106, 17413-17418 (2009).
- McGrath, K. E., Bushnell, T. P., Palis, J. Multispectral imaging of hematopoietic cells: where flow meets morphology. J Immunol Methods. 336, 91-97 (2008).
- Pop, R. A key commitment step in erythropoiesis is synchronized with the cell cycle clock through mutual inhibition between PU.1 and S-phase progression. PLoS Biol. 8, (2010).
- Borsook, H., Lingrel, J. B., Scaro, J. L., Millette, R. L. Synthesis of haemoglobin in relation to the maturation of erythroid cells. Nature. 196, 347-350 (1962).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved