需要订阅 JoVE 才能查看此. 登录或开始免费试用。
Method Article
使用CD71/TER119流流式细胞仪检测小鼠红系祖细胞的识别和分析
摘要
一个流式细胞仪方法,鉴定和分化阶段特异性的小鼠红系祖细胞和前体,直接在新鲜收获的小鼠骨髓,脾脏或胎肝的分子分析流。检测依赖于细胞表面标志物CD71,Ter119,细胞大小。
摘要
红细胞的研究,旨在了解红细胞是如何从早期的造血和红系祖细胞形成。具体来说,是受激素的促红细胞生成素(EPO),其合成是由组织缺氧引起红细胞的形成率。适当组织在迅速增加EPO的充氧效果,驾驶增加红细胞生成率的威胁,被称为红细胞生成应激反应的一个过程。在循环红细胞的数量增加,提高组织的氧输送。红细胞生成一个高效的应激反应,因此,从生理和病理条件下,如高海拔,贫血,出血,化疗或造血干细胞移植的生存和恢复的关键。
鼠标是红细胞和应激反应的研究重点型号。鼠标最终(成人型)红细胞在胚胎12.5和15.5之间天的胎肝,脾中的新生儿,在成人脾和骨髓。确定组织中的红系祖细胞的经典方法依赖于这些细胞的能力,引起红细胞殖民地时,在半固体培养基含有EPO -镀。他们的红易制毒化学后代基于形态学标准确定。无论这些经典的方法能够获得大量的细胞分子研究的特定分化阶段红。在这里,我们目前的流量识别和研究直接在新鲜分离的小鼠组织中的分化阶段特有的红系祖细胞和前体,流式细胞仪方法。检测依赖于细胞表面标志物CD71,Ter119,流流式细胞仪“向前散射”的参数,这是一个细胞大小的功能。 CD71/Ter119法可用于研究红系祖细胞在其体内红细胞生成应力的响应,例如,住在贫血小鼠或老鼠在低氧条件。直接转基因的成年小鼠或胚胎组织,它也可以用来研究红系祖细胞,修改后的红细胞中的分子途径,以评估的具体作用。
研究方案
1。收获的组织
- 准备管含有2至5毫升冷染色缓冲液(磷酸盐缓冲液(PBS)与添加0.2%BSA和5mm葡萄糖)。置于冰上管组织收获前。
- 根据卡尔小鼠适当批准的协议(如CO 2吸入颈椎脱位)。
- EDTA或肝素血液收集管进入心脏穿刺,为以后的分析,如红细胞压积,网织红细胞计数或CBC分析,绘制血。
- 收获脾和骨骼,放置在一个单独的管,准备在第1步,从每个鼠标的组织。易于访问以健脾是从左侧。对于骨髓,收获一个或两个股骨。收获的组织置于冰上。
- 如果需要,权衡脾。小鼠接受红细胞生成应激反应可能表现出显着增加脾脏重量。
2。脾细胞的制备
- 使用预先蘸3毫升注射器推杆,轻轻一推,通过一个40微米的无菌细胞过滤器(Fisherbrand目录编号22363547或其他)脾,或脾的一部分(理想情况下,0.1克或更少,相当于约10 8个细胞)放在一个50毫升的锥形管的顶部。在此过程中试管置于冰上。共2毫升染色缓冲细胞通过过滤网清洗。
- 轻轻吸管紧张的细胞悬液,打破了任何小团块。如果有必要,重新株的细胞。
- 清洗细胞两次离心,重新暂停在寒冷的缓冲区。
- 使用血球计数细胞。典型的产量是1-2 x 10 8细胞/脾脏。流式细胞仪检测分析,aliquote 1至2亿个细胞,每个样品,到流式细胞仪染色管(BD猎鹰聚苯乙烯圆底管,352008)或U型底96孔板(屋宇署猎鹰353910)。样品染色体积为200μL,最后的细胞浓度为0.5〜1 × 10 7细胞/毫升或1-2 × 10 6细胞/ 200μL的样品。
3。骨髓细胞的制备
- 准备与附加的26G针,预充冷染色缓冲1或3毫升的注射器。
- 取出股骨的肌肉,以可视化骨清楚。
- 使用尖锐的手术剪刀,剪断关闭股骨的两端,尽可能接近骨的两端。这应该揭示了一个小洞,在每个切端,领先进入骨髓腔,通过股骨的长度,运行。
- 在第1步中使用的预充式注射器,通过这些孔插入针,轻轻冲洗骨髓通过小孔在另一端,成筒,。
- 通过上述脾为40微米的过滤器(参见2.1节),游离轻柔吹打刷新细胞和应变。
- 在寒冷的染色缓冲液离心洗涤细胞两次
- 计数细胞,重悬在2.4节。典型的产量大约为10 7%,股骨细胞。
4。胎肝细胞的制备
- 要准备定时怀孕的雌性小鼠,设置在晚上的交配小鼠;检查阴道塞前翌日上午10时,检测阴道塞的一天是一天0.5。兽医人员可能能够帮助那些不熟悉这种技术,以确定怀孕女性的调查。怀孕也可以由监控鼠标重量。
- 定时怀孕的雌性小鼠扑杀12.5至14.5怀孕天。子宫角的Petri盘成含有冰冷的培养基或染色缓冲中删除。
- 胚胎从每个子宫和胎肝解剖。在解剖显微镜所需的胚胎12.5天(E12.5)或以下。
- 可能是肝脏分离机械吹打在缓冲区,并单独处理,在96孔板,或汇集起来,根据实验要求。
- 在E13.5胎肝〜10 7细胞。细胞染色缓冲洗两次,并在1-2 x 10 6细胞/流式细胞仪分析200μL样品重悬于。
5。抗体染色流式细胞仪
- 准备主抗体染色,预混合被用于所有的样品,对照样品除外,包含以下内容:
- ChromePure兔IgG(杰克逊015-000-003),到终浓度为200μg/ml。检查瓶子上的股权集中度(它可以改变)。这是用来阻止老鼠细胞的Fc受体,这可能用于替代物种鼠IgG或鼠IgG。树种的选择是由在对大鼠原代/鼠标/兔抗体,这些物种在这种情况下,不能使用导演的二次抗体染色协议中可能存在d为封闭抗体。另外,也可能被用来5%兔血清中纯化IgG的地方。另一种替代方法是使用鼠标Fc受体的单克隆抗体或Fab片段。下面的基本协议不包括任何辅助抗体等可用于任何种抗体。
- CD71 - FITC,稀释1:200(0.5mg/ml的股票,BD生物科学,553266)
- Ter119 - PE,稀释1:200(股票0.2mg/ml,BD Biosciences公司,553673)
- 任何额外的利益表面抗原决定簇的抗体,如抗体冲着FAS或FasL的(见1,2 )。混合抗体溶液轻轻颠倒离心管2-3次。
- 每个细胞样品加入200μL预混合,轻轻地重新悬浮细胞。
- 准备控制细胞样本如下:
- “不染”:留在这些细胞染色缓冲,并提供背景的自发荧光的细胞。
- “单色”的控制:一个这样的控制是需要为每个抗体/在协议中使用的颜色。这些控件的细胞可以直接标记的抗体染色,或与主抗体和标记的二抗。这些控制是使用正确的渠道之间的光谱重叠。
- “荧光减一”(FMO)的控制:一个这样的控制是需要在协议中,每个抗体/颜色:细胞除在协议中的所有颜色/抗体染色的颜色/这是FMO控制的抗体。 FMO控制特定通道,该通道的真实背景。它可能包括同一亚型的非特异性抗体,并与测试抗体(亚型控制)相同的荧光标记共轭。
- 45'至1小时,在黑暗中(冰水桶放在铝箔盖)在冰上孵育和有关管制的主要抗体染色。
- 孵化结束,洗细胞染色缓冲3毫升3'到5'加入到每个样品管和旋转约400 XG在4 ° C如果使用96孔板,细胞体积200μL洗三次。
- 如果相关,申请二级抗体染色。应用为第一抗体染色洗。
- 如果相关,与Annexin V的染色适用于孵化年底,制造商的指示使用一个HEPES缓冲。这个污点是适用于在室温15分钟,或在冰1小时。
- 细胞重新悬浮,流式细胞仪检测分析中包含一个细胞防渗的DNA染料染色溶液,排除死细胞。一些DNA的染料都可用,包括碘化丙啶,7 - 氨基放线菌素D(7AAD),或DAPI。在这些选择取决于可用的通道特异性抗体染色渠道,和渠道流流式细胞仪。 7AAD是从BD Biosciences公司(559925),并根据制造商的指示使用。 DAPI染色,在二甲基甲酰胺(DMF)为1mg/ml的股票从粉(罗氏,CAT#236276),保持在-20 ° C,染色缓冲液稀释1:10,000至1:15,000。
6。流流式细胞仪排序
- 细胞对CD71抗体,Ter119,宗族标记,和生存能力染料流流式细胞仪分析(第5)所述的标记。在标签的细胞浓度可提高到5 × 10 7 / ml的。
- 混合同等体积的每个下面的抗体,使宗族主结构:
- FITC标记的大鼠抗小鼠CD41 MWReg30,BD Pharmingen公司553848
- FITC标记的鼠抗小鼠CD45R/B220,RA3 - 6B2,BD Pharmingen公司553087
- FITC标记的鼠抗鼠CD3e 145 - 2C11,BD Pharmingen公司553061
- FITC标记的鼠抗鼠CD11b/Mac-1 M1/70,BD Pharmingen公司557396
- FITC标记的鼠抗鼠LY - 6G和Ly - 6C(GR - 1)的RB6 - 8C5,BD Pharmingen公司553126
- 1:80主混合使用(这相当于每个人的抗体的股票,这是所有0.5毫克/毫升,以1:400稀释)。
- 使用低压排序条件和广泛的喷嘴。对于咏叹调(BD Biosciences公司),我们用100μ喷嘴,20 psi的压力。
- 收集缓冲液:PBS与添加20%胎牛血清。
- 要检查的排序种群的纯度,重新从每个样品运行在一个缓冲区,它包含一个可行性的染料(7AAD或类似)一个小等份。
7。代表性的成果:
CD71/Ter119成人骨髓或脾脏染色确定了四个亚群的发展序列,标记PROE,尔雅,EryB EryC(图1)1 。形态,这些对应的日益成熟的红细胞。图1说明了浇注序列数据分析阶段,丢弃非常小的事件(包括细胞核,红细胞),汇总的细胞和死细胞。
可同时测量细胞表面蛋白的表达,每个子集,加入有关的抗体,同时Ter119和CD71染色。图1显示了一个细胞表面死亡受体Fas表达的例子。这种测量方法是在与欧洲专利局注入小鼠进行,或在对照组小鼠注射用生理盐水。很明显,EPO抑制Fas表达在体内 1尔雅人口。
细胞内蛋白质或细胞周期状态的表达,也可以测量细胞在每个子集。图2说明了代表刚收获的骨髓细胞的细胞周期分析。这些测量需要,除了细胞表面染色与CD71和Ter119,细胞细胞内标签(见讨论部分)的固定和通透。
在胎儿肝脏中,首先排除非红系细胞通过门控“林”的细胞,CD41负,MAC - 1,GR - 1,B220和CD3(图3)。其余细胞分分为6个亚群,S0到S5。胎儿肝脏中的细胞的精确模式是依赖于胚胎年龄(见讨论部分)。在E13.5胎肝S3子集的一个有代表性的细胞周期分析显示(图4)。
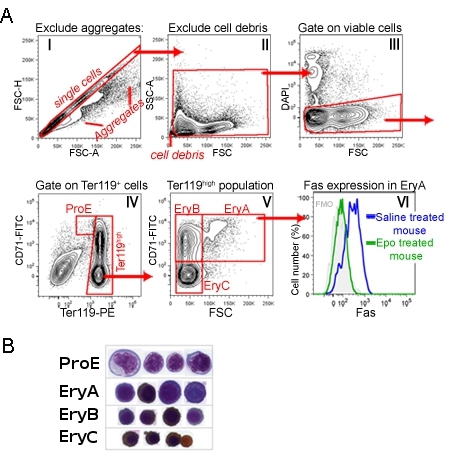
图1 CD71/Ter119红子集A.浇注战略: 在小鼠脾脏。脾细胞处理和标记CD71,Ter119和Fas抗体。此图显示了以下的数据采集步骤的分析策略。直方图我显示了所有收购的事件。对角线门事件,可能是单细胞,但不包括双峰或更大的聚合。这门细胞直方图二是进一步分析。这里非常小的事件,可能的核或碎片,被排除在外。门控单元格显示直方图三,其中的DAPI阳性细胞,有可能半透膜细胞凋亡,进一步的分析排除。直方图四显示可行的脾细胞产生的人口。 PROE门包含CD71 高 Ter119 中间细胞。 Ter119 高细胞进一步分析直方图五高在这里CD71细胞细分成不太成熟,大的“尔雅”的红细胞(CD71高 Ter119高FSC的高)和更小,更成熟的“EryB” 红细胞(CD71高Ter119 高 FSC的低) 。最成熟的红细胞的一个子集EryC(CD71低Ter119高FSC 的低) 。直方图VI,显示细胞表面Fas表达,特别是在尔雅子集,在基础状态下的小鼠(注射用生理盐水),并与单剂量注射的EPO的老鼠,。 Fas抗体染色同时CD71/Ter119染色。Cytospin细胞的每一个指定的子集进行排序的准备。细胞与姬姆萨染色,并与二氨基联苯胺,后者与血红蛋白生成褐色的污渍。刘等人最初发表Cytospin数据,血。 2006年7月1 108(1):123 - 33。 EPUB 2006年3月9日。
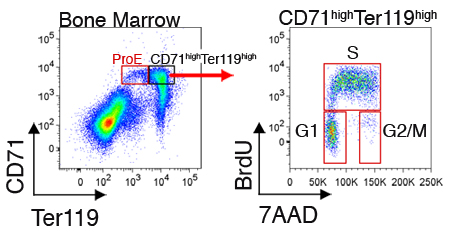
图2 CD71 高 Ter119在小鼠骨髓红细胞的细胞周期分析 。小鼠注射用BrdU腹腔,脾或骨髓收获30至60分钟后。细胞固定和通透,除了被CD71和Ter119染色,染色BrdU掺入到他们的DNA复制与BrdU定向单克隆抗体(固定,通透性和BrdU染色协议是根据制造商的指示)。 BrdU阳性细胞周期S期。间期细胞BrdU阴性和可能解决的G1或G2 / M期,使用DNA染料7AAD。
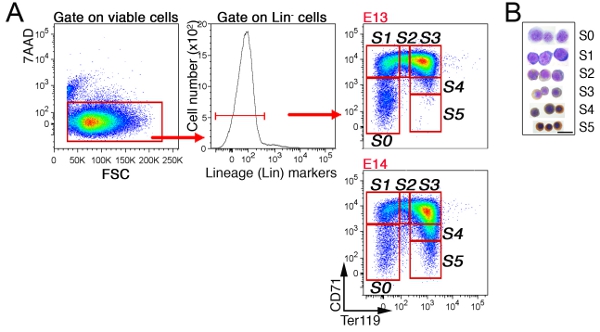
图3 CD71/Ter119红子集A.浇注战略: 在小鼠胎肝。胎肝细胞标记CD71,Ter119,并在非红系标记(“林”)执导的FITC标记的抗体鸡尾酒。林表达活菌(7AAD阴性)进行了分析,和林细胞进一步细分到S0到S5红子集。雅戈尔,是由E13胎肝细胞在成熟的S4/S5子集的情况下表现出不太成熟的红细胞,从每一个指定的子集进行排序的细胞B. Cytospin的准备工作。细胞与姬姆萨染色,并与二氨基联苯胺,后者与血红蛋白生成褐色的污渍。 Cytospin数据最初published公共科学图书馆生物学流行等 ,8(9):e1000484。作者:10.1371/journal.pbio.1000484。
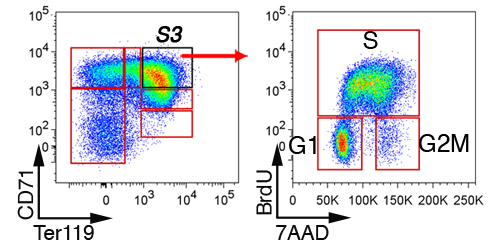
图4。胎肝红亚群细胞周期分析。孕鼠注射用BrdU,胎儿肝脏收获30至60分钟后,固定,透,并与抗体对CD71,Ter119和BrdU染色。 S3细胞的细胞周期的状态显示。
讨论
流流式细胞仪的方法允许同时调查任何可能与一个特定的荧光标记抗体或配体,包括细胞表面标志物,蛋白表达,细胞的存活,使用磷酸化特异性抗体和细胞周期状态的细胞信号检测的细胞功能。这些测量可以在每一个分化阶段的特定子集,在新鲜分离的红细胞生成组织范围内。因此,这种方法允许红细胞生成系统的不同层次的功能和分子的变化进行评估,在广泛的红细胞生成刺激或基因突变的?...
披露声明
动物实验是由马萨诸塞州医学院IACUC委员会大学规定的准则和法规的规定执行。
致谢
我们感谢麻省大学的流式细胞仪的核心是:理查德Konz,特德Giehl,芭芭拉Gosselin,粤华谷和塔米Krupoch。这项工作是由美国国立卫生研究院/ NHLBI RO1 HL084168(MS)和美国国立卫生研究院CA的T32 - 130807(JRS)。也可用于糖尿病内分泌研究中心授予DK32520支持的核心资源。
材料
| Name | Company | Catalog Number | Comments |
| 试剂名称 | 公司 | 目录编号 | |
|---|---|---|---|
| FAS -生物素 | BD Pharmingen公司 | 554256 | |
| 链霉亲和APC | 分子探针 | S868 | |
| 40微米的无菌细胞过滤器 | Fisherbrand | 22363547 | |
| 流式细胞仪染色聚苯乙烯圆底管 | 屋宇署猎鹰 | 352008 | |
| U型底96孔板 | 屋宇署猎鹰 | 353910 | |
| ChromePure兔IgG | 杰克逊ImmunoResearch | 015-000-003 | |
| CD71 - FITC(股票0.5mg/ml的) | BD -生物科学 | 553266 | |
| Ter119 - PE(股票0.2mg/ml) | BD -生物科学 | 553673 | |
| 7AAD | BD -生物科学 | 559925 | |
| DAPI染色粉 | 罗氏公司 | 236276 | |
| FITC标记的大鼠抗小鼠CD41 MWReg30 | BD Pharmingen公司 | 553848 | |
| FITC标记的大鼠抗小鼠CD45R/B220,RA3 - 6B2 | BD Pharmingen公司 | 553087 | |
| FITC标记的大鼠抗小鼠CD411b/Mac-1 M1/70 | BD Pharmingen公司 | 557396 | |
| FITC标记的鼠抗鼠LY - 6G和Ly - 6C(GR - 1)RB6 - 8C5 | BD Pharmingen公司 | 553126 | |
| FITC标记的鼠抗鼠CD3e 145 - 2C11 | BD Pharmingen公司 | 553061 | |
| APC BrdU流试剂盒 | BD Pharmingen公司 | 557892 | |
| Annexin V的抗生物素蛋白 | BD Pharmingen公司 | 556418 |
参考文献
- Liu, Y. Suppression of Fas-FasL coexpression by erythropoietin mediates erythroblast expansion during the erythropoietic stress response in. 108, 123-133 (2006).
- Socolovsky, M. Negative Autoregulation by FAS Mediates Robust Fetal Erythropoiesis. PLoS Biol. 5, e252-e252 (2007).
- Krutzik, P. O., Hale, M. B., Nolan, G. P. Characterization of the murine immunological signaling network with phosphospecific flow cytometry. J Immunol. 175, 2366-2373 (2005).
- Socolovsky, M. Ineffective erythropoiesis in Stat5a(-/-)5b(-/-) mice due to decreased survival of early erythroblasts. Blood. 98, 3261-3273 (2001).
- Guihard, S. The MAPK ERK1 is a negative regulator of the adult steady-state splenic erythropoiesis. Blood. 115, 3686-3694 (2010).
- Yu, X. An erythroid chaperone that facilitates folding of alpha-globin subunits for hemoglobin synthesis. J Clin Invest. 117, 1856-1865 (2007).
- Chen, M. L. Erythroid dysplasia, megaloblastic anemia, and impaired lymphopoiesis arising from mitochondrial dysfunction. Blood. 114, 4045-4053 (2009).
- Chen, K. Resolving the distinct stages in erythroid differentiation based on dynamic changes in membrane protein expression during erythropoiesis. Proc Natl Acad Sci U S A. 106, 17413-17418 (2009).
- McGrath, K. E., Bushnell, T. P., Palis, J. Multispectral imaging of hematopoietic cells: where flow meets morphology. J Immunol Methods. 336, 91-97 (2008).
- Pop, R. A key commitment step in erythropoiesis is synchronized with the cell cycle clock through mutual inhibition between PU.1 and S-phase progression. PLoS Biol. 8, (2010).
- Borsook, H., Lingrel, J. B., Scaro, J. L., Millette, R. L. Synthesis of haemoglobin in relation to the maturation of erythroid cells. Nature. 196, 347-350 (1962).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。