Se requiere una suscripción a JoVE para ver este contenido. Inicie sesión o comience su prueba gratuita.
Method Article
Identificación y análisis de los progenitores eritroides ratón usando el CD71/TER119 citometría de flujo ensayo
En este artículo
Resumen
Un método de citometría de flujo para la identificación y el análisis molecular de la diferenciación de etapas específicas de murino progenitores eritroides y precursores, directamente en la médula ósea recién cosechadas del ratón, el bazo o el hígado fetal. El ensayo se basa en los marcadores de superficie celular CD71, Ter119 y tamaño de la celda.
Resumen
El estudio de la eritropoyesis tiene como objetivo entender cómo las células rojas se forman a partir de progenitores hematopoyéticos y antes eritroides. En concreto, la tasa de formación de glóbulos rojos está regulada por la hormona eritropoyetina (EPO), cuya síntesis es provocada por la hipoxia tisular. Una amenaza para la adecuada oxigenación a los tejidos en los resultados de un rápido aumento de la EPO, impulsando un aumento en la tasa de eritropoyesis, un proceso conocido como la respuesta al estrés eritropoyética. El aumento resultante en el número de glóbulos rojos mejora la entrega de oxígeno tisular. Una respuesta eficaz estrés eritropoyética tanto, es fundamental para la supervivencia y la recuperación de las condiciones fisiológicas y patológicas como la altitud, anemia, hemorragia, la quimioterapia o trasplante de células madre.
El ratón es un modelo clave para el estudio de la eritropoyesis y su respuesta al estrés. Eritropoyesis definitiva del ratón (tipo adulto) se lleva a cabo en el hígado fetal entre los días embrionarias 12,5 y 15,5, en el bazo neonatal, y en el bazo y la médula ósea adulta. Los métodos clásicos de identificación de los progenitores eritroides en el tejido de confiar en la capacidad de estas células para dar lugar a colonias de glóbulos rojos cuando se siembran en la EPO que contienen medio semi-sólido. Su progenie precursores eritroides se identifican con base en criterios morfológicos. Ninguno de estos métodos clásicos permiten el acceso a un gran número de diferenciación de etapas específicas de las células eritroides para el estudio molecular. Aquí presentamos un método de citometría de flujo de identificación y estudio de la diferenciación etapa específica de los progenitores eritroides y precursores, directamente en el contexto de tejido de ratón recién aisladas. El ensayo se basa en los marcadores de superficie celular CD71, Ter119, y en la citometría de flujo parámetro "dispersión frontal, que es una función del tamaño de la celda. El ensayo CD71/Ter119 puede ser usado para estudiar los progenitores eritroides en su respuesta al estrés eritropoyética en vivo, por ejemplo, en ratones con anemia o ratones alojados en condiciones de poco oxígeno. También puede ser utilizado para estudiar los progenitores eritroides directamente en los tejidos de ratones adultos o de embriones genéticamente modificados, a fin de evaluar la función específica de la vía de modificación molecular de la eritropoyesis.
Protocolo
1. La recolección de los tejidos
- Prepare los tubos que contienen 2 a 5 ml de tampón de tinción de frío (tampón fosfato salino (PBS) con adición de 0,2% de BSA y glucosa 5 mM). Mantenga los tubos en hielo antes de la cosecha de tejidos.
- Ratones sacrificio acuerdo con el protocolo adecuado aprobado (por ejemplo, CO 2 por inhalación seguido por dislocación cervical).
- Extracción de sangre por punción cardiaca en tubos con EDTA o heparina de recogida de sangre para su posterior análisis, por ejemplo, de hematocrito, recuento de reticulocitos o análisis CBC.
- Cosecha el bazo y los huesos, la colocación de los tejidos de cada ratón en un tubo separado, preparado en el paso 1. Fácil acceso a las bazo es desde el lado izquierdo. De la médula ósea, la cosecha de uno o ambos fémures. Mantener el tejido cosechado en el hielo.
- Si lo desea, un peso del bazo. Los ratones sometidos a una respuesta de estrés eritropoyética es probable que muestran un aumento significativo en el peso del bazo.
2. Preparación de las células del bazo
- El uso de un pre-humedecidos 3 ml émbolo de la jeringa, empuje suavemente el bazo, o parte del bazo (lo ideal es 0,1 gramos o menos, lo que equivale a aproximadamente 10 8 células) a través de un filtro de 40 micras de células estériles (número de catálogo Fisherbrand 22363547 u otros) colocado en la parte superior de un tubo cónico de 50 ml. Mantenga el tubo en hielo durante este procedimiento. Lavar las células a través del filtro, con un total de 2 ml tinción de amortiguación.
- Pipeta suavemente la suspensión celular se esforzó por romper cualquier pequeños grupos. Si es necesario, re-deformación de las células.
- Lavar las células dos veces por centrifugación y vuelva a suspender en tampón frío.
- Contar las células utilizando un hemocitómetro. Los rendimientos típicos son 1.2 x 10 8 células / bazo. Para el análisis de citometría de flujo, volumen asignado 1 a 2.000.000 células por muestra, ya sea en los tubos de tinción FACS (BD Falcon de poliestireno de fondo redondo-tubos, 352 008) o de fondo en U placa de 96 pocillos (BD Falcon 353 910). Volumen de la muestra es de 200 l tinción, a una concentración final de células 0,5 a 1 x 10 7 células / ml o 1.2 x 10 6 células / muestra de 200 microlitros.
3. Preparación de las células de médula ósea
- Prepare una o jeringas de 3 ml con una aguja 26G, precargada con tinción de amortiguación frío.
- Quitar músculos que se insertan en el fémur con el fin de visualizar claramente el hueso.
- Usando tijeras quirúrgicas agudas, cortar los dos extremos del fémur, lo más cerca posible a los extremos de los huesos. Esto debe revelar un pequeño agujero en cada extremo del corte, lo que lleva en la cavidad de la médula ósea, que corre a través de la longitud del fémur.
- El uso de las jeringas precargadas en el paso 1, insertar la aguja en uno de estos agujeros, y lave cuidadosamente la médula a través del agujero en el otro extremo, en un tubo.
- Disociar las células bañadas por pipeteo suave, y la tensión a través de un colador de 40 micras, como para el bazo por encima (ver sección 2.1).
- Lavar las células dos veces por centrifugación en frío buffer de tinción
- Contar las células y resuspender como en la sección 2.4. Los rendimientos típicos son alrededor de 10 7 células por fémur.
4. Preparación de las células de hígado fetal
- Para preparar el tiempo del embarazo los ratones hembra, creado ratones para el apareamiento de la tarde, para examinar tapones vaginales antes de las 10 horas del día siguiente, el día en que se detectó el tapón vaginal se considera día 0,5. El personal veterinario puede ser capaz de ayudar a los investigadores que no están familiarizados con esta técnica para identificar a las mujeres embarazadas. El embarazo también puede ser determinado por el peso de vigilancia del ratón.
- Cronometrada embarazadas ratones hembras son sacrificadas en los días de 12,5 a 14,5 del embarazo. Los cuernos uterinos se retiran en un plato de Petri que contiene helado medio de cultivo o tinción de amortiguación.
- Los embriones se extraen de cada útero y el hígado del feto disecado es. Un microscopio de disección es necesario para el día embrionario 12.5 (E12.5) o menos.
- Hígados pueden ser disociados mecánicamente pipeteando en tampón y se procesan de forma individual en placas de 96 pozos, o agrupados en conjunto, en función de las necesidades experimentales.
- Un hígado fetal en E13.5 ha ~ 10 7 células. Las células se lavan dos veces en buffer de tinción y se resuspendió en 2.1 x 10 6 células / muestra de 200 l para el análisis de citometría de flujo.
5. Tinción de anticuerpos por citometría de flujo
- Prepare un anticuerpo primario manchas de pre-mezcla que se utilizará para todas las muestras, a excepción de las muestras de control, que contiene lo siguiente:
- ChromePure conejo IgG (Jackson, 015-000-003), a una concentración final de 200μg/ml. Comprobar la concentración de valores en la botella (puede variar). Esto se utiliza para bloquear los receptores Fc en células de ratón, especies alternativas que pueden ser utilizados para esto son IgG de ratón o rata IgG. La elección de especies se determina por la posible presencia en el protocolo de tinción de anticuerpos secundarios contra primarios de rata / ratón / conejo anticuerpos, en cuyo caso las especies no se pueden utilizard como anticuerpos bloqueantes. Por otra parte, el 5% de suero de conejo también puede ser utilizado en lugar de IgG purificada. Otra alternativa es el uso de anticuerpos monoclonales o fragmentos Fab dirigido a los receptores Fc de ratón. El protocolo básico a continuación no incluyen los anticuerpos IgG secundaria y por lo tanto de ninguna de las tres especies pueden ser utilizados.
- CD71-FITC, diluido 1:200 (stock 0.5mg/ml, BD Biosciences-, 553.266)
- Ter119-PE, diluido 1:200 (stock 0.2mg/ml, BD Biosciences-, 553673)
- Los anticuerpos adicionales dirigidos a epítopos superficie de interés, por ejemplo, anticuerpos dirigidos a Fas o FasL (ver 1,2). Mezclar la solución de anticuerpos suavemente invirtiendo el tubo 2-3 veces.
- Añadir 200 ul de la pre-mezcla para cada muestra de células y suavemente volver a suspender las células.
- Preparar las muestras de control celular de la siguiente manera:
- "Teñir": estas células se dejan en el buffer de tinción y proporcionar la autofluorescencia de fondo de las celdas.
- Controles "de un solo color: una de control, se requiere para cada anticuerpo / color que se utiliza en el protocolo. Las células de estos controles se tiñen bien con un anticuerpo primario conjugado directamente, o con ambos un anticuerpo primario y un anticuerpo secundario conjugado. Estos controles se utilizan para corregir el solapamiento espectral entre canales.
- "Fluorescencia menos uno" (FMO) controles: un control es necesario para cada anticuerpo / color en el protocolo: las células se tiñeron con todos los colores / anticuerpos en el protocolo, excepto por el color / del anticuerpo para el cual este es el control de FMO. El control de FMO para un canal en particular proporciona el fondo verdadero de ese canal. Puede incluir no específica del anticuerpo del mismo isotipo, conjugado y con la misma marca de fluorescencia como la prueba de anticuerpos (control de isotipo).
- Incubar las muestras y los controles pertinentes en el anticuerpo primario mancha en hielo durante 45 'a 1 hora en la oscuridad (colocar la cubierta de papel de aluminio en cubo de hielo).
- Al final de la incubación, se lavan las células mediante la adición de 3 ml de solución tampón de tinción para cada tubo de muestra y el giro de 3 'a 5' aproximadamente a 400 xg a 4 ° C. Si utiliza placas de 96 pocillos, se lavan las células tres veces en un volumen de 200 l.
- En su caso, aplicar el anticuerpo secundario mancha. Aplicar y lavar como para el primer anticuerpo mancha.
- Su caso, una mancha con anexina V se aplica al final de la incubación, utilizando un tampón HEPES como en las instrucciones del fabricante. Esta mancha se aplica durante 15 minutos a temperatura ambiente, o durante 1 hora en hielo.
- Las células se volvió a suspender para el análisis de citometría de flujo en la tinción de solución que contiene un tinte de ADN de células impermeable, para excluir a las células muertas. Varios colorantes de ADN están disponibles, incluyendo yoduro de propidio, 7-amino-actinomicina D (7AAD), o DAPI. La elección de entre estos depende de los canales disponibles, teniendo en cuenta los canales de toma para la tinción de anticuerpos específicos, y los canales disponibles en el citómetro de flujo. 7AAD se obtiene a partir de BD Biosciences, (559.925) y se utiliza según las instrucciones del fabricante. Para la tinción DAPI, hacer un balance de 1mg/ml en dimetilformamida (DMF) a partir de polvo (Roche, Cat # 236 276), mantener a -20 ° C y diluir 1:10.000 a 1:15.000 en buffer de tinción.
6. Citometría de flujo clasificación
- Las células son marcadas con anticuerpos contra CD71, Ter119, marcadores de linaje, y un tinte de viabilidad como se describe para el análisis por citometría de flujo (sección 5). La concentración de células durante el etiquetado puede ser mayor a 5 x 10 7 / ml.
- Mezclar un volumen igual de cada uno de los siguientes anticuerpos para hacer la mezcla maestra linaje:
- FITC rata anti-CD41 de ratón MWReg30, BD Pharmingen 553848
- FITC rata anti-ratón CD45R/B220 RA3-6B2, BD Pharmingen 553087
- Hamster FITC anti-ratón CD3e 145-2C11, BD Pharmingen 553061
- FITC rata anti-ratón CD11b/Mac-1 M1/70, BD Pharmingen 557396
- Rata FITC anti-ratón Ly-6G y Ly-6C (Gr-1) RB6-8C5, BD Pharmingen 553126
- Use la mezcla maestra a 1:80 (Esto es equivalente a 1:400 de dilución de cada anticuerpo acciones individuales, que son de 0,5 mg / ml).
- Uso bajo condiciones de presión y boquillas de clasificación de ancho. Para el Aria (BD Biosciences) utilizamos 100 μ de la boquilla, la presión de 20 psi.
- Colección de búfer: PBS con adición de 20% de suero fetal bovino.
- Para comprobar la pureza de las poblaciones ordenados, vuelva a ejecutar una pequeña alícuota de cada muestra en un búfer que contiene un tinte de viabilidad (7AAD o similar).
7. Los resultados representativos:
CD71/Ter119 coloración de los adultos de médula ósea o el bazo identifica una secuencia de desarrollo de los cuatro grupos, con la etiqueta ProE, Erya, EryB y Eryc (Figura 1) 1. Morfológicamente, estos corresponden a los eritroblastos cada vez más maduro. La Figura 1 ilustra la secuencia de disparo en la etapa de análisis de datos, lo que descarta eventos muy pequeños (incluyendo los núcleos, los glóbulos rojos), las células agregadas y las células muertas.
Expresión de proteínas de la superficie celular se puede medir de forma simultánea para cada uno de estos subconjuntos, mediante la adición de los anticuerpos relevantes en el momento mismo que Ter119 y la tinción de CD71. La figura 1 muestra un ejemplo de expresión de la superficie celular de los receptores de muerte Fas 1. Esta medición se llevó a cabo en ratones inyectados con EPO, o en el control de ratones inyectados con solución salina. Es evidente que la Epo suprime la expresión de Fas en la población Erya en vivo 1.
Expresión de las proteínas intracelulares o el estado del ciclo celular también se puede medir por las células en cada subgrupo. La figura 2 muestra un análisis representativo del ciclo celular de las células recién cosechadas de la médula ósea. Estas medidas requieren, además de la tinción de la superficie celular con CD71 y Ter119, la fijación y permeabilización de las células para el etiquetado intracelular (ver sección de Discusión).
En el hígado fetal, las células no eritroides son los primeros excluidos por gating en "Lin-'las células que son negativas para CD41, Mac-1, Gr-1, B220 y CD3 (Figura 3). Las células restantes se sub-divide en seis subgrupos, S0 a S5. La estructura precisa de las células en el hígado fetal depende de la edad embrionaria (ver sección de Discusión). Un análisis del ciclo celular representante del subgrupo de S3 en E13.5 hígado fetal se muestra (Figura 4).
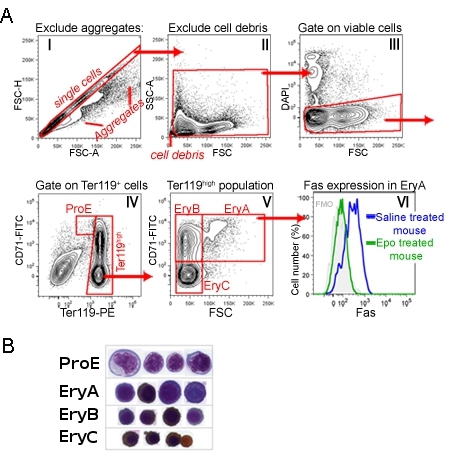
Figura 1 El CD71/Ter119 subconjuntos eritroides en el bazo del ratón estrategia de apertura de puerta A.:.. Las células del bazo fueron procesados y etiquetados con anticuerpos dirigidos a CD71, Ter119 y Fas. Esta figura muestra la estrategia de análisis después de la etapa de adquisición de datos. Histograma que muestra todos los eventos adquiridos. La puerta de diagonal representa eventos que es probable que sean las células individuales, con exclusión de dobletes o agregados más grandes. Las celdas de esta puerta se analizan más en el histograma II. Acontecimientos que tienen lugar muy pequeño, probablemente núcleos o residuos, están excluidos. Las células cerradas se muestran en el histograma III, donde DAPI de células positivas, que probablemente permeable la membrana de las células apoptóticas, se excluyen del análisis posterior. Histograma IV muestra la población como resultado de las células del bazo viable. La puerta de ProE contiene CD71 de alta Ter119 células intermedias. Ter119 células de alta se analizan más en el histograma V. Aquí CD71 células de alta se subdividen en menos maduros, grandes 'Erya' eritroblastos (CD71 Ter119 alta alta alta FSC) y el más pequeño, más maduro "EryB 'eritroblastos (CD71 alta Ter119 alto bajo FSC) . El subconjunto eritroblastos más madura es Eryc (CD71 baja Ter119 alto bajo FSC). VI histograma muestra la superficie celular expresión de Fas, específicamente en el subconjunto Erya, en ratones, en el estado basal (inyección de solución salina), y los ratones inyectados con una sola dosis de EPO. Tinción con el anticuerpo Fas se llevó a cabo simultáneamente con la tinción CD71/Ter119. B. Cytospin preparativos de células seleccionadas de cada uno de los subgrupos indicó. Las células fueron teñidas con Giemsa y con Diaminobencidina, este último genera una mancha marrón con la hemoglobina. Datos Cytospin fue publicado originalmente en Liu et al., Blood. 2006 01 de julio, 108 (1) :123-33. Epub 2006 09 de marzo.
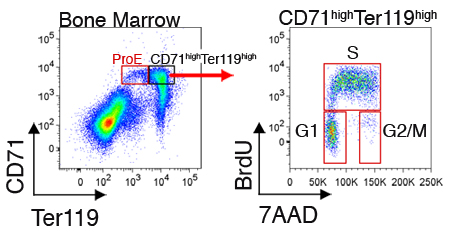
Figura 2. Análisis del ciclo celular de CD71 de alta Ter119 eritroblastos de alta en la médula ósea de ratones. Los ratones fueron inyectados por vía intraperitoneal con BrdU y el bazo o la médula ósea fueron cosechadas 30 a 60 minutos más tarde. Las células fueron fijadas y permeabilized y además de ser teñidas con CD71 y Ter119, se tiñeron de incorporación de BrdU en su ADN replicar con un anticuerpo monoclonal dirigido a BrdU (protocolo de fijación, la permeabilización y BrdU mancha fue de acuerdo a las instrucciones del fabricante). BrdU-positivas las células se encuentran en la fase S del ciclo. Las células en interfase se BrdU-negativas y pueden ser resueltos en las fases G1 y G2 / M, utilizando el ADN tinte 7AAD.
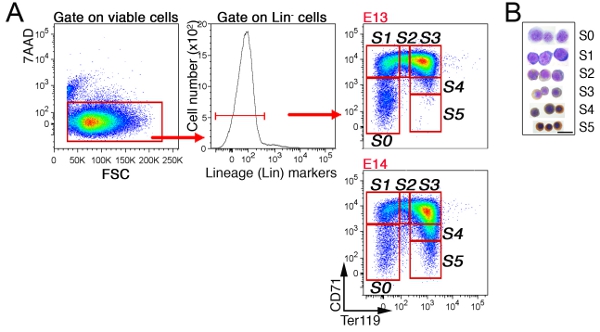
Figura 3 CD71/Ter119 subconjuntos eritroides en el hígado fetal de ratón A. estrategia de apertura de puerta:.. Las células fetales de hígado fueron etiquetados para CD71, Ter119, y un cóctel de FITC anticuerpos dirigidos a marcadores de linaje no eritroides ('Lin'). Células viables (7AAD negativos) fueron analizados para la expresión de Lin, y el Lin-células se subdividen en los S0 a S5 subconjuntos eritroides. Joven, E13 hígado fetal se compone de eritroblastos menos maduros, que se muestra por la ausencia de células maduras en el S4/S5 subconjuntos. B. Cytospin preparativos de las células se separa de cada uno de los subgrupos indicó. Las células fueron teñidas con Giemsa y con Diaminobencidina, este último genera una mancha marrón con la hemoglobina. Datos Cytospin fue originalmente pPrevistos en Pop et al, PLoS Biol 8 (9):. e1000484. doi: 10.1371/journal.pbio.1000484.
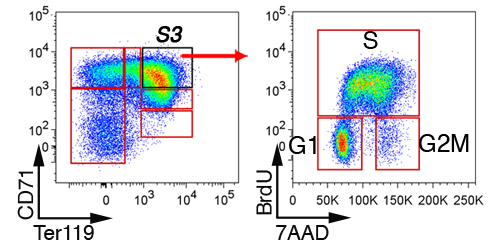
Figura 4. Análisis del ciclo celular de hígado fetal subconjuntos eritroides. Ratones embarazadas fueron inyectados con BrdU, y el hígado fetal se cosecharon 30 a 60 minutos después, fijo, permeabilized y teñidas con anticuerpos contra CD71, Ter119 y BrdU. El ciclo celular de las células de S3 se muestra.
Access restricted. Please log in or start a trial to view this content.
Discusión
La metodología de citometría de flujo permite la investigación simultánea de cualquier función celular que puede ser detectada con un anticuerpo específico conjugado con fluorescencia o ligando, incluidos los marcadores de superficie celular, expresión de la proteína, la supervivencia celular, la señalización celular utilizando fosfato anticuerpos específicos 3 y el estado del ciclo celular. Estas mediciones se pueden hacer en cada uno de una serie de subgrupos específicos de la etapa de diferenci...
Access restricted. Please log in or start a trial to view this content.
Divulgaciones
Los experimentos con animales se realizaron de acuerdo con las directrices y normas establecidas por la Universidad de Massachusetts Medical School IACUC comité.
Agradecimientos
Damos las gracias a la base de citometría de flujo la Universidad de Massachusetts: Richard Konz, Giehl Ted, Gosselin Barbara, Gu Yuehua y Krupoch Tammy. Este trabajo fue financiado por NIH / NHLBI RO1 HL084168 (MS) y NIH CA T32-130 807 (JRS). Los recursos básicos con el apoyo de la Diabetes Endocrinología del Centro de Investigación de subvención DK32520 también fueron utilizados.
Access restricted. Please log in or start a trial to view this content.
Materiales
| Name | Company | Catalog Number | Comments |
| Nombre del reactivo | Empresa | Número de catálogo | |
|---|---|---|---|
| Fas-biotina | BD Pharmingen | 554256 | |
| Estreptavidina-APC | Las sondas moleculares | S868 | |
| 40 micras filtro de células estériles | Fisherbrand | 22363547 | |
| Poliestireno de fondo redondo de tubos para la tinción FACS | BD Falcon | 352008 | |
| De fondo en U placa de 96 pocillos | BD Falcon | 353910 | |
| ChromePure conejo IgG | Jackson ImmunoResearch | 015-000-003 | |
| CD71-FITC (stock 0.5mg/ml) | BD Biosciences- | 553266 | |
| Ter119-PE (stock 0.2mg/ml) | BD Biosciences- | 553673 | |
| 7AAD | BD Biosciences- | 559925 | |
| DAPI en polvo | Roche | 236276 | |
| FITC rata anti-CD41 de ratón MWReg30 | BD Pharmingen | 553848 | |
| FITC rata anti-ratón CD45R/B220 RA3-6B2 | BD Pharmingen | 553087 | |
| FITC rata anti-ratón CD411b/Mac-1 M1/70 | BD Pharmingen | 557396 | |
| Rata FITC anti-ratón Ly-6G y Ly-6C (Gr-1) RB6-8C5 | BD Pharmingen | 553126 | |
| Hamster FITC anti-ratón CD3e 145-2C11 | BD Pharmingen | 553061 | |
| APC BrdU flujo kit | BD Pharmingen | 557892 | |
| Anexina V-biotina | BD Pharmingen | 556418 |
Referencias
- Liu, Y. Suppression of Fas-FasL coexpression by erythropoietin mediates erythroblast expansion during the erythropoietic stress response in. 108, 123-133 (2006).
- Socolovsky, M. Negative Autoregulation by FAS Mediates Robust Fetal Erythropoiesis. PLoS Biol. 5, e252-e252 (2007).
- Krutzik, P. O., Hale, M. B., Nolan, G. P. Characterization of the murine immunological signaling network with phosphospecific flow cytometry. J Immunol. 175, 2366-2373 (2005).
- Socolovsky, M. Ineffective erythropoiesis in Stat5a(-/-)5b(-/-) mice due to decreased survival of early erythroblasts. Blood. 98, 3261-3273 (2001).
- Guihard, S. The MAPK ERK1 is a negative regulator of the adult steady-state splenic erythropoiesis. Blood. 115, 3686-3694 (2010).
- Yu, X. An erythroid chaperone that facilitates folding of alpha-globin subunits for hemoglobin synthesis. J Clin Invest. 117, 1856-1865 (2007).
- Chen, M. L. Erythroid dysplasia, megaloblastic anemia, and impaired lymphopoiesis arising from mitochondrial dysfunction. Blood. 114, 4045-4053 (2009).
- Chen, K. Resolving the distinct stages in erythroid differentiation based on dynamic changes in membrane protein expression during erythropoiesis. Proc Natl Acad Sci U S A. 106, 17413-17418 (2009).
- McGrath, K. E., Bushnell, T. P., Palis, J. Multispectral imaging of hematopoietic cells: where flow meets morphology. J Immunol Methods. 336, 91-97 (2008).
- Pop, R. A key commitment step in erythropoiesis is synchronized with the cell cycle clock through mutual inhibition between PU.1 and S-phase progression. PLoS Biol. 8, (2010).
- Borsook, H., Lingrel, J. B., Scaro, J. L., Millette, R. L. Synthesis of haemoglobin in relation to the maturation of erythroid cells. Nature. 196, 347-350 (1962).
Access restricted. Please log in or start a trial to view this content.
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados