A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
זיהוי וניתוח של אבות עכבר Erythroid באמצעות CD71/TER119 Flow-cytometric Assay
In This Article
Summary
שיטה זרימה cytometric לזיהוי וניתוח מולקולרית של התמיינות בשלב ספציפי אבות Murine erythroid ומבשרי, ישירות במח שאך שנקטפו עכבר העצם, בטחול או בכבד העובר. Assay מסתמך על פני קרום התא הסמנים CD71, Ter119, וגודל התא.
Abstract
המחקר של erythropoiesis שמטרתו להבין כיצד תאים אדומים נוצרים אבות hematopoietic מוקדם erythroid. באופן ספציפי, קצב היווצרות תא אדום מווסתת על ידי ההורמון אריתרופויאטין (EPO), אשר מופעלת על ידי סינתזה היפוקסיה ברקמה. איום על תוצאות נאות חמצון הרקמות לעלייה מהירה Epo, נהיגה עלייה בשיעור erythropoietic, תהליך המכונה תגובת דחק erythropoietic. הגידול וכתוצאה מכך מספר מחזורי תאים אדומים משפר את אספקת החמצן לרקמות. התגובה היעילה מתח erythropoietic ולכן קריטי להישרדות והתאוששות ממצבים פיזיולוגיים ופתולוגיים כגון בגובה רב, אנמיה, דימום, כימותרפיה או השתלת תא גזע.
העכבר הוא מודל מפתח לחקר erythropoiesis ואת תגובת הלחץ שלו. Erythropoiesis עכבר סופי (מבוגרים סוג) מתרחש בכבד העובר בין ימים עובריים 12.5 ו - 15.5, הטחול בילוד, ועל הטחול מבוגרים מוח העצם. שיטות קלאסיות של זיהוי אבות erythroid ברקמות לסמוך על יכולתם של תאים אלה כדי להצמיח מושבות תאים אדום כאשר מצופה ב Epo המכילים מוצקים למחצה בתקשורת. הצאצאים שלהם erythroid מבשר מזוהים על פי קריטריונים מורפולוגיים. אף אחת השיטות הקלאסיות לאפשר גישה למספר גדול של בידול בשלב ספציפי בתאי erythroid למחקר המולקולרי. כאן אנו מציגים שיטה זרימה cytometric לזהות וללמוד בידול בשלב ספציפי אבות erythroid ומבשרי, ישירות בהקשר של רקמות העכבר מבודדים טרי. Assay מסתמך על פני קרום התא הסמנים CD71, Ter119, ועל פרמטר זרימת cytometric "קדימה להתפזר", אשר הוא פונקציה של גודל התא. Assay CD71/Ter119 ניתן ללמוד אבות erythroid במהלך התגובה שלהם ללחץ erythropoietic in vivo, למשל, בעכברים או בעכברים אנמי שוכנו בתנאים חמצן נמוכה. זה עשוי לשמש גם כדי ללמוד אבות erythroid ישירות ברקמות של עוברי עכברים בוגרים או מהונדסים גנטית, כדי להעריך את התפקיד הספציפי של מסלול מולקולרי שונה ב erythropoiesis.
Protocol
1. קציר של רקמות
- הכן צינורות המכיל 2-5 מכתים קר מ"ל חוצץ (בופר פוספט (PBS) עם ארגון ה-BSA הוסיף 0.2% ו גלוקוז 5 מ"מ). שמור צינורות על הקרח לפני הקציר רקמות.
- עכברים ללקט על פי פרוטוקול שאושר המתאים (למשל 2 משאיפת CO ואחריו נקע בצוואר הרחם).
- להקיז דם על ידי דקירה לתוך הלב EDTA או הפרין דם אוסף צינורות לצורך ניתוח מאוחר יותר, למשל של המטוקריט, לספור reticulocyte או ניתוח CBC.
- קציר את הטחול ואת העצמות, הרקמות הצבת מהעכבר כל בצינור נפרד, מוכן בשלב 1. גישה נוחה הטחול הוא מצד שמאל. במשך הקציר, מח עצם אחת או בשתי עצמות הירך. שמור רקמות שנקטפו על הקרח.
- אם תרצה, לשקול את הטחול. עכברים שעברו מענה הלחץ erythropoietic צפויים להראות עלייה משמעותית במשקל הטחול.
2. הכנת התאים הטחול
- באמצעות טרום לחלח 3 מ"ל במזרק הבוכנה, בעדינות לדחוף את הטחול, או חלק של הטחול (באופן אידיאלי, 0.1 גרם או פחות, שווה ערך ל כ 10 8 תאים) דרך מסננת 40 מיקרומטר סטרילי תאים (מספר קטלוג Fisherbrand 22363547 או אחר) מונח על גבי צינור חרוטי 50 מ"ל. שמור את הצינור על הקרח במהלך הליך זה. לשטוף את התאים דרך המסננת עם סך של חיץ 2 מכתים מ"ל.
- בעדינות פיפטה ההשעיה תא מתוחים כדי לשבור את כל גושים קטנים. במידת הצורך, מחדש תאים המתח.
- לשטוף את התאים פעמיים על ידי צנטריפוגה מחדש להשעות במאגר קר.
- ספירת התאים באמצעות hemocytometer. התשואות אופייניים 1-2 x 10 8 תאים / טחול. לניתוח זרימת cytometry, aliquote 1-2000000 תאים לפי המדגם, או לתוך צינורות FACS מכתים (פוליסטירן BD פלקון מסביב לתחתית צינורות, 352008) או U-96 צלחת תחתית היטב (BD פלקון 353,910). מכתים נפח דגימה היא 200 μl, ריכוז תא הסופי 0.5-1 7 x 10 תאים / מ"ל או 1-2 x 10 6 תאים / μl מדגם 200.
3. הכנת מח עצם לתאי
- הכן 1 או 3 מזרקים מ"ל עם מחט 26G המצורפת, מראש מלא חיץ מכתים קר.
- הסר השרירים המחוברים הירך כדי להמחיש את עצם בבירור.
- בעזרת מספריים חדים כירורגית, לגזור את שני הקצוות של עצם הירך, קרוב ככל האפשר אל קצות העצם. זה צריך לגלות חור קטן בכל קצה לחתוך, מובילה לחלל מח עצם, אשר פועל באמצעות אורך עצם הירך.
- באמצעות טרום מלא מזרקים בשלב 1, הכנס את המחט דרך אחד החורים האלה, בעדינות ולשטוף את מוח החוצה דרך החור בקצה השני, לתוך צינור.
- לנתק את התאים סמוקות ידי pipetting עדין, ומתח דרך מסננת 40 מיקרומטר כמו הטחול לעיל (ראה סעיף 2.1).
- שטפו תאים פעמיים על ידי צנטריפוגה במאגר מכתים קר
- ספירת התאים resuspend כאמור בסעיף 2.4. התשואות אופייניים הם כ -10 7 תאים לכל עצם הירך.
4. הכנת תאים בכבד העובר
- כדי להכין מתוזמן בהריון נקבות עכברים, עכברים להגדיר עבור הזדווגות בערב; לבחון עבור תקעים הנרתיק לפני 10:00 ביום שלמחרת, היום שבו את התקע הנרתיק מזוהה נחשבת היום 0.5. הצוות הווטרינרי יוכלו לסייע לחוקרים שאינם מכירים את הטכניקה הזו כדי לזהות נקבות בהריון. הריון יכול להיות גם נקבע על ידי משקל העכבר ניטור.
- מתוזמן בהריון נקבות עכברים ונבחרים בימים 12.5-14.5 של ההריון. קרניים הרחם יוסרו לתוך צלחת פטרי המכילה קר כקרח בינוני תרבות או חיץ מכתים.
- עוברים יוסרו מן הרחם כל הכבד העוברי הוא גזור. מיקרוסקופ לנתח נדרש יום עובריים 12.5 (E12.5) או צעירים יותר.
- כבדים עשויים להיות מנותקת באופן מכני על ידי pipetting במאגר, וכן מעובדים או בנפרד 96 צלחות טוב, או אספו יחד, בהתאם לדרישות הניסוי.
- בכבד העובר על E13.5 יש 7 ~ 10 תאים. תאים נשטפים פעמיים מכתים חיץ resuspended ב 1-2 x 10 6 תאים / 200 מדגם μl לניתוח זרימת cytometric.
5. נוגדן מכתים עבור cytometry זרימה
- הכינו נוגדן ראשוני מכתים מראש לערבב לשמש כל הדגימות, למעט דגימות שליטה, המכיל את הפעולות הבאות:
- ChromePure הארנב IgG (ג'קסון, 015-000-003), ריכוז סופי של 200μg/ml. בדוק את ריכוז המניות על הבקבוק (זה יכול להשתנות). זה משמש כדי לחסום קולטנים Fc בתאי עכבר, מינים אלטרנטיביים שעשויים לשמש זה עכבר או עכברוש IgG IgG. הבחירה המינים נקבעת על ידי נוכחות פוטנציאל בפרוטוקול מכתים של נוגדנים המכוונים נגד משני עכברוש העיקרי / עכבר / ארנב נוגדנים, ובמקרה מינים אלה לא ניתן להשתמשד כמו נוגדנים חוסמים. לחלופין, סרום ארנבת 5% יכול לשמש גם במקום מטוהרים IgG. חלופה נוספת היא השימוש נוגדנים חד שבטיים או שברי Fab מכוון את הקולטנים Fc העכבר. פרוטוקול בסיסי להלן אינו כולל נוגדנים משני ולכן IgG של כל שלושת המינים ניתן להשתמש.
- CD71-FITC, 1:200 מדולל (מניות 0.5mg/ml, BD-Biosciences, 553,266)
- Ter119-PE, מדולל 1:200 (מניות 0.2mg/ml, BD-Biosciences, 553,673)
- כל נוגדנים נוספים המכוונים epitopes פני השטח של עניין, כגון נוגדנים המכוונים פאס או FasL (ראה 1,2). מערבבים את הפתרון נוגדן בעדינות על ידי צינור היפוך 2-3 פעמים.
- הוסף 200 μl של תערובת טרום לטעום כל תא בעדינות מחדש להשעות את התאים.
- הכינו דגימות תאים בקרת כדלקמן:
- "בלא כתם": תאים אלה נותרו מכתים חיץ ולספק את autofluorescence הרקע של התאים.
- שולטת "צבע יחיד": אחד לשלוט כזה נדרש כל נוגדן / צבע השתמשו בפרוטוקול. התאים שולטת אלה מוכתם או עם נוגדן ראשוני מצומדות ישירות, או עם נוגדן שני ראשוניים נוגדן משני מצומדות. בקרות אלה משמשים לתיקון חפיפה ספקטרלית בין ערוצים.
- "הקרינה מינוס אחד" (FMO) שולטת: פקד אחד כזה נדרש כל נוגדן / צבע בפרוטוקול: תאים מגואלות את כל הצבעים / נוגדנים בפרוטוקול למעט צבע / נוגדנים עבורו זהו לשלוט FMO. השליטה FMO עבור ערוץ מסוים מספק את הרקע נכון גם לגבי ערוץ זה. זה עשוי לכלול הלא ספציפית של נוגדן אלוטיפ זהה, מצומדות עם סימן את הקרינה כמו נוגדנים במבחן (שליטה אלוטיפ).
- דגימות דגירה בקרות רלוונטיות הנוגדן העיקרי כתם על קרח למשך 45 'עד 1 שעה בחושך (לשים רדיד אלומיניום לכסות על דלי קרח).
- בסוף הדגירה, לשטוף את התאים על ידי הוספת 3ml של חיץ מכתים את הצינור בכל מדגם ספין עבור 3 'ל 5' ב XG כ 400 ב 4 ° C. אם אתה משתמש 96 צלחות טוב, לשטוף את התאים שלוש פעמים בהיקף של μl 200.
- אם רלוונטי, להחיל נוגדנים משני הכתם. החל לשטוף כמו הנוגדן first הכתם.
- אם רלוונטי, כתם עם Annexin V מוחל בסוף הדגירה, באמצעות חיץ hepes כפי הוראות היצרן. כתם זה מוחל במשך 15 דקות בטמפרטורת חדר, או במשך שעה 1 על הקרח.
- תאים הם מחדש מושעה לניתוח זרימת cytometry ב מכתים תמיסה המכילה צבע התא חדיר DNA, להוציא תאים מתים. צבעי ה-DNA קיימות מספר, כולל יודיד Propidium, 7-אמינו actinomycin D (7AAD), או DAPI. הבחירה מקרב אלה תלויה הערוצים הזמינים, בהתחשב ערוצי נלקח עבור מכתים נוגדן ספציפי, ערוצים זמינים על cytometer-הזרם. 7AAD מתקבל BD-Biosciences (559,925) ו משומשות בהתאם להוראות היצרן. עבור מכתים DAPI, להפוך מלאי של 1mg/ml ב dimethylformamide (DMF) מן אבקה (רוש, חתול # 236276), לשמור ב -20 ° C, כדי לדלל 1:10,000 1:15,000 ב מכתים חיץ.
6. Flow-cytometric מיון
- תאים מסומנים עם נוגדנים כנגד CD71, Ter119, סמנים השושלת, לבין צבע הכדאיות כמתואר לניתוח זרימת cytometric (סעיף 5). ריכוז נייד במהלך תיוג ניתן להעלות את 5 x 10 7 / מ"ל.
- מערבבים נפח שווה של כל אחד נוגדנים הבאים כדי להפוך את תמהיל אב השושלת:
- FITC עכברוש Anti-CD41 עכבר MWReg30, BD Pharmingen 553848
- FITC עכברוש אנטי עכבר CD45R/B220 RA3-6B2, BD Pharmingen 553087
- FITC אוגר אנטי עכבר CD3e 145-2C11, BD Pharmingen 553061
- FITC אנטי עכבר עכברוש CD11b/Mac-1 M1/70, BD Pharmingen 557396
- FITC אנטי עכבר עכברוש Ly-6g ו Ly-6C (Gr-1) RB6-8C5, BD Pharmingen 553126
- השתמש לערבב אמן 1:80 (זה שווה דילול 1:400 של כל מניות נוגדן יחיד, אשר כל 0.5 מ"ג / מ"ל).
- השתמש בלחץ נמוך התנאים מיון חרירי רחב. עבור Aria (BD Biosciences) אנו משתמשים זרבובית μ 100, 20 בלחץ psi.
- אוסף חיץ: PBS עם הוסיפה 20% בסרום שור עוברית.
- כדי לבדוק את purities של האוכלוסיות מיון, להפעיל מחדש aliquot קטן מכל מדגם במאגר המכיל צבען הכדאיות (7AAD או דומה).
7. נציג תוצאות:
CD71/Ter119 מכתים של מח עצם, מבוגר או הטחול מזהה הרצף ההתפתחותי של ארבע קבוצות משנה, ProE שכותרתו, EryA, EryB ו EryC (איור 1) 1. מורפולוגית, אלה מתאימות erythroblasts בוגרת יותר ויותר. איור 1 מדגים את רצף gating בשלב ניתוח הנתונים, אשר מבטלת את אירוע קטן מאוד (כולל תאים גרעינים אדום), התאים מצטברים התאים המתים.
ביטוי של חלבונים על פני קרום התא ניתן למדוד בו זמנית עבור כל תת אלו, על ידי הוספת נוגדנים רלוונטיים באותו זמן כמו Ter119 ו CD71 מכתים. איור 1 מציג דוגמה של הביטוי על פני קרום התא של הקולטן מוות פאס 1. מדידה זו בוצעה עכברים שהוזרק עם EPO, או עכברים שליטה הזריק עם מלוחים. ניכר כי Epo מדכאת ביטוי Fas באוכלוסייה EryA in vivo 1.
ביטוי של חלבונים תאיים או מחזור מעמד התא יכול להיות גם נמדד תאים משנה כל אחד. איור 2 ממחיש מחזור התא נציג ניתוח של תאים במח העצם שנקטפו זה עתה. מדידות אלה דורשים, בנוסף מכתים תא השטח עם CD71 ו Ter119, את קיבעון ו permeabilization של תאים עבור תיוג תאיים (ראה סעיף דיון).
בכבד העובר, ללא erythroid תאים ייכללו הראשון על תאים "לין," כי הם שליליים עבור CD41, Mac-1, Gr-1, B220 ו CD3 (איור 3) על ידי gating. התאים הנותרים מתחלקים לתוך תת 6, S0 ל S5. דפוס הפעולה המדויק של תאים בכבד העובר תלוי גיל עובריים (ראה סעיף דיון). מחזור התא נציג ניתוח של תת S3 בכבד E13.5 העובר מוצג (איור 4).
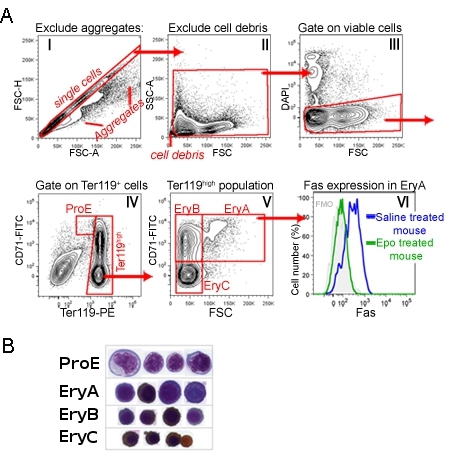
איור 1 CD71/Ter119 תת erythroid הטחול עכבר אסטרטגיה gating א:.. תאים הטחול עובדו ומסומן עם נוגדנים המכוונים CD71, Ter119 ו פאס. נתון זה מראה את האסטרטגיה ניתוח הנתונים הבאים צעד הרכישה. היסטוגרמה אני מראה את כל האירועים רכשה. השער אלכסוני מייצג אירועים צפויים להיות תאים בודדים, ללא כפילויות או אגרגטים גדולים יותר. תאים השער הזה מנותחים נוספת II היסטוגרמה. אירועים כאן קטן מאוד, פסולת גרעינים או סביר, אינם נכללים. התאים מגודרת מוצגים III היסטוגרמה, שם DAPI חיובי תאים, שסביר קרום חדיר תאים אפופטוטיים, אינם נכללים ניתוח נוסף. IV היסטוגרמה מציגה את האוכלוסייה וכתוצאה מכך התאים הטחול קיימא. השער ProE מכיל CD71 גבוה Ter119 תאים ביניים. Ter119 תאים גבוה מנותחים נוספת היסטוגרמה V. כאן CD71 בתאים גבוה מחולקים פחות בוגר, erythroblasts גדול "EryA" (CD71 Ter119 גבוה גבוה גבוה FSC) ו קטן יותר, בוגרת יותר erythroblasts "EryB" (CD71 Ter119 גבוה גבוה נמוך FSC) . משנה erythroblast הבשל ביותר הוא EryC (CD71 נמוך Ter119 גבוה FSC נמוך). VI היסטוגרמה מראה על פני קרום התא ביטוי פאס, במיוחד בתת EryA, בעכברים במצב הבסיסי (מוזרק עם מלח), וכן עכברים שהוזרק עם מנה אחת של EPO. מכתים עם נוגדן פאס בוצעה בו זמנית עם מכתים CD71/Ter119. B. ההכנות Cytospin של תאים ממוינים מכל אחד תת המצוין. תאים הוכתמו Giemsa ועם Diaminobenzidine, הלה יוצר כתם חום עם המוגלובין. נתונים Cytospin פורסם במקור ליו et al. דם. 1 יולי 2006; 108 (1) :123-33. Epub 9 מרס 2006.
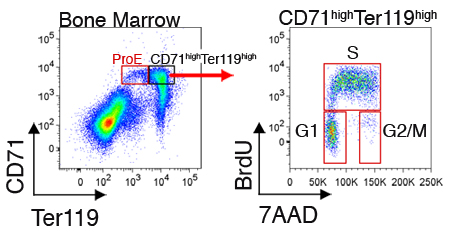
איור 2. מחזור התא ניתוח CD71 Ter119 erythroblasts הגבוה במח העצם העכבר. עכברים הוזרקו intraperitoneally עם BrdU, והטחול או מח עצם נבצרו 30 עד 60 דקות מאוחר יותר. תאים היו קבועים permeabilized ו בנוסף להיותו מוכתם עבור CD71 ו Ter119, היו מוכתמים עבור התאגדות BrdU לתוך ה-DNA שכפול שלהם עם נוגדן חד שבטי המכוון BrdU (פרוטוקול, קיבעון permeabilization ו-BrdU מכתים היה על פי הוראת היצרן). BrdU חיובי התאים בשלב-S של מחזור. תאים שלבי הביניים הם BrdU שלילי וניתן לפתור לשלבים G1 או G2 / M, באמצעות ה-DNA לצבוע 7AAD.
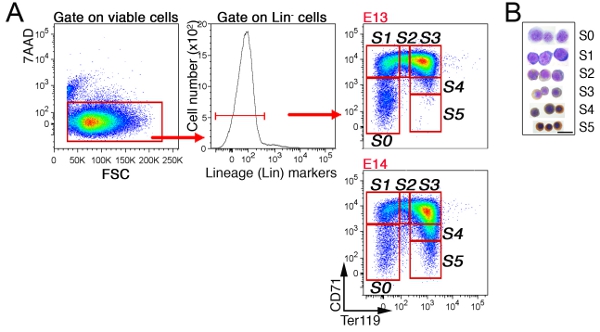
איור 3 CD71/Ter119 תת erythroid בכבד עכבר עוברי אסטרטגיה gating א:.. בתאי הכבד עוברית תויגו עבור CD71, Ter119, ואת קוקטייל של FITC שכותרתו נוגדנים המכוונים לא erythroid סמנים השושלת ("לין"). תאים חיים (7AAD שלילי) נותחו לביטוי לין, ואת לין תאים מחולקים נוספת לתוך S0 כדי S5 תת erythroid. הצעיר, E13 בכבד העובר מורכב erythroblasts פחות בוגר, שמוצג על ידי בהעדר תאים S4/S5 תת בוגר. B. ההכנות Cytospin של תאים ממוינים מכל אחד תת המצוין. תאים הוכתמו Giemsa ועם Diaminobenzidine, הלה יוצר כתם חום עם המוגלובין. נתונים Cytospin היה במקור published ב פופ ואח', PLoS Biol 8 (9):. e1000484. doi: 10.1371/journal.pbio.1000484.
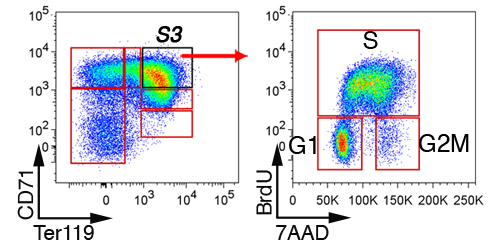
איור 4. מחזור התא ניתוח של תת בכבד העובר erythroid. עכברים הרות הוזרקו BrdU, ואת הכבדים העובר נבצרו 30 עד 60 דקות מאוחר יותר, קבוע, permeabilized, ומוכתמת עם נוגדנים נגד CD71, Ter119 ו BrdU. מחזור התא מעמד של תאים S3 מוצג.
Discussion
המתודולוגיה זרימה cytometric מאפשר חקירה סימולטני של כל פונקציה תאית עשויה להתגלות עם נוגדן פלואורסצנטי, מצומדות ליגנד ספציפי או, כולל משטח סמנים התא, ביטוי חלבון, הישרדות התא, מאותת לתא באמצעות נוגדנים ספציפיים phospho 3 מחזור מצב התא. מדידות אלה עשויים להיות בכל מספר ?...
Disclosures
ניסויים בבעלי חיים בוצעו בהתאם להנחיות והתקנות שנקבעו על ידי אוניברסיטת מסצ'וסטס בבית הספר לרפואה IACUC הוועדה.
Acknowledgements
אנו מודים הליבה UMass cytometry זרימה: ריצ'רד Konz, טד Giehl, ברברה גוזלן, Yuehua גו ותמי Krupoch. עבודה זו מומנה על ידי NIH / NHLBI RO1 HL084168 (MS) ו-NIH CA T32-130807 (JRS). משאבים Core נתמך על ידי לאנדוקרינולוגיה וסוכרת במרכז המחקר מענק DK32520 שימשו גם.
Materials
| Name | Company | Catalog Number | Comments |
| שם מגיב | חברה | מספר קטלוגי | |
|---|---|---|---|
| פאס-ביוטין | BD Pharmingen | 554256 | |
| Streptavidin-APC | מולקולרית בדיקות | S868 | |
| 40 מיקרומטר תא סטרילי מסננת | Fisherbrand | 22363547 | |
| פוליסטירן מסביב לתחתית צינורות עבור מכתים FACS | BD פלקון | 352008 | |
| U-96 גם צלחת תחתית | BD פלקון | 353910 | |
| ChromePure הארנב IgG | ג'קסון ImmunoResearch | 015-000-003 | |
| CD71-FITC (מניות 0.5mg/ml) | BD-Biosciences | 553266 | |
| Ter119-PE (מניות 0.2mg/ml) | BD-Biosciences | 553673 | |
| 7AAD | BD-Biosciences | 559925 | |
| DAPI אבקת | רוש | 236276 | |
| FITC עכברוש Anti-CD41 עכבר MWReg30 | BD Pharmingen | 553848 | |
| FITC עכברוש אנטי עכבר CD45R/B220 RA3-6B2 | BD Pharmingen | 553087 | |
| FITC עכברוש אנטי עכבר CD411b/Mac-1 M1/70 | BD Pharmingen | 557396 | |
| FITC אנטי עכבר עכברוש Ly-6g ו Ly-6C (Gr-1) RB6-8C5 | BD Pharmingen | 553126 | |
| FITC אוגר אנטי עכבר CD3e 145-2C11 | BD Pharmingen | 553061 | |
| APC BrdU תזרים ערכת | BD Pharmingen | 557892 | |
| Annexin V-ביוטין | BD Pharmingen | 556418 |
References
- Liu, Y. Suppression of Fas-FasL coexpression by erythropoietin mediates erythroblast expansion during the erythropoietic stress response in. 108, 123-133 (2006).
- Socolovsky, M. Negative Autoregulation by FAS Mediates Robust Fetal Erythropoiesis. PLoS Biol. 5, e252-e252 (2007).
- Krutzik, P. O., Hale, M. B., Nolan, G. P. Characterization of the murine immunological signaling network with phosphospecific flow cytometry. J Immunol. 175, 2366-2373 (2005).
- Socolovsky, M. Ineffective erythropoiesis in Stat5a(-/-)5b(-/-) mice due to decreased survival of early erythroblasts. Blood. 98, 3261-3273 (2001).
- Guihard, S. The MAPK ERK1 is a negative regulator of the adult steady-state splenic erythropoiesis. Blood. 115, 3686-3694 (2010).
- Yu, X. An erythroid chaperone that facilitates folding of alpha-globin subunits for hemoglobin synthesis. J Clin Invest. 117, 1856-1865 (2007).
- Chen, M. L. Erythroid dysplasia, megaloblastic anemia, and impaired lymphopoiesis arising from mitochondrial dysfunction. Blood. 114, 4045-4053 (2009).
- Chen, K. Resolving the distinct stages in erythroid differentiation based on dynamic changes in membrane protein expression during erythropoiesis. Proc Natl Acad Sci U S A. 106, 17413-17418 (2009).
- McGrath, K. E., Bushnell, T. P., Palis, J. Multispectral imaging of hematopoietic cells: where flow meets morphology. J Immunol Methods. 336, 91-97 (2008).
- Pop, R. A key commitment step in erythropoiesis is synchronized with the cell cycle clock through mutual inhibition between PU.1 and S-phase progression. PLoS Biol. 8, (2010).
- Borsook, H., Lingrel, J. B., Scaro, J. L., Millette, R. L. Synthesis of haemoglobin in relation to the maturation of erythroid cells. Nature. 196, 347-350 (1962).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved