Un abonnement à JoVE est nécessaire pour voir ce contenu. Connectez-vous ou commencez votre essai gratuit.
Method Article
Identification et analyse des progéniteurs érythroïdes de la souris en utilisant les CD71/TER119 cytométrie en flux Assay
Dans cet article
Résumé
Une méthode cytométrie en flux pour l'identification et l'analyse moléculaire de la différenciation-spécifiques au stade progéniteurs érythroïdes murines et précurseurs, directement dans la moelle osseuse de souris fraîchement récoltés, de la rate ou du foie fœtal. Le test repose sur la surface des cellules CD71 marqueurs, Ter119, et la taille des cellules.
Résumé
L'étude de l'érythropoïèse a pour objectif de comprendre comment les cellules rouges sont formés à partir de progéniteurs hématopoïétiques et érythroïdes tôt. Plus précisément, le taux de formation de globules rouges est régulée par l'hormone érythropoïétine (Epo), dont la synthèse est déclenchée par une hypoxie tissulaire. Une menace pour les résultats adéquats oxygénation tissulaire à une augmentation rapide de l'Epo, la conduite d'une augmentation du taux de l'érythropoïèse, un processus connu comme la réponse au stress érythropoïétique. L'augmentation du nombre de cellules circulantes rouges améliore l'apport d'oxygène des tissus. Une réponse au stress efficaces érythropoïétique est donc essentielle à la survie et au rétablissement de conditions physiologiques et pathologiques telles que l'altitude élevée, une anémie, des hémorragies, une chimiothérapie ou une transplantation de cellules souches.
La souris est un modèle clé pour l'étude de l'érythropoïèse et sa réponse au stress. Souris érythropoïèse définitive (de type adulte) a lieu dans le foie fœtal entre les jours embryonnaires 12,5 et 15,5, dans la rate néonatale, et dans la rate et la moelle osseuse adulte. Les méthodes classiques d'identification progéniteurs érythroïdes dans le tissu reposent sur la capacité de ces cellules pour donner naissance à des colonies de cellules rouges lorsque plaquées Epo contenant milieux semi-solides. Leur descendance précurseurs érythroïdes sont identifiés sur la base des critères morphologiques. Aucune de ces méthodes classiques permettent d'accéder à un grand nombre de cellules érythroïdes différenciation spécifiques au stade de l'étude moléculaire. Nous présentons ici une méthode cytométrie en flux d'identifier et d'étudier la différenciation spécifiques au stade progéniteurs érythroïdes et des précurseurs, directement dans le contexte d'un tissu de souris fraîchement isolées. Le test repose sur les marqueurs de surface cellulaire CD71, Ter119, et sur la cytométrie en flux "en avant-scatter" paramètre, qui est fonction de la taille des cellules. Le dosage de CD71/Ter119 peut être utilisé pour étudier les progéniteurs érythroïdes au cours de leur réponse au stress érythropoïétique in vivo, par exemple, chez la souris anémiques ou souris logés dans des conditions pauvres en oxygène. Il peut également être utilisée pour étudier les progéniteurs érythroïdes directement dans les tissus de souris adultes génétiquement modifiés ou des embryons, afin d'évaluer le rôle spécifique de la voie moléculaire modifiée dans l'érythropoïèse.
Protocole
1. La récolte des tissus
- Préparer des tubes contenant 2 à 5 ml tampon de coloration à froid (tampon phosphate salin (PBS) avec ajout de BSA 0,2% et glucose 5 mM). Garder les tubes sur la glace avant la récolte des tissus.
- Cull souris selon le protocole approuvé approprié (par exemple le CO 2 par inhalation suivie de dislocation cervicale).
- Prélever du sang par ponction cardiaque sur EDTA ou héparine de collecte de sang pour une analyse ultérieure des tubes, par exemple, de l'hématocrite, numération des réticulocytes ou l'analyse de la SRC.
- Récolte de la rate et des os, des tissus de placer de chaque souris dans un tube séparé, préparé à l'étape 1. Un accès facile à la rate est du côté gauche. Pour la moelle osseuse, la récolte d'une ou deux fémurs. Gardez les tissus récoltés sur la glace.
- Si désiré, peser la rate. Souris subissant une réponse au stress érythropoïétique sont susceptibles de montrer une augmentation significative du poids de la rate.
2. Préparation des cellules spléniques
- L'utilisation d'un pré-humidifiées 3 ml piston de la seringue, poussez doucement la rate, ou une partie de la rate (idéalement, 0,1 gramme ou moins, ce qui équivaut à environ 10 8 cellules) à travers une passoire 40 um de cellules stériles (numéro de catalogue Fisherbrand 22363547 ou autre) placé sur le dessus d'un tube conique de 50 ml. Maintenir le tube sur la glace pendant cette procédure. Laver les cellules à travers le tamis avec un total de 2 ml tampon de coloration.
- Délicatement la pipette la suspension cellulaire tendues pour briser les mottes de petite taille. Si nécessaire, re-déformation des cellules.
- Laver les cellules deux fois par centrifugation et remettre en suspension dans un tampon de froid.
- Compter les cellules en utilisant un hématimètre. Les rendements typiques sont 1-2 x 10 8 cellules / rate. Pour cytométrie en flux analyse, aliquotes de 1 à 2.000.000 cellules par échantillon, soit dans des tubes FACS coloration (BD Falcon polystyrène à fond rond tubes, 352 008) ou à fond en U 96 puits (BD Falcon 353 910). Volume de coloration de l'échantillon est 200 pi, à une concentration cellulaire finale 0,5 à 1 x 10 7 cellules / ml ou 1-2 x 10 6 cellules / échantillon de 200 pi.
3. Préparation des cellules de moelle osseuse
- Préparez 1 ou 3 seringues ml avec une aiguille attachée 26G, pré-rempli avec le tampon de coloration à froid.
- Enlever les muscles attachés au fémur afin de visualiser l'os clairement.
- En utilisant des ciseaux chirurgicaux pointus, coupez les deux extrémités du fémur, aussi près que possible des extrémités de l'os. Cela devrait révéler un petit trou à chaque extrémité coupée, entraînant dans la cavité de la moelle osseuse, qui traverse la longueur du fémur.
- Utiliser des seringues pré-remplies à l'étape 1, insérer l'aiguille dans un de ces trous, et doucement rincer la moelle par le trou à l'autre bout, dans un tube.
- Dissocier les cellules vidées par pipetage doux, et passer dans une passoire 40 um que pour la rate plus haut (voir section 2.1).
- Laver les cellules deux fois par centrifugation dans un tampon de coloration à froid
- Compter les cellules et resuspendre comme dans la section 2.4. Les rendements typiques sont d'environ 10 7 cellules par le fémur.
4. Préparation des cellules de foie foetal
- Pour préparer chronométré enceintes souris femelles, mis en place pour l'accouplement des souris dans la soirée; examiner pour les bouchons vaginaux avant 10 h le lendemain, le jour où le bouchon vaginal est détecté est considéré comme jour 0.5. Le personnel vétérinaire peut être en mesure d'aider les enquêteurs qui sont peu familiers avec cette technique pour identifier les femmes enceintes. La grossesse peut également être déterminé par le poids de la souris de contrôle.
- Timed enceintes souris femelles sont abattues sur les jours de 12,5 à 14,5 de la grossesse. Les cornes utérines sont enlevés dans une boîte de Petri contenant glacée milieu de culture ou de tampon de coloration.
- Les embryons sont retirés de chaque utérus et le foie fœtal est disséqué. Un microscope à dissection est nécessaire pour jour embryonnaire 12,5 (E12.5) ou moins.
- Foies peuvent être dissociées mécaniquement par pipetage dans un tampon, et sont traitées individuellement dans des plaques 96 puits, ou regroupés, selon les exigences expérimentales.
- Un foie fœtal à E13.5 a ~ 10 7 cellules. Les cellules sont lavées deux fois dans la coloration de tampon et remises en suspension à 1-2 x 10 6 cellules / échantillon de 200 ul pour l'analyse par cytométrie en flux.
5. Coloration des anticorps pour la cytométrie en flux
- Préparer un anticorps primaire coloration pré-mix à être utilisé pour tous les échantillons, sauf pour les échantillons de contrôle, contenant les éléments suivants:
- ChromePure IgG de lapin (Jackson, 015-000-003), à une concentration finale de 200μg/ml. Vérifiez la concentration des stocks sur la bouteille (elle peut varier). Ceci est utilisé pour bloquer les récepteurs Fc des cellules de souris, des espèces alternatives qui peuvent être utilisées pour cela sont IgG de souris ou rat IgG. Le choix des espèces est déterminée par la présence potentielle dans le protocole de coloration des anticorps secondaire dirigé contre primaires de rat / souris / lapin des anticorps, dans ce cas, ces espèces ne peuvent pas être utiliséD que les anticorps bloquant. Alternativement, sérum de lapin 5% peut également être utilisée à la place de IgG purifiées. Une autre alternative est l'utilisation d'anticorps monoclonaux ou des fragments Fab dirigés au niveau des récepteurs Fc de souris. Le protocole de base ci-dessous ne comprennent pas les anticorps IgG secondaire et donc d'aucune des trois espèces peuvent être utilisées.
- CD71-FITC, dilué 1:200 (stock 0.5mg/ml, BD-Biosciences, 553266)
- Ter119-PE, dilué 1:200 (stock 0.2mg/ml, BD-Biosciences, 553673)
- Tout anticorps supplémentaire destinée à des épitopes de surface de l'intérêt, par exemple des anticorps dirigés au Fas ou FasL (voir 1,2). Mélanger délicatement la solution d'anticorps en inversant le tube 2-3 fois.
- Ajouter 200 pi de la pré-mélange pour chaque échantillon de cellules et doucement remettre en suspension les cellules.
- Préparer des échantillons de cellules de contrôle comme suit:
- «Non marqué»: ces cellules sont laissées à la coloration de tampon et de fournir l'autofluorescence de fond des cellules.
- «Couleur unique" contrôles: un contrôle est nécessaire pour chaque anticorps / couleur utilisée dans le protocole. Les cellules de ces contrôles sont colorées soit avec un anticorps directement conjugués primaire, ou avec les deux un anticorps primaire et un anticorps secondaire conjugué. Ces contrôles sont utilisés pour corriger les chevauchements entre les canaux spectraux.
- 'Fluorescence moins un "(FMO) contrôles: un contrôle est nécessaire pour chaque anticorps / couleur dans le protocole: les cellules sont colorées avec toutes les couleurs / anticorps dans le protocole, sauf pour la couleur / anticorps pour lesquels cela est le contrôle FMO. Le contrôle FMO pour un canal particulier fournit le vrai fond de ce canal. Il peut s'agir non spécifique d'anticorps de même isotype, et conjugué avec la même marque de fluorescence de l'anticorps d'essai (contrôle isotypique).
- Incuber les échantillons et les contrôles pertinents dans l'anticorps primaire tache sur la glace pendant 45 'à 1 heure dans le noir (mettre du papier d'aluminium sur le couvercle seau à glace).
- A la fin de l'incubation, laver les cellules en ajoutant 3ml de tampon de coloration pour chaque tube d'échantillon et de spin de 3 'à 5' à environ 400 xg à 4 ° C. Si vous utilisez des plaques de 96 puits, laver les cellules à trois reprises dans un volume de 200 pl.
- Le cas échéant, appliquer anticorps secondaire tache. Appliquer et laver comme pour le premier anticorps tache.
- Le cas échéant, une tache avec de l'annexine V est appliquée à la fin de l'incubation, en utilisant un tampon HEPES comme dans les instructions du fabricant. Cette tache est appliquée pendant 15 minutes à température ambiante, ou pendant 1 heure sur la glace.
- Les cellules sont re-suspendu pour cytométrie en flux d'analyse de la coloration solution contenant un colorant ADN cellulaire imperméable, d'exclure les cellules mortes. Plusieurs colorants ADN sont disponibles, y compris l'iodure de propidium, 7-amino-actinomycine D (7AAD), ou DAPI. Le choix parmi ces dépend des canaux disponibles, étant donné les canaux pris pour la coloration des anticorps spécifiques, et les canaux disponibles sur le cytomètre de flux-. 7AAD est obtenu à partir de BD-Biosciences (559 925) et utilisé conformément aux instructions du fabricant. Pour la coloration DAPI, faire un bilan de 1mg/ml dans le diméthylformamide (DMF) à partir de poudre (Roche, Cat # 236276), conserver à -20 ° C, et diluer à 1:10,000 1:15,000 dans la coloration de mémoire tampon.
6. Cytométrie en flux de tri
- Les cellules sont marquées avec des anticorps contre le CD71, Ter119, marqueurs lignée, et la viabilité d'un colorant comme décrit pour l'analyse par cytométrie en flux (article 5). La concentration cellulaire pendant l'étiquetage peut être augmentée à 5 x 10 7 / ml.
- Mélanger un volume égal de chacun des anticorps à la suite de faire le master mix lignée:
- Rat FITC anti-souris CD41 MWReg30, BD Pharmingen 553848
- Rat FITC anti-souris CD45R/B220 RA3-6B2, BD Pharmingen 553087
- Hamster FITC anti-souris CD3e 145-2C11, BD Pharmingen 553061
- FITC rat anti-souris CD11b/Mac-1 M1/70, BD Pharmingen 557396
- Rat FITC anti-souris Ly-6G et Ly-6C (GR-1) RB6-8C5, BD Pharmingen 553126
- Utiliser le mélange maître à 1:80 (Ceci est équivalent à 1:400 dilution de chacun stocks d'anticorps individuels, qui sont tous de 0,5 mg / ml).
- Utiliser des conditions de tri à basse pression et les buses de large. Pour l'Aria (BD Biosciences), nous utilisons 100 μ buse, 20 psi.
- Collection tampon: PBS avec ajouté 20% de sérum de veau fœtal.
- Pour vérifier la pureté des populations triées, ré-exécuter une petite aliquote de chaque échantillon dans un tampon qui contient un colorant viabilité (7AAD ou similaire).
7. Les résultats représentatifs:
CD71/Ter119 coloration de moelle osseuse adulte ou de la rate identifie une séquence de développement de quatre sous-ensembles, étiquetées ProE, Erya, EryB et Eryc (figure 1) 1. Morphologiquement, elles correspondent à des érythroblastes en plus mature. La figure 1 illustre la séquence de déclenchement à l'étape de l'analyse de données, qui se défait événement très petite taille (y compris les noyaux, les globules rouges), les cellules agrégées et les cellules mortes.
Expression des protéines de surface cellulaire peut être mesurée simultanément pour chacun de ces sous-ensembles, en ajoutant que les anticorps concernés au même moment que Ter119 et CD71 coloration. La figure 1 montre un exemple de surface cellulaire d'expression du récepteur de mort Fas 1. Cette mesure a été réalisée chez des souris injectées avec l'EPO, ou chez les souris témoins injectés avec une solution saline. Il est évident que l'Epo supprime l'expression de Fas dans la population Erya in vivo 1.
Expression de protéines intracellulaires ou le statut du cycle cellulaire peut également être mesurée pour les cellules dans chaque sous-ensemble. La figure 2 illustre représentant l'analyse du cycle cellulaire des cellules fraîchement récoltées moelle osseuse. Ces mesures nécessitent, en plus de coloration de surface des cellules CD71 et avec Ter119, la fixation et perméabilisation des cellules pour l'étiquetage intracellulaire (voir la section Discussion).
Dans le foie fœtal, non érythroïdes cellules sont d'abord exclus par gating sur «Lin-» les cellules qui sont négatives pour CD41, Mac-1, Gr-1, B220 et CD3 (figure 3). Les cellules restantes sont sous-divisé en 6 sous-ensembles, S0 à S5. Le modèle précis de cellules dans le foie fœtal dépend de l'âge embryonnaire (voir section Discussion). Une analyse de cellules représentatives du cycle du sous-ensemble S3 dans E13.5 foie fœtal est montré (figure 4).
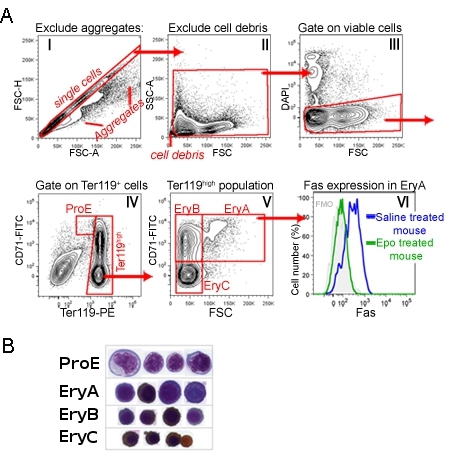
Figure 1 Les sous-ensembles CD71/Ter119 érythroïde dans la rate de souris stratégie Gating A.:.. Les cellules de rate ont été traités et étiquetés avec des anticorps dirigés au CD71, Ter119 et Fas. Cette figure montre la stratégie d'analyse suite à l'étape d'acquisition de données. Histogramme I montre des événements tous les acquis. La porte diagonale représente les événements qui sont susceptibles d'être des cellules individuelles, à l'exclusion des doublets ou des agrégats plus gros. Les cellules de cette porte sont analysés plus en histogramme II. Voici des événements très petites, les noyaux probable ou de débris, sont exclus. Les cellules fermée sont présentés dans l'histogramme III, où DAPI cellules positives, qui sont susceptibles de membrane perméable cellules apoptotiques, sont exclus de l'analyse. Histogramme IV montre la population résultant de cellules spléniques viables. Le portail contient ProE CD71 haute Ter119 cellules intermédiaires. Ter119 cellules haute sont analysés plus en histogramme V. Voici CD71 cellules haute sont subdivisés en moins matures, grand érythroblastes 'Erya (CD71 haute Ter119 haute FSC élevé) et plus petit, plus mature érythroblastes' EryB (CD71 haute Ter119 haute FSC basse) . Le sous-ensemble des érythroblastes les plus matures est Eryc (CD71 faible Ter119 haute FSC basse). VI Histogramme expression de Fas à la surface cellulaire, en particulier dans le sous-ensemble Erya, chez la souris à l'état basal (injecté avec du sérum physiologique), et les souris injectées avec une dose unique de l'Epo. La coloration avec des anticorps Fas a été réalisée simultanément avec la coloration CD71/Ter119. Cytospin B. préparations de cellules triées à partir de chacun des sous-ensembles indiqués. Les cellules ont été colorées au Giemsa et avec diaminobenzidine, celui-ci génère une tache brune à l'hémoglobine. Cytospin données a été initialement publié dans Liu et al. Blood. 2006 Jul 1; 108 (1) :123-33. Epub mars 2006 9.
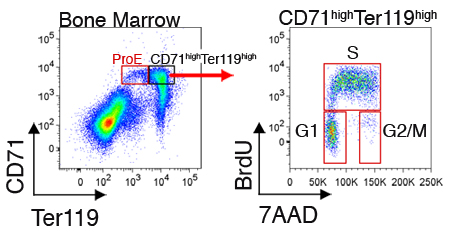
Figure 2. Analyse du cycle cellulaire de CD71 haute Ter119 érythroblastes élevé dans la moelle osseuse de souris. Des souris ont été injectés par voie intrapéritonéale avec BrdU, et la rate ou de moelle osseuse ont été récoltés 30 à 60 minutes plus tard. Les cellules ont été fixées et perméabilisées et en plus d'être colorées pour CD71 et Ter119, ont été colorées pour l'incorporation de BrdU dans leur ADN réplication avec un anticorps monoclonal dirigé au BrdU (protocole de fixation, et de perméabilisation BrdU-coloration a été selon les instructions du fabricant). BrdU positives cellules sont en phase S du cycle. Cellules en interphase sont BrdU négative et peut être résolu en phases G1 ou G2 / M, en utilisant l'ADN de teinture 7AAD.
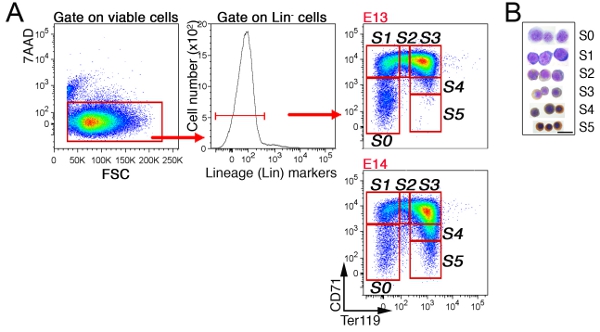
Figure 3 sous-ensembles CD71/Ter119 érythroïdes dans le foie de souris fœtales stratégie Gating A.:.. Les cellules du foie fœtal ont été étiquetés pour CD71, Ter119, et un cocktail d'anticorps marqués FITC dirigés au niveau des marqueurs lignée non érythroïdes («Lin»). Les cellules viables (7AAD-négatifs) ont été analysés pour l'expression de Lin, et le Lin-cellules sont ensuite subdivisés en sous-ensembles érythroïdes S0 à S5. Jeune, E13 foie fœtal est composé d'érythroblastes moins matures, en témoigne l'absence de cellules dans le S4/S5 matures sous-ensembles. Cytospin B. préparations de cellules triées à partir de chacun des sous-ensembles indiqués. Les cellules ont été colorées au Giemsa et avec diaminobenzidine, celui-ci génère une tache brune à l'hémoglobine. Des données Cytospin était à l'origine publié au Pop et al, Biol PLoS 8 (9):. e1000484. doi: 10.1371/journal.pbio.1000484.
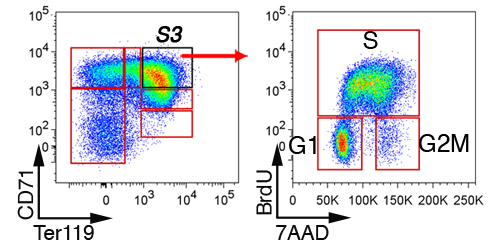
Figure 4. Analyse du cycle cellulaire des cellules érythroïdes du fœtus sous-ensembles du foie. Des souris gravides ont été injectés avec BrdU, et le foie du fœtus ont été récoltés 30 à 60 minutes plus tard, fixées, perméabilisées et colorées avec des anticorps contre le CD71, Ter119 et BrdU. L'état du cycle cellulaire des cellules S3 est montré.
Discussion
La méthodologie cytométrie en flux permet l'étude simultanée de toutes les fonctions cellulaires qui peuvent être détectées avec un anticorps conjugué à fluorescence spécifique ou ligand, y compris les marqueurs de surface cellulaire, l'expression des protéines, la survie cellulaire, signalisation cellulaire en utilisant des anticorps phospho-spécifiques 3 et l'état du cycle cellulaire. Ces mesures peuvent être effectuées dans chacun d'un nombre de différenciation au stade des ...
Déclarations de divulgation
Expériences sur les animaux ont été effectuées en conformité avec les directives et règlements établis par l'Université du Massachusetts Medical School comité IACUC.
Remerciements
Nous remercions le cœur des flux UMass cytométrie: Richard Konz, Ted Giehl, Barbara Gosselin, Yuehua Gu et Tammy Krupoch. Ce travail a été financé par le NIH / NHLBI RO1 HL084168 (MS) et le NIH CA T32-130 807 (JRS). Les ressources de base soutenu par le diabète de recherche en endocrinologie Centre DK32520 subventions ont également été utilisés.
matériels
| Name | Company | Catalog Number | Comments |
| Nom du réactif | Société | Numéro de catalogue | |
|---|---|---|---|
| Fas-biotine | BD Pharmingen | 554256 | |
| Streptavidine-APC | Molecular Probes | S868 | |
| 40 um tamis cellulaire stérile | Fisherbrand | 22363547 | |
| Polystyrène fond rond tubes pour la coloration FACS | BD Falcon | 352008 | |
| À fond en U 96 puits | BD Falcon | 353910 | |
| ChromePure IgG de lapin | Jackson ImmunoResearch | 015-000-003 | |
| CD71-FITC (stock 0.5mg/ml) | BD-Biosciences | 553266 | |
| Ter119-PE (stock 0.2mg/ml) | BD-Biosciences | 553673 | |
| 7AAD | BD-Biosciences | 559925 | |
| DAPI en poudre | Roche | 236276 | |
| Rat FITC anti-souris CD41 MWReg30 | BD Pharmingen | 553848 | |
| Rat FITC anti-souris CD45R/B220 RA3-6B2 | BD Pharmingen | 553087 | |
| Rat FITC anti-souris CD411b/Mac-1 M1/70 | BD Pharmingen | 557396 | |
| Rat FITC anti-souris Ly-6G et Ly-6C (GR-1) RB6-8C5 | BD Pharmingen | 553126 | |
| Hamster FITC anti-souris CD3e 145-2C11 | BD Pharmingen | 553061 | |
| APC kit de BrdU débit | BD Pharmingen | 557892 | |
| Annexine V-biotine | BD Pharmingen | 556418 |
Références
- Liu, Y. Suppression of Fas-FasL coexpression by erythropoietin mediates erythroblast expansion during the erythropoietic stress response in. 108, 123-133 (2006).
- Socolovsky, M. Negative Autoregulation by FAS Mediates Robust Fetal Erythropoiesis. PLoS Biol. 5, e252-e252 (2007).
- Krutzik, P. O., Hale, M. B., Nolan, G. P. Characterization of the murine immunological signaling network with phosphospecific flow cytometry. J Immunol. 175, 2366-2373 (2005).
- Socolovsky, M. Ineffective erythropoiesis in Stat5a(-/-)5b(-/-) mice due to decreased survival of early erythroblasts. Blood. 98, 3261-3273 (2001).
- Guihard, S. The MAPK ERK1 is a negative regulator of the adult steady-state splenic erythropoiesis. Blood. 115, 3686-3694 (2010).
- Yu, X. An erythroid chaperone that facilitates folding of alpha-globin subunits for hemoglobin synthesis. J Clin Invest. 117, 1856-1865 (2007).
- Chen, M. L. Erythroid dysplasia, megaloblastic anemia, and impaired lymphopoiesis arising from mitochondrial dysfunction. Blood. 114, 4045-4053 (2009).
- Chen, K. Resolving the distinct stages in erythroid differentiation based on dynamic changes in membrane protein expression during erythropoiesis. Proc Natl Acad Sci U S A. 106, 17413-17418 (2009).
- McGrath, K. E., Bushnell, T. P., Palis, J. Multispectral imaging of hematopoietic cells: where flow meets morphology. J Immunol Methods. 336, 91-97 (2008).
- Pop, R. A key commitment step in erythropoiesis is synchronized with the cell cycle clock through mutual inhibition between PU.1 and S-phase progression. PLoS Biol. 8, (2010).
- Borsook, H., Lingrel, J. B., Scaro, J. L., Millette, R. L. Synthesis of haemoglobin in relation to the maturation of erythroid cells. Nature. 196, 347-350 (1962).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon