A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
تطوير خلية من نوع معين الأبتامرات gp120 المضادة لفيروس الإيدز لتسليم سيرنا
In This Article
Summary
يتم عزل عدة 2' - RNA الفلوري الأبتامرات ضد فيروس نقص المناعة البشرية 1Ba - L gp120 مع تقارب nanomole من مكتبة بواسطة الحمض النووي الريبي في المختبر سيليكس الداخلي. يتم إنشاء وظيفة جديدة مزدوجة المثبطة المضادة للgp120 aptamer - سيرنا الوهم ويبين الوعد كبيرة للعلاج المضاد لفيروس نقص المناعة البشرية الشاملة.
Abstract
وقد خلق هذا الوباء العالمي للعدوى بفيروس نقص المناعة البشرية حاجة ملحة لفئات جديدة من وكلاء المضادة للفيروسات. ويجري استغلال قدرة قوية من الرناوات الصغيرة (SI) بالتدخل لمنع التعبير عن النصوص الحمض النووي الريبي باعتبارها مكملة فئة جديدة من العلاجات لمجموعة متنوعة من الأمراض بما فيها فيروس نقص المناعة البشرية. وقد أظهرت العديد من التقارير السابقة أن رواية [رني مكافحة الإيدز المستندة إلى استراتيجيات علاجية واعدة كبيرة ، ومع ذلك ، يشكل عقبة رئيسية لتطبيق العلاجية الناجحة والترجمة السريرية لsiRNAs هو تسليم كفاءة. خصوصا ، نظرا لسلامة وفعالية العلاجات المستندة إلى رني ، فمن المرغوب فيه جدا لتطوير استهدفت تسليم سيرنا داخل الخلايا نهج للسكان خلية معينة أو الأنسجة. في HIV - 1 gp120 البروتين ، بروتين سكري مغلف على سطح HIV - 1 ، ويلعب دورا هاما في دخول الفيروس الى خلايا CD4. وقد تم التحقق من صحة تفاعل gp120 CD4 والذي يقوم بتشغيل HIV - 1 دخول الخلية ويبدأ الانصهار بوصفها استراتيجية مضادة للفيروسات ذات الصلة سريريا لاكتشاف المخدرات.
هنا ، نحن نناقش أولا اختيار وتحديد 2' - F معدلة لمكافحة فيروس نقص المناعة البشرية الأبتامرات RNA gp120. باستخدام أسلوب التصفية النيتروسليلوز سيليكس التقليدية ، وقد تم عزل عدة الأبتامرات جديدة مع تقارب nanomolar من 50 عشوائي مكتبة RNA NT. من أجل الحصول على الأنواع بنجاح ملزمة مع ارتفاع تقارب ، ويتم التحكم بعناية في اختيار التشدد من خلال تعديل الشروط. يمكن ربط الأبتامرات مختارة خصيصا ويكون استوعب بسرعة إلى الخلايا التعبير عن بروتين HIV - 1 المغلف. بالإضافة إلى ذلك ، يمكن للالأبتامرات وحده تحييد عدوى HIV - 1. استنادا إلى أفضل aptamer A - 1 ، ونحن أيضا إنشاء وظيفة مزدوجة المثبطة المضادة للرواية gp120 aptamer - سيرنا في الوهم الذي aptamer كلا من والأجزاء سيرنا وفعالة لمكافحة فيروس نقص المناعة البشرية الأنشطة. كذلك ، ونحن الاستفادة من gp120 aptamer - سيرنا الوهم لخلية من نوع التسليم المحددة للسيرنا داخل الخلايا المصابة HIV - 1. هذه الوظيفة المزدوجة خيمر يظهر إمكانات كبيرة للجمع بين مختلف وكلاء الحمض النووي العلاجية (aptamer وسيرنا) في عدوى HIV - 1 قمع ، مما يجعل من الوهم aptamer - سيرنا المرشحين العلاجية لمرضى الفشل جذابة العلاج المضاد للفيروسات نشطة للغاية (HAART).
Protocol
1. إعداد المكتبة RNA
- مكتبة تحتوي على الحمض النووي بدءا من 50 النيوكليوتيدات تسلسل عشوائي وتم تصنيعه من خلال تقنيات الحمض النووي المتكاملة (كورالفيل ، أيوا). واحد الذين تقطعت بهم السبل مكتبة بنسبة ضئيلة تسلسل الحمض النووي هو 5' - GGG ATG CGG AGG ACG -- N 50 -- CAG ACG ACT CGC CCG أ -- 3 "(81 NT). ويحيط منطقة عشوائية حسب المناطق مستمرة ، والتي تشمل المروج T7 عن النسخ في المختبر ، ووضع علامة على 3 'لRT - PCR. 5 'و 3' تسلسل ثابت و5 '-- TAA TAC GAC TCA CTA TAG GGA GGA CGA TGC GG -- 3" (32 سورمير) و 5 'GGC - GAG TCG TCG TCT G -- 3" (16 MER) ، على التوالي. جعل حل الأسهم مع المياه وتخزينها في aliquots في -20 درجة مئوية.
- تضخيم واحد الذين تقطعت بهم السبل الحمض النووي بنسبة ضئيلة عشوائي مكتبة (0.4 ميكرومتر) بواسطة PCR باستخدام 3 ميكرومتر كل من 5' والاشعال 3' ، جنبا إلى جنب مع MgCl 2 مم 2 و 200 ميكرومتر لكل dNTP. من أجل الحفاظ على وفرة من المكتبة الحمض النووي الأصلي ، والحد من PCR إلى عشرة دورات. بعد ردود الفعل PCR (10 ردود الفعل ، 100 ميكرولتر في رد الفعل) ، واسترداد تجمع dsDNA تضخيمها باستخدام تنقية جل QIAquick كيت (QIAGEN).
- تحويل dsDNA مما أدى إلى مكتبة RNA باستخدام أدوات DuraScription (Epicentre ، ماديسون ، ويسكونسن) وفقا لتعليمات الشركة الصانعة. في النسخ خليط التفاعل ، واستبدال CTP UTP مع 2' - F - CTP و2' - F - UTP لانتاج الحمض النووي الريبي ريبونوكلياز مقاومة. عادة ، وإعداد 20 ميكرولتر من ردود الفعل التي تحتوي على 1 ميكروغرام من الحمض النووي القالب المنقى ، 2 ميكرولتر العازلة × 10 ، 2 dATP ميكرولتر ، 2 dGTP ميكرولتر ، 2 ميكرولتر 2' - F - dCTP ، 2 ميكرولتر 2' - F - dUTP ، 2 DTT ميكرولتر و 2 ميكرولتر بوليميريز RNA T7 في درجة حرارة الغرفة ثم احتضان عند 37 درجة مئوية لمدة ساعة 6 (50 ملم من كل dNTP).
- هضم لاحقا إلى التفاعل مع أنني الدناز (1.5 ميكرولتر في 20 ميكرولتر رد فعل النسخ T7) لإزالة قالب الحمض النووي وتنقية عن طريق بولي أكريلاميد 8 ٪ / 7 هلام اليوريا M. قياس الحمض النووي الريبي المنقى المكتبة القياس الطيفي للأشعة فوق البنفسجية.
2. الجيل في المختبر الأبتامرات
- قبل الاختيار ، وإعداد واختيار العازلة العازلة refolding. إعداد HEPES العازلة التي تحتوي على 100 ملي Hepes ، ودرجة الحموضة 7.4. هيدروكسيد الصوديوم تستخدم لضبط قيمة درجة الحموضة ومن ثم تخزين في درجة حرارة الغرفة. تعد منطقة عازلة refolding الحمض النووي الريبي (5xHBS) يحتوي على 50 درجة الحموضة 7.4 ملي Hepes و 750 ملي مول كلوريد الصوديوم ، 5 ملم MgCl 2 ، 5 ملي CaCl 2 ؛ بوكل 13.5 ملم. تعد منطقة عازلة RNA قليل الملح ملزمة (10 مم HEPES الحموضة 7.4 و 50 ملي مول كلوريد الصوديوم ، 1 ملم CaCl 2 ، 1 ملم MgCl 2 ، و 2.7 ملي بوكل ، 10 ملي DTT ، 0.01 ٪ و BSA عازلة RNA عالية من الملح ملزمة (10 HEPES ملي درجة الحموضة 7.4 ، 150 مم كلوريد الصوديوم ، 1 ملم CaCl 2 ، 1 ملم MgCl 2 ، و 2.7 ملي بوكل ، 10 ملي DTT ، BSA 0.01 ٪). مخزن في هذه المخازن -20 درجة مئوية.
- نفذ سيليكس أساسا كما هو موضح 1-4. قبل كل جولة الاختيار ، refold تجمعات الحمض النووي الريبي في 1xHBS العازلة (10 مم HEPES الرقم الهيدروجيني 7.4 ، 150 مم كلوريد الصوديوم ، 1 ملم CaCl 2 ، 1 ملم MgCl 2 ، و 2.7 ملي بوكل) ، والحرارة إلى 95 درجة مئوية لمدة 3 دقائق ثم تبرد ببطء إلى 37 درجة مئوية. تستمر الحضانة في 37 دقيقة لمدة 10 درجة مئوية.
- عموما ، من أجل تقليل ملزم غير محددة مع مرشحات النيتروسليلوز ، قبل أن كثف refolded أحواض الحمض النووي الريبي لمرشح النيتروسليلوز (HAWP التصفية ، 0.45 ميكرون) لمدة 30 دقيقة ، قبل الحضانة مع هدف بال HIV - 1 gp120 البروتين.
- احتضان تجمع الحمض النووي الريبي قبل تطهيرها مع البروتين الهدف العازلة في الحمض النووي الريبي ملزمة قليل الملح لمدة 30 دقيقة لجولات سيليكس 1-4. بعد الجولة الرابعة من سيليكس ، استخدام الحمض النووي الريبي العازلة عالية من الملح ملزمة. مع التقدم سيليكس ، وخفض كمية البروتين gp120 وزيادة المنافسة في الحمض الريبي النووي النقال الخميرة لزيادة التشدد في اختيار aptamer.
- في الجولة الأولى من الاختيار ، واحتضان ما قبل تطهيرها تجمع عشوائي RNA (40 ميكروغرام ، 1.5 nmol ، 9x10 جزيئات 14) وبال HIV - 1 gp120 البروتين (0.23 nmol ، RNA / نسبة بروتين 6.5 / 1) في 200 منخفضة ميكرولتر ملح الحمض النووي الريبي ملزمة العازلة على منصة دوارة في درجة حرارة الغرفة لمدة 30 دقيقة.
- تمرير رد الفعل من خلال مرشح النيتروسليلوز قبل المبللة وغسل العازلة مع 1 مل ملزمة.
- أزل الحمض النووي الريبي ملزمة من التصفية مع 200 العازلة شطف ميكرولتر (7 M اليوريا و 5 ملي EDTA) في 95 درجة مئوية لمدة 5 دقائق ، ثم استخراج الفينول / الكلوروفورم وتركيز مع عمود Microcon YM - 30.
- عكس تدوين تجمع باستخدام الحمض النووي الريبي تعافى RT - PCR ThermoScript النظام (Invitrogen) وتضخيم لمدة 15 دورات PCR.
- تنقية تجمع dsDNA تضخيمها باستخدام تنقية جل QIAquick كيت وتدوين على النحو الموصوف أعلاه للجولة المقبلة من التحديد.
3. سيليكس رصد التقدم عن طريق الفحص ملزمة التصفية
- رصد التقدم المحرز من سيليكس الأبتامرات بواسطة مقايسة ملزمة التصفية. علاج تجمع RNA مع المركز الدولي للبطاطا لإزالة التسمية بدء 5' - ثلاثي الفوسفات ثم مع كيناز عديد النوكليوتيد T4 و γ - 32P ATP.
- المعالجة بالحرارة 10 بمول من الحمض النووي الريبي CIP المكتبة في 95 درجة مئوية لمدة 5 دقائق ثم البرد على الجليد. لاحقا ، إضافة 2ميكرولتر من PNK العازلة ، 1 ميكرولتر من كيناز عديد النوكليوتيد T4 ، 1 ميكرولتر من جاما - P - 32 ATP والمياه إلى 20 ميكرولتر.
- احتضان عند 37 درجة مئوية لمدة 30 دقيقة ، ثم إضافة 20 ^ مو ؛ لتر من المياه ، وتنقية رد فعل من جانب العمود G - 50. أخيرا ، الحصول على 40 ميكرولتر من الحمض النووي الريبي المسمى في تركيز النهائي من 250 نانومتر.
- قبل الفحص ، المسمى refold في الحمض النووي الريبي في برك العازلة 1xHBS (HEPES 10 ملم 7.4 درجة الحموضة ، 150 ملي مول كلوريد الصوديوم ، 1 ملم CaCl 2 ، 1 ملم MgCl 2 ، و 2.7 ملي بوكل) ، والحرارة إلى 95 درجة مئوية لمدة 3 دقائق ثم تبرد ببطء 37 درجة مئوية. تستمر الحضانة في 37 دقيقة لمدة 10 درجة مئوية.
- إجراء ميكرولتر 100 من رد فعل ملزم كمثال هنا. احتضان النهائي المسمى RNA بركة (10 نانومتر) مع بروتين gp120 (100 نانومتر) وفائض بمقدار 10 أضعاف من الحمض الريبي النووي النقال المولي منافس غير محدد (100 نانومتر) في الحمض النووي الريبي العازلة عالية ملزمة الملح لمدة 30 دقيقة.
- فصل 50 ميكرولتر من ردود الفعل ملزم من قبل مرشح النيتروسليلوز قبل الرطب.
- غسل فلتر مع العازلة 2 مل ملزمة وحساب النشاط الإشعاعي الاحتفاظ على طريق تصفية عداد التلألؤ متعددة الأغراض (بيكمان كولتر). كعنصر تحكم المدخلات ، وعدد ما تبقى من 50 ميكرولتر من ردود الفعل ملزم في نفس الوقت. حساب في المئة من الحمض النووي الريبي على الاحتفاظ التصفية في الحمض النووي الريبي المدخلات كما تقارب ملزمة.
4. الاستنساخ ، وتسلسل والتحالفات
- بعد 11 جولات ، وإذا لوحظ أي مزيد من التخصيب حتى بعد جولات اختيار إضافية يحتمل ذلك الحين تم الربط القصوى لتجمع RNA الذي تم التوصل إليه.
- عكس تدوين تجمع aptamer المخصب للغاية (12 تجمع ال RNA) باستخدام RT PCR - ThermoScript النظام (Invitrogen) وبعد ذلك [كدنا] تضخيم الناتجة عن طريق PCR. تنقية المنتج PCR باستخدام تنقية جل QIAquick كيت (QIAGEN). استنساخ هلام تنقية المنتج الحمض النووي في PCR TA ناقلات الاستنساخ 2.1 (Invitrogen). في المجموع ، وتطعيم الحيوانات المستنسخة 170 فرد وتحديد المزيد منها من خلال تسلسل الحمض النووي للحصول على تسلسل الفردية.
- تصنيف الحيوانات المستنسخة الفردية إلى ست مجموعات مختلفة على أساس التحالفات تسلسل aptamer الفردية. اختارت سلسلة واحدة من ممثل لكل مجموعة (A - 1 ، A - 5 ، A - 9 ، A - 12 ، A - 28 و B - 68) لمزيد من توصيف بسبب الوفرة النسبية داخل جماعتهم.
5. جيل من aptamer والرناوات خيمر في المختبر بواسطة النسخ
- توليد مباشرة المزدوج تقطعت بهم السبل الحمض النووي عن طريق القالب PCR باستخدام 2 ميكرومتر لكل من 5' والاشعال 3' ، جنبا إلى جنب مع MgCl 2 مم 2 و 200 ميكرومتر لكل dNTP ، واستعادة المنتجات الناتجة PCR باستخدام تنقية جل QIAquick كيت.
- تدوين خيمر حبلا من الشعور به PCR DNA قوالب إنشاؤها باستخدام أدوات DuraScription (Epicentre ، ماديسون ، ويسكونسن). في النسخ خليط التفاعل ، استبدال CTP الكنسي وUTP مع 2' - F - CTP و2' - F - UTP لانتاج الحمض النووي الريبي التي هي مقاومة للتردي وريبونوكلياز.
- عادة ، واحتضان 20 ميكرولتر من ردود الفعل التي تحتوي على 1 ميكروغرام من الحمض النووي القالب ، 2 10xbuffer مل ، 2 dATP ميكرولتر ، 2 dGTP ميكرولتر ، 2 ميكرولتر 2' - F - dCTP ، 2 ميكرولتر 2' - F - dUTP و 2 و 2 ميكرولتر DTT ميكرولتر T7 بوليميريز الحمض النووي الريبي عند 37 درجة مئوية لمدة 6 ساعات ، وتنقية لاحقا مع الأعمدة 30 سبين بيو (بيو راد) بعد استخراج الإيثانول الفينول وهطول الأمطار.
- من أجل تجنب الإنترفيرون ردا على ذلك ، كذلك علاج RNA كتب من قبل المركز الدولي للبطاطا لإزالة بدء 5' - ثلاثي الفوسفات. احتضان مجموع 60 ميكرولتر من ردود الفعل التي تحتوي على 3 ميكروغرام من النصوص ، 6 ميكرولتر من الاحتياطي 3 و 0.25 ميكرولتر من CIP عند 37 درجة مئوية لمدة 60 دقيقة. بعد الفينول / كلوروفورم اقتضاء وهطول الأمطار الإيثانول ، resuspend RNA بيليه في الماء.
- لإعداد الوهم ، والجمع بين 95 درجة مئوية لمدة 3 دقائق ثم تبرد إلى 37 درجة مئوية ببطء. الوهم وايواء فقط حبلا الشعور الحمض النووي الريبي RNA مع العقاقير المناسبة في refolding العازلة ، والحرارة إلى تستمر الحضانة في 37 دقيقة لمدة 10 درجة مئوية. refolding تنفيذ الخطوة في finial 1xHBS العازلة. على سبيل المثال : مزيج 10 ميكرولتر من 10 ميكرومتر خيمر حبلا المعنى ، 10 ميكرولتر من 10 ميكرومتر حبلا العقاقير و 5 العازلة refolding ميكرولتر (5xHBS) في 25 ميكرولتر النظام.
6. تحديد ثوابت التفكك التي تحول جل المقايسات
- نهاية ف 32 تسمية aptamer ممثل من كل مجموعة والوهم حبلا ثم RNA الحس وrefold في 1xHBS العازلة كما هو موضح أعلاه.
- تحضير 25 مل من هلام 5 ٪ عن طريق خلط 2.5 مل من 10xTBE العازلة ، مع 3.125 مل من محلول مادة الأكريلاميد / مكرر 40 ٪ ، 19.375 مل ماء ، و 150 ميكرولتر من بيرسلفات الأمونيوم 10 ٪ (APS) حل ، و 30 TEMED ميكرولتر. ينبغي أن جل تتبلمر في حوالي 30 دقيقة. إزالة بعناية المشط واستخدام الحقنة 30 مل مزودة بإبرة لغسل الآبار مع العازلة تشغيل (1xTBE).
- استكمال تجميع وحدة جل والاتصال لامدادات الطاقة. يمكن أن يكون جل ما قبل التشغيل لمدة ساعة واحدة في 180 الخامس في 4 درجات مئوية.
- مخفف تسلسليا لفيروس العوز المناعي البشري مع بروتين gp120 1Bal العازلة ملزما للتركيز المطلوب. آر النهائيتركيزات eaction من gp120 هي 0 ، 1 ، 5 ، 10 ، 20 ، 40 ، 80 ، 160 ، 320 ، 640 نانومتر. احتضان كمية ثابتة من 5' - P - 32 - نهاية المسماة الحمض النووي الريبي (10 نانومتر) مع زيادة تركيز بروتين gp120 في المنطقة العازلة ملزمة (المجموع 20 ميكرولتر من رد الفعل) على منصة دوارة في درجة حرارة الغرفة لمدة 30 دقيقة.
- بعد الحضانة ، 20 ميكرولتر مزيج من ردود الفعل ملزم مع 5 ميكرولتر العازلة تحميل الأم وتحميله إلى 5 ٪ هلام بولي أكريلاميد غير تغيير طبيعة. إعداد العازلة تحميل الأصلي (4X) تحتوي على 10 ملي تريس ، حمض الهيدروكلوريك ، ودرجة الحموضة 7.5 ، 1 ملم EDTA ، الأزرق Bromophenol 0.1 ٪ ، 0.1 ٪ الزيلين Cyanol FF ، 0.1 ٪ البرتقالية G ، الجلسرين 40 ٪. في متجر في aliquots -20 درجة مئوية.
- رحلان التالية (180 الخامس في 4 درجات مئوية لمدة 2 ساعة ، حتى الصبغة الثانوية يقام في منتصف هلام) ، تعرض هلام إلى شاشة الصورة الفوسفور وقياس النشاط الإشعاعي باستخدام ماسح ضوئي الاعصار.
- حساب الثوابت تفارق به غير منحنى الانحدار الخطي مع الرسم البياني بريزم الوسادة.
7. سطح الخلية الدراسات ملزمة التدفق الخلوي
- توليد aptamer الفلورسنت والوهم وصفها باستخدام أدوات سيرنا كاتم الصوت (Ambion). إضافة الكواشف التالية بالترتيب : 22.5 ميكرولتر nuclease خالية من المياه ، 5 مل 10 × العازلة وصفها ؛ 15 ميكرولتر الحمض النووي الريبي (5 ميكروغرام) ؛ 7.5 ميكرولتر صبغ وصفها. احتضان تفاعل مجموع 50 ميكرولتر الوسم في 37 درجة مئوية لمدة 1 ساعة.
- بعد حضانة ، إضافة 5.0 ميكرولتر (0.1 المجلد) 5 M كلوريد الصوديوم و 125 ميكرولتر (2.5 المجلد) الباردة EtOH 100 ٪ ، وتخلط جيدا. في احتضان -20 درجة مئوية لمدة 60 دقيقة. أجهزة الطرد المركزي على سرعة أعلى في درجة مئوية لمدة 20 دقيقة 4. إزالة طاف بيليه ويغسل مع EtOH ميكرولتر 175 70 ٪. الهواء الجاف بيليه في الظلام ومن ثم تعليق RNA المسمى في 15 ميكرولتر من nuclease خالية من المياه.
- قياس الامتصاصية من الحمض النووي الريبي المسمى في 260 نانومتر ، وعند الحد الأقصى لامتصاص الصبغة الفلورسنت. حساب القاعدة : نسبة الأصباغ وتركيز الحمض النووي الريبي وفقا لآلة حاسبة التي تقدمها http://www.ambion.com/techlib/append/base_dye.html .
- مزيج Cy3 المسمى بمعنى الوهم حبلا حبلا والعقاقير وrefold في refolding العازلة كما هو موضح أعلاه.
- الحصول على CHO - WT معربا عن gp160 وخلايا مكافحة CHO - EE من خلال أبحاث الإيدز ومرجع برنامج الكاشف 5 ، 6. تنمو الخلايا في GMEM - S المتوسطة (الجلوتامين التي تعاني من نقص أساسي المتوسطة مع الحد الأدنى من 400 ميكرومتر sulfoximine ميثيونين (MSX)) (Gibco ، Invitrogen). ثقافة الخلايا في الحاضنة ترطيب 5 ٪ CO 2 عند 37 درجة مئوية.
- غسل gp160 CHO - WT أو خلايا تحكم CHO - EE مع prewarmed العازلة الغسيل ، ويعرض للتريبسين وفصل من لوحات. بعد غسل الخلايا مرتين مع العازلة 500 ميكرولتر ملزمة ، resupend الكريات خلية في ملزمة واحتضان العازلة في 37 دقيقة لمدة 30 درجة مئوية. بيليه الخلايا ثم resuspend لهم في 50 ميكرولتر من العازلة التي تحتوي على ملزمة prewarmed 400 نانومتر Cy3 المسمى الرناوات التجريبية.
- بعد الحضانة عند 37 درجة مئوية لمدة 40 دقيقة ، يغسل خلايا ثلاث مرات مع 500 ميكرولتر من العازلة prewarmed ملزمة ، وأخيرا في 350 resuspend ميكرولتر من العازلة ملزمة prewarmed إلى 37 درجة مئوية ، وعلى الفور من قبل تحليل التدفق الخلوي.
8. استيعاب وتوطين دراسات الخلايا الحية بواسطة خلايا المجهري مبائر
- قبل يوم واحد من الفحص ، وتنمو على gp160 CHO - WT وخلايا مكافحة CHO - EE في لوحة 35 ملم مع البذر في 0.3x10 6 في المتوسط 2 GMEM - S مل للسماح للالتقاء حوالي 70 ٪ في غضون 24 ساعة.
- في يوم من التجارب ، وغسل الخلايا مع 1 مل من برنامج تلفزيوني prewarmed. واحتضان مع 1 مل من قبل حرارة متوسطة النمو الشامل لمدة 30 دقيقة عند 37 درجة مئوية.
- إعداد Cy3 المسمى aptamer - سيرنا الوهم كما هو موضح أعلاه. لاحتضان refold aptamer العصا مع سيرنا العصا التي تحتوي على 5' - Cy3 المسمى حبلا معنى لتشكيل مترافق aptamer العصا - سيرنا على النحو المبين أعلاه.
- قبل الفحص ، وإعداد 0.15 ملغ / مل حل هويشت 33342 (صبغة النووي للخلايا الحية ، المسابر الجزيئية ، Invitrogen ، كاليفورنيا) في مجال المياه وتخزينها في aliquots في 4 درجة مئوية.
- وصمة عار في الخلايا عن طريق العلاج مع هويشت ملغ / مل 0.15 33342 لمدة 15 دقيقة عند 37 درجة مئوية. على الفور ، تغسل الصبغة مع متوسط 1.0 مل مرتين الطازجة واستبدال 2 مل prewarmed المتوسطة الطازجة.
- إضافة Cy3 المسمى aptamer - خيمر سيرنا في نهائي تركيز 100 نانومتر في وسائل الإعلام واحتضان للخلية الحية المجهري متحد البؤر المجهري في حاضنة CO2 5 ٪ عند 37 درجة مئوية.
- جمع الصور كل 15 دقيقة باستخدام LSM زايس 510 ميتا معكوس 2 الفوتون النظام تحت المجهر مبائر غمر المياه في التكبير 40X.
9. وفي تحد HIV - 1 المختبر وفحص المستضد P24
- شراء CCRF - CEM الخلايا من ATCC. تنمو في RPMI - 1640 (Cellgro ، Mediatech شركة) تستكمل مع مصل بقري جنيني من 10 ٪ (FBS ، HyClone) ، ولام الجلوتامين و1xPen بكتيريا - (Gibco ، Invitrogen). خلايا الثقافة في ترطيب 5 ٪ CO 2 الحاضنة في 37 درجة مئوية.
- الحصول على الدم الطرفية mononucleع عينات من المتبرعين الأصحاء من مدينة الأمل المركز الوطني الطبي (عيادة الموظفين).
- عزل PBMCs من الدم الكامل بواسطة الطرد المركزي من خلال Ficoll - Hypaque الحل (Histopaque - 1077 ، سيغما). CD8 تستنفد خلايا (خلايا T-cytotoxic/suppressor) من PBMCs باستخدام Dynabeads CD8 (Invitrogen ، CA).
- تنمو الخلايا في خلية T - المتوسطة النشطة (BIOE ، وسانت بول ، مينيسوتا). خلايا الثقافة في ترطيب 5 ٪ CO 2 الحاضنة في 37 درجة مئوية.
- الحصول على HIV - 1 وIIIB NL4 - 3 فيروس HIV - 1 وفيروس بال من أبحاث الإيدز ومرجع برنامج الكاشف. بعد انتشار تخزين ، على الفيروس في aliquots -80 درجة مئوية.
- CCRF تصيب الخلايا أو CEM - PBMCs البشرية بفيروسات نقص المناعة البشرية (IIIB ، NL4 - 3 أو بال) (وزارة الداخلية أو 0.001 0.005). بعد 24 ساعة من الإصابة آخر ، وغسل بلطف مع الخلايا ثلاث مرات لإزالة الفيروس PBS الحرة. تواصل ثقافة الخلايا المصابة في 5 ٪ CO حاضنة المجهري 2 عند 37 درجة مئوية لمدة 4 أيام.
- الحمض النووي الريبي قبل العلاج ، وغسل بلطف مع الخلايا المصابة ثلاث مرات لإزالة الفيروس PBS الحرة. refolded احتضان 2x10 4 الخلايا المصابة والخلايا غير المصابة 4 3x10 مع الرناوات التجريبية في 400 نانومتر تركيز النهائي في 96 - جيدا لوحات عند 37 درجة مئوية (100 ميكرولتر لكل بئر مقايسة ثلاثي ،).
- جمع supernatants الثقافة (10 ميكرولتر لكل بئر) في أوقات مختلفة (3 د ، 5 د ، 7 د و د 9) وتخزينها في -20 درجة مئوية حتى مقايسة P24.
- إجراء تحليلات مستضد P24 باستخدام مستضد HIV - 1 P24 ELISA عدة.
10. الكشف عن وظيفة سيرنا بواسطة فحص RT - PCR الكمي
- CCRF تصيب الخلايا أو CEM - PBMCs البشرية بفيروسات نقص المناعة البشرية (IIIB ، NL4 - 3 أو بال) وعلاج مع الرناوات التجريبية (400 نانومتر) على النحو المبين أعلاه.
- بعد 7 أيام من العلاج ، وعزل الخلايا بيليه الرناوات التام مع STAT - 60. علاج الرناوات التام مع أنني الدناز لإزالة الحمض النووي الجيني وانتاج [كدنا] باستخدام 2 ميكروغرام من الحمض النووي الريبي الإجمالي.
- مزج الكواشف التالية : 8 مل nuclease خالية من المياه ، 10 × 1،5 مل الدناز العازلة ؛ 4 ميكرولتر RNA (2 ميكروغرام) ؛ مثبط RNain 0.5 و 1.0 ميكرولتر ميكرولتر ريبونوكلياز خالية الدناز أولا احتضان تفاعل الكلي 15 ميكرولتر 37 درجة مئوية لمدة 1 ساعة والحرارة الى 80 درجة مئوية لمدة 10 دقيقة إلى تعطيل الدناز أولا وعلى الفور رد فعل البرد على الجليد.
- إضافة 2 التمهيدي عشوائي ميكرولتر (50 نانوغرام / ميكرولتر) و1μL dNTP (10 ملم) في خليط التفاعل أعلاه ، ثم الحرارة عند 65 درجة مئوية لمدة 5 دقائق. على الفور ، رد فعل البرد على الجليد.
- إضافة الكواشف التالية : 5 مل 5xFirst حبلا العازلة ؛ 2،5 0،1 مل M DTT ؛ 0.5 مل RNain المانع و 1.0 مل MMLV - RT. احتضان تفاعل مجموع 27 مل عند 25 درجة مئوية لمدة 10 دقيقة وعند 37 درجة مئوية لمدة 1 ساعة. بعد خليط التفاعل الحر ، في 70 درجة مئوية لمدة 15 دقيقة إلى تعطيل الناسخ العكسي ثم البرد على الجليد. [كدنا] مستعد لqRT - PCR التحليل.
- تحليل التعبير عن الجينات المستهدفة بواسطة RT - PCR الكمي باستخدام 2 × قريش SyberGreen Mastermix ومجموعات محددة التمهيدي في التركيز النهائي من 400 نيوتن متر (ثلاثي مقايسة). استخدم التعبير GAPDH باعتبارها الرقابة الداخلية لتطبيع البيانات qPCR.
11. ممثل النتائج :
1. يتم عزل الحمض النووي الريبي الأبتامرات جديدة ضد HIV - 1 gp120 بال ، وتميزت.
كما هو موضح في القسم التجريبي ، وهو قليل النوكليوتيد الحمض النووي الأولي مكتبة تحتوي على 50 منطقة عشوائية NT يحيط بها مناطق التمهيدي ثابتة في 5 'و 3' يتم تضخيمه وكتب في تاريخ حوض الحمض النووي الريبي. هذه المكتبة الأولي تتكون من ما يصل الى 15 10 متواليات متنوعة (1 nmol) ، الذي أضعاف في مجموعة واسعة من الهياكل 3 - D مختلفة. قد عالية التعقيد والتنوع من المكتبة الأولي ضمان وجود هياكل نشط مع تقارب ملزم جيدة لهذا الهدف.
توظف في المختبر الداخلي سيليكس (الشكل 1) لتحديد 2' - fluoropyrimidine الأبتامرات تعديل الحمض النووي الريبي التي تربط بشكل انتقائي سلالة R5 بال HIV - 1 البروتين المغلف gp120 7. كما هو مبين في الشكل (1) ، يتم تنفيذ استراتيجية اختيار النيتروسليلوز القائم على عزل محددة الهدف ملزم الرناوات من جزيئات الحمض النووي الريبي غير ملزم. منذ بروتين يلتصق النيتروسليلوز ، لا يمكن إلا أن يكون الإبقاء على الحمض النووي الريبي / البروتين المجمعات أو المجاميع على الغشاء وتغسل الرناوات الحرة خارج. في ظل ظروف تغيير طبيعة ، يتم استرداد الرناوات ملزمة ويتم نسخها على عكس [كدنا] ومن ثم تضخيمها في dsDNA ، وبعد ذلك كتب في المختبر لإنشاء تجمع RNA جديد للدورة المقبلة الاختيار وزادت صرامة الاختيار عن طريق تقليل كمية من البروتين المستهدفة وزيادة كمية من الحمض الريبي النووي النقال منافس. يظهر مبلغ تجمع RNA والبروتين والحمض الريبي النووي النقال منافس المستخدمة في كل جولة اختيار في الجدول رقم 1.
رصد التقدم المحرز في الاختيار بعد كل دورة من قبل سيليكس مقايسة الربط التصفية. تقييم تقارب ملزمة كما في المئة من الحمض النووي الريبي الإبقاء على فيلثالثا في التجمع مجموع RNA. تجمع بدءا RNA (1 - RNA) يظهر سوى 0.1 ٪ من مدخلات الرناوات الإبقاء على غشاء. ومع ذلك ، بعد جولات اختيار تسعة من الحمض النووي الريبي ninth مكتبة (9 - RNA) و9.72 ٪ من الحمض النووي الريبي إدخال محدد. على الرغم من أن أجريت جولات الاختيار إضافية ، لا مزيد من التخصيب لوحظ ، مما يشير إلى أنه قد تم التوصل ملزمة القصوى لتجمع الحمض النووي الريبي (الشكل 2A). مماثلة مع مقايسة الربط تصفية ، وتحول جل مقايسة هي أيضا واحدة من الاستراتيجيات الأكثر شعبية لتحديد ثوابت التفكك. هذا الإجراء هو سهلة ومريحة. كما هو مبين في الشكل 2B ، المقايسات تحول جل تأكيد مواصلة الأنشطة الملزمة للتجمعات الحمض النووي الريبي. هذه النتائج تثبت أن يتم التخصيب على التوالي مع بعض يغاندس خصوصية عالية ملزمة للبروتين المستهدف في هذه البرك RNA..
استنساخ وتسلسل تجمعات aptamer عالي التخصيب (12 - RNA). وفقا لتسلسل التحالفات الفردية aptamer المستنسخة ، ويتم تصنيف ست مجموعات مختلفة كما هو موضح في الجدول رقم 2. حوالي 40 ٪ من الحيوانات المستنسخة (المجموعة الأولى والثانية الأبتامرات) تحتوي على تسلسل الحفظ : A TTGAGGGACC (A / G) (A / G). نختار سلسلة واحدة من ممثل لكل مجموعة (على سبيل المثال : A - 1 ، A - 5 ، A - 9 ، A - 12 ، A - 28 و B - 68) لمزيد من توصيف بسبب الوفرة النسبية داخل جماعتهم. من خلال فحص هلام الأصلي التحول التنقل ، يتم حساب ثوابت التفكك (K د) من هذه الأبتامرات ممثل (3A الشكل). على سبيل المثال ، A - 1 ، وأفضل من الأبتامرات ، لديه قيم واضحة دينار من 52 نانومتر (الشكل 3B). كما هو مبين في الشكل 3A ، يمكن لهذه الأبتامرات ربط بشكل انتقائي مع تحديد هدف بال HIV - 1 gp120 ، ولكن ليس CM gp120 بروتين الفيروس.
2. مكافحة gp120 aptamer يربط بشكل محدد وغير المنضوية بواسطة الخلايا معربا عن فيروس نقص المناعة البشرية gp160 وتمنع عدوى HIV - 1 في ثقافة الخلية.
CHO - gp160 تستخدم الخلايا التعبير عن بروتين سكري ستابلي وفيروس نقص المناعة البشرية المغلف gp160 لاختبار استيعاب ملزمة ولمكافحة الأبتامرات gp120 المحدد. هذه الخلايا لا gp160 في عملية gp120 gp41 ونظرا لأنها تفتقر إلى البروتياز هفوة المشفرة اللازمة لمعالجة ظرف. كعنصر تحكم نستخدم الوالدية خط الخلية CHO - EE الذي لا يعبر عن gp160. تحليل تدفق cytometric (الشكل 4A) تكشف عن أن Cy3 المسمى الأبتامرات خصيصا لربط الخلايا تشو gp160 لكن ليس السيطرة CHO - EE الخلايا وعلاوة على ذلك ، في الوقت الحقيقي يعيش خلية Z - محور المجهري مبائر يشير إلى أن المنضوية انتقائي - Cy3 المسمى aptamer داخل خلايا gp160 CHO (الشكل 4B و 4C) بعد 2 ساعة من الحضانة ، ولكن ليس السيطرة على الخلايا CHO - EE ( الشكل 4D). الشكل 4C يظهر أيضا أن aptamer تجميعها داخل السيتوبلازم ، مما يشير إلى دخول الأبتامرات gp120 ربما عبر مستقبلات الخلايا بوساطة الإلتقام.
في مقايسة HIV - 1 التحدي ، وتعامل HIV - 1 - المصابة PBMC الخلايا مع الأبتامرات. في أيام مختلفة بعد العلاج مع الأبتامرات ، ويعاير aliquots من وسائل الإعلام لمستويات مستضد الفيروسية P24 (4E الشكل). وأظهرت النتائج أن الأبتامرات مكافحة gp120 (A - 1) يمنع إنتاج HIV - 1 P24 مع التركيز نانو مولار.
3. تم تصميم المضادة للgp120 aptamer - سيرنا خيمر وتقييمها فعاليته كما الخلية من نوع محدد نظام تسليم سيرنا
كما هو مبين في الشكل 5A ، aptamer وشعور شريحة حبلا من siRNAs الواردة nuclease المقاوم 2' - الفلوري UTP و2' الفلورية CTP وتوليفها من القوالب dsDNA المناظرة في النسخ التي عاثية المختبر. من أجل زيادة المرونة في الجزيء ، وهو رابط two النوكليوتيدات (UU) يتم إدراج بين aptamer والجزء الركيزة المقامر. لإعداد سيرنا تحتوي على الوهم ، في المختبر خيالية كتب البوليمرات حبلا aptamer بين الشعور وصلب مع وجود تركيزات متساوي المولية RNA العقاقير حبلا معدلة. هذه البيانات من مقايسة التحول هلام (الشكل 5B) والتدفق الخلوي (الشكل 5C) تشير إلى أن الحفاظ على الوهم تقريبا نفس الانتماءات الملزمة كما الأبتامرات وحدها. الصور طبعا من الوقت في الوقت الحقيقي المجهري متحد البؤر (الشكل 5D) تبين أن Cy3 التي تحمل علامات يمكن الفصل خيمر 1 - A المنضوية بنجاح في سيتوبلازم الخلايا. كما هو متوقع ، لوحظ امتصاص أي من الوهم مع الخلايا السيطرة CHO - EE (الشكل 5E).
وبالمثل ، يتم تقييم القدرة المضادة للفيروسات من RNAs بواسطة HIV - 1 مقايسة التحدي. نتائج تحاليل فيروس نقص المناعة البشرية مستضد P24 (الشكل 6A و 6B) تبين أن كلا من aptamer وخيمر منع انتاج P24 ، ولكن لوحظ تثبيط أقوى مع الفصل خيمر A - 1 العلاج.
لتأكيد أن المكون سيرنا يعمل جنبا إلى جنب مع APTAمير ، بعد استيعاب من الفصل A - 1 خيمر في الخلايا المصابة ، ونحن أيضا تقييم المستويات النسبية للتثبيط التعبير الجيني المتبادل / دوران المحرك عن طريق فحوصات التعبير الكمي RT - PCR. نجد أن علاج الخلايا المصابة مع الوهم قادرة على حمل إسكات الجين المتبادل / دوران المحرك ، بينما aptamer وحده لا يؤثر على الجينات متبادلة تزيد السرعة / التعبير (والشكل 6C 6D). هذه النتائج أن تقديم المزيد من الدعم لتسليم سيرنا aptamer مشغلات رني.
| كمية من البروتين ، واستخدام حوض السباحة والحمض النووي الريبي لاختيار الحمض الريبي النووي النقال | |||||
| جولات سيليكس | نسبة الهدف / RNA | Gp120 البروتين | RNA بركة | منافس الحمض الريبي النووي النقال | اختيار العازلة |
| 1 | 1/6.5 | 229.8 بمول | 1.5 nmol (40.1 ميكروغرام) | 0 | العازلة منخفضة الملح سيليكس |
| 2 | 1/6.5 | 114.9 بمول | 0.75 nmol (20.1 ميكروغرام) | 0.25 nmol (6.6 ميكروغرام) | |
| 3 | 08/01 | 76.6 بمول | 0،625 nmol (16.7 ميكروغرام) | 0.25 nmol (6.6 ميكروغرام) | |
| 4 | 08/01 | 76.6 بمول | 0،625 nmol (16.7 ميكروغرام) | 0.25 nmol (6.6 ميكروغرام) | |
| 5 | 08/01 | 38.3 بمول | nmol 0،306 (8.18 ميكروغرام) | 0.5 nmol (13.2 ميكروغرام) | العازلة عالية من الملح سيليكس |
| 6 | 08/01 | 38.3 بمول | nmol 0،306 (8.18 ميكروغرام) | 0.5 nmol (13.2 ميكروغرام) | |
| 7 | 1 / 10 | 26.8 بمول | nmol 0،268 (7.16 ميكروغرام) | 0.5 nmol (13.2 ميكروغرام) | |
| 8 | 1 / 10 | 26.8 بمول | بمول nmol 0،268 (7.16 ميكروغرام) | 1 nmol (26.4 ميكروغرام) | |
| 9 | 1 / 10 | 15.3 بمول | nmol 0،153 (4.09 ميكروغرام) | 1 nmol (26.4 ميكروغرام) | |
| 10 | 1 / 10 | 15.3 بمول | nmol 0،153 (4.09 ميكروغرام) | 1.5 nmol (39.6 ميكروغرام) | |
| 11 | 1/12.5 | 7.66 بمول | nmol 0،096 (2.56 ميكروغرام) | 2 nmol (52.8 ميكروغرام) | |
| 12 | 1/12.5 | 7.66 بمول | nmol 0،096 (2.56 ميكروغرام) | 2 nmol (52.8 ميكروغرام) | |
الجدول 1. شروط الاختيار. كمية من البروتين ، ويشار إلى RNA سباحة والحمض الريبي النووي النقال المستخدمة لكل اختيار وانتقاء العازلة.
| مجموعة | RNA | تسلسل عشوائي | التردد (140 استنساخ) |
| المجموعة الأولى | A - 1 | AATTGAGGGACCA CGCGCTGCTTGTTGTGATAAGCAG TTTGT CG GATGG | 33 (23.6 ٪) |
| B - 7 | AATTGAGGGACCA ACGCGAGGATGTGGATAGTGTGTA TTTGC GT GATGG | 3 | |
| A - 32 | AATTGAGGGACCG TTGGTAAAAGCCGGA AATTG AGCT TTTAC GGC GATGG | 5 | |
| B - 55 | AATTGAGGTACCGCG TTATTAGGAACA AATTG GAATTCTAAACGC GATGG | 2 | |
| A - 24 | AATAGAGGGACC CAGATATAGGCTACACGGATGATGGTGTATCTG GATGG | 1 | |
| B - 19 | AATAGAGGAACCG TTTCAGAAGACTACAGGTTAGTCCAATGAAGC GACGG | 1 | |
| B - 31 | AATAGAGGGACCG TGGACAATAATTTATGGTCA TTTATTGGCAC GATGG | 1 | |
| المجموعة الثانية | A - 12 | AGTAGAGGAACCA AGCAATGGATGAATGCAAAAGTGTAAATGCTT GATGG | 10 (7.1 ٪) |
| المجموعة الثالثة | A - 9 | TGAGTTTGGGTAAATTTCCGGTTTCGGTTTACTCACGAAAGATCGGTCGG | 15 (10.7 ٪) |
| المجموعة الرابعة | A - 28 | TAAAGGAGGGAAGGATGAGACCGCACGAAAAATATCAGCATACG TTTGTG | 10 (7.1 ٪) |
| المجموعة الخامسة | A - 5 | GAAACTAGTTTGAATAATGGTGTAGAGGAGGGTCAATAGTTTCG TTGGTG | 9 (6.4 ٪) |
| المجموعة السادسة | B - 68 | ACATAGTAATGACACGGAGGATGGAGAAAAAACAGCCATCTCTTGACGGT | 2 |
| آخرون | تسلسل اليتيم | 48 |
الجدول 2. المحاذاة وتحديد الأبتامرات الحمض النووي الريبي. بعد الجولة ال 12 من التحديد ، تم استنساخ الحمض النووي الريبي تجمع المختارة ومتسلسلا. بعد مواءمة جميع الحيوانات المستنسخة 140 ، وقد تم تحديد ست مجموعات مناهضة للgp120 الأبتامرات. يشار فقط في تسلسل عشوائي للمناطق aptamer الأساسية (5' - 3 '). يتم تحديد العزلات التي تحدث مع الترددات متعددة.
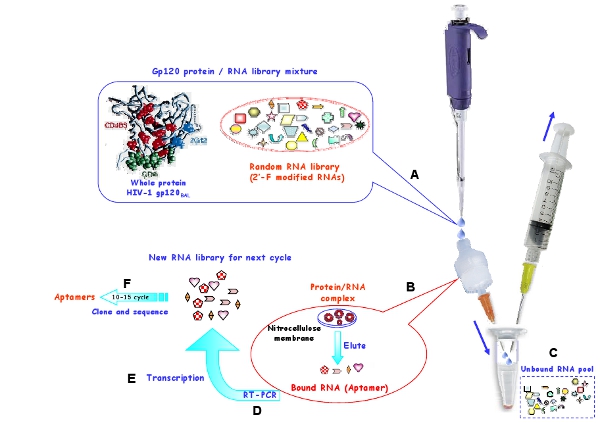
الشكل 1 : تمثيل تخطيطي لعملية الانتقاء في المختبر باستخدام غشاء النيتروسليلوز ، لتوليد الحمض النووي الريبي لالأبتامرات HIV - 1 بروتين gp120 بال. (A) وحضنت تجمع بدءا RNA والبروتين المستهدف لتشكيل تعقيدا. (ب) وأبقي على جزيئات الحمض النووي الريبي ملزمة على الغشاء وeluted من الغشاء تحت شرط تغيير طبيعة. (C) وتتغسل الرناوات غير منضم بعيدا. (D) وكتب عكس الرناوات مختارة وتضخيمها من قبل الاسترداد. (E) وكتب لاحقا أن الحمض النووي الريبي ذات الصلة في تجمع جديد لاختيار الدورات المقبلة. (F) بعد جولات اختيار 10-15 ، تم استنساخ الأبتامرات مختارة والتسلسل.
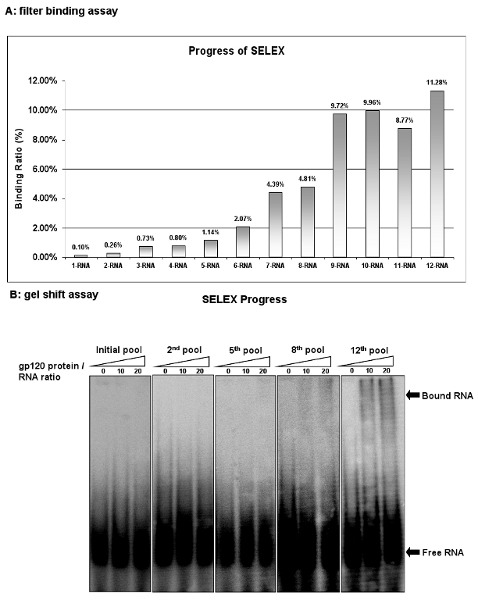
الشكل 2 : إن التقدم من HIV - 1 اختيار الأبتامرات gp120. (أ) تم تحليل النشاط ملزمة تجمع الحمض النووي الريبي في كل دورة من خلال فحص الحمض الريبي النووي النقال ملزمة تصفية مع منافس. حسبت الأنشطة ملزمة حسب نسبة مساهمة RNA الاحتفاظ على تصفية في البروتين / RNA المعقدة. (ب) وتم تحليل النشاط ملزمة تجمع الحمض النووي الريبي في كل دورة من خلال فحص التحول هلام. وأظهر تجمع ال 12 الجيش الملكي النيبالي على أعلى نشاط ملزمة.
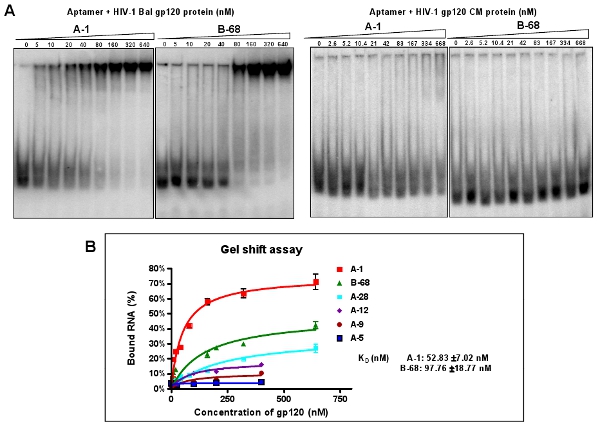
الشكل 3 : تجليد مقايسة نشاط الأبتامرات الفرد المختار ضد بال HIV - 1 gp120. (A) وحضنت و5' نهاية ف 32 الأبتامرات الفرد المسمى مع الكميات المتزايدة من البروتين gp120 المستهدفة أو غير محددة من البروتين CM. تم تحليل خليط التفاعل ملزمة التحول مقايسة هلام التنقل. Aptamer A - 1 و B - 68. أظهرت تقارب أفضل ملزمة مع البروتين الهدف ، ولكن البروتين لا CM البيانات تمثل المتوسط أربعة مكررات. (ب) منحنى ملزم من هلام مقايسة التحول.
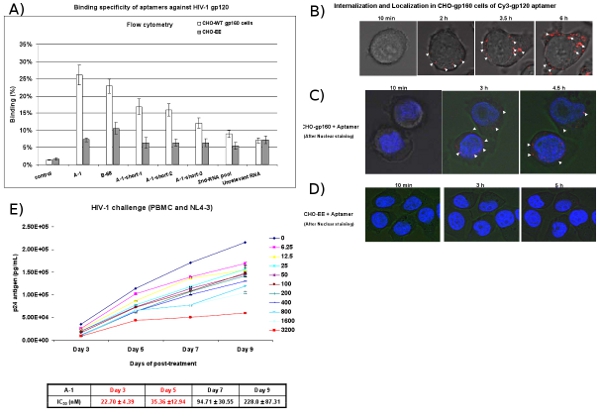
الشكل 4 : خلية من نوع الملزمة ودراسات محددة امتصاص الأبتامرات. تم تقييم (A) من سطح الخلية ملزم Cy3 المسمى الرناوات بواسطة التدفق الخلوي. تم اختبار الرناوات Cy3 المسمى للربط إلى تشو gp160 الخلايا والخلايا السيطرة CHO - EE. وأظهرت الأبتامرات تحديد الخلية من نوع تقارب ملزمة محددة. تم استخدام الحمض النووي الريبي الثانية 2 حمام سباحة وغير ذي صلة كما الرناوات ضوابط السلبية. تمثل البيانات بمعدل ثلاثة مكررات. (ب) تحليل التطبع. ونمت الخلايا تشو gp160 في لوحات 35 ملم وحضنت مع التركيز نانومتر 100 من المسمى Cy3 - A - 1 في وسائل الاعلام عن الثقافة في الوقت الحقيقي التحليل المجهري للخلايا الحية مبائر. وقد جمعت هذه الصور في 15 دقيقة. فترات به التكبير 40X. (C ، D) التعريب التحليل. CHO - gp160 ما نمت الخلايا والخلايا السيطرة CHO - EE في 35 لوحات ملم. قبل الحضانة مع 100 نيوتن متر من Cy3 المسمى A - 1 ، تم صبغ الخلايا مع هويشت 33342 (صبغة النووي للخلايا حية) ومن ثم تحليلها في الوقت الحقيقي باستخدام المجهر مبائر. (ه) المضادة للاختيار gp120 الأبتامرات تمنع HIV - 1 تكرارها في PBMCs البشرية المصابة سابقا مع HIV - 1 - 3 NL4 الفيروس. تركيزات مختلفة والوقت وعرضت pointes. أدرج IC50 القيمة. البيانات تمثل متوسط القياسات ثلاث نسخ من P24.
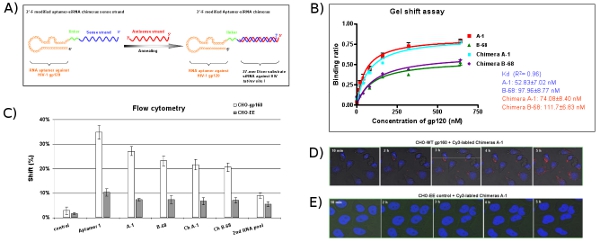
الشكل 5 : تصميم وتقييم نظام aptamer - سيرنا التسليم وهم. (أ) تخطيطي aptamer - سيرنا الرناوات خيالية : منطقة aptamer مكافحة gp120 مسؤولة عن الربط لgp120 وسيرنا هو استهداف اكسون المشتركة HIV - 1 المتبادل / مراجعة. كان 2' - الفلوري تعديل حبلا الشعور aptamer سيرنا واحد ، شارك في كتابته أو يليها من الصلب حبلا سيرنا العقاقير التكميلية لاستكمال جزيء خيالية. يشار إلى رابط (UU) بين aptamer وسيرنا في الأخضر. (ب) والرناوات aptamer - سيرنا خيالية التي تحتوي على قيم دينار كويتي مقارنة فضلا عن ربط الأبتامرات الوالدين على وجه التحديد بروتين gp120 بال فيروس نقص المناعة البشرية. تمثل البيانات بمعدل ثلاثة مكررات. (ج) خلية من نوع معين من الدراسات ملزمة الأبتامرات. تم اختبار الرناوات Cy3 المسمى للربط إلى تشو gp160 الخلايا والخلايا السيطرة CHO - EE. خلية سوروجرى تقييم الارتباطات وجه من RNAs - Cy3 صفها التدفق الخلوي. وأظهرت الأبتامرات تحديد الخلية من نوع تقارب ملزمة محددة. استخدمت الثانية 2 حمام سباحة والحمض النووي الريبي RNA لا صلة له ضوابط السلبية. البيانات تمثل المتوسط اثنين من يعيد. (D ، E) التطبع والتحليلات التوطين داخل الخلايا. ونمت الخلايا gp160 تشو في 35 ملم وكانت لوحات ملطخة هويشت 33342 (صبغة النووي للخلايا حية). لاحقا ، وحضنت الخلايا في مستنبت مع تركيز 100 نيوتن متر من Cy3 الوهم المسمى في الوقت الحقيقي يعيش خلية التحليل المجهري مبائر كما هو موضح سابقا.
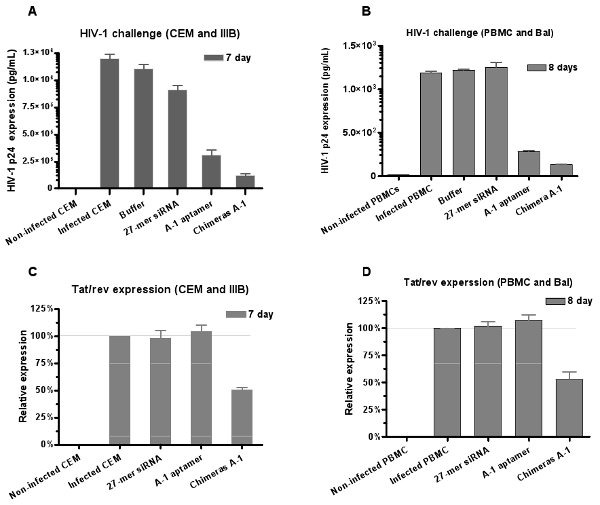
الشكل 6 : تثبيط مزدوجة من عدوى HIV - 1 - aptamer بوساطة سيرنا الوهم. سواء لمكافحة gp120 aptamer والوهم aptamer - سيرنا تحييد عدوى HIV - 1 في خلايا CEM (A) (IIIB سلالة) و (ب) ثقافة PBMCs الإنسان (سلالة بال) ، على التوالي. البيانات تمثل متوسط القياسات ثلاث نسخ من P24. وأظهرت الوهم أقوى من تثبيط aptamer حدها مشيرا الى ان (C ، D) وسيرنا ألقاه الأبتامرات أسفل ينظم التعبير الجيني المتبادل / دوران المحرك في PBMCs. تمثل البيانات بمعدل ثلاثة مكررات.
Discussion
الأبتامرات هي في المختبر تطورت الأحماض النووية التي تفترض محددة ومستقرة الأشكال ثلاثية الأبعاد ، مما يوفر للغاية محددة وملزمة لضيق الجزيئات المستهدفة 8. انخفاض تقارب ملزم nanomolar ونوعية رائعة من الأبتامرات إلى أهدافهم جعلها أدوات متعددة للتشخيص والتصوير
Disclosures
Acknowledgements
نشكر بريتا Hoehn ، أحد Guihua ، Soifer هاريس وليزا شيرر لإجراء مناقشات مفيدة. وأيد هذا العمل من المنح المقدمة من المعاهد الوطنية للصحة وAI29329 HL07470 منحت لJJR والكواشف التالية تم الحصول عليها من خلال أبحاث الإيدز والمعاهد الوطنية للصحة مرجع برنامج الكاشف ، شعبة الإيدز ، NIAID ، المعاهد الوطنية للصحة : إن تشو تشو والخلية EE - gp160 خط ، وpNL4 - 3 ناقلات لوك ؛ بال HIV - 1 من gp120 DAIDS ، NIAID.
Materials
| Name | Company | Catalog Number | Comments |
| اسم كاشف | شركة | فهرس العدد | تعليقات (اختياري) |
|---|---|---|---|
| MF - ميليبور غشاء فلتر | ميليبور | HAWP01300 | حجم مسام 0.45 ميكرون |
| Swinnex تصفية حامل | ميليبور | SX0001300 | قطرها 13 ملم |
| QIAquick جل استخراج كيت | QIAGEN | 28706 | تنقية الحمض النووي |
| Microcon YM - 30 عمود | ميليبور | 42410 | تركيز الحمض النووي الريبي |
| الحيوي تدور العمود 30 | الحيوي راد | 732-6250 | RNA تنقية |
| طق البلمرة PCR DNA | سيغما الدريخ | D1806 | |
| ThermoScript RT - PCR النظام | Invitrogen | 11146-024 | |
| DuraScribe T7 كيت النسخ | EpiCentre | DS010925 | |
| dNTP لPCR | روش | 1 581 295 | |
| حمض النووي الريبي ، ونقل من القولونية | سيغما الدريخ | R1753 | الحمض الريبي النووي النقال منافس |
| HIV - 1 - L با بروتين gp120 | للأبحاث الإيدز ومرجع برنامج الكاشف | 4961 | الهدف من البروتين |
| طقم كاتم الصوت الوسم سيرنا -- Cy3 | Ambion | 1632 | |
| حمض الفينول / كلوروفورم 01/05 الحل (درجة الحموضة 4.5) | Ambion | AM9720 | |
| كلوروفورم / الأيزوبروبانول 24 / 1 الحل | سيغما | C0549 | |
| العجل الفوسفاتيز المعوية (CIP) | نيو إنجلاند BioLab | M0290L | |
| عديد النوكليوتيد كيناز T4 | نيو إنجلاند BioLab | M0201L | |
| الجليكوجين | روش | 10 901 393 001 | RNA هطول الأمطار |
| غاما - P - 32 ATP | النائب الطبية الحيوية | 013502002 | Radiactivity |
| 40 ٪ AccuGel 19:01 | تشخيص وطنية | EC - 850 | |
| 10xTBE | تشخيص وطنية | EC - 860 | |
| ن ، ن ، ن ، N' - Tetramethylethylenediamine (TMEMD) | سيغما الدريخ | T9281 | |
| بيرسلفات الأمونيوم (APS) | سيغما الدريخ | A3678 | |
| L - methioine sulfoximine | سيغما الدريخ | M5379 - 250 ملغ | |
| RPMI الإعلام 1640 | Invitrogen | 11835-030 | |
| بيكربونات الصوديوم ، 7.5 ٪ وزن / V | Invitrogen | 25080-094 | |
| متوسطة الأساسية الدنيا (MEM) (10 ) | Invitrogen | 11430-030 | |
| MEM غير الاساسيين من الأحماض الأمينية (100 ) | Invitrogen | 11140-050 | |
| TA استنساخ عدة مع PCR 2.1 | Invitrogen | K2040 - 01 |
References
- Tuerk, C., Gold, L. Systematic evolution of ligands by exponential enrichment: RNA ligands to bacteriophage T4 DNA polymerase. Science. 249, 505-510 (1990).
- Ellington, A. D., Szostak, J. W. In vitro selection of RNA molecules that bind specific ligands. Nature. 346, 818-822 (1990).
- Robertson, D. L., Joyce, G. F. Selection in vitro of an RNA enzyme that specifically cleaves single-stranded DNA. Nature. 344, 467-468 (1990).
- Fitzwater, T., Polisky, B. A SELEX primer. Methods Enzymol. 267, 275-301 (1996).
- Weiss, C. D., White, J. M. Characterization of stable Chinese hamster ovary cells expressing wild-type, secreted, and glycosylphosphatidylinositol-anchored human immunodeficiency virus type 1 envelope glycoprotein. J Virol. 67, 7060-706 (1993).
- Vodicka, M. A. Indicator cell lines for detection of primary strains of human and simian immunodeficiency viruses. Virology. 233, 193-198> (1997).
- Zhou, J. Selection, characterization and application of new RNA HIV gp 120 aptamers for facile delivery of Dicer substrate siRNAs into HIV infected cells. Nucleic Acids Res. , (2009).
- Mayer, G. The chemical biology of aptamers. Angew Chem Int Ed Engl. 48, 2672-2689 (2009).
- Famulok, M., Hartig, J. S., Mayer, G. Functional aptamers and aptazymes in biotechnology, diagnostics, and therapy. Chem Rev. 107, 3715-3743 (2007).
- Chu, T. C., Twu, K. Y., Ellington, A. D., Levy, M. Aptamer mediated siRNA delivery. Nucleic Acids Res. 34, e73-e73 (2006).
- McNamara, J. O., 2nd, . Cell type-specific delivery of siRNAs with aptamer-siRNA chimeras. Nat Biotechnol. 24, 1005-1015 (2006).
- Dassie, J. P. Systemic administration of optimized aptamer-siRNA chimeras promotes regression of PSMA-expressing tumors. Nat Biotechnol. 27, 839-849 (2009).
- Zhou, J., Rossi, J. J. The therapeutic potential of cell-internalizing aptamers. Curr Top Med Chem. 9, 1144-1157 (2009).
- Zhou, J., Li, H., Li, S., Zaia, J., Rossi, J. J. Novel dual inhibitory function aptamer-siRNA delivery system for HIV-1 therapy. Mol Ther. 16, 1481-1489 (2008).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved