Bu içeriği görüntülemek için JoVE aboneliği gereklidir. Oturum açın veya ücretsiz deneme sürümünü başlatın.
Method Article
Hücre tipi siRNA teslimat için özel anti-HIV gp120 aptamers Geliştirme
Bu Makalede
Özet
Nanomole afinite ile HIV 1BA-L gp120 karşı çeşitli 2'-Fluoro RNA aptamers bir RNA kütüphanesi ile izole edilmiştir. In vitro SELEX prosedürü. Chimera yeni bir çift inhibitör fonksiyonu anti-gp120 aptamer-siRNA oluşturulur ve sistemik anti-HIV tedavisi için önemli bir söz gösterir.
Özet
HIV enfeksiyonu küresel salgın antiretroviral ajanlar ile yeni sınıflar için acil bir ihtiyaç yarattı. Tamamlayıcı RNA transkript ekspresyonunu inhibe güçlü yeteneği küçük bir müdahale (si) RNA'lar, HIV dahil olmak üzere çeşitli hastalıklar için terapötikler yeni bir sınıf olarak istismar ediliyor. Birçok önceki raporlarda roman RNAi tabanlı anti-HIV/AIDS tedavi stratejileri önemli bir söz var olduğunu göstermiştir, ancak başarılı bir tedavi uygulaması ve siRNA'lar klinik çevirisi kilit bir engel verimli teslimat. Özellikle, RNAi temelli tedaviler güvenliği ve etkinliği göz önünde bulundurularak, belirli bir hücre popülasyonları ya da doku hedeflenen hücre içi siRNA teslim yaklaşımı geliştirmek için son derece cazip. HIV-1 gp120 proteini, HIV-1 yüzeyinde bir glikoprotein zarf, CD4 hücrelerinin viral giriş önemli bir rol oynar. HIV-1 giriş tetikler ve hücre füzyonu başlatır gp120 ve CD4 etkileşimi ilaç keşfi için klinik olarak anlamlı bir anti-viral bir strateji olarak onaylanmıştır.
Bu yazıda öncelikle 2'-F modifiye anti-HIV RNA aptamers gp120 seçimi ve kimlik tartışacağız. Geleneksel bir nitroselüloz filtre SELEX yöntemi kullanarak, nanomolar afinite ile birçok yeni aptamers rasgele 50 nt RNA kütüphanesi izole edilmiştir. Başarılı bir şekilde yüksek bir afinite ile bağlı türler elde etmek için, dikkatli bir seçim darlığı koşulları ayarlayarak kontrol edilir. Seçilen aptamers özellikle bağlamak ve hızlı bir şekilde HIV-1 zarf proteini eksprese eden hücrelerin içine içselleştirilmiş. Ayrıca, tek başına aptamers HIV-1 enfektivite nötralize eder. En iyi aptamer A-1 dayanarak, biz de chimera aptamer ve siRNA bölümlerini hem de sahip olduğu güçlü anti-HIV faaliyetlerinin bir roman çift inhibitör fonksiyonu anti-gp120 aptamer-siRNA oluşturun. Ayrıca, HIV-1 ile enfekte hücrelerin içine siRNA hücre türüne özgü bir teslimat için gp120 aptamer siRNA kimeralar kullanmaktadır. Chimera Bu ikili işlevi, bastırmak, HIV-1 enfeksiyonu çeşitli nükleik asit terapötik ajanlar (aptamer ve siRNA) birleştirerek, hastalar için son derece aktif antiretroviral tedavinin (HAART) başarısız aptamer siRNA kimeralar çekici bir terapötik adaylar için önemli bir potansiyel gösterir.
Protokol
1. RNA kütüphanesi hazırlanması
- Başlangıç DNA kütüphanesi rastgele dizileri 50 nükleotidler bulunan ve Entegre DNA Teknolojileri (Coralville, Iowa) tarafından sentezlenmiştir. N 50 - CAG ACG ACT CGC CCG - 3 '(81 nt) AGG ACG ATG CGG tek iplikli DNA oligo kütüphane dizisi 5'-GGG. T7 in vitro transkripsiyon için organizatörü ve RT-PCR için 3 'etiketi içeren sabit bölgelerde, rastgele bölge ile çevrili. 5 've 3' sabit dizileri 5 '- TAA TAC GAC TCA CTA TAG GGA GGA CGA TGC GG-3' (32 mer) ve 5-TCG GGC GAG TCG TCT G-3 '(16 mer), sırasıyla. -20 ° C'de alikotları su ve mağaza stok solüsyonu olun
- PCR 2 mM MgCl 2 ve 200 mcM her dNTP ile birlikte, her biri 3 mcM 5'-3'-primerler kullanılarak tek iplikli DNA oligo rastgele kitaplığı (0.4 mcM) artırın . Orijinal DNA kütüphanesi zenginliği korumak için, on çevrim PCR sınırı. PCR reaksiyonları (10 reaksiyonlar, reaksiyon başına 100 mcL) sonra, QIAquick Jel arıtma Kiti (QIAGEN) kullanılarak amplifiye dsDNA havuzu kurtarmak.
- Üreticinin talimatlarına göre DuraScription Seti (Epicentre, Madison, WI) kullanarak bir RNA kütüphane dsDNA dönüştürün. Transkripsiyon Reaksiyon karışımı, Ribonükleaz dirençli RNA üretmek için 2'-F-CTP ve 2'-F-UTP ile CTP ve UTP değiştirin. Tipik olarak, 1 mg içeren saflaştırılmış mcL DNA şablonu, 2 mcL 10 x tampon, 2 mcL dATP, 2 mcL dGTP, 2 mcL 2'F-dCTP, 2 2'-F-dUTP, 2 mcL DTT 20 mcL reaksiyon hazırlamak ve sonra 2 mcL T7 RNA oda sıcaklığında polimeraz ve 37 ° C, 6 saat süreyle inkübe (50 mM her dNTP).
- Daha sonra% 8'lik poliakrilamid / 7 M üre jel DNA kaldırmak ve arındırmak için DNaz I (20 mcL T7 transkripsiyon reaksiyonu başına 1,5 mcL) ile reaksiyon sindiremez. UV spektrofotometresi saflaştırılmış RNA kütüphanesi sayısal olmalıdır.
2 aptamers, in vitro üretimi
- Seçiminden önce, seçim tampon ve refolding tampon hazırlamak. 100 mM HEPES, pH 7.4 içeren bir HEPES tamponu hazırlayın. NaOH oda sıcaklığında pH değeri ve daha sonra mağaza ayarlamak için kullanın. 13.5 mM KCl, 5 mM MgCl 2; 5 mM CaCl 2, 50 mM HEPES pH 7.4, 750 mM NaCl içeren bir RNA refolding tamponu (5xHBS) hazırlayın . Düşük tuzlu RNA bağlayıcı tamponu (10 mM HEPES pH 7.4, 50 mM NaCl, 1 mM CaCl 2, 1 mM MgCl 2, 2.7 mM KCl, 10 mM DTT,% 0.01 'BSA ve yüksek tuz RNA bağlayıcı tamponu (10 hazırlayın mM HEPES pH 7.4, 150 mM NaCl, 1 mM CaCl 2, 1 mM MgCl 2, 2.7 mM KCl, 10 mM DTT,% 0.01 BSA) -20 ° C'de bu tamponlar Mağaza
- Esas olarak 1-4 açıklanan SELEX gerçekleştirin. Önce her seçim yuvarlak, 1xHBS tampon (10 mM Hepes pH 7.4, 150 mM NaCl, 1 mM CaCl 2, 1 mM MgCl 2, 2.7 mM KCl), 3 dakika ısı 95 ° C katlanamayan RNA havuzları ve daha sonra yavaş yavaş serin 37 ° C 37 ° inkübasyon devam ° C, 10 dk.
- Genellikle, nitroselüloz filtre ile nonspesifik bağlanma, ön-adsorbe en aza indirmek amacıyla hedef HIV-1 Bal gp120 protein ile inkübasyon öncesinde, 30 dakika için bir nitroselüloz filtre (HAWP filtre, 0.45 mikron) RNA havuzları refolded.
- 4 SELEX turlarında 1 için 30 dakika önceden temizlenmiş düşük tuz RNA bağlayıcı tampon hedef protein ile RNA havuzu inkübe edin. SELEX dördüncü turdan sonra, yüksek tuz RNA bağlayıcı tampon kullanın. SELEX ilerleme ile gp120 protein miktarını azaltmak ve aptamer seçim darlığı artırmak amacıyla rakip maya tRNA artırmak.
- Ilk seçim döngüsü için, önceden temizlenmiş rastgele RNA havuzu (40 mg, 1.5 nmol, 9x10 14 moleküller) ve HIV-1 Bal gp120 protein (0.23 nmol, RNA / protein oranı 6.5 / 1) 200 mcL düşük inkübe 30 dakika oda sıcaklığında dönen bir platform üzerine tuz RNA bağlayıcı tampon.
- Önceden ıslatılmış nitroselüloz filtre ile reaksiyon Pass ve 1 ml bağlayıcı tamponu ile yıkayın.
- 95 200 mcL elüsyon tampon (7 M üre ve 5 mM EDTA) ° C, 5 dk Microcon YM-30 sütun ile fenol / kloroform ekstraksiyon ve konsantrasyon ile filtre bağlı bir RNA Zehir
- Ters ThermoScript RT-PCR sistemi (Invitrogen) kullanarak kurtarılan RNA havuzu uyarlamak ve 15 döngü PCR yükseltmek.
- QIAquick Jel temizleme kiti kullanılarak amplifiye dsDNA havuzu arındırmak ve sonraki turda seçim için yukarıda açıklanan yazıya.
3. SELEX ilerleme bağlayıcı tahlil filtre tarafından izlenir
- Filtre bağlama yöntemi ile aptamers SELEX ilerleme izleyin. T4 polinükleotid kinaz ve γ-32P-ATP ile 5'-trifosfat sonra başlatılması ve etiketi kaldırmak için CIP RNA havuzu davranın.
- Isı 10 pmol CIP 95 ° C ve 5 dakika sonra soğuk buz üzerinde RNA kütüphanesi davrandı. Daha sonra, 2 eklemekPNK tampon, T4 polinükleotid kinaz 1 mcL, 20 mcL gama-P 1 mcL 32-ATP ve su mcL.
- 37 ° ° C'de 30 dakika sonra 20 ^ mu ekleyin; L su ve G-50 sütun tarafından tepki arındırmak. Sonuç olarak, nihai konsantrasyonu 250 nM etiketli RNA 40 mcL edinin.
- Tahlil önce 1xHBS tampon (10 mM Hepes pH 7.4, 150 mM NaCl, 1 mM CaCl 2, 1 mM MgCl 2, 2.7 mM KCl), 95 ısı katlanamayan etiketli RNA havuzları ° C, 3 dk sonra yavaş yavaş serin 37 ° C 37 ° inkübasyon devam ° C, 10 dk.
- Burada örnek olarak bağlayıcı bir reaksiyon 100 mcL yürütmek. Inkübe son etiketli gp120 protein (100 nM) ve 10 kat, 30 dakika boyunca yüksek tuz RNA bağlayıcı tampon nonspesifik rakip tRNA (100 nM) molar fazla RNA havuzu (10 nM).
- Bir ön ıslak nitroselüloz filtre tarafından bağlayıcı bir reaksiyon 50 mcL ayırın.
- 2 mL bağlayıcı tamponu ile filtre yıkayın ve çok amaçlı bir sintilasyon sayacı (Beckman Coulter) ile filtre üzerinde tutulan radyoaktivite saymak. Bir giriş kontrolü gibi, aynı zamanda bağlama reaksiyon kalan 50 mcL sayılır. Afinitesi olarak giriş RNA filtre muhafaza RNA yüzde hesaplayın.
4. Klonlama, sıralama ve doğrultma
- 11 tur sonra başka zenginleştirme ek seçim turlarında bile incelendiğinde ise, daha sonra RNA havuzu maksimum bağlanma potansiyel ulaşmış oldu.
- Ters ThermoScript RT-PCR sistemi (Invitrogen) ile zenginleştirilmiş aptamer havuzu (12. RNA havuzu) yazıya ve daha sonra PCR ile sonuçlanan cDNA yükseltmek . QIAquick Jel arıtma Kiti (QIAGEN) kullanılarak PCR ürünü arındırın. Klon jel-TA klonlama vektörü PCR 2.1 (Invitrogen) içine saflaştırılmış DNA ürün. Toplam, 170 bireysel klonlar aşılamak ve daha fazla olarak DNA dizileri tek tek almak için bunları tanımlamak.
- Bireysel aptamer dizilerinin hizalanmalar göre altı farklı gruba bireysel klonlar sınıflandırır. Çünkü kendi grupları içinde göreceli bolluk ileri karakterizasyonu için her grup (A-1, A-5, A-9, A-12, A-28 ve B-68), bir temsilci dizisi seçti.
5. In vitro transkripsiyon aptamer ve Chimera RNA'lar Üretimi
- Doğrudan PCR 2 mM MgCl 2 ve 200 mcM her dNTP ile birlikte, her biri 2 mcM 5'-3'-primerler kullanılarak çift iplikli DNA şablonu oluşturmak ve QIAquick Jel arıtma Kit kullanarak sonuç PCR ürünleri kurtarmak .
- DuraScription Seti (Epicentre, Madison, WI) kullanılarak üretilen PCR DNA şablonları chimera anlamda iplikçik Transcribe. Transkripsiyon Reaksiyon karışımı, RNaz bir bozulma dayanıklı RNA üretmek için 2'-F-CTP ve 2'-F-UTP kanonik CTP ve UTP değiştirin.
- Tipik olarak, 20 mcL mcL DNA örneğinin 1 mg, 2 ml 10xbuffer, 2 mcL dATP, 2 mcL dGTP, 2 mcL 2'-F-dCTP, 2 mcL 2'-F-dUTP, 2 mcL DTT ve 2 içeren reaksiyon inkübe T7 RNA polimeraz ° 37 ° C 6 saat, ve daha sonra fenol ekstraksiyonu ve etanol yağış sonrası Bio-Spin 30 Kolonlar (Bio-Rad) ile arındırmak.
- Interferon yanıt önlemek için, daha fazla başlatan 5'-trifosfat kaldırmak için CIP tarafından transkripsiyonu RNA tedavisi. 60 dakika için 37 ° C, transkript 3 mikrogram Tampon 3, 6 mcL ve CIP 0.25 mcL içeren reaksiyon toplam 60 mcL inkübe edin. Sonra, kloroform / fenol zorla alınan ve etanol yağış, suya tekrar süspansiyon RNA pelet.
- Kimeralar hazırlamak için, tampon, ısı refolding uygun antisense RNA ile sadece duygusu sarmallı RNA barındıran kimeralar birleştirmek 95 ° C - 37 serin sonra 3 dakika ve ° C için yavaş yavaş. 37 ° inkübasyon devam ° C, 10 dk. Tepede alem yarım ay 1xHBS tampon adım refolding gerçekleştirin. Örneğin: 10 mcM chimera anlamda iplikçik karışımı 10 mcL, 10, 10 mcM antisens iplikçik ve 5 mcL refolding 25 mcL sistem içine tampon (5xHBS) mcL.
6. Jel kayma testleri disosiasyon sabitlerin belirlenmesi
- sonuna P 32 etiket temsilcisi her grup ve kuruntulardan anlamda iplikçik aptamer ve daha sonra yukarıda açıklandığı gibi katlanamayan 1xHBS tampon RNA.
- % 40 akrilamid / bis çözüm, 19,375 ml su,% 10 amonyum persülfat (APS) çözüm ve 30 mcL TEMED 150 mcL 3.125 ml, 2.5 ml 10xTBE tampon karıştırarak 25 mL% 5 jel hazırlayın. Jel, yaklaşık 30 dakika içinde polimerize olmalıdır. Tarak dikkatlice çıkarın ve çalışan tampon (1xTBE) ile kuyu yıkamak için bir iğne ile donatılmış 30 ml şırınga kullanın.
- Jel ünitesi montajı doldurun ve bir güç kaynağına bağlayın. Jel 4 180 V 'te bir saat önceden çalıştırmak ° C.
- Seri istenilen konsantrasyonlarda bağlayıcı tamponu ile HIV 1Bal gp120 protein sulandırmak. Nihai rgp120, eaction konsantrasyonları 0, 1, 5, 10, 20, 40, 80, 160, 320, 640 nM. 5'-P sabit bir miktar RNA (10 nM) 30 dakika oda sıcaklığında dönen bir platform üzerinde bağlayıcı tampon gp120 protein artmış konsantrasyonları (reaksiyon mcL toplam 20) ile 32-uç-etiketlenmiş inkübe edin.
- Inkübasyondan sonra,% 5-denatüre olmayan poliakrilamid jel içine 5 mcL yerli yükleme tamponu ve yük bağlama reaksiyon 20 mcL karıştırın. 1 mM EDTA,% 0.1 Bromophenol Mavi,% 0.1 Ksilen Cyanol FF,% 0.1 Orange G,% 40 gliserol içeren 10 mM Tris-HCl, pH 7.5 yerel bir yükleme tamponu (4x) hazırlayın. -20 ° C'de alikotları saklayın
- Ardından elektroforez (180 V 4 ° C de 2 saat boyunca, ikincil boya jel ortasında çalışır kadar), Fosfor görüntü ekranı, jel maruz ve Typhoon bir tarayıcı kullanarak radyoaktivite miktarını.
- Grafik Pad Prism, non-lineer eğri regresyon kullanılarak ayrışma sabitleri hesaplayın.
7. Hücre yüzey bağlanma çalışmaları flow sitometri
- Susturucu siRNA Etiketleme Kiti (Ambion) kullanarak, floresan aptamer ve kimeralar oluşturun. Için aşağıdaki reaktifler ekle: 22.5 mcL nükleaz içermeyen su, 5 ml 10 x Etiketleme Tampon; 15 mcL RNA (5 mg), 7.5 mcL Etiketleme Boya. 37 ° toplam 50 mcL etiketleme tepki ° C 1 saat süreyle inkübe edin.
- Inkübasyondan sonra, 5.0 mcL (0,1 vol) 5 M NaCl ve 125 mcL (2,5 hacim) soğuk% 100 EtOH ekleyin ve iyice karıştırın. -20 ° C'de 60 dakika inkübe edin. 4 ° C'de 20 dakika süreyle en yüksek hızda santrifüjleyin. 175 mcL% 70 EtOH süpernatant ve yıkama pelet çıkarın. Sonra Hava kuru pelet ve karanlıkta etiketli RNA nükleaz serbest su 15 mcL askıya aldı.
- 260 nm'de absorbans maksimum floresan boya etiketli RNA absorbansı ölçülür. Boya oranı ve RNA konsantrasyonu tarafından sağlanan hesap göre: Temel hesaplayın http://www.ambion.com/techlib/append/base_dye.html .
- Mix Cy3 etiketli kimeralar anlamda iplikçik ve antisens iplikçik ve yukarıda açıklandığı gibi tampon refolding katlanamayan.
- AIDS Araştırma ve Referans Reaktifi Programı 5, 6 ile gp160 ve CHO-EE kontrolü hücreleri ifade CHO-WT alın. GMEM-S ortamda hücrelerin (400 mcM metionin sulfoximine (MSX) Glutamine eksikliği minimal temel orta) (Gibco, Invitrogen) büyütün. 37 nemlendirilmiş bir% 5 CO2 inkübatör Kültür hücreleri ° C
- CHO-WT gp160 veya CHO-EE kontrolü hücreleri prewarmed yıkama tamponu ile yıkayın trypsinize ve plakalar terketmez. Hücre pelet bağlayıcı tampon ve inkübe resupend hücreleri ile iki kez 500 mcL bağlayıcı tampon yıkadıktan sonra, 37 ° C'de 30 dk. 400 nM Cy3 etiketli deneysel RNA'lar içeren prewarmed bağlayıcı tampon 50 mcL Pelet hücreleri ve sonra onları tekrar süspansiyon haline getirin.
- - 37 ° C 40 dakika, 37 ° inkübasyondan sonra 500 mcL prewarmed bağlayıcı tampon hücreleri üç kez yıkayın ve sonunda bağlayıcı tampon 350 mcL tekrar süspansiyon prewarmed ° C ve hemen flow sitometri ile analiz.
8. Canlı hücre konfokal mikroskopi tarafından içselleştirilmesi ve hücre içi yerelleştirme çalışmaları
- Testin bir gün önce, 24 saat içinde yaklaşık% 70 izdiham izin vermek için 2 mL GMEM-S orta 0.3x10 6 ekim ile 35 mm plaka CHO-WT gp160 ve CHO-EE kontrol hücreleri büyümek
- Deneylerin yapıldığı gün, 1 prewarmed PBS mL hücreleri yıkayın. ° C ve 37, 30 dakika için, önceden ısıtılmış tam büyüme orta 1 ml ile inkübe
- Cy3-etiketli aptamer siRNA kimeralar yukarıda açıklandığı gibi hazırlayın. SiRNA-sopa 5'-Cy3 etiketli anlamda iplikçik yukarıda açıklandığı gibi aptamer-sopa-siRNA konjuge formda içeren aptamer sopa katlanamayan inkübe edin.
- Tahlil önce, 4 ° C'de alikotları su ve mağaza Hoechst 33.342 (nükleer boya, canlı hücreler için, Molecular Probes, Invitrogen, CA) 0.15 mg / ml solüsyon hazırlamak
- 37 az 15 dakika süreyle 0.15 mg / ml Hoechst 33.342 ile tedavi hücreleri Leke ° C Hemen iki kez 1.0 ml taze orta boya yıkayın ve 2 ml taze prewarmed orta yerine.
- Cy3 etiketli 37 5% CO2 mikroskopi inkübatör canlı hücre konfokal mikroskopi için medya ve inkübe içine 100 nM final konsantrasyonda aptamer siRNA chimera ° C
- Görüntüleri her 15 dakikada 2 foton konfokal mikroskop sistemi Tersyüz edilmiş bir su altında kalacak 40x büyütme Zeiss LSM 510 Meta kullanarak toplayın.
9 in vitro HIV-1 meydan okuma ve p24 antijen testinin
- ATCC CCRF-CEM hücreleri satın alın. % 10 fetal sığır serumu (FBS, HyClone), L-glutamin ve 1xPen-Strep (Gibco Invitrogen) ile desteklenebilir (Cellgro Mediatech Inc.) RPMI-1640 büyümek. 37 nemlendirilmiş bir% 5 CO2 inkübatör Kültür hücreleri ° C
- Periferik kan mononucle edininHope Ulusal Tıp Merkezi (klinik personel) Şehir sağlıklı donörlerin ar örnekleri.
- Ficoll Hypaque çözüm ile santrifüj (Histopaque-1077, Sigma) ile tam kan PBMC'ler izole edin. Dynabeads CD8 (Invitrogen, CA) kullanılarak CD8 hücreleri (T-cytotoxic/suppressor hücre) PBMC'ler İncelten.
- T-hücre aktif ortamda hücrelerin büyümesine (BioE, St Paul, MN). 37 nemlendirilmiş bir% 5 CO2 inkübatör Kültür hücreleri ° C
- HIV-1 IIIB ve AIDS Araştırma ve Referans Reaktifi Programı NL4-3 virüsü ve HIV-1 Bal virüs alın. -80 Alikotları içinde virüs, mağaza ° C yayılması sonra
- HIV virüsü ile CCRF-CEM hücre veya insan PBMC (IIIB, NL4-3 veya Bal) (İçişleri Bakanlığı 0.001 ya da 0.005) bulaştırmak. Enfeksiyon sonrası 24 saat sonra, yavaşça kaldırın ücretsiz virüs olan hücreler PBS üç kez yıkayın. Kültür için 37,% 5 CO 2 mikroskopi inkübatör enfekte hücreleri ° C'de 4 gün boyunca devam edin .
- RNA önce, tedavileri ücretsiz virüs kaldırmak için PBS üç kez enfekte olan hücreleri hafifçe yıkayın. Inkübe 2x10 4 ile enfekte olan hücreleri ve 3x10 4 enfekte olmamış hücrelerdeki 37 ° C (100 mcL, tripleks tahlil de ortalama) 96-kuyucuğu 400 nM final konsantrasyonu deneysel RNA'lar refolded.
- Farklı zamanlarda (3 gün, 5 d, 7 gün ve 9 d) ve p24 tahlil kadar -20 ° C'de mağaza kültür süpernatantlar (ortalama 10 mcL) toplayın.
- HIV-1 p24 Antijen ELISA kiti kullanılarak p24 antijen analizleri gerçekleştirin.
10 Kantitatif RT-PCR yöntemi ile siRNA fonksiyonu algılama
- CCRF-CEM hücre veya insan PBMC'ler HIV virüsleri (IIIB NL4-3 veya Bal) ile enfekte ve yukarıda açıklandığı gibi deneysel RNA'lar (400 nM) ile tedavi.
- İST-60 ile tedavi, pelet hücreleri ve 7 gün sonra toplam RNA'lar izole eder. Genomik DNA kaldırmak ve 2 mg total RNA kullanarak cDNA üretmek için DNaz ile toplam RNA'lar davranın.
- 1,5 mL 10 x DNaz Tampon; 4 mcL RNA (2 mg); 0.5 mcL RNain inhibitörü ve 1 için 1.0 mcL RNaz ücretsiz DNaz I. inkübe toplam 15 mcL reaksiyon 37 ° C 8 mL nükleaz içermeyen su: Aşağıdaki reaktifler karıştırın saat ve ısı 80 ° C 'de 10 dakika süreyle Hemen DNaz I. inaktive buz üzerinde reaksiyon soğuk.
- Ekle sonra 2 mcL rastgele astar (50 ng / mcL) ve yukarıdaki reaksiyon karışımının içine 1μL dNTP (10 mM) ve ısı 65 ° C de 5 dakika. Derhal reaksiyon, buz üzerinde soğutun.
- Aşağıdaki reaktifler ekleyin: 5 ml 5xFirst iplikçik tampon, 2.5 mL 0.1 M DTT 0.5 mL RNain inhibitörü ve 1,0 mL MMLV-RT. Toplam 27 ml reaksiyon 25 ° 1 saat 10 dakika ve 37 ° C inkübe edin. 70 reaksiyon, ısı karışımı sonra ° C 15 dakika buz üzerinde soğutun sonra ters transkriptaz inaktive için. CDNA QRT-PCR analizi için hazırdır.
- Kantitatif RT-PCR nihai konsantrasyonu 400 nM (tripleks tahlil) 2 x iQ SyberGreen Mastermix ve spesifik primer setleri kullanılarak hedef genlerin ifade analiz edin. GAPDH ifade qPCR veri normalleşmesi için bir iç kontrol sistemi olarak kullanın.
11. Temsilcisi sonuçları:
1. RNA aptamers HIV-1 Bal gp120 karşı izole ve karakterize edilir.
Deneysel bölümü, 5 've 3' uçları amplifiye ve bir RNA havuza transkripsiyonu sabit astar bölgeleri ile çevrili bir 50 nt rastgele bölge içeren bir ilk DNA oligonükleotid kütüphane açıklandığı gibi. Bu ilk kütüphane, çeşitli 3-D yapıların geniş bir diziye kat 10 15 farklı dizileri (1 nmol) oluşur . Ilk kütüphane yüksek karmaşıklık ve çeşitlilik, hedef için iyi bir afinitesi aktif yapıların varlığını garanti olabilir.
Seçici R5 suşu HIV-1 Bal gp120 zarf proteini 7 bağlayan 2'-floropirimidin modifiye RNA aptamers seçmek için bir in vitro SELEX prosedürü (Şekil 1) çalıştırmak . Şekil 1'de gösterildiği gibi, nitroselüloz tabanlı bir seçim stratejisi, bağlayıcı olmayan RNA moleküllerinin belirli hedef bağlayıcı RNA'lar izole etmek için yapılır. Protein nitroselüloz yapışıyor bu yana, sadece RNA / protein kompleksleri veya agrega membran korunur ve ücretsiz RNA'lar yıkanır. Denatüre edici koşullar altında, bağlı RNA'lar kurtarılır ve ters cDNA için transkripsiyonu ve sonra dsDNA içine yükseltilen ve daha sonra bir sonraki seçim döngüsü için yeni bir RNA havuzu oluşturmak için transkripsiyonu in vitro . Seçim darlığı hedef protein miktarını azaltarak ve rakip tRNA miktarını artırarak artar. Her seçim turunda kullanılan RNA havuzu, protein ve rakip tRNA miktarı Tablo 1'de gösterilmiştir.
SELEX filtre bağlama yöntemi ile her döngüden sonra seçim ilerleme izleyin. RNA yüzde fil muhafaza afinitesi değerlendirintoplam RNA havuzu ter. Başlangıç RNA havuzu (1-RNA) membran üzerinde kalan giriş RNA'lar, sadece% 0,1 'i gösteriyor. Ancak, dokuz seçim turundan sonra dokuzuncu RNA kütüphanesi (9-RNA) bağlı giriş RNA 9,72% bulunmaktadır. Ek seçim turlarında yapılmış olmasına rağmen, başka zenginleştirme RNA havuzu maksimum bağlanma (Şekil 2A) ulaşıldı olduğunu düşündüren görülmektedir. Filtre bağlayıcı tahlil ile benzer şekilde, jel kayma yöntemi de disosiasyon sabitleri belirlenmesi için en popüler stratejileri biridir. Bu prosedür, kolay ve rahat. Şekil 2B gösterildiği gibi, jel kayma testleri RNA havuzları bağlayıcı faaliyetleri daha teyit etmektedir. Bu sonuçlar, hedef protein bağlayıcı özgüllüğü yüksek olan bazı ligandlar gittikçe bu RNA havuzlarında zenginleştirilmiş olduğunu göstermektedir ..
Clone ve sıra zenginleştirilmiş aptamer havuzları (12-RNA). Bireysel klonlanmış aptamer dizilerinin hizalanmalar göre, altı farklı grup Tablo 2'de gösterildiği gibi sınıflandırılır. A (A / G) TTGAGGGACC (A / G): klon yaklaşık% 40 (Grup I ve II aptamers) korunmuş bir sekans içeriyor. Çünkü kendi grupları içinde göreceli bolluk daha fazla karakterizasyonu için: (A-1, A-5, A-9, A-12, A-28 ve B-68 gibi) bir temsilci, her grup sıra seçin. Yerli bir jel mobilite kayma yöntemi sayesinde, bu temsili aptamers ayrışma sabitleri (K d) (Şekil 3A) hesaplanır. Örneğin, A-1, aptamers en iyi 52 nM (Şekil 3B) belirgin bir Kd değerleri vardır. Şekil 3A gösterildiği gibi, bu seçilen aptamers seçici hedef HIV-1 Bal gp120 bind, ancak HIV gp120 CM protein değil.
2. Anti-gp120 aptamer özellikle bağlanır ve HIV gp160 ifade hücreleri tarafından içselleştirilmiş ve hücre kültürü HIV-1 enfeksiyonu inhibe.
CHO-gp160 stably HIV zarf glikoprotein gp160 ifade hücreleri seçilen anti-gp120 aptamers bağlayıcı ve içselleştirilmesi için test etmek için kullanılır. Zarf işleme için gerekli gag kodlanmış proteazlar eksikliği beri Bu hücreler gp120 ve gp41 gp160 bir süreç değildir. Kontrol olarak biz gp160 ifade etmez ebeveyn CHO-EE hücre hattı kullanıyoruz. Akış sitometrik analizler (Şekil 4A) Cy3 etiketli aptamers özellikle CHO gp160 hücreleri bağlamak ortaya koyuyor ama kontrol CHO-EE hücreleri. Ayrıca, gerçek zamanlı, canlı hücre Z-ekseni konfokal mikroskopi Cy3 etiketli aptamer seçici inkübasyon 2 saat sonra CHO-gp160 hücreleri (Şekil 4B ve 4C) içinde içselleştirilmiş olduğunu gösterir, ancak CHO-EE kontrolü hücreleri ( Şekil 4D). Şekil 4C aptamer gp120 aptamers belki reseptör-aracılı endositoz yoluyla hücrelerine girmek anlaşılacağı sitoplazma içinde toplanmış olduğunu gösterir.
HIV-1 meydan tahlil, HIV-1 ile enfekte PBMC hücreleri aptamers ile tedavi edilir. Aptamers ile tedavi sonrası, farklı günlerde medya hacimde viral p24 antijen düzeyleri (Şekil 4E) için test. Anti-gp120 aptamers (A-1) bir nano-Molar konsantrasyon ile HIV-1 p24 üretimi inhibe ettiğini göstermektedir.
3. Anti-gp120 aptamer siRNA chimera tasarlanmış ve hücre tipi özel siRNA dağıtım sistemi olarak etkinliği değerlendirilir
Şekil 5A, aptamer ve nükleaz dayanıklı 2'-Fluoro UTP ve 2'-Fluoro CTP siRNA'lar anlamda iplikçik segmentinde gösterilir ve in vitro bakteriyofaj transkripsiyon ilgili dsDNA şablonları sentezlenir. , Iki nükleotid ilintileyici molekülün esnekliği artırmak amacıyla (UÜ) aptamer ve Dicer substrat kısmı arasındaki eklenir. Kimeralar içeren siRNA hazırlamak için, in vitro transkripsiyonu kimerik aptamer anlamda iplikçik polimerler değiştirilmemiş bir antisens sarmallı RNA ekimolar konsantrasyonları ile tavlanır. Bu jel kayma yöntemi (Şekil 5B) ve akım sitometri (Şekil 5C) verileri, kuruntulardan aptamers tek başına yaklaşık olarak aynı bağlama yakınlık korumak göstermektedir . Zaman ders görüntüler gerçek zamanlı konfokal mikroskobu (Şekil 5D) A-1 Ch chimera başarıyla hücre sitoplazma içine içselleştirilmiş Cy3 etiketli göstermektedir. Beklendiği gibi, kabus hiçbir alımı CHO-EE kontrol hücreleri (Şekil 5E) görülmektedir.
Benzer şekilde, RNA'lar, antiviral potansiyel HIV-1 ile mücadele yöntemi ile değerlendirilir. Aptamer ve Chimera hem p24 üretimini engeller, ancak en güçlü inhibisyonu chimera Şamp A-1 tedavisi ile gözlenen olduğunu HIV p24 antijen analizleri (Şekil 6A ve 6B) sonuçlarını gösterir.
SiRNA bileşeni APTA ile birlikte çalışıp çalışmadığını onaylamak içinmer, enfekte olmuş hücrelerde A-1 chimera Şamp içselleştirilmesi aşağıdaki, aynı zamanda kantitatif RT-PCR ifade analizleri ile tat / dev gen ekspresyonu inhibe göreli seviyeleri değerlendirmek . Biz, yalnız aptamer tat / dev gen ekspresyonu (Şekil 6C ve 6D) etkilemez iken, kuruntulardan ile enfekte olan hücreleri tedavi tat / dev gen susturma ikna etmek mümkün olduğunu bulmak. Bu sonuçlar, aptamer teslim siRNA RNAi tetikleyen daha fazla destek sağlar.
| Protein miktarı, RNA havuzu ve tRNA seçimi için kullanılan | |||||
| SELEX tur | Hedef / RNA Oranı | Gp120 protein | RNA havuzu | Rakip tRNA | Seçim Tampon |
| 1 | 1/6.5 | 229.8 pmol | 1.5 nmol (40.1 mg) | 0 | Düşük tuz SELEX tampon |
| 2 | 1/6.5 | 114.9 pmol | 0.75 nmol (20.1 mg) | 0.25 nmol (6.6 mg) | |
| 3 | 1 / 8 | 76.6 pmol | 0.625 nmol (16.7 mg) | 0.25 nmol (6.6 mg) | |
| 4 | 1 / 8 | 76.6 pmol | 0.625 nmol (16.7 mg) | 0.25 nmol (6.6 mg) | |
| 5 | 1 / 8 | 38.3 pmol | 0.306 nmol (8.18 mcg) | 0.5 nmol (13.2 mg) | Yüksek tuz SELEX tampon |
| 6 | 1 / 8 | 38.3 pmol | 0.306 nmol (8.18 mcg) | 0.5 nmol (13.2 mg) | |
| 7 | 1 / 10 | 26.8 pmol | 0.268 nmol (7.16 mcg) | 0.5 nmol (13.2 mg) | |
| 8 | 1 / 10 | 26.8 pmol | pmol 0.268 nmol (7.16 mcg) | 1 nmol (26.4 mg) | |
| 9 | 1 / 10 | 15.3 pmol | 0,153 nmol (4.09 mcg) | 1 nmol (26.4 mg) | |
| 10 | 1 / 10 | 15.3 pmol | 0,153 nmol (4.09 mcg) | 1.5 nmol (39.6 mg) | |
| 11 | 1/12.5 | 7.66 pmol | 0,096 nmol (2.56 mcg) | 2 nmol (52.8 mg) | |
| 12 | 1/12.5 | 7.66 pmol | 0,096 nmol (2.56 mcg) | 2 nmol (52.8 mg) | |
Tablo 1, seçim şartları . Protein miktarı, her seçim ve seçim tampon için kullanılan RNA havuz ve tRNA gösterilir.
| Grup | RNA | Rasgele Seriler | Frekans (140 klonlar) |
| Grup I | A-1 | AATTGAGGGACCA CGCGCTGCTTGTTGTGATAAGCAG TTTGT CG GATGG | 33 (% 23.6) |
| B-7 | AATTGAGGGACCA ACGCGAGGATGTGGATAGTGTGTA TTTGC GT GATGG | 3 | |
| A-32 | AATTGAGGGACCG TTGGTAAAAGCCGGA AATTG AGCT TTTAC GGC GATGG | 5 | |
| B-55 | AATTGAGGTACCGCG TTATTAGGAACA AATTG GAATTCTAAACGC GATGG | 2 | |
| A-24 | AATAGAGGGACC CAGATATAGGCTACACGGATGATGGTGTATCTG GATGG | 1 | |
| B-19 | AATAGAGGAACCG TTTCAGAAGACTACAGGTTAGTCCAATGAAGC GACGG | 1 | |
| B-31 | AATAGAGGGACCG TGGACAATAATTTATGGTCA TTTATTGGCAC GATGG | 1 | |
| Grup II | A-12 | AGTAGAGGAACCA AGCAATGGATGAATGCAAAAGTGTAAATGCTT GATGG | 10 (% 7.1) |
| Grup III | A-9 | TGAGTTTGGGTAAATTTCCGGTTTCGGTTTACTCACGAAAGATCGGTCGG | 15 (% 10.7) |
| Grup IV | A-28 | TAAAGGAGGGAAGGATGAGACCGCACGAAAAATATCAGCATACG TTTGTG | 10 (% 7.1) |
| Grup V | A-5 | GAAACTAGTTTGAATAATGGTGTAGAGGAGGGTCAATAGTTTCG TTGGTG | 9 (% 6.4) |
| Grup VI | B-68 | ACATAGTAATGACACGGAGGATGGAGAAAAAACAGCCATCTCTTGACGGT | 2 |
| Diğerleri | Yetim dizisi | 48 |
(Tablo 2). Hizalama ve RNA aptamers belirlenmesi. 12. turda seçim ardından, seçilen RNA havuzu klonlanmış ve sıralı idi. 140 klonların uyum sonra, anti-gp120 aptamers altı grup tespit edilmiştir. Aptamer çekirdek bölgelerde sadece rastgele dizileri (5'-3 ') gösterilir. Birden fazla frekansları ile meydana gelen izolatlar belirtilmiştir.
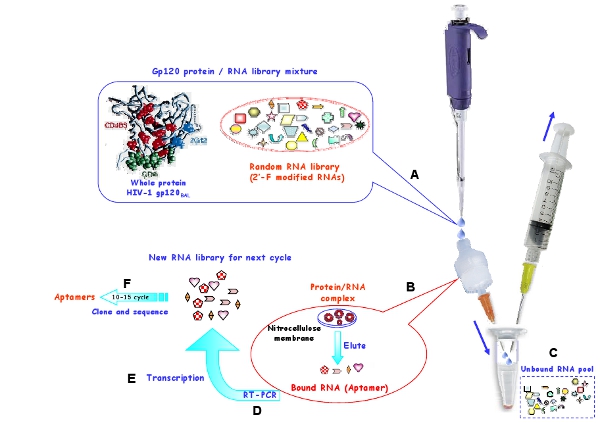
Şekil 1: HIV-1 Bal gp120 protein RNA aptamers üretmek için, nitroselüloz membran kullanılarak in vitro seçim prosedürü, şematik . (A) başlangıç RNA havuzu ve hedef protein kompleksi oluşturmak için inkübe edildi. (B) bağlı RNA molekülleri membran korunur ve yıkandı, denatüre koşul altında membran edildi. (C) bağlanmamış RNA'lar uzakta yıkandı. (D) Seçilen RNA'lar ters transkripsiyonu ve PCR ile amplifiye edildi. (E) ilgili DNA daha sonra sonraki seçim döngüleri için yeni RNA havuza transkripsiyonu da yapılmıştır . (F) 10-15 seçim turlarında sonra, seçilen aptamers klonlanmış ve dizisi vardı.
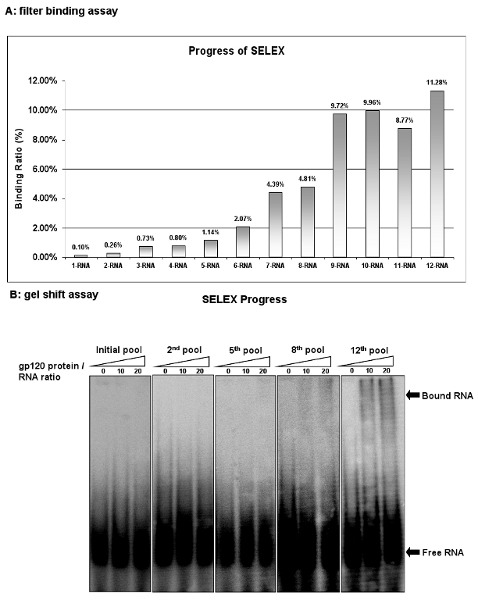
Şekil 2: HIV-1 gp120 aptamers seçim ilerleme. (A), her bir döngüde RNA havuzu bağlanma aktivitesi rakip tRNA filtre bağlama yöntemi ile analiz edildi . Cilt faaliyetleri, RNA, protein kompleksi RNA / filtre muhafaza giriş yüzdesi olarak hesaplandı. (B), her bir döngüde RNA havuzu bağlanma aktivitesi jel kayma yöntemi ile analiz edildi . 12. RNA havuzu yüksek bağlayıcı faaliyet gösterdi.
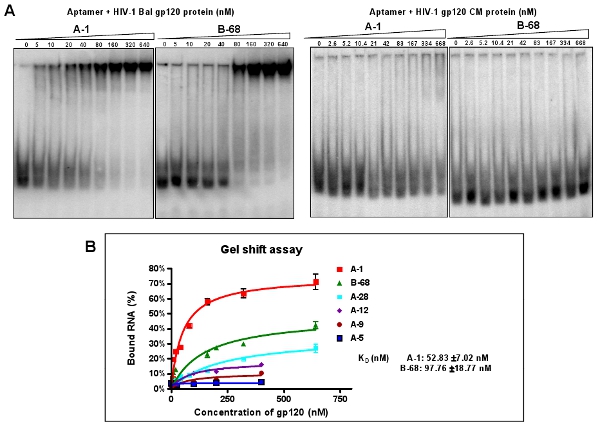
Şekil 3: HIV-1 Bal gp120 karşı bireysel aptamers bağlanması aktivite assay. (A) 5'-P 32 etiketli bireysel aptamers hedef gp120 protein veya non-spesifik CM protein artan miktarlarda inkübe edildi. Bağlayıcı tepkime bir jel mobilite kayma yöntemi ile analiz edildi. Aptamer A-1 ve B-68 hedef protein ile en iyi afinitesi gösterdi, ancak CM olmayan protein. Veri ortalama dört çoğaltır temsil eder. (B) Cilt jel vardiya testte eğrisi.
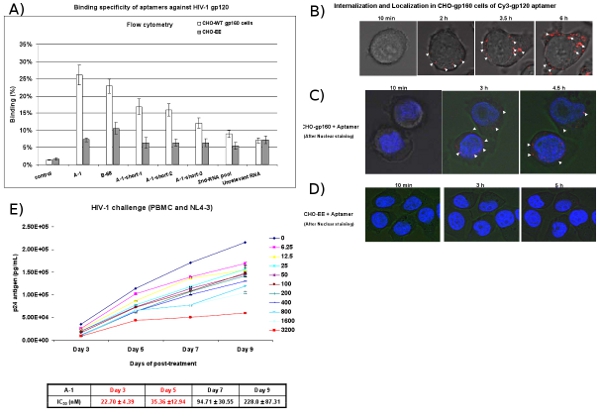
Şekil 4: Hücre tipi belirli bağlayıcı ve aptamers alımı çalışmaları. Cy3 etiketli RNA'lar (A) Hücre yüzey bağlanma flow sitometri ile değerlendirildi. Cy3 etiketli RNA'lar CHO-gp160 hücreleri ve CHO-EE kontrol hücreleri bağlanma test edildi. Seçilen aptamers hücre türüne özgü bir afinitesi gösterdi. 2. RNA havuzu ve ilgisiz RNA'lar negatif kontrol olarak kullanılmıştır. Veri ortalama üç çoğaltır temsil eder. (B) İçselleştirme analizi. CHO-gp160 hücreleri 35 mm plakalar yetişen ve gerçek zamanlı olarak canlı hücre konfokal mikroskopi analizi için kültür ortamı A-1 Cy3-etiketli 100 nM konsantrasyon ile inkübe edildi. 15 dakika görüntü toplanmıştır. 40X büyütme kullanarak aralıklarla. (C, D) Yerelleştirme analizi. CHO gp160 hücreleri ve CHO-EE kontrolü hücrelerinin 35 mm plakalar yetiştirilmiştir. 100 nM A-1 Cy3 etiketli ile inkübasyon önce, hücreleri Hoechst 33.342 (canlı hücreler için nükleer boya) ile boyanmış ve daha sonra gerçek zamanlı konfokal mikroskopi kullanılarak analiz edildi. (E), HIV-1 NL4-3 virüsü ile enfekte insan PBMC'ler seçilen anti-gp120 aptamers HIV-1 replikasyon inhibe ederler . Farklı konsantrasyonlarda ve zaman pointes sunuldu. IC50 değeri yer aldı. Veri p24 üç nüsha ölçümlerin ortalamasını temsil etmektedir.
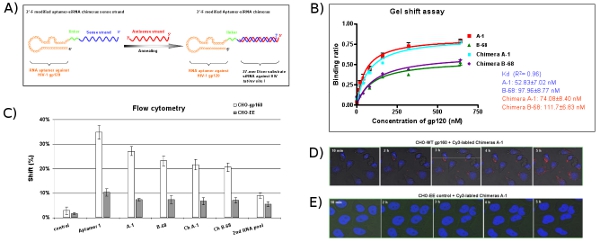
Şekil 5: aptamer siRNA chimera dağıtım sistemi tasarım ve değerlendirme. (A) Şematik aptamer siRNA kimerik RNA'lar: anti-gp120 aptamer bölgede gp120 için bağlayıcı ve HIV-1 tat / dev ortak bir ekson siRNA hedefliyor sorumludur. 2'-Fluoro değiştirilmiş aptamer siRNA anlamda tek iplikçik kimerik molekül tamamlamak için tamamlayıcı siRNA antisens iplikçik tavlama, co-transkripsiyonu. Aptamer ve siRNA arasında Bağlayıcı (UÜ) yeşil gösterilir. (B) yanı sıra, ebeveyn aptamers olarak, karşılaştırılabilir Kd değerlere sahip aptamer siRNA kimerik RNA'lar, özellikle HIV Bal gp120 protein bağlanır. Veri ortalama üç çoğaltır temsil eder. (C) aptamers Hücre tipi özel bağlama çalışmaları. Cy3 etiketli RNA'lar CHO-gp160 hücreleri ve CHO-EE kontrol hücreleri bağlanma test edildi. Hücre surCy3-etiketli RNA'lar yüz bağları flow sitometri ile değerlendirildi. Seçilen aptamers hücre türüne özgü bir afinitesi gösterdi. 2. RNA havuz ve ilgisiz RNA negatif kontrol olarak kullanılmıştır. Veri ortalama iki çoğaltır temsil eder. (D, E) İçselleştirme ve hücre içi yerelleştirme analizleri. CHO-gp160 hücreleri 35 mm plakalar yetişen ve Hoechst 33.342 (canlı hücreler için nükleer boya) ile boyandı. Daha sonra, hücreleri daha önce açıklandığı gibi gerçek zamanlı, canlı hücre konfokal mikroskopi analizi için chimera Cy3 etiketli 100 nM konsantrasyonu ile kültür ortamında inkübe edildi.
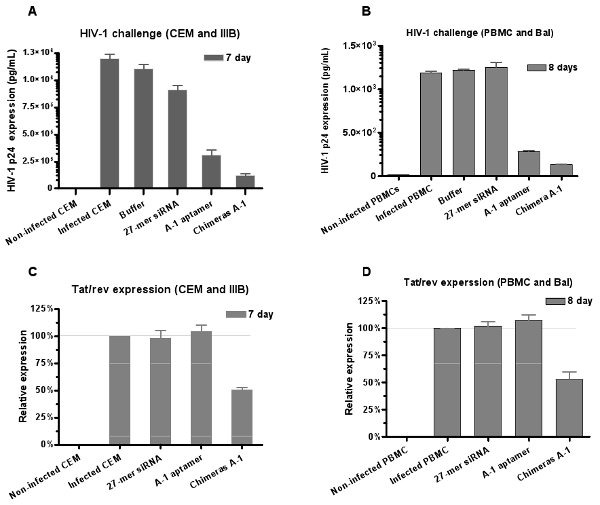
Şekil 6: Çift inhibisyonu aptamer-siRNA kimeralar aracılığı ile HIV-1 enfeksiyonu. Her ikisi de anti-gp120 aptamer ve aptamer-siRNA kimeralar sırasıyla, (A) CEM hücreleri (IIIB suşu) HIV-1 enfeksiyonu nötralize ve (B) insan PBMC (BAL suşu) kültür. Veri p24 üç nüsha ölçümleri ortalama temsil eder. (C, D) aptamers PBMC'lerdeki down regüle tat / dev gen ekspresyonu tarafından teslim siRNA kimeralar gösteren tek başına aptamer daha güçlü inhibisyonu gösterdi . Veri ortalama üç çoğaltır temsil eder.
Tartışmalar
In vitro ve böylece hedef moleküller 8 için son derece özel, sıkı bağlantı sağlayarak, özel ve istikrarlı bir üç boyutlu şekiller varsayıyorum nükleik asitler gelişti Aptamers . Düşük nanomolar afinitesi ve hedeflerine aptamers nefis özgüllüğü, in vivo görüntüleme ve tedavi 9, teşhis için çok yönlü araçlar olun . Hedeflenen siRNA teslimat için aptamer teknolojinin gelişi ile şimdi siRNA'lar 10-12 reseptör aracılı endositoz apt...
Açıklamalar
Teşekkürler
Britta Hoehn, Guihua Sun, Harris Soifer ve Lisa Scherer yararlı tartışmalar için teşekkür ederiz. CHO-EE ve CHO-gp160 hücre: Bu çalışma, Ulusal Sağlık Enstitüsü, AIDS Araştırma ve Referans Reaktifi Programı, AIDS Bölümü, NIAID, NIH yoluyla elde edilen, Sağlık AI29329 ve aşağıdaki reaktifler JJR layık HL07470 National Institutes of hibe tarafından desteklenen doğrultusunda; pNL4-3 luc vektör; NIAID DAIDS, HIV-1 Bal gp120.
Malzemeler
| Name | Company | Catalog Number | Comments |
| Reaktifin Adı | Şirket | Katalog numarası | Yorumlar (isteğe bağlı) |
|---|---|---|---|
| MF-Millipore membran filtreden | Millipore | HAWP01300 | Gözenek büyüklüğü 0.45 mikron |
| Swinnex Filtre sahibi | Millipore | SX0001300 | 13 mm çapında |
| QIAquick Jel Ekstraksiyon Seti | QIAGEN | 28706 | DNA saflaştırılması |
| Microcon YM-30 sütun | Millipore | 42410 | RNA konsantrasyonu |
| Bio-spin 30 sütun | Bio-Rad | 732-6250 | RNA saflaştırılması |
| Taq PCR DNA polimeraz | Sigma-Aldrich | D1806 | |
| ThermoScript RT-PCR sistemi | Invitrogen | 11146-024 | |
| T7 transkripsiyon Kit DuraScribe | Epicentre | DS010925 | |
| PCR dNTP | Roche | 1 581 295 | |
| Ribonükleik asit, E.coli, transfer | Sigma-Aldrich | R1753 | tRNA rakip |
| HIV-1 Ba-L gp120 protein | AIDS Araştırma ve Referans Reaktifi Programı | 4961 | Hedef protein |
| Susturucu siRNA etiketleme kiti - Cy3 | Ambion | 1632 | |
| Asit fenol / kloroform 5 / 1 çözeltisi (pH 4,5) | Ambion | AM9720 | |
| Kloroform / 24 / 1 Isopropanol çözümü | Sigma | C0549 | |
| Buzağı bağırsak fosfataz (CIP) | Yeni İngiltere Biolab | M0290L | |
| T4 polinükleotid kinaz | Yeni İngiltere Biolab | M0201L | |
| Glikojen | Roche | 10 901 393 001 | RNA yağış |
| Gamma-P 32-ATP | MP Biyomedikal | 013502002 | Radiactivity |
| % 40 AccuGel 19:01 | Milli Diagnostics | EC-850 | |
| 10xTBE | Milli Diagnostics | EC-860 | |
| N, N, N, N'-Tetramethylethylenediamine (TMEMD) | Sigma-Aldrich | T9281 | |
| Amonyum persulfate (APS) | Sigma-Aldrich | A3678 | |
| L-methioine sulfoximine | Sigma-Aldrich | M5379-250 mg | |
| RPMI Medya 1640 | Invitrogen | 11835-030 | |
| Sodyum Bikarbonat solüsyonu,% 7.5 w / v | Invitrogen | 25080-094 | |
| Minimum Essential Medium (MEM) ve (10 ) | Invitrogen | 11430-030 | |
| MEM elzem olmayan bir amino asit (100 ) | Invitrogen | 11140-050 | |
| PCR 2.1 ile TA klonlama kiti | Invitrogen | K2040-01 |
Referanslar
- Tuerk, C., Gold, L. Systematic evolution of ligands by exponential enrichment: RNA ligands to bacteriophage T4 DNA polymerase. Science. 249, 505-510 (1990).
- Ellington, A. D., Szostak, J. W. In vitro selection of RNA molecules that bind specific ligands. Nature. 346, 818-822 (1990).
- Robertson, D. L., Joyce, G. F. Selection in vitro of an RNA enzyme that specifically cleaves single-stranded DNA. Nature. 344, 467-468 (1990).
- Fitzwater, T., Polisky, B. A SELEX primer. Methods Enzymol. 267, 275-301 (1996).
- Weiss, C. D., White, J. M. Characterization of stable Chinese hamster ovary cells expressing wild-type, secreted, and glycosylphosphatidylinositol-anchored human immunodeficiency virus type 1 envelope glycoprotein. J Virol. 67, 7060-706 (1993).
- Vodicka, M. A. Indicator cell lines for detection of primary strains of human and simian immunodeficiency viruses. Virology. 233, 193-198> (1997).
- Zhou, J. Selection, characterization and application of new RNA HIV gp 120 aptamers for facile delivery of Dicer substrate siRNAs into HIV infected cells. Nucleic Acids Res. , (2009).
- Mayer, G. The chemical biology of aptamers. Angew Chem Int Ed Engl. 48, 2672-2689 (2009).
- Famulok, M., Hartig, J. S., Mayer, G. Functional aptamers and aptazymes in biotechnology, diagnostics, and therapy. Chem Rev. 107, 3715-3743 (2007).
- Chu, T. C., Twu, K. Y., Ellington, A. D., Levy, M. Aptamer mediated siRNA delivery. Nucleic Acids Res. 34, e73-e73 (2006).
- McNamara, J. O., 2nd, . Cell type-specific delivery of siRNAs with aptamer-siRNA chimeras. Nat Biotechnol. 24, 1005-1015 (2006).
- Dassie, J. P. Systemic administration of optimized aptamer-siRNA chimeras promotes regression of PSMA-expressing tumors. Nat Biotechnol. 27, 839-849 (2009).
- Zhou, J., Rossi, J. J. The therapeutic potential of cell-internalizing aptamers. Curr Top Med Chem. 9, 1144-1157 (2009).
- Zhou, J., Li, H., Li, S., Zaia, J., Rossi, J. J. Novel dual inhibitory function aptamer-siRNA delivery system for HIV-1 therapy. Mol Ther. 16, 1481-1489 (2008).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır