需要订阅 JoVE 才能查看此. 登录或开始免费试用。
Method Article
发展的细胞类型特异性的抗艾滋病毒gp120基因的siRNA传递适配
摘要
从RNA库是孤立的几个2' -氟RNA对HIV - 1BA - L的gp120的nanomole亲和力的适配在体外 SELEX程序。创建一种新的双抑菌功能抗- gp120的适配子的siRNA的嵌合体,显示了相当的全身抗艾滋病毒治疗的承诺。
摘要
全球艾滋病毒感染疫情已创建了一个新类抗逆转录病毒药物的迫切需要。很强的能力,抑制小分子干扰(SI)的RNA互补的RNA转录表达是被人利用作为一个新类的疗法,为各种疾病,包括艾滋病毒。许多以前的报告表明,新型RNAi为基础的治疗策略anti-HIV/AIDS有相当大的承诺,然而,成功的siRNAs的临床治疗中的应用和翻译的一个主要障碍是有效地提供。特别是,考虑RNAi为基础的疗法的安全性和有效性,它是非常可取的,制定有针对性的细胞内的siRNA传递到特定的细胞群体或组织的方法。 HIV - 1的gp120的蛋白质,对HIV - 1病毒表面的糖蛋白的信封,到病毒进入CD4细胞起着重要作用。已通过验证的触发HIV - 1项,并启动细胞融合的gp120与CD4的相互作用作为临床相关的抗病毒的药物发现策略。
在此,我们首先讨论2' - F改性抗- HIV的gp120基因的RNA适配子的选择和鉴定。使用传统的硝化纤维过滤器SELEX方法,几个新的适配纳摩尔亲和力,从50个随机NT RNA文库中分离。为了成功地获得绑定的物种具有较高的亲和力,选择紧缩小心控制调整的条件。选定适配特异性结合,并迅速进入细胞表达的HIV - 1包膜蛋白的内化。此外,单独的适配,可中和HIV - 1病毒的传染性。根据最好的适体A - 1中,我们还创建了一种新型的双抑菌功能抗- gp120的适配子的siRNA的嵌合体适体和siRNA的部分具有强大的抗艾滋病毒的活动。此外,我们利用gp120的适体的siRNA嵌合体细胞类型特定的siRNA传递到HIV - 1感染细胞。这种双重功能的嵌合体,显示了相当大的潜力相结合的各种核酸治疗剂(适体和siRNA)抑制HIV - 1感染,使适配子的siRNA嵌合体,没有高活性抗逆转录病毒疗法(HAART)的患者有吸引力的治疗候选人。
研究方案
1。制备的RNA库
- 起始的DNA库中包含50个核苷酸的随机序列,并结合DNA技术(Coralville,衣阿华)合成。单链DNA寡核苷酸库序列为5' - GGG AGG的ACG ATG CGG公司- N 50 - CAG的ACG ACT的CGC CCG一个- 3“(81新台币)。随机区域的两侧是由不断的地区, 其中包括在体外转录的T7启动子和3'标签用于RT - PCR。 5'和3'恒定序列5' - TAA交咨会GAC TCA CTA的豪GGA GGA CGA TGC GG - 3“(32 MER)和5',TCG的GGC GAG TCG的大老山隧道G - 3”(16 MER),分别。与水存放,分装于-20 ° C原液
- PCR方法MgCl 2的 2毫米,每个的dNTP 200微米3微米的5' -和3' -引物,扩增单链DNA寡核苷酸随机库(0.4μM)。为了保存大量原始的DNA库,限制PCR扩增十个周期。经过PCR反应(10反应,每个反应100μL),恢复使用QIAquick凝胶纯化试剂盒(QIAGEN公司)扩增双链DNA池。
- 转换产生双链的RNA库,根据制造商的说明使用DuraScription套件(震中,麦迪逊,威斯康星州)。在转录反应混合物,取代2' - F CTP和2' - F - UTP CTP和UTP产生核糖核酸酶的耐核糖核酸。通常情况下,准备20μL含1微克纯化的DNA为模板,2μL,10 ×缓冲,2μLdATP的,2μL,dGTP,2μL,2' - F - dCTP,2μL,2' - F,2μL的数码地面电视的dUTP的反应2μL,T7 RNA聚合酶在室温下,然后在37 ° 6小时彗星每个的dNTP(50毫米)。
- 随后消化去除DNA模板和8%的聚丙烯酰胺/ 7 M尿素凝胶净化用DNase I(1.5%,20μL,T7转录反应液)的反应。紫外分光光度法量化纯化的RNA库。
(2) 在体外生成的适配
- 在选择之前,准备选择缓冲区和复性缓冲液。准备一个含有100毫米HEPES,pH值7.4的HEPES缓冲液。使用氢氧化钠调整pH值,然后存储在室温。准备一种RNA复性缓冲液(5xHBS)包含的50 mM HEPES pH值7.4,氯化钠750毫米; MgCl 2的 5毫米;氯化钙2 5毫米,13.5毫米氯化钾。准备低盐RNA结合缓冲液(10 mM的HEPES pH值7.4,50毫米氯化钠,氯化钙2 1毫米,1毫米氯化镁2,氯化钾2.7毫米,10毫米数码地面电视,0.01%BSA和高盐RNA结合缓冲液(10 mM的HEPES MgCl 2的 1毫米,1毫米氯化钙2,pH值7.4,150 mM氯化钠,氯化钾2.7毫米,10毫米数码地面电视,0.01%BSA)。存放于-20 ° C这些缓冲区
- 执行主要为描述1-4 SELEX。在每次选择轮,折叠的RNA池1xHBS缓冲液(10 mM的HEPES pH值7.4,150 mM氯化钠,氯化钙2 1毫米,1毫米氯化镁2,氯化钾2.7毫米),加热到95℃3分钟,然后慢慢冷却至37 ° C。继续孵化,在37 ° C为10分钟。
- 一般情况下,以尽量减少非特异性结合,与硝酸纤维素膜过滤器,预吸附复性的RNA池硝酸纤维过滤器(HAWP过滤器,0.45微米),30分钟前, 孵化 HIV - 1巴尔的gp120的蛋白质与目标。
- 低盐RNA结合缓冲液中的靶蛋白前清除RNA为30分钟1轮SELEX池孵育4。 SELEX第四轮后,使用高盐的RNA结合的缓冲区。随着SELEX实验的进展,减少gp120的蛋白质的数量和增加竞争对手酵母tRNA,以提高适体选择的严格。
- 对于选择的第一个周期,在200μL低孵化事先批准的随机RNA的池(40微克,1.5 nmol,9x10 14分子)和HIV - 1巴尔gp120的蛋白质(0.23 nmol,RNA /蛋白质比例为6.5 / 1)盐RNA结合缓冲液在室温下30分钟的旋转平台上。
- 通过通过预湿硝化纤维过滤器的反应,并用1 mL结合缓冲液。
- 从200μL洗脱缓冲液(7 M尿素和5毫米EDTA)在95 ° C为5分钟,酚/氯仿抽提和浓度与单片机YM - 30柱。的过滤器洗脱结合的RNA
- 反向转录回收的RNA池使用ThermoScript RT - PCR检测系统(Invitrogen公司)和15个周期的PCR扩增。
- 使用QIAquick凝胶纯化试剂盒纯化扩增双链DNA池和抄写以上所述为下一轮的选择。
3。 SELEX进展监测过滤器的结合实验
- 监控通过过滤器结合法的适体的SELEX的进展。治疗与CIP的RNA池中删除启动5' -三磷酸,然后用T4多核苷酸激酶和γ- 32P - ATP的标签。
- RNA文库热10 pmol的CIP治疗95 ° C 5分钟,然后在冰面上寒气。随后,添加2PNK缓冲液,1μLT4多聚核苷酸激酶,1μLγ- P 的 32 - ATP和水至20μL微升。
- 在37 ° C 30分钟,然后加入20 ^亩; L的水和净化G - 50柱的反应。最后,获得40μL标记的RNA终浓度为250纳米。
- 检测前,折叠标记的RNA池1xHBS缓冲液(10 mM的HEPES pH值7.4,150 mM氯化钠,氯化钙2 1毫米,1毫米氯化镁2,氯化钾2.7毫米),加热至95℃,3分钟,然后慢慢冷却至37 ° C。继续孵化,在37 ° C为10分钟。
- 开展的100μL的结合反应为例。孵育结束标记与gp120的蛋白质(100纳米)和10倍,在高盐的RNA结合缓冲液中30分钟的非特异性竞争对手的tRNA(100纳米)的摩尔过剩的RNA池(10纳米)。
- 单独由预湿硝化纤维过滤器的结合反应50μL。
- 2 mL结合缓冲液洗的过滤器和计数过滤器上保留通过一个多用途的闪烁计数器(Beckman Coulter公司)的放射性。作为输入控制,计数,同时结合反应的其余50μL。 %计算的RNA保留在过滤器上输入RNA结合的亲和力。
4。克隆,测序和路线
- 经过11轮,如果没有进一步的浓缩,是观察以下额外的选择轮,那么最大结合的RNA池具有潜在的达成。
- 反向转录高度丰富的适体池(12日RNA池)使用ThermoScript RT - PCR检测系统(Invitrogen公司),随后造成的cDNA通过PCR放大。使用QIAquick凝胶纯化试剂盒(Qiagen)纯化的PCR产物。克隆凝胶纯化到TA克隆载体的PCR 2.1(Invitrogen)的DNA产物。共接种170单个克隆,并进一步确定他们的DNA测序,以获得单个序列。
- 单个克隆分为六种不同的群体,基于个人的适体序列的路线。选择从每个组进一步鉴定,因为它们在它们的组内的相对丰度(A - 1,A - 5,A - 10,A - 12,A - 28和B - 68)的一名代表序列。
5。 通过体外转录生成的适体和嵌合体的RNA
- 直接产生双链DNA为模板,通过PCR方法MgCl 2的 2毫米,每个的dNTP 200微米的5' -和3' -引物各2微米,并恢复产生的PCR产物,使用QIAquick凝胶纯化试剂盒。
- 嵌合体义链转录PCR扩增产生的DNA模板使用DuraScription套件(震中,麦迪逊,威斯康星州)。在转录反应混合物,取代2' - F CTP和2' - F - UTP规范CTP和UTP耐核糖核酸酶降解产生的RNA。
- 通常情况下,孵化20μL含1微克的DNA为模板,2毫升10xbuffer,2μLdATP的,2μL,dGTP,2μL2' - F - dCTP 2μL,2' - F的dUTP 2μL,数码地面电视和2μL的反应T7 RNA聚合酶在37℃6小时彗星,并随后与生物自旋30列(BIO - RAD)苯酚抽提和乙醇沉淀净化。
- 为了避免干扰素反应,进一步处理CIP转录RNA删除启动5' -三磷酸。孵育总在37 ° C,60分钟含3微克的成绩单,6缓冲区3μL和0.25μL的CIP反应60μL。经酚/氯仿乱摊派和乙醇沉淀,重悬的RNA沉淀成水。
- 要准备的嵌合体,与相应的反义RNA在复性缓冲液,热窝藏只有正义链RNA结合嵌合体95℃3分钟,然后冷却至37 ° C缓慢。继续孵化,在37 ° C为10分钟。执行复性一步一个顶尖1xHBS缓冲区。例如:10微米嵌合体义链的混合10μL,10μL10微米的反义链和5μL复性缓冲液(5xHBS)到25μL体系。
6。凝胶迁移实验离解常数的测定
- 年底P 32标签代表各组和嵌合体义链的适体,然后折叠核糖核酸1xHBS缓冲区如上所述。
- 准备3.125毫升40%丙烯酰胺/ BIS的解决方案,19.375 mL水,150μL10%过硫酸铵(APS)的解决方案,和30μLTEMED混合10xTBE缓冲区的2.5毫升,25毫升5%的凝胶。凝胶聚合在约30分钟。小心取出梳子和使用装有针井用运行缓冲液(1xTBE)30毫升的注射器。
- 凝胶单位完成的组装和连接到电源。凝胶可以一小时前运行,在180 V 4 ° C。
- 串行的HIV - 1Bal gp120的蛋白质结合缓冲液至所需的浓度稀释。最终的Reaction gp120的浓度是0,1,5,10,20,40,80,160,320,640 nm处。孵育32月底,标记的RNA(10 nm)的浓度升高gp120的结合缓冲液中的蛋白质在室温下30分钟的旋转平台上(共20μL的反应)的5' - P的固定数量。
- 孵育后,与5μL的本机装载缓冲区,并加载到5%的非变性聚丙烯酰胺凝胶混合20μL结合反应。准备一个本机上样缓冲液(4X)含10毫米的Tris - HCl,pH值7.5; 1毫米EDTA,0.1%溴酚蓝,0.1%二甲苯蓝FF,0.1%,40%的甘油橙G。在-20 ° C分装店
- 以下的电泳(180 V在4℃2小时,直到二次染料在凝胶的中间运行),揭露凝胶磷影像画面和量化台风扫描仪使用的放射性。
- 使用图形片棱镜的非线性曲线回归计算的解离常数。
7。通过流式细胞仪检测细胞表面结合的研究
- 生成使用的消声器的siRNA标记试剂盒(Ambion公司)的荧光核酸适体和嵌合体。为了加入下列试剂:22.5μL无核酸水; 5毫升10 ×标记缓冲液15μL,RNA(5微克); 7.5μL标记染料。孵育总额在37 50微升标记反应° C,持续1小时。
- 孵育后,加入5.0μL(0.1卷)5 M氯化钠和125μL(2.5卷)冷轧100%的乙醇调匀。在-20 ° C孵育60分钟。在4 ° C离心20分钟,以最快的速度。上清,取出175μL70%乙醇洗涤沉淀。在黑暗中的空气干燥颗粒,然后在15μL无核酸酶水暂停标记的RNA。
- 测量标记的RNA的吸光度在260 nm和荧光染料的吸光度最大。计算基础:染料比率和RNA的浓度,根据提供的计算器 http://www.ambion.com/techlib/append/base_dye.html 。
- 混合Cy3标记标记的嵌合体义链和反义链和折叠复性缓冲如上所述。
- 通过对艾滋病的研究和参考试剂计划5,6表达gp160的CHO - EE控制细胞获取的CHO - WT。种植GMEM - S的培养基中的细胞(谷氨酰胺缺陷最少的400μm的蛋氨酸亚砜(MSX)的基本媒介)(GIBCO,Invitrogen公司)。文化一个加湿的5%二氧化碳培养箱中培养的细胞在37 ° C。
- 预热洗涤液洗的CHO - WT gp160或CHO - EE控制细胞,trypsinize脱离板块。 500μL结合缓冲液洗细胞两次后,resupend在结合缓冲液中孵育中的细胞沉淀在37 ° C为30分钟。颗粒细胞,然后重悬在50μL预热约束力包含400纳米Cy3标记实验的RNA的缓冲区。
- 孵化后在37 ° C下40分钟,洗涤细胞500μL结合缓冲液预热三次,终于在350μL结合缓冲液悬浮预热至37 ° C,并立即通过流式细胞仪分析。
8。内化和细胞内定位研究活细胞共聚焦显微镜
- 一天前的检测,生长与播种在2 mL GMEM - S中等0.3x10 6 CHO - WT gp160的CHO - EE控制细胞允许在24小时约70%汇合,在35毫米板
- 在一天的实验,用1毫升的预热PBS洗细胞。 1毫升预热30分钟的完全培养基在37 ° C。
- 如上所述,准备Cy3标记的适配子的siRNA嵌合体。孵育REFOLD适体的siRNA棒含有5' - Cy3标记的正义链,形成适体棒siRNA的共轭如上所述棒。
- 在实验之前,准备在4 ° C 0.15毫克/毫升的Hoechst 33342(活体细胞的核染料,分子探针,Invitrogen公司,加利福尼亚),分装在水和存储解决方案
- 细胞染色15分钟的治疗与0.15毫克/毫升赫斯特33342在37 ° C。随即,洗出1.0毫升的新鲜培养基染料两次并更换预热2毫升的新鲜培养基。
- Cy3标记的一个终浓度为100纳米到活细胞共聚焦显微镜在5%CO2显微镜孵化器的孵化和媒体的适体,嵌合体的siRNA在37 ° C
- 每15分钟使用的Zeiss LSM 510 META倒开水浸泡在40倍的放大倍率下2光子共聚焦显微镜系统收集的图像。
在体外挑战HIV - 1和p24抗原检测9。
- 购买自ATCC CCRF - CEM细胞。成长的RPMI - 1640(Cellgro科技股份有限公司),辅以10%小牛血清(FBS,Hyclone公司),L -谷氨酰胺和1xPen链球菌(GIBCO,Invitrogen公司)。培养细胞在加湿5%CO2培养箱在37 ° C
- 获得周边血液mononucleAR希望城国家医学中心(门诊人员)的健康献血者的样本。
- 通过聚蔗糖- Hypaque液离心(Histopaque - 1077,Sigma公司)分离外周血全血。通过使用磁珠CD8(Invitrogen公司,CA)的消耗,从外周血CD8细胞(T-cytotoxic/suppressor细胞)。
- 种植在T细胞的活性介质细胞(BioE,明尼苏达州圣保罗)。培养细胞在加湿5%CO2培养箱在37 ° C
- 获得HIV - 1的IIIB和NL4 - 3病毒HIV - 1巴尔病毒和艾滋病的研究和参考试剂计划。后传播的病毒分装,储存在-80 ° C
- 感染CCRF - CEM细胞与HIV病毒或人类外周血单个核细胞(IIIB部,NL4 - 3或BAL)(教学语言的0.001或0.005)。感染后24小时后,轻轻地用PBS洗3次删除免费的病毒细胞。继续以文化感染的细胞在5%的CO 2显微镜孵化器在37 ° 4天的彗星。
- RNA的治疗方法之前,轻轻洗用PBS洗3次免费的病毒感染的细胞,以消除。孵育2X10 4感染的细胞和3X10 4未受感染的细胞与复性实验的RNA在400 nm,在96孔板终浓度在37 ° C(100μL每口井区三重检测) 。
- 收集在不同的时间(3天,5天,7 d和9 D),并储存在-20 ° C,直到P24检测培养上清中(每孔10μL)。
- 执行使用HIV - 1 P24抗原检测试剂盒的p24抗原分析。
10。定量RT - PCR检测siRNA的功能检测
- 感染CCRF - CEM细胞与HIV病毒(IIIB部,NL4 - 3或BAL)或人类外周血单核细胞和治疗如上所述,与实验的RNA(400毫微米)。
- 经过7天的治疗,颗粒细胞和隔离与STAT - 60的总RNA。治疗的总RNA用DNase我去除基因组DNA,并用2μg总RNA产生的cDNA。
- 混合以下试剂:8毫升无核酸酶水1.5毫升10 × DNA酶缓冲液4μL,核糖核酸(2微克),0.5μLRNain抑制剂和1.0μL无RNA酶的DNA酶一孵育共15μL反应为37℃1小时,热在80℃10分钟灭活DNA酶一,立即,在冰面上寒气的反应。
- 添加2μL,随机引物(50毫微克/μL)和1μL的dNTP(10毫米)到上述反应混合物,然后热量,在65 ° C为5分钟。随即,寒冷的冰的反应。
- 加入下列试剂:5毫升5xFirst链缓冲区; 2.5毫升0.1 M的数码地面电视服务; 0.5毫升RNain抑制剂和1.0毫升MMLV - RT。共27 mL反应孵育25 ° 10分钟和37℃℃,1小时。反应后,热的混合物在70 ° C下15分钟灭活逆转录酶,然后在冰面上寒气。 cDNA的准备QRT - PCR分析。
- 分析定量RT - PCR使用2 × IQ SyberGreen Mastermix和特异性引物套在400 nm的终浓度(三缸检测)靶基因的表达。作为内部控制的qPCR数据正常化GAPDH的表达。
11。代表性的成果:
1。新的RNA适配子对HIV - 1 BAL gp120的孤立和特点。
在实验部分,最初的DNA寡核苷酸库,其中包含50 NT随机区域两侧固定引物的5'和3'末端的扩增和转录成一个RNA池地区。这个初始库由10月15日多样的序列(1 nmol),折叠成各种三维结构的广大阵列。初始库的高度复杂性和多样性,保证活动构造具有良好的亲和力目标。
采用体外 SELEX程序( 图1)选择2' -氟嘧啶修改RNA适配有选择性地绑定在R5株HIV - 1的BAL gp120的包膜蛋白7。 如图1所示,硝酸纤维素为基础的选择策略进行隔离来自非约束性的RNA分子的具体目标结合的RNA。由于蛋白质坚持以硝化棉,只有RNA /蛋白质复合物或聚合可以保留在膜和自由RNA是冲了出去。变性条件下,恢复和绑定的RNA反转录成cDNA,然后到双链DNA扩增,并随后在体外转录,以创建一个新的RNA池下一个选择周期。选择紧缩是通过降低靶蛋白的数量,增加竞争对手的tRNA数量增加。 RNA池,蛋白质和竞争对手的tRNA在每一轮选择使用量见表1。
监视器的选择SELEX循环后,每个过滤器结合试验的进展。评估的结合亲和力%的RNA上FIL保留之三中的总RNA池。起始RNA池(1 - RNA)的显示膜保留了输入的RNA的0.1%。然而,经过9轮筛选的第九届RNA库(9 - RNA)的有9.72%的输入的RNA。虽然其他选择进行了两轮,没有进一步浓缩,这表明,已达到最大结合的RNA池( 图2A)。与筛选结合法相似,凝胶迁移实验还确定解离常数的最流行的战略之一。此过程既简单又方便。 如图2b所示,凝胶迁移实验进一步证实的RNA池的具有约束力的活动。这些结果表明,配体与靶蛋白结合的特异性高一些,先后在这些RNA池丰富的..
克隆和序列的高度浓缩的适体池(12 - RNA)的。根据个人的克隆适体序列的路线,6个不同组别进行分类,如表2所示。约有40%的克隆(I和II组适配)包含一个保守的序列:(A / G)TTGAGGGACC(A / G)。我们选择从每个组的代表序列:进一步鉴定,因为它们在它们的组内的相对丰度(例如A - 1,A - 5,A - 10,A - 12,A - 28和B - 68)。通过本机的凝胶迁移实验中,这些代表适配的解离常数(K D)计算( 图 3A )。举例来说,A - 1的最佳适配,具有明显的Kd值的52纳米( 图3B) 。如图3a所示,这些选定的适配可以选择性地结合与目标巴尔gp120的HIV - 1,但不是艾滋病毒的gp120的CM蛋白质。
2。抗- gp120的适体特异性结合,并表达艾滋病毒gp160的细胞内化和抑制HIV - 1感染细胞培养。
CHO - gp160细胞稳定表达HIV包膜糖蛋白gp160是用来测试约束力和内部选定的抗- gp120的适配。这些细胞不加工成gp120和gp41 gp160的,因为他们缺乏信封加工所需的 GAG编码蛋 白酶。作为对照,我们用父母的CHO - EE细胞株不表达gp160。流( 图4A),流式细胞仪分析表明,Cy3标记的适配特异性结合gp160的CHO细胞,但不是控制的CHO - EE细胞。此外,实时活细胞共聚焦显微镜Z轴表示Cy3标记的核酸适配体是选择性- gp160的CHO细胞(图4B和 4C)内孵化后2小时内,但不是控制细胞的CHO - EE ( 图4D)。图4C还显示,适体,这表明gp120的适配可能通过受体介导的内吞作用进入细胞胞浆内聚集。
在HIV - 1的挑战的检测,HIV - 1感染外周血单个核细胞治疗与适配。在不同的日子里与适配的治疗后,媒体等分是检测病毒p24抗原水平(图 4E) 。结果表明,抗- gp120的适配(A - 1)抑制HIV - 1 P24与纳米摩尔浓度生产。
3。抗- gp120的适体的siRNA嵌合体的设计和评估其细胞类型特异siRNA传递系统的功效
所示,图5A,适体和感载核酸耐2' -氟UTP和CTP 2' -氟的siRNA链段,并从相应的双链DNA模板在体外噬菌体转录合成。为了增加分子的灵活性,两个核苷酸连接器(UU)之间插入的适体和Dicer的基板部分。为了准备含有嵌合体的siRNA, 在体外转录嵌合体适体感链聚合物摩尔浓度与未修改的反义链RNA退火。凝胶迁移实验( 图5B)和流式细胞仪( 图5C)这些数据表明,嵌合体维持大约相同的亲和力作为单独的适配。从实时共聚焦显微镜( 图5D)的时间,当然图像显示,Cy3标记的CH A - 1嵌合体可以成功地进入细胞的细胞质内在。正如预期的那样,没有摄取的嵌合体的CHO - EE控制细胞( 图5E)观察。
同样,抗病毒RNA的潜力是HIV - 1病毒的挑战测定评价。艾滋病毒p24抗原分析(图6A和6B)的结果表明,适体和嵌合体抑制P24的生产,但抑制作用最强的嵌合体的CH A - 1治疗观察。
要确认siRNA的组成部分是运作的“亚太贸易协定”MER,CH - 1感染的细胞嵌合体的内化,我们还通过定量RT - PCR表达分析评估抑制达/转基因表达的相对水平。我们发现,治疗感染的细胞嵌合体能够诱导达/转基因沉默,而适体本身并不影响达/转基因的表达( 图6C及6D)。这些结果提供进一步的支持,适体交付的siRNA触发的RNAi。
| 蛋白质的量,RNA池和tRNA用于选择 | |||||
| SELEX轮 | 目标/ RNA的比率 | GP120蛋白 | RNA的池 | 竞争对手的tRNA | 选择缓冲区 |
| 1 | 1/6.5 | 229.8 pmol | 40.1微克(1.5 nmol) | 0 | 低盐SELEX缓冲区 |
| 2 | 1/6.5 | 114.9 pmol | 0.75 nmol(20.1微克) | 0.25 nmol(6.6微克) | |
| 3 | 1 / 8 | 76.6 pmol | 0.625 nmol(16.7微克) | 0.25 nmol(6.6微克) | |
| 4 | 1 / 8 | 76.6 pmol | 0.625 nmol(16.7微克) | 0.25 nmol(6.6微克) | |
| 5 | 1 / 8 | 38.3 pmol | 0.306 nmol(8.18微克) | 13.2微克(0.5 nmol) | 高盐SELEX缓冲区 |
| 6 | 1 / 8 | 38.3 pmol | 0.306 nmol(8.18微克) | 13.2微克(0.5 nmol) | |
| 7 | 1 / 10 | 26.8 pmol | 0.268 nmol(7.16微克) | 13.2微克(0.5 nmol) | |
| 8 | 1 / 10 | 26.8 pmol | pmol 0.268 nmol(7.16微克) | 1 nmol(26.4微克) | |
| 9 | 1 / 10 | 15.3 pmol | 0.153 nmol(4.09微克) | 1 nmol(26.4微克) | |
| 10 | 1 / 10 | 15.3 pmol | 0.153 nmol(4.09微克) | 39.6微克(1.5 nmol) | |
| 11 | 1/12.5 | 7.66 pmol | 0.096 nmol(2.56微克) | 2 nmol(52.8微克) | |
| 12 | 1/12.5 | 7.66 pmol | 0.096 nmol(2.56微克) | 2 nmol(52.8微克) | |
表1:选择条件。蛋白质的量,RNA池和tRNA的每个选择和选择缓冲区使用的表示。
| 集团 | 核糖核酸 | 随机序列 | 频率(140个克隆) |
| I组 | A - 1 | AATTGAGGGACCA CGCGCTGCTTGTTGTGATAAGCAG TTTGT重心GATGG | 33(23.6%) |
| B - 7 | AATTGAGGGACCA ACGCGAGGATGTGGATAGTGTGTA TTTGC GT GATGG | 3 | |
| A - 32 | AATTGAGGGACCG TTGGTAAAAGCCGGA AATTG AGCT TTTAC GGC GATGG | 5 | |
| B - 55 | AATTGAGGTACCGCG TTATTAGGAACA AATTG GAATTCTAAACGC GATGG | 2 | |
| A - 24 | AATAGAGGGACC CAGATATAGGCTACACGGATGATGGTGTATCTG GATGG | 1 | |
| B - 19 | AATAGAGGAACCG TTTCAGAAGACTACAGGTTAGTCCAATGAAGC GACGG | 1 | |
| B - 31 | AATAGAGGGACCG TGGACAATAATTTATGGTCA TTTATTGGCAC GATGG | 1 | |
| 第二组 | A - 12 | AGTAGAGGAACCA AGCAATGGATGAATGCAAAAGTGTAAATGCTT GATGG | 10(7.1%) |
| 第三组 | A - 10 | TGAGTTTGGGTAAATTTCCGGTTTCGGTTTACTCACGAAAGATCGGTCGG | 15(10.7%) |
| IV组 | A - 28 | TAAAGGAGGGAAGGATGAGACCGCACGAAAAATATCAGCATACG TTTGTG | 10(7.1%) |
| 第五组 | A - 5 | GAAACTAGTTTGAATAATGGTGTAGAGGAGGGTCAATAGTTTCG TTGGTG | 9(6.4%) |
| 六和集团 | B - 68 | ACATAGTAATGACACGGAGGATGGAGAAAAAACAGCCATCTCTTGACGGT | 2 |
| 其他 | 孤儿序列 | 48 |
表2的路线和确定的RNA适配。继12 日一轮的选择,选定的RNA池被克隆和测序。全部140个克隆的对齐后,确定了6组,抗- gp120的适配。只有适体的核心区域的随机序列(5' - 3')表示。多种频率发生分离指定。
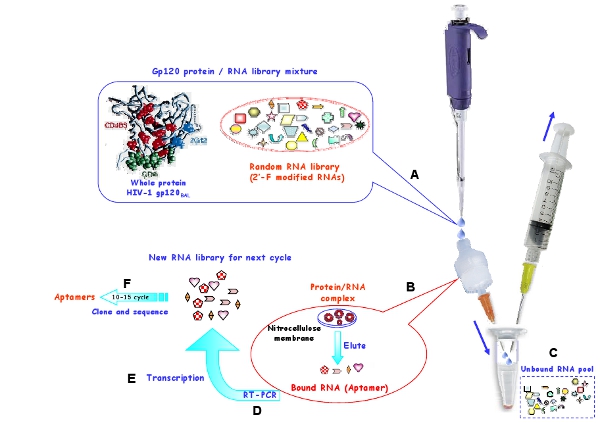
图1:在体外的遴选程序的示意图使用硝酸纤维素膜,巴尔为HIV - 1 gp120的蛋白质生成的RNA适配。 ( 一 )起始RNA的游泳池和靶蛋白孵育,形成复杂的。 (二)结合的RNA分子被保留在膜和膜变性条件下洗脱。 (三)未绑定的RNA被洪水冲走。 (四)被选定的RNA反转录和PCR扩增。 (e)有关的DNA其后转录成新的RNA为下一个选择循环池。 (六)10-15轮筛选后,选定适配被克隆和序列。
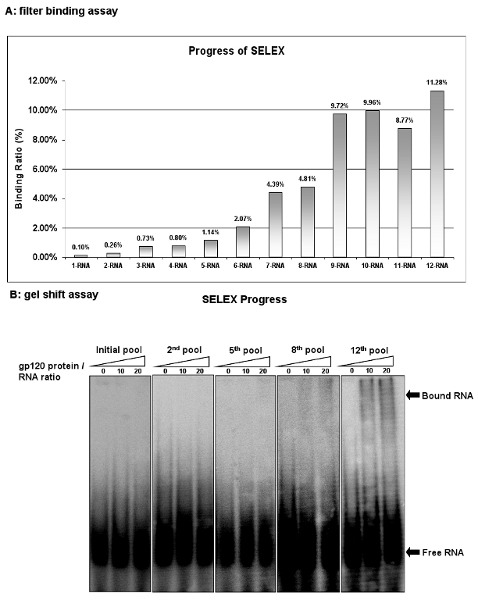
图2:HIV - 1 gp120的适配选择的进展。 ( 一 )在每个周期的结合活性的RNA池的过滤与竞争对手的tRNA结合实验进行了分析。结合活性RNA上的过滤器保留在蛋白质/ RNA的复杂输入的百分比计算。 (二)在每个周期的结合活性的RNA池通过凝胶迁移实验进行了分析。 12 日的RNA池显示出最高的结合活性。
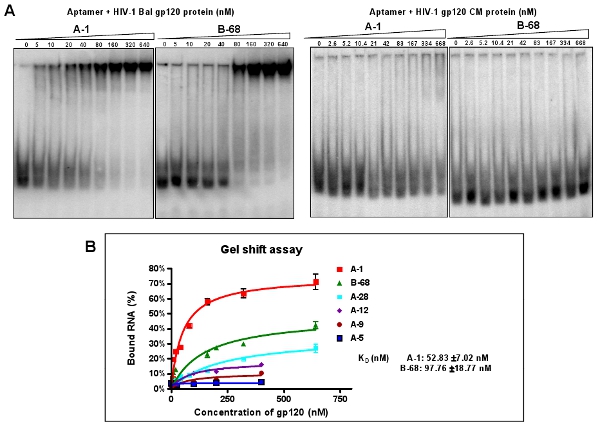
图3:结合活性检测抗HIV - 1 巴尔 gp120的选择个人适配。 ( 一 )5' - P 32标记的个人适配培养目标gp120的蛋白质或者非特定CM蛋白的数量不断增加。凝胶迁移实验结合反应混合物进行了分析。适体A - 1和B - 68表现出最好的靶蛋白结合的亲和力,但没有CM蛋白。数据代表的四个平均复制。 (二)结合曲线从凝胶迁移实验。
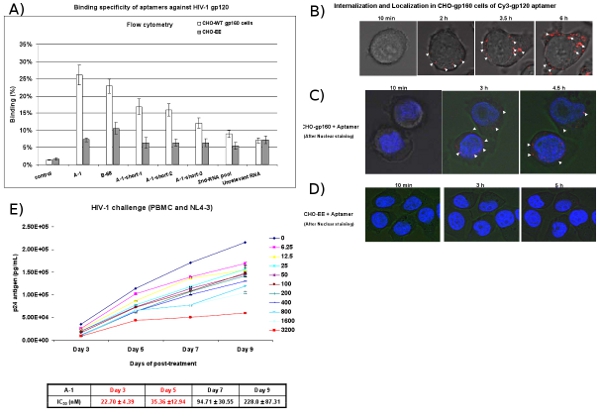
图4:细胞类型的特异性结合和吸收适配研究。 ( 一 )Cy3标记的RNA的细胞表面结合,通过流式细胞仪检测评估。 Cy3标记的RNA - gp160的CHO细胞和CHO - EE控制细胞结合测试。选定的适配显示细胞类型特异性结合亲和力。 第二 RNA池和无关的RNA被用来作为阴性对照。数据代表三个平均复制。 (二)内在分析。 CHO - gp160细胞生长在35毫米板和培养与Cy3标记在实时活细胞共聚焦显微镜分析的培养基A - 1 100 nm的浓度。在15分钟的图像采集。使用40X放大倍率的间隔。 (C,D)定位分析。 CHO - gp160细胞和CHO - EE控制细胞生长在35毫米板。与Cy3标记A - 1 100 nm的孵化之前,细胞,用Hoechst 33342(活体细胞的核染料)染色,然后利用实时共聚焦显微镜分析。 (五)选定的抗- gp120的适配在以前与HIV - 1的NL4 - 3型病毒感染的人类外周血抑制HIV - 1的复制。不同浓度和时间pointes。 IC50值上市。数据表示的P24一式三份的测量平均。
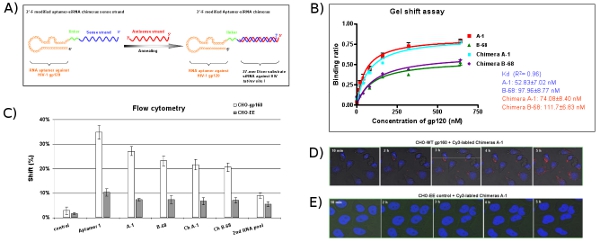
图5:适体,嵌合体的siRNA传递系统的设计和评价。 ( 一 )示意图适体嵌合体RNA的siRNA的抗- gp120的适体的区域是负责结合gp120和siRNA是针对常见的外显子的HIV - 1达/转。修改2' -氟- siRNA的适体感的单链合作转录,通过互补的siRNA反义链退火完成嵌合分子。适体和siRNA之间的连接器(UU)是绿色表示。 (二)嵌合体的RNA适配子的siRNA的具有可比性的Kd值以及父母适配特异性结合艾滋病毒巴尔gp120的蛋白质。数据代表三个平均复制。 (三)细胞类型的特定约束力的适配研究。 Cy3标记的RNA - gp160的CHO细胞和CHO - EE控制细胞结合测试。细胞表面面对Cy3标记,标记的RNA绑定由流式细胞仪进行了评估。选定的适配显示细胞类型特异性结合亲和力。 第二届 RNA池和无关的RNA被用来作为阴性对照。数据代表平均两个复制。 (D,E)的内化和胞内本地化分析。 CHO - gp160细胞生长在35毫米板,并用Hoechst 33342(活体细胞的核染料)染色。随后,细胞在培养基中培养,与Cy3标记为实时活细胞共聚焦显微镜分析如前所述嵌合体的100纳米的浓度。
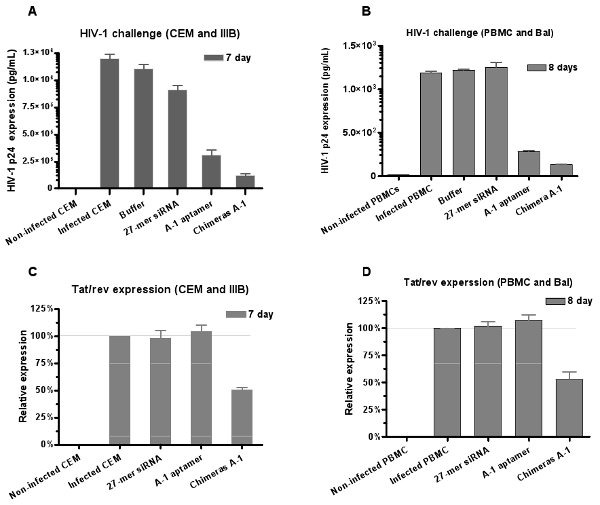
图6:双抑制适配子的siRNA嵌合体介导的HIV - 1感染。抗- gp120的适体和siRNA的适体,嵌合体中和HIV - 1感染( 一 )CEM细胞(IIIB应变)和(B)人类外周血单个核细胞(BAL应变)的文化,分 别为。数据代表的P24一式三份的测量平均。嵌合体表现出更强的抑制比适体,仅表示,(C,D) 的适配下调达/转的外周血单个核细胞的基因表达提供的siRNA。数据代表三个平均复制。
讨论
适配是在体外进化承担具体的和稳定的三维形状的核酸,从而提供了非常具体的,紧密结合到目标分子 8 。低纳摩尔结合的亲和力和精致的特异性适配,他们的目标,使他们的多用途工具用于诊断,在体内成像和治疗9。随着适体进行有针对性的siRNA传递技术的到来,现在是可行的,使用的适体为受体介导的内吞作用的 siRNA 10-12的绑定功能。对细胞膜受体提出?...
披露声明
致谢
我们感谢布丽塔赫恩,孙桂花,哈里斯Soifer有益的讨论和莉萨舍雷尔。这项工作是支持通过美国国立卫生研究院艾滋病研究和参考试剂计划,艾滋病司,NIAID的,美国国立卫生研究院从国立卫生AI29329,授予JJR下列试剂HL07470研究院获得资助的CHO - EE和CHO - gp160细胞行; pNL4 - 3吕克载体; gp120的HIV - 1 BAL DAIDS,NIAID的。
材料
| Name | Company | Catalog Number | Comments |
| 试剂名称 | 公司 | 目录编号 | 评论(可选) |
|---|---|---|---|
| MF微孔膜过滤器 | Millipore公司 | HAWP01300 | 孔径0.45微米 |
| Swinnex过滤持有人 | Millipore公司 | SX0001300 | 直径13毫米 |
| QIAquick凝胶提取试剂盒 | QIAGEN公司 | 28706 | DNA纯化 |
| 单片机YM - 30列 | Millipore公司 | 42410 | RNA浓度 |
| 生物旋转30列 | Bio - Rad公司 | 732-6250 | RNA纯化 |
| Taq酶PCR扩增DNA聚合酶 | Sigma - Aldrich公司 | D1806 | |
| ThermoScript RT - PCR检测系统 | Invitrogen公司 | 11146-024 | |
| DuraScribe T7转录试剂盒 | 震中 | DS010925 | |
| 的dNTP进行PCR | 罗氏公司 | 1 581 295 | |
| 核糖核酸,转移,从大肠杆菌 | Sigma - Aldrich公司 | R1753 | tRNA的竞争对手 |
| HIV - 1 八- L的 gp120的蛋白质 | 艾滋病研究和参考试剂计划 | 4961 | 靶蛋白 |
| 消声器的siRNA标记试剂盒 - Cy3标记 | Ambion公司 | 1632 | |
| 酚/氯仿5 / 1的溶液(pH值4.5) | Ambion公司 | AM9720 | |
| 氯仿/异丙醇24 / 1解决方案 | 西格玛 | C0549 | |
| 小牛肠碱性磷酸酶(CIP) | 新英格兰Biolab公司 | M0290L | |
| T4多聚核苷酸激酶 | 新英格兰Biolab公司 | M0201L | |
| 糖原 | 罗氏公司 | 10 901 393 001 | RNA沉淀 |
| γ- P 32 + - ATP | MP生物医学 | 013502002 | Radiactivity |
| 40%AccuGel 19:1 | 全国诊断 | EC - 850 | |
| 10xTBE | 全国诊断 | EC - 860 | |
| N,N,N' -四甲基乙二胺(TMEMD) | Sigma - Aldrich公司 | T9281 | |
| 过硫酸铵(APS) | Sigma - Aldrich公司 | A3678 | |
| L -蛋氨酸亚砜 | Sigma - Aldrich公司 | M5379 - 250毫克 | |
| RPMI媒体1640 | Invitrogen公司 | 11835-030 | |
| 碳酸氢钠溶液,7.5%W / V | Invitrogen公司 | 25080-094 | |
| 最低限度的基本培养基(MEM)(10) | Invitrogen公司 | 11430-030 | |
| MEM非必需氨基酸(100) | Invitrogen公司 | 11140-050 | |
| TA克隆试剂盒与PCR 2.1 | Invitrogen公司 | K2040 - 01 |
参考文献
- Tuerk, C., Gold, L. Systematic evolution of ligands by exponential enrichment: RNA ligands to bacteriophage T4 DNA polymerase. Science. 249, 505-510 (1990).
- Ellington, A. D., Szostak, J. W. In vitro selection of RNA molecules that bind specific ligands. Nature. 346, 818-822 (1990).
- Robertson, D. L., Joyce, G. F. Selection in vitro of an RNA enzyme that specifically cleaves single-stranded DNA. Nature. 344, 467-468 (1990).
- Fitzwater, T., Polisky, B. A SELEX primer. Methods Enzymol. 267, 275-301 (1996).
- Weiss, C. D., White, J. M. Characterization of stable Chinese hamster ovary cells expressing wild-type, secreted, and glycosylphosphatidylinositol-anchored human immunodeficiency virus type 1 envelope glycoprotein. J Virol. 67, 7060-706 (1993).
- Vodicka, M. A. Indicator cell lines for detection of primary strains of human and simian immunodeficiency viruses. Virology. 233, 193-198> (1997).
- Zhou, J. Selection, characterization and application of new RNA HIV gp 120 aptamers for facile delivery of Dicer substrate siRNAs into HIV infected cells. Nucleic Acids Res. , (2009).
- Mayer, G. The chemical biology of aptamers. Angew Chem Int Ed Engl. 48, 2672-2689 (2009).
- Famulok, M., Hartig, J. S., Mayer, G. Functional aptamers and aptazymes in biotechnology, diagnostics, and therapy. Chem Rev. 107, 3715-3743 (2007).
- Chu, T. C., Twu, K. Y., Ellington, A. D., Levy, M. Aptamer mediated siRNA delivery. Nucleic Acids Res. 34, e73-e73 (2006).
- McNamara, J. O., 2nd, . Cell type-specific delivery of siRNAs with aptamer-siRNA chimeras. Nat Biotechnol. 24, 1005-1015 (2006).
- Dassie, J. P. Systemic administration of optimized aptamer-siRNA chimeras promotes regression of PSMA-expressing tumors. Nat Biotechnol. 27, 839-849 (2009).
- Zhou, J., Rossi, J. J. The therapeutic potential of cell-internalizing aptamers. Curr Top Med Chem. 9, 1144-1157 (2009).
- Zhou, J., Li, H., Li, S., Zaia, J., Rossi, J. J. Novel dual inhibitory function aptamer-siRNA delivery system for HIV-1 therapy. Mol Ther. 16, 1481-1489 (2008).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。