A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
تصور وظيفة الجهاز التنفسي الميتوكوندريا باستخدام السيتوكروم C أوكسيديز / سكسينات نازعة (كوكس / SDH) مزدوجة وضع العلامات الكيمياء النسيجية
In This Article
Summary
والسيتوكروم أوكسيديز ج / نازعة الصوديوم (كوكس / SDH) المزدوج الوسم الأسلوب يسمح للرؤية مباشرة من الميتوكوندريا القصور التنفسي الانزيم في أقسام الأنسجة الطازجة المجمدة. هذا هو أسلوب مباشر النسيجية ومفيد في التحقيق في أمراض الميتوكوندريا ، والشيخوخة ، والاضطرابات المتصلة بالشيخوخة.
Abstract
الميتوكوندريا الحمض النووي (و mtDNA) العيوب هي سبب هام للمرض ، وربما تكمن وراء الشيخوخة والشيخوخة ذات الصلة 1،2 التعديلات. نظرية الميتوكوندريا الشيخوخة يشير إلى وجود دور للطفرات و mtDNA ، الذي يمكن أن يغير توازن الطاقة الحيوية والوظيفة الخلوية ، في عملية الشيخوخة 3. وقد تم تجميع ثروة من الأدلة لدعم هذا 1،4 الناحية النظرية ، على سبيل المثال يجري mutator 5 و mtDNA الماوس ، ولكن الدور الدقيق للضرر و mtDNA في الشيخوخة ليست مفهومة تماما 6،7.
مراقبة نشاط الانزيمات التنفسية هو نهج واضحة للتحقيق في ضعف الميتوكوندريا. رابعا معقدة ، أو السيتوكروم أوكسيديز ج (كوكس) ، أمر ضروري من أجل وظيفة الميتوكوندريا. يتم ترميز مفارز الحفاز كوكس و mtDNA والتي تعتبر ضرورية لتجميع المجمع (الشكل 1). وبالتالي ، تستند إلى حد كبير التوليف الصحيح والدالة على سلامة و mtDNA 2.رغم أن من الممكن تحقيق المجمعات التنفسية الأخرى ، المجمعات الرابع والثاني هم الأكثر قابلية للفحص النسيجية 8،9. يتم ترميز معقدة تماما الثاني ، أو نازعة سكسينات (SDH) ، عن طريق الحمض النووي (الشكل 1) ، وعادة ما يكون نشاطها لم تتأثر و mtDNA ضعاف ، على الرغم من زيادة قد تشير إلى نشوء حيوي الميتوكوندريا 10-12. لاحظ و mtDNA ضعف في أمراض الميتوكوندريا ، والشيخوخة ، والأمراض المرتبطة بالعمر وغالبا ما يؤدي إلى وجود خلايا للنشاط COX منخفضة أو غائبة 2،12-14. على الرغم من أن يتم التحقيق كوكس وSDH أنشطة فردية ، أثبتت متتابعة المزدوج وسم 15،16 طريقة ليكون من المفيد في تحديد الخلايا التي تحتوي على ضعف الميتوكوندريا 12،17-21.
وقد تم تحديد العديد من الدساتير الأمثل للمقايسة ، مثل تركيز الركيزة ، يقبلون الإلكترون / المتبرعين والناقلين الإلكترون وسيطة ، وتأثير درجة الحموضة ، والتفاعل طنIME 9،22،23. 3،3 '- diaminobenzidine (DAB) هو المانحة الإلكترون فعالة وموثوق بها 22. في الخلايا التي تحتوي على سير كوكس ، فإن البوليمر الناتج البني indamine توطين في أعراف الميتوكوندريا وتشبع الخلايا 22. وبالتالي فإن هذه الخلايا مع كوكس مختلة لا تكون مشبعة بواسطة المنتج DAB ، والسماح للتصور النشاط SDH بتخفيض tetrazolium nitroblue (NBT) ، والمتقبلة الإلكترون ، إلى منتج الأزرق نهاية formazan 9،24. تضاف السيتوكروم ج سكسينات الصوديوم وركائز لتطبيع المستويات المحلية بين السيطرة والأنسجة المريضة / 9 متحولة. الكاتلاز يضاف كاجراء احترازي لتجنب ردود الفعل المحتملة من تلوث النشاط البيروكسيداز 9،22. يستخدم Phenazine methosulfate (PMS) ، حاملة الإلكترون الوسيطة ، بالاشتراك مع أزيد الصوديوم ، مثبط السلسلة التنفسية ، وزيادة في تشكيل منتجات التفاعل النهائي 9،25. على الرغم من ذلك إبلاغأوجه ، وبعض التفاصيل الهامة التي تؤثر على نتيجة الفحص هذه واضحة لائق ، بالإضافة إلى الضوابط المحددة والتقدم في التقنية ، لم يتم تقديمها حتى الآن.
Protocol
1. التحضير لأنسجة cryosectioning
- التضحية الحيوانية إما خلع عنق الرحم أو قطع الرأس ، وفقا لتصريح الأخلاقية المتاحة.
- جمع الأنسجة بسرعة من الفائدة (على سبيل المثال. الدماغ) ، وتجميد بسرعة على الثلج الجاف (الأنسجة قد تتطلب درجة التجمد في isopentane أو البروبان المبردة مع النتروجين السائل للحصول على التشكل الأمثل). تخزينها في الأنسجة رقائق الألومنيوم في -80 درجة مئوية حتى جاهزة للمقطع.
- تضمين الأنسجة المجمدة تمهيدا لcryosectioning.
- جمع المقاطع ناظم البرد 14 ميكرومتر في -21 درجة مئوية (قد تحتاج إلى ضبط درجة الحرارة ± 1-2 درجة مئوية). ذوبان الجليد على أبواب الشرائح باستخدام كتلة التدفئة ، والشرائح في مخزن دون coverslipping -20 درجة مئوية حتى جاهزة للاستخدام.
2. كوكس الكيمياء النسيجية
- تسمح الشرائح لتجف في درجة حرارة الغرفة لمدة 1 ساعة. خفض وضع الشرائح في غرفة الشريحة تلطيخ مع ورق الترشيح الرطب ، إلى شرائح. للحصول على consistenالنتائج طنا في كل تجربة ، فمن المستحسن أن العملية بحد أقصى عشرة شرائح في تجربة لتقليل فترات التأخير.
- السيتوكروم 100 ميكرومتر تعد تحت DAB الكيميائية 1X هود ، ج 0.1 درجة الحموضة في برنامج تلفزيوني M = 7.0. الدوامة بسرعة.
- إضافة 2 ميكروغرام البقري الكاتلاز (2 ميكروغرام مل -1 أو IU حوالي 4 مل -1). مزيج جيد من قبل vortexing لتفريق جميع الحبوب من الكاتلاز.
- تطبيق 150 -- إلى كل شريحة من 200 ميكرولتر المتوسطة الحضانة ، واستخدام ماصة للطرف موزعة بالتساوي على جميع الأقسام.
- احتضان الشرائح لمدة 40 دقيقة عند 37 درجة مئوية.
- الحل إزالة الزائدة من الشرائح. تغسل الشرائح 4 مرات ، و 10 دقائق في كل مرة ، في 0.1 درجة الحموضة PBS M = 7.0.
- عودة إلى الشريحة الشرائح تلطيخ الغرفة بشرائط الورق الرطب.
3. SDH الكيمياء النسيجية
- تعد تحت غطاء الكيميائية NBT 1.5 ملم ، 130 ملم سكسينات الصوديوم ، 0.2 PMS ملم ، و 1.0 ملي أزيد الصوديوم في 0.1 درجة الحموضة PBS M = 7.0. الحيطة والحذر لحمايةPMS بعيدا عن الضوء. الدوامة بسرعة.
- تطبيق 150-200 ميكروليتر المتوسطة حضانة إلى كل الشرائح ، واستخدام ماصة للطرف موزعة بالتساوي على جميع الأقسام.
- احتضان الشرائح لمدة 40 دقيقة عند 37 درجة مئوية.
- الحل إزالة الزائدة من الشرائح. تغسل الشرائح 4 مرات ، و 10 دقائق في كل مرة ، في 0.1 درجة الحموضة PBS M = 7.0.
- يذوى الشرائح لمدة 2 دقيقة في تركيزات التالية من الايثانول : 70 ٪ ، 70 ٪ ، 95 ٪ ، 95 ٪ ، 99.5 ٪. السماح ثم 10 دقيقة في خطوة إضافية 99.5 ٪.
- مكان الشرائح في الزيلين لمدة 10 دقائق. جبل مع Entellan وساترة. السماح للشرائح حتى يجف ساعات خلال الليل ، أو على الأقل 1-2 في منطقة جيدة التهوية.
4. تحديد الخلل الميتوكوندريا
- يشار إلى ضعف كمية الميتوكوندريا بمقدار تلطيخ الزرقاء الخلوية. إلى شبه تحديد هذه المبالغ ، ينبغي ترميز الشرائح وتصور تحت المجهر مشرق الميدان. ينبغي أن يقوم على القياس الكمي شبه أعمى باستخدام مقياس أساس ، على سبيل المثال 0-4 (0 ، أي تلطيخ الأزرق ؛ 4 ، تلوين فقط أزرق). فمن الأفضل لتنفيذ هذا النوع من القياس الكمي شبه على عدة أقسام من موضوع معين / الحيوان لحساب القيمة المتوسطة لكل موضوع / الحيوانات.
- يجب أن يتم تنفيذ الإحصاءات باستخدام اختبار غير المعلمية ، مثل مان ويتني أو كروسكال واليس.
5. ضوابط خصوصية المناسبة
- لضوابط خصوصية للنشاط كوكس ، كرر "كوكس الكيمياء النسيجية" خطوات ، وإضافة 2.5 ملي أزيد الصوديوم ، سلسلة تنفسية مثبط المحطة.
- لضوابط خصوصية للنشاط SDH ، كرر "SDH الكيمياء النسيجية" خطوات مع إزالة سكسينات الصوديوم وإضافة المالونات 50 مم ، والمانع التنافسية للSDH.
- يغسل ويجفف المقاطع في سلسلة الإيثانول ، وإعداد العدة ثم ساترة الشرائح كما هو موضح في الخطوات 3،4-3،6.
6. ممثل النتائج :
خيمة "> وترد الخطة الشاملة للالأمثلة الممثل كوكس / SDH المزدوج العلامات مقايسة النسيجية هو موضح في الشكل 2. كوكس من الكيمياء النسيجية / SDH المزدوج وضع العلامات المناسبة في أقسام الدماغ من النوع البري والشيخوخة قبل الأوان الفئران mutator و mtDNA في الشكل 3. أظهرت تلوين بني غامق في البرية من نوع الفئران (الشكل 3 ، لوحة على اليسار) العادي كوكس نشاط الخلايا مع سلسلة القصور التنفسي ، التي أشار إليها تلطيخ الأزرق ، والذي كشف في 12 أسبوع من العمر و mtDNA mutator الفئران ، وأصبحت هذه العيوب أكثر انتشارا في الفئران الذين تتراوح أعمارهم بين mutator و mtDNA إلى 46 أسابيع (الشكل 3 ، ومركز اللوحة اليمنى).وترد أمثلة كوكس / SDH مناسبة مزدوجة وضع العلامات في أقسام الدماغ من الفئران من النوع البري بسبب عدم كفاية العلامات كوكس في الشكل 4. عدم كفاية الوقت لاحتضان هذه التظاهرة من النشاط كوكس ، أو الحد من توافر الأكسجين الجزيئي التي coverslipping الشريحة أثناء الحضانة ، أسفرت عن خفض ترسب من رد فعل DABايون المنتج ، وبالتالي السماح لتشكيل المنتج الأزرق نهاية formazan خلال حضانة SDH.
ويمكن أيضا كوكس SDH وأنشطة يتم التحقيق بشكل منفصل (الشكل رقم 5 ، واليسار والوسط) ، إلا أن العلامات متسلسلة مفيد في تحديد الخلايا التي تحتوي على أوجه القصور كوكس ، ويرجع ذلك إلى تشكيل ليعجل الزرقاء خلال الاحتضان SDH (الشكل 3 ، ومركز اليمين). ويمكن أيضا ضوابط لأنشطة خصوصية كوكس وSDH ينبغي القيام به (الشكل رقم 5 ، والحق).
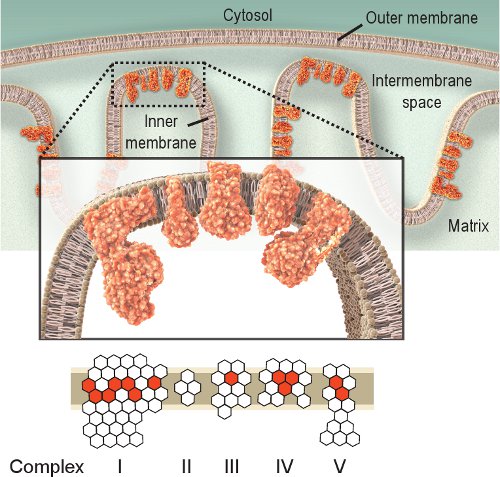
الشكل 1. الميتوكوندريا التنفسي المجمعات الرابع. وتقع سلسلة تنفسية الميتوكوندريا داخل الغشاء الداخلي وتشمل خمسة مجمعات. الغرض من هذه السلسلة هو الجهاز التنفسي لنقل الإلكترونات من مجمع من الأول إلى الرابع ، وبذلك يخلق تدرج البروتونات عبر الغشاء الداخلي المستخدمة من قبل مجمع الخامس (أتباز) لإنتاج ATP. أحمر السداسي represeمفارز المشفرة بواسطة NT و mtDNA. السداسي بيضاء تمثل مفارز المشفرة بواسطة الحمض النووي (لاحظ أنه يتم ترميز تماما مجمع الثاني من الجينوم النووي). وبالتالي ، يمكن أن طفرات في الجينوم الميتوكوندريا تسبب خلل في الجهاز التنفسي بسبب سلسلة الطفرات في مفارز من سلسلة مجمعات في الجهاز التنفسي.
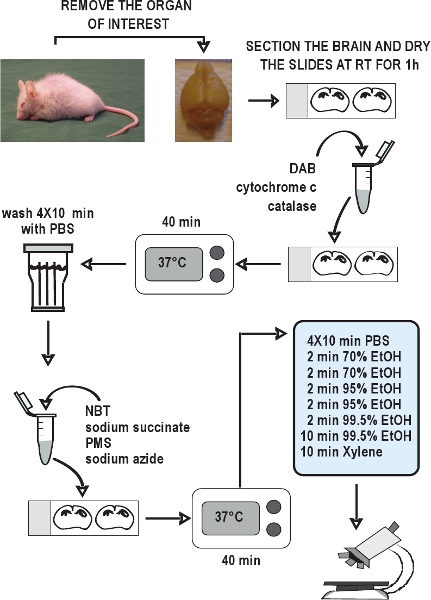
الشكل 2. الرسم البياني للمقايسة كوكس / SDH المزدوج العلامات النسيجية. تشريح أجهزة الفائدة ، وتجميد الأنسجة بسرعة على الثلج الجاف ، وتخزينها في -- 80 درجة مئوية. جمع المقاطع ناظم البرد والحفاظ على -- 20 درجة مئوية حتى الاستخدام. السماح ليجف المقاطع في الهواء في درجة حرارة الغرفة لمدة 1 ساعة. إعداد المتوسطة حضانة الكيمياء النسيجية كوكس ، وتطبيق ذلك على الشرائح ، واحتضان لمدة 40 دقيقة عند 37 درجة مئوية. يغسل المقاطع في برنامج تلفزيوني 4 مرات لمدة 10 دقيقة كل غسل. إعداد المتوسطة حضانة الكيمياء النسيجية SDH ، تطبيقه على سليقصر ، واحتضان مرة أخرى لمدة 40 دقيقة عند 37 درجة مئوية. يغسل المقاطع مرة أخرى في برنامج تلفزيوني ، يذوى في سلسلة من الإيثانول ، ومن ثم تحميل وساترة الشرائح. كوكس / SDH المزدوج المسمى المقاطع على استعداد لعرض تحت المجهر مشرق الميدان في غضون 1-2 ساعات.

الشكل 3 أمثلة ممثل كوكس / SDH المزدوج التوسيم. وصفت بالتسلسل أقسام الدماغ من النوع البري والشيخوخة قبل الأوان الفئران mutator و mtDNA لأنشطة كوكس وSDH. وقد ظهر نشاط عادي كوكس (المشار إليها بواسطة اللون البني الداكن) في قرن آمون من الفئران البرية من نوع (اليسار) : (200 ميكرون شريط مقياس). تم الكشف عن أوجه القصور كوكس (المشار إليها باللون الأزرق) في قرن آمون من الفئران mutator و mtDNA (الوسط واليمين). كان هناك مزيد من الانخفاض في النشاط كوكس بنسبة 46 أسابيع من العمر في الفئران mutator و mtDNA ، مما يشير إلى تفاقم الخلل واسع النطاق للسلسلة في الجهاز التنفسي. لاحظ ميتوسبب الخلل في chondrial و mtDNA mutator الفئران 12 من مستويات عالية من الطفرات نقطة و mtDNA فضلا عن زيادة مستويات الحذف الخطية 5.

الشكل 4. أمثلة من غير الملائم كوكس / SDH المزدوج التوسيم. وصفت بالتسلسل أقسام الدماغ من الفئران من النوع البري للأنشطة كوكس وSDH. (شريط القياس : 200 ميكرون) أدى عدم كفاية حضانة مرات (10 و 25 دقيقة) للمظاهرة النشاط كوكس في ترسب خفض رد الفعل الناتج البني DAB ، بالمقارنة مع فترة حضانة لمدة 40 دقيقة (يسار ووسط). أوقات حضانة تقصير سمح لتشكيل المنتج الأزرق نهاية formazan خلال حضانة SDH ، مما يوحي بشكل مضلل وجود خلايا مع القصور كوكس. Coverslipping الشرائح خلال حضانة كوكس أسفرت أيضا عن تشكيل غير دقيقة وترسب من رد فعل DABايون المنتج (يمين).
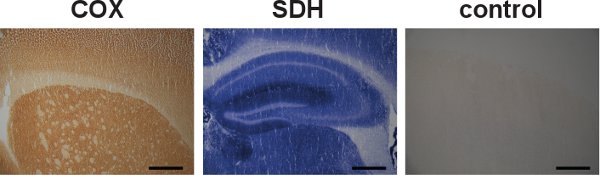
الشكل 5. أنا ndividual كوكس SDH ووضع العلامات والسيطرة النوعية. وصفت بشكل منفصل من أقسام الدماغ من النوع البري الفئران لأنشطة كوكس والمحددات ، وأشارت حسب اللون البني الداكن واللون الأزرق ، على التوالي (يسار ووسط). بالرغم من أنه يمكن كوكس والأنشطة SDH المسمى بشكل فردي ، أثبت التوسيم متتابعة ليكون من المفيد في تحديد الخلايا التي تحتوي على ضعف الميتوكوندريا. وأظهر مثال على السيطرة النوعية للأنشطة كوكس وSDH في الدماغ من ماوس البرية من نوع غياب العلامات (يمين). (شريط القياس : 200 ميكرون)
Discussion
مجتمعة كوكس / SDH النسيجية طريقة تمكن من الخلايا التصور مع ضعف الميتوكوندريا. هذه التقنية ، مع دراسات في وقت مبكر يعود إلى عام 1968 ، لا يزال يتمتع بشعبية ، مع العديد من معتبرا انه "المعيار الذهبي" لتحديد أمراض الميتوكوندريا في المرضى 14،19،26،27. الآن أنها كثيرا م?...
Disclosures
الإعلان عن أي تضارب في المصالح.
Acknowledgements
وأيد هذا العمل من قبل المعهد الوطني للشيخوخة (AG04418) ، المعهد الوطني لتعاطي المخدرات ، والمعهد الوطني للصحة من معهد كارولينسكا برنامج الشراكات العليا ، معهد كارولينسكا ، مجلس البحوث السويدية والسويدية كهربائية الدماغ ، والسويدية مؤسسة الدماغ. شكرا جزيلا لKarlen والدكتور ماتياس Coppotelli جوزيبي للحصول على الدعم الخلاق مع الشكل 1 و 2 ، على التوالي ؛ كارين Pernold للحصول على المساعدة التقنية ، والدكاترة. باري ج. هوفر ، لارس أولسون ، ونيلز لارسون ، غوران لنصائح مفيدة كثيرا والمناقشة.
Materials
| اسم الكاشف | شركة | فهرس العدد | تعليق (اختياري) |
| الثلج الجاف | AGA AB الغاز | كتلة النموذج | |
| Isopentane (2 - methylbutane) | سيغما الدريخ | 277258 CAS : 78-78-4 | |
| Cyrostat تضمين الحل | ساكورا Finetek | الأنسجة تك 4583 | |
| ناظم البرد | Microm | Microm النموذجي جلالة 500M | |
| الشرائح | الحرارية العلمية | سوبر بلس فروست منزل جلاسر J1800AMWZ | |
| تغطية النظارات البورسليكات الزجاج | VWR الدولية | 16004-098 | 24 × 50 مم |
| مرشح ورقة | Munktell تصفية AB | جودة : 1350 مقالةرقم : 242 001 | 430 X 430 مم |
| 3،3 '- diaminobenzidine tetrahydrochloride (DAB) | سيغما الدريخ | سيغما النظام الركيزة السائل ، D7304 | |
| ج السيتوكروم (النوع الثالث ، من القلب الخيول) | سيغما الدريخ | C2506 CAS : 9007-43-6 | |
| الكاتلاز البقري (من الكبد) | سيغما الدريخ | C9322 CAS : 9001-05-2 | |
| زرقة النتروتترازوليوم (NBT) | سيغما الدريخ | N6876 CAS : 298-83-9 | |
| سكسينات الصوديوم | سيغما الدريخ | S2378 CAS : 6106-21-4 | |
| Phenazine methosulfate (PMS) | سيغما الدريخ | P9625 CAS : 299-11-6 | PMS حساس الضوء. درع من الضوء. |
| أزيد الصوديوم | سيغما الدريخ | S8032 CAS : 26628-22-8 | |
| الزيلين | VWR الدولية | EM - XX0060 - 4 | |
| Entellan | VWR الدولية | 100503-870 | |
| المالونات (حمض المالونيك) | سيغما الدريخ | M1296 CAS : 141-82-2 |
References
- Larsson, N. G. Somatic mitochondrial DNA mutations in mammalian aging. Annu. Rev. Biochem. 79, 683-706 (2010).
- Cottrell, D. A. Role of mitochondrial DNA mutations in disease and aging. Ann. NY Acad. Sci. 908, 199-207 (2000).
- Harman, D. The biologic clock: the mitochondria. J. Am. Geriatr. Soc. 20, 145-147 (1972).
- Wallace, D. C. Mitochondrial genetics - a paradigm for aging and degenerative diseases. Science. 256, 628-632 (1992).
- Trifunovic, A. Premature ageing in mice expressing defective mitochondrial DNA polymerase. Nature. 429, 417-423 (2004).
- Ameur, A. Ultra-deep sequencing of mouse mitochondrial DNA: mutational patterns and their origins. PLoS Genet. 7, e1002028-e1002028 (2011).
- Safdar, A. Endurance exercise rescues progeroid aging and induces systemic mitochondrial rejuvenation in mtDNA mutator mice. Proc. Natl. Acad. Sci. U. S. A. 108, 4135-4140 (2011).
- DiMauro, S., Bonilla, E., Zeviani, M., Nakagawa, M., DeVivo, D. C. Mitochondrial myopathies. Ann. Neurol. 17, 521-538 (1985).
- Old, S. L., Johnson, M. A. Methods of microphotometric assay of succinate dehydrogenase and cytochrome c oxidase activities for use on human skeletal muscle. Histochem. J. 21, 545-555 (1989).
- Chaturvedi, R. K. Impaired PGC-1alpha function in muscle in Huntington's disease. Hum. Mol. Genet. 18, 3048-3065 (2009).
- Edgar, D. Random point mutations with major effects on protein-coding genes are the driving force behind premature aging in mtDNA mutator mice. Cell. Metab. 10, 131-138 (2009).
- Ross, J. M. High brain lactate is a hallmark of aging and caused by a shift in the lactate dehydrogenase A/B ratio. Proc. Natl. Acad. Sci. U. S. A. 107, 20087-20092 (2010).
- Crugnola, V. Mitochondrial respiratory chain dysfunction in muscle from patients with amyotrophic lateral sclerosis. Arch. Neurol. 67, 849-854 (2010).
- Nonaka, I. Muscle pathology in cytochrome c oxidase deficiency. Acta. Neuropathol. 77, 152-160 (1988).
- DiMauro, S. Mitochondrial encephalomyopathies. Neurol. Clin. 8, 483-506 (1990).
- Bonilla, E. New morphological approaches to the study of mitochondrial encephalomyopathies. Brain. Pathol. 2, 113-119 (1992).
- Brierley, E. J., Johnson, M. A., Lightowlers, R. N., James, O. F., Turnbull, D. M. Role of mitochondrial DNA mutations in human aging: implications for the central nervous system and muscle. Ann. Neurol. 43, 217-223 (1998).
- Borthwick, G. M., Johnson, M. A., Ince, P. G., Shaw, P. J., Turnbull, D. M. Mitochondrial enzyme activity in amyotrophic lateral sclerosis: implications for the role of mitochondria in neuronal cell death. Ann. Neurol. 46, 787-790 (1999).
- Gellerich, F. N. Mitochondrial respiratory rates and activities of respiratory chain complexes correlate linearly with heteroplasmy of deleted mtDNA without threshold and independently of deletion size. Biochim. Biophys. Acta. 1556, 41-52 (2002).
- Larsson, N. G. Mitochondrial transcription factor A is necessary for mtDNA maintenance and embryogenesis in mice. Nat. Genet. 18, 231-236 (1998).
- Ekstrand, M. I. Progressive parkinsonism in mice with respiratory-chain-deficient dopamine neurons. Proc. Natl. Acad. Sci. U. S. A. 104, 1325-1330 (2007).
- Seligman, A. M., Karnovsky, M. J., Wasserkrug, H. L., Hanker, J. S. Nondroplet ultrastructural demonstration of cytochrome oxidase activity with a polymerizing osmiophilic reagent, diaminobenzidine (DAB). J. Cell. Biol. 38, 1-14 (1968).
- Dubowitz, V., Brooke, M. Muscle Biopsy: A Modern Approach. , (1973).
- Cottrell, D. A. Cytochrome c oxidase deficient cells accumulate in the hippocampus and choroid plexus with age. Neurobiol. Aging. 22, 265-272 (2001).
- Blanco, C. E., Sieck, G. C., Edgerton, V. R. Quantitative histochemical determination of succinic dehydrogenase activity in skeletal muscle fibres. Histochem. J. 20, 230-243 (1988).
- Moraes, C. T., Ricci, E., Bonilla, E., DiMauro, S., Schon, E. A. The mitochondrial tRNA(Leu(UUR)) mutation in mitochondrial encephalomyopathy, lactic acidosis, and strokelike episodes (MELAS): genetic, biochemical, and morphological correlations in skeletal muscle. Am. J. Hum. Genet. 50, 934-949 (1992).
- Petruzzella, V. Extremely high levels of mutant mtDNAs co-localize with cytochrome c oxidase-negative ragged-red fibers in patients harboring a point mutation at nt 3243. Hum. Mol. Genet. 3, 449-454 (1994).
- Tulinius, M. H., Holme, E., Kristiansson, B., Larsson, N. G., Oldfors, A. Mitochondrial encephalomyopathies in childhood. I. Biochemical and morphologic investigations. J. Pediatr. 119, 242-250 (1991).
- Haas, R. H. The in-depth evaluation of suspected mitochondrial disease. Mol. Genet. Metab. 94, 16-37 (2008).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved