Un abonnement à JoVE est nécessaire pour voir ce contenu. Connectez-vous ou commencez votre essai gratuit.
Method Article
Visualisation de la fonction respiratoire mitochondriale utilisant Cytochrome C Oxydase / succinate déshydrogénase (COX / SDH) Double-histochimie étiquetage
Dans cet article
Résumé
Le cytochrome c oxydase / sodium déshydrogénase (COX / SDH) double étiquetage méthode permet la visualisation directe de l'ADN mitochondrial des déficits enzymatiques respiratoires dans des coupes de tissus congelés frais. C'est une technique simple histochimiques et est utile dans les enquêtes sur les maladies mitochondriales, le vieillissement et les troubles liés au vieillissement.
Résumé
ADN mitochondrial (ADNmt) des défauts sont une cause importante de maladie et peut expliquer le vieillissement et liées au vieillissement 1,2 altérations. La théorie mitochondriale du vieillissement suggère un rôle pour les mutations de l'ADNmt, ce qui peut altérer l'homéostasie bioénergétique et la fonction cellulaire, dans le processus de vieillissement 3. Une abondance de preuves ont été rassemblées à l'appui de cette théorie de 1,4, un exemple étant l'ADNmt mutator souris 5, mais le rôle précis des dégâts ADNmt dans le vieillissement n'est pas entièrement comprise 6,7.
Observer l'activité des enzymes respiratoires est une approche simple pour enquêter sur un dysfonctionnement mitochondrial. Complexe IV ou cytochrome c oxydase (COX), est essentielle pour la fonction mitochondriale. Les sous-unités catalytiques de la COX sont codées par l'ADNmt et sont essentiels pour l'assemblage du complexe (figure 1). Ainsi, la synthèse et la fonction sont largement basées sur l'ADN mitochondrial de l'intégrité 2.Bien que d'autres complexes respiratoires pourraient être étudiés, Complexes IV et II sont les mieux adaptés à l'examen histochimique 8,9. Complexe II ou succinate déshydrogénase (SDH), est entièrement codée par l'ADN nucléaire (figure 1), et son activité n'est généralement pas affecté par l'ADNmt altérée, bien qu'une augmentation pourrait indiquer la biogenèse mitochondriale 10-12. L'ADNmt déficience observée dans les maladies mitochondriales, le vieillissement et maladies liées au vieillissement amène souvent à la présence de cellules ayant une activité COX faible ou absente 2,12-14. Bien que les activités COX et SDH peuvent être étudiées individuellement, le double étiquetage séquentielle méthode de 15,16 s'est avéré être avantageux de localiser les cellules présentant un dysfonctionnement mitochondrial 12,17-21.
Beaucoup de constitutions optimale de l'essai ont été déterminés, tels que la concentration du substrat, les accepteurs d'électrons / donateurs, intermédiaire des transporteurs d'électrons, l'influence du pH, et la réaction tIME 9,22,23. 3,3 '-diaminobenzidine (DAB) est un donneur d'électrons efficace et fiable 22. Dans les cellules avec des inhibiteurs de la COX fonctionnement, la brune indamine polymère produit localiser dans crêtes mitochondriales et saturer les cellules 22. Ces cellules avec des inhibiteurs de la COX dysfonctionnel ne seront donc pas être saturé par le produit DAB, permettant la visualisation de l'activité SDH par réduction de nitrobleu de tétrazolium (NBT), un accepteur d'électrons, d'un produit formazan extrémité bleue 9,24. Cytochrome c et substrats de succinate de sodium sont ajoutés à normaliser les niveaux endogènes entre le contrôle et malades / mutant tissus 9. La catalase est ajoutée à titre de précaution pour éviter de possibles réactions du contaminant 9,22 activité peroxydase. Méthosulfate de phénazine (PMS), un transporteur d'électrons intermédiaire, est utilisé en conjonction avec l'azoture de sodium, un inhibiteur de la chaîne respiratoire, d'augmenter la formation des produits de réaction final 9,25. En dépit de cette informationtion, certains détails critiques qui affectent le résultat de ce dosage convenable simple, en plus des contrôles de spécificité et les progrès de la technique, n'ont pas encore été présenté.
Protocole
1. Préparation des tissus pour les cryosectioning
- Sacrifice de l'animal par dislocation cervicale ou décapitation, conformément au permis éthiques disponibles.
- Recueillir rapidement les tissus d'intérêt (par ex. Cerveau), et rapidement geler sur la glace sèche (tissus peut exiger la congélation dans l'isopentane ou propane réfrigéré à l'azote liquide pour obtenir la morphologie optimale). Tissus magasin dans du papier aluminium à -80 ° C jusqu'au moment de la section.
- Intégrer les tissus congelés en préparation pour cryosectioning.
- Recueillir des sections cryostat de 14 um à -21 ° C (peut-être besoin d'ajuster la température de ± 1-2 ° C). Dégel des sections sur des lames à l'aide de bloc de chauffage, et les diapositives magasin sans lamelles à -20 ° C jusqu'au moment de servir.
2. Histochimie COX
- Autoriser lames sécher à température ambiante pendant 1 heure. Mettez lames dans une chambre glisser-coloration avec du papier filtre humide, coupé en lanières. Pour obtenir consistenrésultats de t dans chaque expérience, il est recommandé de traiter un maximum de dix diapositives par expérience pour minimiser les retards.
- Préparer dans un DAB chimiques capuche 1X, 100 uM cytochrome c en 0,1 M de pH = 7,0. Vortex rapidement.
- Ajouter 2 ug bovins catalase (2 pg ml -1, soit environ 4 UI ml -1). Mélangez bien au vortex pour briser tous les grains de la catalase.
- Appliquer 150 à 200 pi de milieu d'incubation à chaque diapositive, utilisez la pointe de pipette pour répandre uniformément sur toutes les sections.
- Incuber les lames pendant 40 minutes à 37 ° C.
- Retirez l'excès de solution de la glisse. Laver les lames 4 fois, 10 minutes à chaque fois, dans 0,1 M de pH = 7,0.
- Retour diapositives de glisser-coloration de chambre avec des bandes de papier mouillé.
3. Histochimie SDH
- Préparer sous une hotte chimique 1,5 mM NBT, 130 mM de succinate de sodium, 0,2 mM PMS, et 1,0 mM d'azoture de sodium à 0,1 M de pH = 7,0. Prenez garde pour protéger lePMS de la lumière. Vortex rapidement.
- Appliquer 150 à 200 pi de milieu d'incubation à chaque diapositive, utilisez la pointe de pipette pour répandre uniformément sur toutes les sections.
- Incuber les lames pendant 40 minutes à 37 ° C.
- Retirez l'excès de solution de la glisse. Laver les lames 4 fois, 10 minutes à chaque fois, dans 0,1 M de pH = 7,0.
- Déshydrater les lames pendant 2 minutes dans les concentrations suivantes d'éthanol: 70%, 70%, 95%, 95%, à 99,5%. Puis laissez 10 minutes dans une étape supplémentaire de 99,5%.
- Placer les lames dans le xylène pendant 10 minutes. Monter avec Entellan et la lamelle. Laisser les lames sécher heures, la nuit, ou au moins 1-2 dans un endroit aéré.
4. Détermination de la dysfonction mitochondriale
- Le montant de la dysfonction mitochondriale est indiquée par la quantité de coloration au bleu cellulaire. À semi-quantifier ces montants, les lames doivent être codées et visualisés sous champ lumineux microscopie. Semi-quantification devrait être effectuée sur un store base en utilisant une échelle, par exemple de 0-4 (0, pas de coloration bleue; 4, seulement une coloration bleue). Il est préférable d'effectuer ce type de semi-quantification sur plusieurs sections à partir d'un sujet donné / animal pour calculer une valeur moyenne pour chaque sujet / animal.
- Les statistiques doivent être effectuées en utilisant un test non-paramétrique, tels que Mann-Whitney ou de Kruskal-Wallis.
5. Contrôles de spécificité appropriée
- Pour les contrôles de spécificité pour l'activité de COX, répéter «COX histochimie" étapes, et ajouter 2,5 mM d'azoture de sodium, un inhibiteur de la chaîne terminale des voies respiratoires.
- Pour les contrôles de spécificité pour l'activité SDH, répéter «SDH histochimie" étapes avec le retrait de succinate de sodium et l'addition de 50 mM malonate, un inhibiteur compétitif de la SDH.
- Lavez et déshydrater sections dans une série d'éthanol, puis monter et lamelle les diapositives que décrit dans les étapes 3.4 à 3.6.
6. Les résultats représentatifs:
tente »> Le régime global de la COX exemples représentatifs / SDH double étiquetage test histochimique est illustrée dans la Figure 2. appropriée des inhibiteurs de la COX / SDH double marquage histochimique de coupes de cerveau de type sauvage et vieillissement prématuré des souris mutantes ADNmt sont présentés dans la figure 3. La coloration brun foncé souris de type sauvage (figure 3, panneau de gauche) a montré une activité normale de COX. Cellules avec des déficiences de la chaîne respiratoire, indiquée par la coloration au bleu, ont été révélés dans 12 semaines chez des souris âgées mutator ADNmt, et ces carences est devenu plus répandue que les souris mutantes ADNmt âgés de 46 semaines (figure 3, centre et droite).Exemples de inappropriés COX / SDH double étiquetage dans les sections du cerveau à partir souris de type sauvage à cause de la COX étiquetage insuffisant sont présentés dans la figure 4. Temps d'incubation inadéquate pour la démonstration de l'activité de COX, ou en réduisant la disponibilité de l'oxygène moléculaire par la lame de lamelles pendant l'incubation, a entraîné une réduction des dépôts de la réaction DABproduit ionique, et donc permis la formation du produit formazan bleu pendant la fin de l'incubation SDH.
Activités COX et SDH peut aussi être étudiée séparément (Figure 5, gauche et centre), mais l'étiquetage séquentiel est utile pour identifier les cellules avec des déficiences COX, en raison de la formation du précipité bleu lors de l'incubation SDH (figure 3, le centre et droite). Spécificité de contrôle pour les activités de la COX et SDH peut également être effectué (figure 5, à droite).
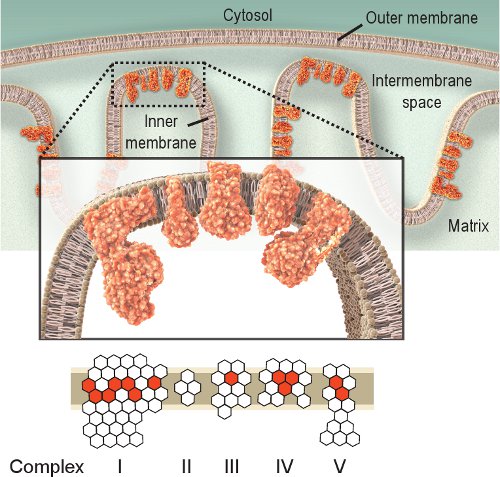
Figure 1. Respiratoire mitochondriale Complexes IV. La chaîne respiratoire mitochondriale est située dans la membrane interne et comprend cinq complexes. Le but de la chaîne respiratoire est de transporter des électrons à partir complexe I à IV et, ce faisant, il crée un gradient de protons à travers la membrane interne utilisé par le complexe V (ATPase) pour produire de l'ATP. Rouge represe hexagonessous-unités codées par l'ADN mitochondrial NT. Hexagones blancs représentent les sous-unités codées par l'ADN nucléaire (à noter que complexe II est entièrement codée par le génome nucléaire). Ainsi, des mutations dans le génome mitochondrial pourrait provoquer un dysfonctionnement de la chaîne respiratoire due à des mutations dans les sous-unités des complexes de la chaîne respiratoire.
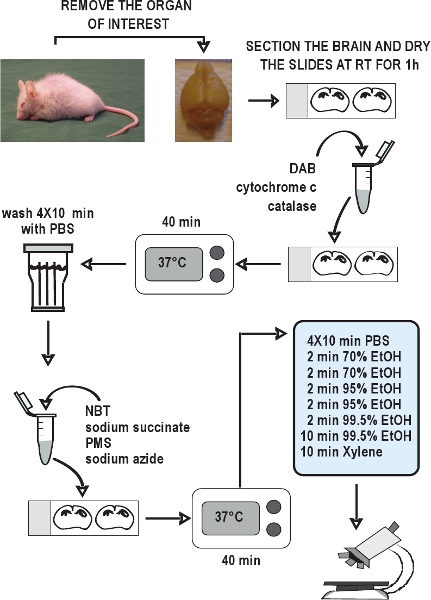
Figure 2. Organigramme du dosage de la COX / SDH double marquage histochimique. Disséquer les organes d'intérêt, rapidement geler les tissus sur la glace sèche, et les stocker à - 80 ° C. Recueillir des sections de cryostat et de garder à - 20 ° C jusqu'à utilisation. Autoriser les sections à l'air sec à température ambiante pendant 1 heure. Préparer le milieu d'incubation de la COX histochimie, l'appliquer à la glisse, et incuber pendant 40 minutes à 37 ° C. Laver les coupes dans le PBS 4 fois pendant 10 minutes à chaque lavage. Préparer le milieu d'incubation pour histochimie SDH, l'appliquer à la SLIdes, et à nouveau incuber pendant 40 minutes à 37 ° C. Laver les coupes à nouveau dans du PBS, déshydrater dans une série d'éthanol, puis monter et lamelle les diapositives. La COX / SDH doublement marquée sections sont prêtes à vue sous la microscopie à champ lumineux en 1-2 heures.

Figure 3. Des exemples représentatifs de la COX / SDH double étiquetage. Coupes de cerveau de type sauvage et vieillissement prématuré des souris mutantes ont été ADNmt séquentielle étiquetés pour les activités de la COX et SDH. (Barre d'échelle: 200. Um) L'activité normale de COX (indiqué par une couleur brun foncé) a été montré dans l'hippocampe de souris de type sauvage (à gauche). Déficiences COX (indiqué par la couleur bleue) ont été révélés dans l'hippocampe de souris mutantes ADNmt (centre et droite). Il y avait une nouvelle baisse de l'activité COX de 46 semaines d'âge chez les souris mutantes ADNmt, suggérant l'exacerbation généralisée de la dysfonction de la chaîne respiratoire. Le observés mitoun dysfonctionnement de l'ADNmt chondrial mutator souris 12 est causé par des niveaux élevés de mutations ponctuelles ADNmt ainsi que des niveaux accrus de suppressions linéaire 5.

Figure 4. Exemples de inappropriés COX / SDH double étiquetage. Coupes de cerveau de souris de type sauvage ont été étiquetés de manière séquentielle pour les activités de la COX et SDH. (Barre d'échelle: 200. Um) temps d'incubation insuffisant (10 et 25 minutes) pour la démonstration de l'activité de COX a entraîné une réduction des dépôts de produit de réaction marron DAB, par rapport à la période d'incubation de 40 minutes (à gauche et au centre). Le temps d'incubation a permis de raccourcir la formation du produit formazan bleu pendant la fin de l'incubation SDH, trompeusement suggérant la présence de cellules présentant des déficiences COX. Lamelles les diapositives pendant l'incubation Cox a également abouti à la formation inexacte et le dépôt de la réaction DABions produits (à droite).
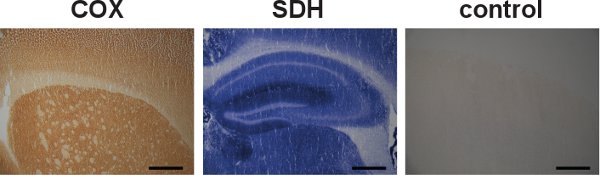
Figure 5. Je ertaines COX et de l'étiquetage et le contrôle SDH spécificité. Coupes de cerveau de souris de type sauvage ont été séparément étiquetés pour les activités de la COX et SDH, indiqué par la couleur brun foncé et la couleur bleue, respectivement (gauche et centre). Bien que les activités COX et SDH peuvent être étiquetées individuellement, l'étiquetage séquentielle s'est révélée être avantageuse appréciée en localisant les cellules présentant un dysfonctionnement mitochondrial. Un exemple d'un contrôle de spécificité pour les activités de la COX et SDH dans le cerveau d'une souris de type sauvage a montré l'absence d'étiquetage (à droite). (Barre d'échelle: 200. Um)
Discussion
Le combiné COX / SDH méthode histochimique permet la visualisation des cellules présentant un dysfonctionnement mitochondrial. Cette technique, avec les premières études remontent à 1968, reste populaire, avec beaucoup estiment qu'il s'agit de «gold standard» pour identifier les maladies mitochondriales chez les patients 14,19,26,27. Il est maintenant fréquemment utilisée pour étudier l'ADNmt mutation conduit le vieillissement et le vieillissement des troubles liés 12,13,18,20,21,...
Déclarations de divulgation
Pas de conflits d'intérêt déclarés.
Remerciements
Ce travail a été soutenu par le National Institute of Aging (AG04418), le National Institute on Drug Abuse, Institut national de santé-Karolinska Institutet Graduate Programme de partenariats, Karolinska Institutet, Conseil de recherche suédois, Brain Power suédois, et la Fondation du cerveau suédois. Un grand merci à Mattias Karlen et le Dr Giuseppe Coppotelli pour le soutien créatif avec la figure 1 et 2, respectivement; Karin Pernold d'assistance technique, et les Drs. Barry J. Hoffer, Lars Olson, et Nils-Göran Larsson pour des conseils utiles et bien des discussions.
matériels
| Nom du réactif | Société | Numéro de catalogue | Commentaires (optionnel) |
| Dry Ice | AGA Gas AB | sous forme de bloc | |
| L'isopentane (2-méthylbutane) | Sigma-Aldrich | 277258 CAS: 78-78-4 | |
| Solution intégrant Cyrostat | Sakura Finetek | Tissue Tek 4583 | |
| Cryostat | Microm | Microm Modèle HM 500M | |
| Diapositives | Thermo Scientific | Super gel plus Menzel Gläser J1800AMWZ | |
| Lunettes de couverture Verre borosilicate | VWR International | 16004-098 | 24 x 50 mm |
| Papier filtre | Munktell Filtre AB | Qualité: 1350 L'articleNombre: 242 001 | 430 x 430 mm |
| 3,3 '-diaminobenzidine tétrachlorhydrate (DAB) | Sigma-Aldrich | Système Sigma substrat liquide, D7304 | |
| Cytochrome C (type III, à partir du cœur équin) | Sigma-Aldrich | C2506 CAS: 9007-43-6 | |
| Bovine catalase (de foie) | Sigma-Aldrich | C9322 CAS: 9001-05-2 | |
| Nitrobleu de tétrazolium (NBT) | Sigma-Aldrich | N6876 CAS: 298-83-9 | |
| Succinate de sodium | Sigma-Aldrich | S2378 CAS: 6106-21-4 | |
| Méthosulfate de phénazine (PMS) | Sigma-Aldrich | P9625 CAS: 299-11-6 | PMS est sensible à la lumière. Bouclier de la lumière. |
| L'azoture de sodium | Sigma-Aldrich | S8032 CAS: 26628-22-8 | |
| Xylène | VWR International | EM-XX0060-4 | |
| Entellan | VWR International | 100503-870 | |
| Malonate (Acide malonique) | Sigma-Aldrich | M1296 CAS: 141-82-2 |
Références
- Larsson, N. G. Somatic mitochondrial DNA mutations in mammalian aging. Annu. Rev. Biochem. 79, 683-706 (2010).
- Cottrell, D. A. Role of mitochondrial DNA mutations in disease and aging. Ann. NY Acad. Sci. 908, 199-207 (2000).
- Harman, D. The biologic clock: the mitochondria. J. Am. Geriatr. Soc. 20, 145-147 (1972).
- Wallace, D. C. Mitochondrial genetics - a paradigm for aging and degenerative diseases. Science. 256, 628-632 (1992).
- Trifunovic, A. Premature ageing in mice expressing defective mitochondrial DNA polymerase. Nature. 429, 417-423 (2004).
- Ameur, A. Ultra-deep sequencing of mouse mitochondrial DNA: mutational patterns and their origins. PLoS Genet. 7, e1002028-e1002028 (2011).
- Safdar, A. Endurance exercise rescues progeroid aging and induces systemic mitochondrial rejuvenation in mtDNA mutator mice. Proc. Natl. Acad. Sci. U. S. A. 108, 4135-4140 (2011).
- DiMauro, S., Bonilla, E., Zeviani, M., Nakagawa, M., DeVivo, D. C. Mitochondrial myopathies. Ann. Neurol. 17, 521-538 (1985).
- Old, S. L., Johnson, M. A. Methods of microphotometric assay of succinate dehydrogenase and cytochrome c oxidase activities for use on human skeletal muscle. Histochem. J. 21, 545-555 (1989).
- Chaturvedi, R. K. Impaired PGC-1alpha function in muscle in Huntington's disease. Hum. Mol. Genet. 18, 3048-3065 (2009).
- Edgar, D. Random point mutations with major effects on protein-coding genes are the driving force behind premature aging in mtDNA mutator mice. Cell. Metab. 10, 131-138 (2009).
- Ross, J. M. High brain lactate is a hallmark of aging and caused by a shift in the lactate dehydrogenase A/B ratio. Proc. Natl. Acad. Sci. U. S. A. 107, 20087-20092 (2010).
- Crugnola, V. Mitochondrial respiratory chain dysfunction in muscle from patients with amyotrophic lateral sclerosis. Arch. Neurol. 67, 849-854 (2010).
- Nonaka, I. Muscle pathology in cytochrome c oxidase deficiency. Acta. Neuropathol. 77, 152-160 (1988).
- DiMauro, S. Mitochondrial encephalomyopathies. Neurol. Clin. 8, 483-506 (1990).
- Bonilla, E. New morphological approaches to the study of mitochondrial encephalomyopathies. Brain. Pathol. 2, 113-119 (1992).
- Brierley, E. J., Johnson, M. A., Lightowlers, R. N., James, O. F., Turnbull, D. M. Role of mitochondrial DNA mutations in human aging: implications for the central nervous system and muscle. Ann. Neurol. 43, 217-223 (1998).
- Borthwick, G. M., Johnson, M. A., Ince, P. G., Shaw, P. J., Turnbull, D. M. Mitochondrial enzyme activity in amyotrophic lateral sclerosis: implications for the role of mitochondria in neuronal cell death. Ann. Neurol. 46, 787-790 (1999).
- Gellerich, F. N. Mitochondrial respiratory rates and activities of respiratory chain complexes correlate linearly with heteroplasmy of deleted mtDNA without threshold and independently of deletion size. Biochim. Biophys. Acta. 1556, 41-52 (2002).
- Larsson, N. G. Mitochondrial transcription factor A is necessary for mtDNA maintenance and embryogenesis in mice. Nat. Genet. 18, 231-236 (1998).
- Ekstrand, M. I. Progressive parkinsonism in mice with respiratory-chain-deficient dopamine neurons. Proc. Natl. Acad. Sci. U. S. A. 104, 1325-1330 (2007).
- Seligman, A. M., Karnovsky, M. J., Wasserkrug, H. L., Hanker, J. S. Nondroplet ultrastructural demonstration of cytochrome oxidase activity with a polymerizing osmiophilic reagent, diaminobenzidine (DAB). J. Cell. Biol. 38, 1-14 (1968).
- Dubowitz, V., Brooke, M. Muscle Biopsy: A Modern Approach. , (1973).
- Cottrell, D. A. Cytochrome c oxidase deficient cells accumulate in the hippocampus and choroid plexus with age. Neurobiol. Aging. 22, 265-272 (2001).
- Blanco, C. E., Sieck, G. C., Edgerton, V. R. Quantitative histochemical determination of succinic dehydrogenase activity in skeletal muscle fibres. Histochem. J. 20, 230-243 (1988).
- Moraes, C. T., Ricci, E., Bonilla, E., DiMauro, S., Schon, E. A. The mitochondrial tRNA(Leu(UUR)) mutation in mitochondrial encephalomyopathy, lactic acidosis, and strokelike episodes (MELAS): genetic, biochemical, and morphological correlations in skeletal muscle. Am. J. Hum. Genet. 50, 934-949 (1992).
- Petruzzella, V. Extremely high levels of mutant mtDNAs co-localize with cytochrome c oxidase-negative ragged-red fibers in patients harboring a point mutation at nt 3243. Hum. Mol. Genet. 3, 449-454 (1994).
- Tulinius, M. H., Holme, E., Kristiansson, B., Larsson, N. G., Oldfors, A. Mitochondrial encephalomyopathies in childhood. I. Biochemical and morphologic investigations. J. Pediatr. 119, 242-250 (1991).
- Haas, R. H. The in-depth evaluation of suspected mitochondrial disease. Mol. Genet. Metab. 94, 16-37 (2008).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon