É necessária uma assinatura da JoVE para visualizar este conteúdo. Faça login ou comece sua avaliação gratuita.
Method Article
Visualização da função respiratória mitocondrial usando Citocromo C Desidrogenase Oxidase / Succinato (COX / SDH) Histoquímica rotulagem dupla
Neste Artigo
Resumo
O citocromo c oxidase desidrogenase / sódio (COX / SDH) método duplo-rotulagem permite a visualização direta de deficiências enzimáticas mitocondriais respiratória em seções de tecido fresco congelado. Esta é uma técnica simples histoquímica e é útil na investigação de doenças mitocondriais, envelhecimento, envelhecimento e distúrbios relacionados.
Resumo
DNA mitocondrial (mtDNA) defeitos são uma importante causa de doença e pode ser a base de envelhecimento e relacionadas ao envelhecimento 1,2 alterações. A teoria mitocondrial do envelhecimento sugere um papel para mutações do mtDNA, que pode alterar a homeostase bioenergética e função celular, no processo de envelhecimento 3. A riqueza de evidências foram compiladas em apoio a este 1,4 teoria, a exemplo do mtDNA modificador do mouse 5, mas o papel preciso de mtDNA danos do envelhecimento não é totalmente compreendido 6,7.
Observando a atividade das enzimas respiratórias é uma abordagem simples para investigar a disfunção mitocondrial. Complexo IV ou citocromo c oxidase (COX), é essencial para a função mitocondrial. As subunidades catalítica da COX são codificadas por mtDNA e são essenciais para a montagem do complexo (Figura 1). Assim, a síntese adequada e função são em grande parte com base na integridade mtDNA 2.Apesar de outros complexos respiratórios poderiam ser investigados, Complexos IV e II são as mais passíveis de exame histoquímico 8,9. Complexo II ou succinato desidrogenase (SDH), é inteiramente codificada pelo DNA nuclear (Figura 1), e sua atividade normalmente não é afetado por deficiência mtDNA, apesar de um aumento pode indicar biogênese mitocondrial 10-12. O mtDNA prejudicada observado em doenças mitocondriais, envelhecimento e doenças relacionadas à idade, muitas vezes leva à presença de células com baixa ou ausente a atividade da COX 2,12-14. Embora as atividades de COX e SDH podem ser investigados individualmente, o método duplo-rotulagem seqüencial 15,16 provou ser vantajoso para localizar células com disfunção mitocondrial 12,17-21.
Muitas das constituições ótima do ensaio foram determinadas, como a concentração do substrato, receptores de elétrons / doadores, intermediário portadores de elétrons, a influência do pH e de reação time 9,22,23. 3,3 '-diaminobenzidina (DAB) é um doador de elétrons eficaz e confiável 22. Em células com funcionamento COX, o indamine marrom produto polímero irá localizar em cristas mitocondriais e saturar as células 22. Essas células com COX disfuncionais, portanto, não ser saturado pelo produto DAB, permitindo a visualização da atividade SDH pela redução da nitroblue tetrazólio (NBT), um receptor de elétrons, a um produto azul final formazan 9,24. Citocromo c e substratos succinato de sódio são adicionados para normalizar os níveis endógenos entre controle e doentes / mutante tecidos 9. Catalase é adicionado como uma precaução para evitar possíveis reações contaminação da atividade da peroxidase 9,22. Metasulfato fenazina (PMS), uma transportadora de elétrons intermediário, é utilizado em conjunto com azida de sódio, um inibidor da cadeia respiratória, para aumentar a formação dos produtos da reacção final de 9,25. Apesar desta informarção, alguns detalhes críticos que afetam o resultado deste ensaio seemly simples, além de controles especificidade e avanços na técnica, ainda não foram apresentados.
Protocolo
1. Preparação de tecidos para cryosectioning
- Sacrificar o animal por qualquer deslocamento cervical ou a decapitação, em conformidade com a ética permitir disponíveis.
- Recolher rapidamente os tecidos de interesse (por exemplo. Cérebro), e rapidamente congelar em gelo seco (tecidos podem exigir congelamento em isopentano ou propano refrigerado com nitrogênio líquido para obter a morfologia ideal). Loja de tecidos em folha de alumínio a -80 ° C até que esteja pronto para a seção.
- Incorporar tecidos congelados em preparação para cryosectioning.
- Coletar seções 14 mícrons criostato a -21 ° C (pode ser necessário para ajustar a temperatura ± 02/01 ° C). Seções descongelar em slides usando bloco de aquecimento, e slides loja sem lamínulas a -20 ° C até que esteja pronto para uso.
2. Histoquímica COX
- Permitir slides para secar em temperatura ambiente por 1 hora. Coloque slides em uma câmara de corrediça mancha com papel de filtro molhado, cortado em tiras. Para obter consistenresultados t em cada experimento, recomenda-se a processo de um máximo de dez slides por experimento para minimizar os atrasos.
- Prepare sob um capuz químico 1X DAB, 100 mM citocromo c em 0,1 M PBS pH = 7,0. Vortex rapidamente.
- Adicionar 2 g de bovinos catalase (2 mg ml -1 ou aproximadamente 4 UI ml -1). Misturar bem em vórtice para quebrar todos os grãos de catalase.
- Aplicar 150-200 mL de meio de incubação para cada slide, use pipeta de espalhar uniformemente em todas as seções.
- Incubar as lâminas por 40 minutos a 37 ° C.
- Remover excesso de solução da slides. Lavagem das lâminas 4 vezes, 10 minutos de cada vez, em 0,1 M PBS pH = 7,0.
- Retornar slides para deslizar coloração de câmara com tiras de papel molhado.
3. Histoquímica SDH
- Prepare sob um capuz químico 1,5 mM NBT, 130 mM succinato de sódio, 0,2 mM PMS, e 1,0 mM de azida de sódio em 0,1 M PBS pH = 7,0. Tome cuidado para proteger aPMS da luz. Vortex rapidamente.
- Aplicar 150-200 mL de meio de incubação para cada slide, use pipeta de espalhar uniformemente em todas as seções.
- Incubar as lâminas por 40 minutos a 37 ° C.
- Remover excesso de solução da slides. Lavagem das lâminas 4 vezes, 10 minutos de cada vez, em 0,1 M PBS pH = 7,0.
- Desidratar as lâminas durante 2 minutos nas seguintes concentrações de etanol: 70%, 70%, 95%, 95%, 99,5%. Em seguida, permitir que 10 minutos em uma etapa adicional de 99,5%.
- Coloque as lâminas em xilol por 10 minutos. Montar com Entellan e lamínula. Permitir que os slides para secar horas durante a noite, ou pelo menos 1-2 em uma área ventilada.
4. Determinação de disfunção mitocondrial
- A quantidade de disfunção mitocondrial é indicado pela quantidade de coloração azul celular. Para semi-quantificar estes valores, slides deve ser codificado e visualizados sob microscopia de campo brilhante. Semi-quantificação devem ser realizados em um cego base utilizando uma escala, por exemplo, 0-4 (0, coloração azul não; 4, apenas coloração azul). É melhor realizar esse tipo de semi-quantificação de várias seções de um determinado assunto / animal para calcular um valor médio para cada disciplina / animal.
- Estatísticas devem ser realizados através de um teste não-paramétrico, como Mann-Whitney ou Kruskal-Wallis.
5. Controles adequados especificidade
- Para controles especificidade para a atividade COX, repita "histoquímica COX" passos e adicionar 2,5 mM de azida de sódio, um inibidor da cadeia respiratória terminal.
- Para controles especificidade para a atividade SDH, repita "histoquímica SDH" passos com a remoção de succinato de sódio ea adição de 50 mM malonato, um inibidor competitivo da SDH.
- Lavar e desidratar seções em uma série de etanol, e depois montar e lamínula os slides conforme descrito nas etapas 3,4-3,6.
6. Resultados representativos:
tenda "> O esquema geral dos exemplos COX / SDH duplo rotulagem ensaio histoquímico é ilustrada na Figura 2. Representante da histoquímica COX / SDH duplo rotulagem adequada no cérebro de seções do tipo selvagem e camundongos mutator prematuramente envelhecimento mtDNA são mostrados na Figura 3. A coloração marrom escuro em camundongos selvagens (Figura 3, painel da esquerda) mostrou atividade COX normal. células com deficiências da cadeia respiratória, indicada pela coloração azul, foram revelados em 12 semanas de idade ratos mutator mtDNA, e essas deficiências se tornou mais difundido como ratos mutator mtDNA idade para 46 semanas (Figura 3, centro e painel da direita).Exemplos de inadequado COX / SDH dupla rotulagem em seções do cérebro de camundongos selvagens, devido à rotulagem COX insuficiente são mostrados na Figura 4. Tempo de incubação insuficiente para a demonstração da atividade da COX, ou reduzir a disponibilidade de oxigênio molecular pela cobertura das deslize durante a incubação, resultou em uma redução da deposição de reagir DABíon produto e, assim, permitido para a formação do produto final formazan azul durante a incubação SDH.
Atividades COX e SDH também pode ser investigado separadamente (Figura 5, esquerda e centro), no entanto, a rotulagem seqüencial é útil na identificação de células com deficiências COX, devido à formação do precipitado azul durante a incubação SDH (Figura 3, centro e à direita). Controles especificidade para COX atividades e SDH também pode ser feito (Figura 5, direita).
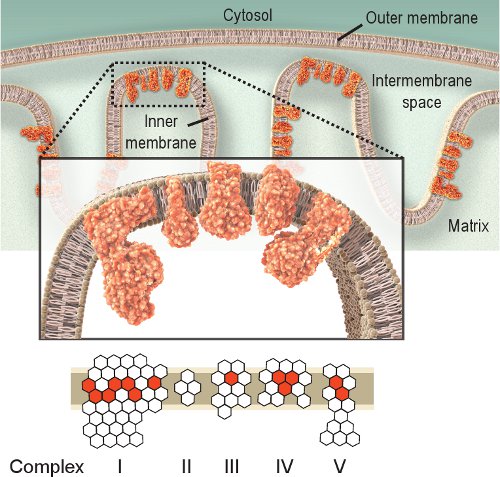
Figura 1. Respiratória mitocondrial Complexos IV. A cadeia respiratória mitocondrial está localizado dentro da membrana interna e inclui cinco complexos. A finalidade da cadeia respiratória é transportar elétrons do complexo I a IV e ao fazê-lo cria um gradiente de prótons através da membrana interna usada por V Complex (ATPase) para produzir ATP. Represe hexágonos vermelhosubunidades nt codificadas por mtDNA. Hexágonos brancos representam subunidades codificadas pelo DNA nuclear (note que o complexo II é completamente codificada a partir do genoma nuclear). Assim, mutações no genoma mitocondrial pode causar disfunção da cadeia respiratória devido a mutações nas subunidades dos complexos da cadeia respiratória.
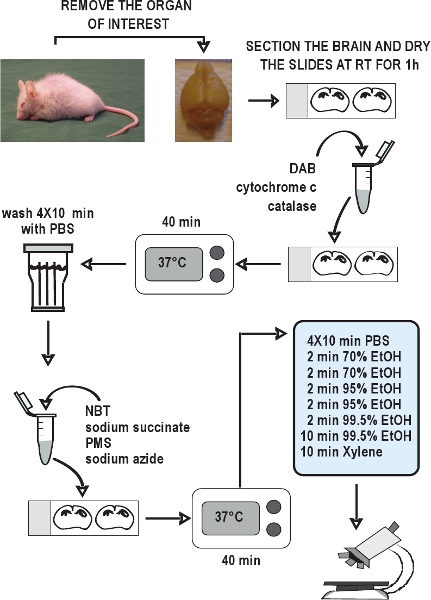
Figura 2. Fluxograma do ensaio COX / SDH duplo rotulagem histoquímica. Dissecar os órgãos de interesse, rapidamente congelar os tecidos em gelo seco, e guarde-a - 80 ° C. Coletar seções criostato e manter a - 20 ° C até usar. Permitir seções para ar seco em temperatura ambiente por 1 hora. Preparar o meio de incubação para histoquímica COX, aplicá-lo à slides, e incubar por 40 minutos a 37 ° C. Lavar as seções em PBS 4 vezes por 10 minutos cada lavagem. Preparar o meio de incubação para histoquímica SDH, aplicá-la ao slides, e novamente incubar por 40 minutos a 37 ° C. Lavar as seções novamente em PBS, desidratar em série etanólica, e depois montar e lamínula os slides. A COX / SDH duplo rotulados seções estão prontos para ver brilhantes sob microscopia de campo dentro de 1-2 horas.

Figura 3. Exemplos representativos de COX / SDH dupla rotulagem. Seções do cérebro de tipo selvagem e camundongos mutator prematuramente envelhecimento mtDNA foram seqüencialmente marcados para as atividades COX e SDH. (Bar da escala: 200. Mm) a atividade da COX Normal (indicada pela cor marrom escuro) foi mostrado no hipocampo de camundongos selvagens (esquerda). Deficiências COX (indicado pela cor azul) foram revelados no hipocampo de ratos mtDNA mutator (centro e direita). Houve uma redução ainda maior na atividade da COX por 46 semanas de idade em ratos mutator mtDNA, sugerindo exacerbação da disfunção generalizada da cadeia respiratória. O mito observadodisfunção mitocondrial em ratos mtDNA mutator 12 é causada por altos níveis de mutações pontuais mtDNA, bem como aumento dos níveis de deleções linear 5.

Figura 4. Exemplos de inadequado COX / SDH dupla rotulagem. Seções do cérebro de camundongos selvagens foram seqüencialmente marcados para as atividades COX e SDH. (Bar da escala: 200. Mm) tempos de incubação inadequada (10 e 25 minutos) para a demonstração da atividade da COX resultou em uma redução de deposição do produto da reação DAB marrom, em comparação com o tempo de incubação de 40 minutos (esquerda e centro). Os tempos de incubação reduzidos permitiu a formação do produto final formazan azul durante a incubação SDH, enganosamente, sugerindo a presença de células com deficiências COX. Cobertura das lâminas durante a incubação COX também resultou na formação imprecisas e deposição do reagir DABíon produto (direita).
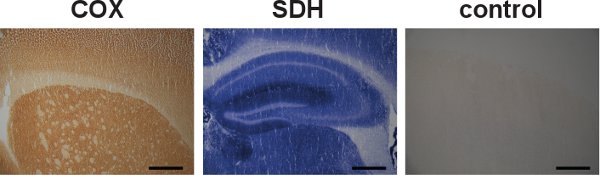
Figura 5. I INDIVIDUAIS COX e SDH rotulagem e controle de especificidade. Seções do cérebro de camundongos selvagens foram separadamente rotulado para COX e SDH atividades, indicado pela cor castanho escuro ea cor azul, respectivamente (esquerda e centro). Embora as atividades de COX e SDH podem ser individualmente rotulados, os rótulos seqüencial mostrou-se vantajosa em localizar células com disfunção mitocondrial. Um exemplo de um controle de especificidade para COX e SDH atividades no cérebro de um rato do tipo selvagem mostrou falta de rotulagem (direita). (Bar da escala: 200. Mm)
Discussão
O método de COX / SDH combinado histoquímica permite a visualização de células com disfunção mitocondrial. Esta técnica, com estudos iniciais datam de 1968, permanece popular, com muitos considerando-o "padrão ouro" para a identificação de doenças mitocondriais em pacientes 14,19,26,27. Agora, é freqüentemente usada para investigar o envelhecimento mutação mtDNA-driven e envelhecimento distúrbios relacionados 12,13,18,20,21,24. A COX / SDH método duplo-rotulagem é frequ...
Divulgações
Não há conflitos de interesse declarados.
Agradecimentos
Este trabalho foi financiado pelo Instituto Nacional do Envelhecimento (AG04418), Instituto Nacional de Abuso de Drogas, Instituto Nacional do Programa de Saúde Karolinska Institutet Parcerias Pós-Graduação, Karolinska Institutet, da Suécia de Pesquisa do Conselho, Brain Power Sueco e Fundação Cérebro sueco. Muito obrigado a Mattias Karlen e Giuseppe Dr. Coppotelli de apoio criativo com a Figura 1 e 2, respectivamente; Karin Pernold de assistência técnica; e as Dras. Barry J. Hoffer, Lars Olson, e Nils-Göran Larsson para o conselho útil muito e discussão.
Materiais
| Nome do reagente | Companhia | Número de catálogo | Comments (opcional) |
| Gelo seco | AGA Gas AB | forma de bloco | |
| Isopentano (2 metilbutano) | Sigma-Aldrich | 277258 CAS: 78-78-4 | |
| Cyrostat solução incorporação | Sakura Finetek | Tissue Tek 4583 | |
| Criostato | Microm | Microm Modelo HM 500M | |
| Slides | Thermo Scientific | Super geada Mais Menzel Glaser J1800AMWZ | |
| Lamínulas de vidro Vidro borosilicato | VWR International | 16004-098 | 24 x 50 mm |
| Papel de filtro | Munktell Filtro AB | Qualidade: 1350 ArtigoNúmero: 242 001 | 430 x 430 mm |
| Tetrahidrocloreto 3,3 'diaminobenzidina (DAB) | Sigma-Aldrich | Sigma Sistema de substrato líquido, D7304 | |
| Citocromo c (Tipo III, do coração de eqüinos) | Sigma-Aldrich | C2506 CAS: 9007-43-6 | |
| Bovina catalase (de fígado) | Sigma-Aldrich | C9322 CAS: 9001-05-2 | |
| Nitroblue tetrazólio (NBT) | Sigma-Aldrich | N6876 CAS: 298-83-9 | |
| Succinato de sódio | Sigma-Aldrich | S2378 CAS: 6106-21-4 | |
| Metasulfato fenazina (PMS) | Sigma-Aldrich | P9625 CAS: 299-11-6 | PMS é sensível à luz. Escudo da luz. |
| Azida de sódio | Sigma-Aldrich | S8032 CAS: 26628-22-8 | |
| Xileno | VWR International | EM-XX0060-4 | |
| Entellan | VWR International | 100503-870 | |
| Malonato (Ácido malónico) | Sigma-Aldrich | M1296 CAS: 141-82-2 |
Referências
- Larsson, N. G. Somatic mitochondrial DNA mutations in mammalian aging. Annu. Rev. Biochem. 79, 683-706 (2010).
- Cottrell, D. A. Role of mitochondrial DNA mutations in disease and aging. Ann. NY Acad. Sci. 908, 199-207 (2000).
- Harman, D. The biologic clock: the mitochondria. J. Am. Geriatr. Soc. 20, 145-147 (1972).
- Wallace, D. C. Mitochondrial genetics - a paradigm for aging and degenerative diseases. Science. 256, 628-632 (1992).
- Trifunovic, A. Premature ageing in mice expressing defective mitochondrial DNA polymerase. Nature. 429, 417-423 (2004).
- Ameur, A. Ultra-deep sequencing of mouse mitochondrial DNA: mutational patterns and their origins. PLoS Genet. 7, e1002028-e1002028 (2011).
- Safdar, A. Endurance exercise rescues progeroid aging and induces systemic mitochondrial rejuvenation in mtDNA mutator mice. Proc. Natl. Acad. Sci. U. S. A. 108, 4135-4140 (2011).
- DiMauro, S., Bonilla, E., Zeviani, M., Nakagawa, M., DeVivo, D. C. Mitochondrial myopathies. Ann. Neurol. 17, 521-538 (1985).
- Old, S. L., Johnson, M. A. Methods of microphotometric assay of succinate dehydrogenase and cytochrome c oxidase activities for use on human skeletal muscle. Histochem. J. 21, 545-555 (1989).
- Chaturvedi, R. K. Impaired PGC-1alpha function in muscle in Huntington's disease. Hum. Mol. Genet. 18, 3048-3065 (2009).
- Edgar, D. Random point mutations with major effects on protein-coding genes are the driving force behind premature aging in mtDNA mutator mice. Cell. Metab. 10, 131-138 (2009).
- Ross, J. M. High brain lactate is a hallmark of aging and caused by a shift in the lactate dehydrogenase A/B ratio. Proc. Natl. Acad. Sci. U. S. A. 107, 20087-20092 (2010).
- Crugnola, V. Mitochondrial respiratory chain dysfunction in muscle from patients with amyotrophic lateral sclerosis. Arch. Neurol. 67, 849-854 (2010).
- Nonaka, I. Muscle pathology in cytochrome c oxidase deficiency. Acta. Neuropathol. 77, 152-160 (1988).
- DiMauro, S. Mitochondrial encephalomyopathies. Neurol. Clin. 8, 483-506 (1990).
- Bonilla, E. New morphological approaches to the study of mitochondrial encephalomyopathies. Brain. Pathol. 2, 113-119 (1992).
- Brierley, E. J., Johnson, M. A., Lightowlers, R. N., James, O. F., Turnbull, D. M. Role of mitochondrial DNA mutations in human aging: implications for the central nervous system and muscle. Ann. Neurol. 43, 217-223 (1998).
- Borthwick, G. M., Johnson, M. A., Ince, P. G., Shaw, P. J., Turnbull, D. M. Mitochondrial enzyme activity in amyotrophic lateral sclerosis: implications for the role of mitochondria in neuronal cell death. Ann. Neurol. 46, 787-790 (1999).
- Gellerich, F. N. Mitochondrial respiratory rates and activities of respiratory chain complexes correlate linearly with heteroplasmy of deleted mtDNA without threshold and independently of deletion size. Biochim. Biophys. Acta. 1556, 41-52 (2002).
- Larsson, N. G. Mitochondrial transcription factor A is necessary for mtDNA maintenance and embryogenesis in mice. Nat. Genet. 18, 231-236 (1998).
- Ekstrand, M. I. Progressive parkinsonism in mice with respiratory-chain-deficient dopamine neurons. Proc. Natl. Acad. Sci. U. S. A. 104, 1325-1330 (2007).
- Seligman, A. M., Karnovsky, M. J., Wasserkrug, H. L., Hanker, J. S. Nondroplet ultrastructural demonstration of cytochrome oxidase activity with a polymerizing osmiophilic reagent, diaminobenzidine (DAB). J. Cell. Biol. 38, 1-14 (1968).
- Dubowitz, V., Brooke, M. Muscle Biopsy: A Modern Approach. , (1973).
- Cottrell, D. A. Cytochrome c oxidase deficient cells accumulate in the hippocampus and choroid plexus with age. Neurobiol. Aging. 22, 265-272 (2001).
- Blanco, C. E., Sieck, G. C., Edgerton, V. R. Quantitative histochemical determination of succinic dehydrogenase activity in skeletal muscle fibres. Histochem. J. 20, 230-243 (1988).
- Moraes, C. T., Ricci, E., Bonilla, E., DiMauro, S., Schon, E. A. The mitochondrial tRNA(Leu(UUR)) mutation in mitochondrial encephalomyopathy, lactic acidosis, and strokelike episodes (MELAS): genetic, biochemical, and morphological correlations in skeletal muscle. Am. J. Hum. Genet. 50, 934-949 (1992).
- Petruzzella, V. Extremely high levels of mutant mtDNAs co-localize with cytochrome c oxidase-negative ragged-red fibers in patients harboring a point mutation at nt 3243. Hum. Mol. Genet. 3, 449-454 (1994).
- Tulinius, M. H., Holme, E., Kristiansson, B., Larsson, N. G., Oldfors, A. Mitochondrial encephalomyopathies in childhood. I. Biochemical and morphologic investigations. J. Pediatr. 119, 242-250 (1991).
- Haas, R. H. The in-depth evaluation of suspected mitochondrial disease. Mol. Genet. Metab. 94, 16-37 (2008).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados