このコンテンツを視聴するには、JoVE 購読が必要です。 サインイン又は無料トライアルを申し込む。
Method Article
シトクロムを使用してミトコンドリア呼吸機能の可視化 Cオキシダーゼ/コハク酸脱水素酵素(COX / SDH)二重標識組織化学
要約
シトクロムcオキシダーゼ/ナトリウム脱水素酵素(COX / SDH)二重標識法では、新鮮凍結組織切片におけるミトコンドリアの呼吸酵素の欠乏の直接可視化することができます。これは簡単な組織化学的手法であり、ミトコンドリア病、老化、および老化関連疾患を検討する上で有用です。
要約
ミトコンドリアDNA(mtDNA)の欠陥は、病気の重要な原因であり、変化の1,2の高齢化や老化に関連する根底にある。老化のミトコンドリア説は、老化プロセス3で、生体エネルギーの恒常性と細胞機能を変化させることができるミトコンドリアDNA変異、の役割を示唆している。豊富な証拠は、この理論の1,4、mtDNAの突然変異誘発マウス5にする例のサポートでコンパイルされているが、高齢化のmtDNAの損傷の正確な役割は、6,7完全には理解されていない。
呼吸酵素の活性を観察することによりミトコンドリアの機能障害を調査するための簡単なアプローチです。複雑なIV、またはシトクロム c オキシダーゼ (COX)は、ミトコンドリアの機能に不可欠です。 COXの触媒サブユニットはミトコンドリアDNAによってエンコードされ、複合体の構築(図1)のために必須であるされています。従って、適切な合成と機能は、主にミトコンドリアDNAの完全性2に基づいています。他の呼吸器複合体を調査することもできますが、複合体IVとIIは、組織化学的検査8,9に最も適しています。増加はミトコンドリアの生合成10-12を示すかもしれませんが、複雑なII、またはコハク酸脱水素酵素(SDH)は、完全に核DNA(図1)によってエンコードされ、その活性は、通常、障害のあるミトコンドリアDNAの影響を受けません。障害ミトコンドリア病で観察されるミトコンドリア、老化、そして加齢に伴う病気は、しばしば低いか不在のCOX活性2,12-14と細胞の存在につながる。 COXおよびSDHの活動を個別に調査することができますが、連続した二重標識法15,16は、ミトコンドリア機能障害12,17-21で細胞を見つけるのに有利で あることが証明されている。
アッセイの最適な憲法の多くは、基質濃度、電子受容体/供与体、中間の電子キャリア、pHの影響、及び反応のtとして、決定されているIME 9,22,23。 3,3' -ジアミノベンジジン(DAB)は、効果的かつ信頼性の高い電子供与体22です。機能COXを持つ細胞では、茶色のインダミンポリマー生成物は、ミトコンドリアのクリステに局在し、細胞22を飽和します。機能不全にCOXとそれらの細胞は、青色ホルマザンの最終製品9,24に、ニトロブルーテトラゾリウム(NBT)、電子受容体の減少により、SDH活性の可視化を可能にする、DABの製品で飽和されることはありません。 シトクロム cとコハク酸ナトリウムの基板は、制御および変異型/疾患組織から9までの内因性レベルを標準化するために追加されます。カタラーゼペルオキシダーゼ活性9,22から可能な限り汚染反応を避けるための予防措置として追加されます。フェナジンメトサルフェート(PMS)、中間電子伝達体は、最終の反応生成物9,25の形成を高めるために、呼吸鎖阻害剤、アジ化ナトリウムと組み合わせて使用されます。これは、通知にもかかわらずationは、この上品な簡単なアッセイの結果に影響を及ぼすいくつかの重要な詳細は、特異性のコントロールやテクニックの進歩に加えて、まだ提示されていない。
プロトコル
1。 cryosectioningのための組織の準備
- 利用可能な倫理的な許可証に基づき、頸椎脱臼または断頭のいずれかの方法で動物を生け贄に捧げる。
- 迅速に関心の組織( 例えば 、脳)を収集し、迅速に(組織の最適な形態を得るために液体窒素で冷やしイソペンタンまたはプロパンで凍結が必要になる場合があります)ドライアイスで凍結。セクションに-80℃アルミホイルで店の組織は、° Cまでの準備。
- cryosectioningの準備のために凍結組織を埋め込みます。
- -21で14μmの凍結切片を収集° C(温度を調整する必要があります± 1〜2 ° C)。使用する準備ができるまで-20℃で封入することなく加熱ブロック、および店舗のスライドを使用してスライド上のセクションを解凍します。
2。 COXの組織化学
- スライドは、1時間室温で乾燥することができます。湿った濾紙を持つスライド染色室でスライドを入れ、ストリップに切断。 consistenを取得するには各実験におけるtの結果、それは時間の遅延を最小限に抑えるため、実験ごとに10個のスライドの最大値を処理することをお勧めします。
- 化学フード1X DAB、0.1 M PBSのpH = 7.0で100μM シトクロム cの下準備。すぐに渦。
- (2μgのml -1のまたは約4 IU ml -1の )カタラーゼ、ウシ2μgのを追加。カタラーゼのすべての穀物を分割してボルテックスでよく混和する。
- 150適用 - インキュベーション培地200μLを各スライドに、すべてのセクションの上に均等に分散するためにピペットチップを使用してください。
- 37℃で40分間スライドをインキュベート℃に
- スライド上の過剰な溶液を除去。洗浄は、0.1 M PBSのpH = 7.0の4倍、10分ごとに時間を、スライド。
- 湿紙のストリップをスライド染色室にスライドを返します。
3。 SDHの組織化学
- 1.5mMのNBT、130mMのコハク酸ナトリウム、0.2mMのPMS、および0.1MのPBSのpH = 7.0の1.0 mMのアジ化ナトリウムは、化学物質のボンネットの下準備。遮蔽するために十分注意してください光からPMS。すぐに渦。
- 各スライドにインキュベーション培地の150〜200μLを適用し、すべてのセクションの上に均等に分散するためにピペットチップを使用してください。
- 37℃で40分間スライドをインキュベート℃に
- スライド上の過剰な溶液を除去。洗浄は、0.1 M PBSのpH = 7.0の4倍、10分ごとに時間を、スライド。
- エタノールの下記の濃度で2分間スライドを脱水:70%、70%、95%、95%、99.5%。その後は、追加の99.5%の段階で10分の時間を要します。
- 10分間、キシレンのスライドを置きます。 Entellanとカバースリップをマウントします。スライドは、換気の良い場所で一晩、または少なくとも1〜2時間乾燥することができます。
4。ミトコンドリア機能障害の定量
- ミトコンドリア機能障害の量は、細胞ブルー染色の量で示されます。これらの金額を半定量するために、スライドはコード化し、明視野顕微鏡下で可視化されるべきである。半定量は、ブラインドで実行する必要がありますスケールを使用して基礎は、0 - 4(0、青なし染色、4、唯一青色の染色)から、例えば。各被験者/動物の平均値を計算するために与えられた件名(subject)/動物からいくつかのセクションで半定量化のこの種類を実行するのが最善です。
- 統計は、マン - ホイットニーまたはKruskal - Wallisのような非パラメトリックテストを、使用して実行する必要があります。
5。適切な特異性のコントロール
- COX活性のための特異性のコントロールについては、"COXの組織化学"の手順を繰り返し、および2.5 mMのアジ化ナトリウム、ターミナルの呼吸鎖阻害剤を加える。
- SDH活性のための特異性のコントロールについては、コハク酸ナトリウムの除去し、50mMマロン酸、SDHの競合阻害剤を加えて"SDHの組織化学"の手順を繰り返します。
- 洗い、エタノール系列でセクションを脱水してから、などの手順3.4で説明したスライドにマウントし、カバースリップ - 3.6。
6。代表的な結果:
テント"> COX / SDH二重標識組織化学的アッセイの全体的なスキームを図2に示されています。野生型と年不相応に老けているmtDNAの突然変異誘発のマウスからの脳切片における適切なCOX / SDH二重標識組織化学の代表的な例が図に示されている(3)野生型マウス(図3、左パネル)の暗褐色の染色は、通常のCOXの活性を示した。青色染色によって示される呼吸鎖の欠陥を持つ細胞は、12週齢のミトコンドリアDNAの突然変異誘発のマウスでは明らかに、これらの欠陥は、となった46週間(図3、中央と右のパネル)に歳のmtDNAミューテータマウスとして普及。不十分なCOXラベリングのために野生型マウスの脳切片における不適切なCOX / SDH二重標識の例を図4に示されています。不十分なインキュベーションのCOX活性のデモンストレーションのための時間、またはインキュベーション中にスライドを封入により、分子状酸素の利用を減らすことは、DAB反応するの低下沈着をもたらしたしたがって、イオン積、とは、SDHのインキュベーション中に、青色のホルマザンの最終製品の形成を可能にした。
COXとSDH活性はまた(図5、左と中央)別々に調べることができますが、系列ラベリングには、COXの不足で細胞の同定に有用であり、SDHのインキュベーション(図3中の青い沈殿が形成されるため、中心をと右)。 COXおよびSDH活動のための特異性のコントロールも(図5、右)に行うことができます。
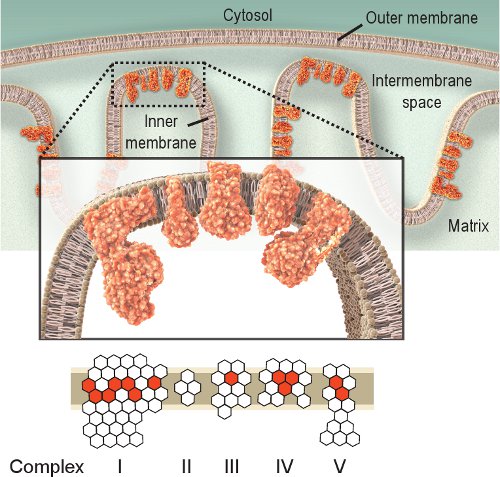
図1。ミトコンドリア呼吸複合体IV。ミトコンドリア呼吸鎖は、内膜内に位置し、5つの複合体を含んでいます。呼吸鎖の目的は、複雑なIからIVにして、ATPを生産する複合V(ATPアーゼ)で使用されている内側の膜を横切るプロトン勾配を作るそうすることで電子を輸送することです。赤い六角形represeNTのサブユニットはミトコンドリアDNAによってコードさ。白い六角形は、核DNA(複合体IIが完全に核ゲノムからエンコードされていることに注意)でエンコードされたサブユニットを表しています。従って、ミトコンドリアゲノムの変異は、呼吸鎖複合体のサブユニットの変異に起因する呼吸鎖の機能障害を引き起こす可能性があります。
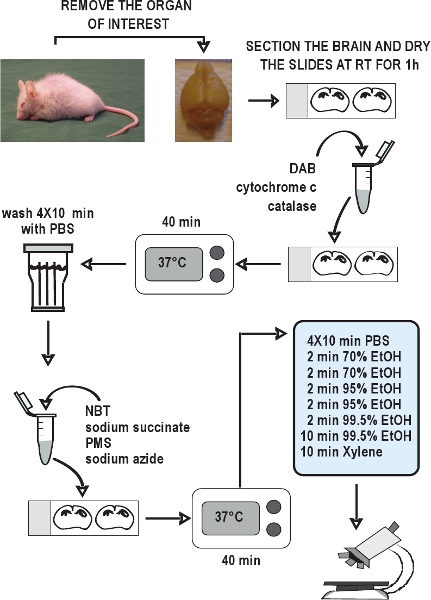
図2。COX / SDH二重標識組織化学アッセイのフローチャート 。興味の器官を分析、急速にドライアイス上で組織を凍結し、そして、それらを保存する - 80℃をクリオスタット切片を収集し備え置かなければならない - 20 ° Cまでの使用を。 1時間室温で空気乾燥のセクションを許可する。 、COXの組織化学のためのインキュベーション培地を準備したスライドに適用し、37℃で40分間インキュベート℃を10分各洗浄用PBS 4倍のセクションを洗ってください。 SDHの組織化学のために培養培地を調製、SLIに適用DESは、再度37℃で40分間インキュベートPBSでもう一度セクションを洗浄、エタノール系列で脱水し、マウントしてスライドをカバースリップ。 COX / SDH二重標識のセクションでは、1〜2時間以内に明視野顕微鏡下で表示する準備ができました。

図3。COX / SDH二重標識の代表例 。野生型と年不相応に老けているmtDNAの突然変異誘発のマウスの脳切片を順次COXおよびSDH活動のために標識した。 (スケールバー:200μmの)通常のCOX活性は、(ダークブラウン色で示される)野生型マウス(左)から海馬に示す通りであった。 COXの欠陥は、(青い色で示される)のmtDNAミューテータマウス(中央と右)から海馬において明らかにされた。 mtDNAの突然変異誘発マウスの年齢の46週までにCOX活性のさらなる減少は、呼吸鎖の機能障害の広範な悪化を示唆し、そこにあった。観測された水戸mtDNAの突然変異誘発マウス12のchondrial機能障害は、ミトコンドリアDNAの点突然変異だけでなく、リニア失5の増加したレベルの高レベルによって引き起こされる。

図4。不適切なCOX / SDH二重標識の例 。野生型マウスの脳切片を順次COXおよびSDH活動のために標識した。 (スケールバー:200μmの)不適切なインキュベーション時間(10〜25分)COX活性のデモンストレーションのためには、40分間のインキュベーション時間(左と中央)と比較して、茶色のDABの反応生成物の削減堆積をもたらした。 SDHのインキュベーション中に、青色のホルマザンの最終製品を形成するために許可されて短縮されたインキュベーション時間は、誤解を招くCOXの欠陥を持つ細胞の存在を示唆している。 COXのインキュベーション中にスライドを封入することも、DAB反応するの不正確な形成と沈着をもたらしたイオン製品(右)。
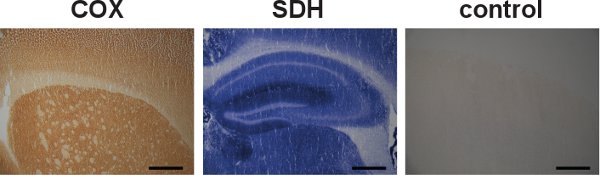
図5。私ndividual COXおよびSDHのラベリングと特異性の制御 。野生型マウスの脳切片を別々にCOXとSDH活動のために標識した、(左と中央)がそれぞれ、ダークブラウン色とブルー色で示されます。 COXおよびSDHの活動が個々にラベルを付けることができますが、系列ラベリングは、ミトコンドリア機能障害を有する細胞を見つけるのに有利であることが証明されている。野生型マウスから脳内COXおよびSDH活動のための特異性の制御の例は、ラベルの有無を(右)を示した。 (スケールバー:200μmの)
ディスカッション
複合COX / SDH組織化学的方法では、ミトコンドリア機能障害を有する細胞の可視化を可能にします。この手法は、初期の研究、1968年にさかのぼると、多くはそれの患者14,19,26,27のミトコンドリア病を識別するための"ゴールドスタンダード"を考慮して、人気を保っています。それは今頻繁にmtDNA変異主導老化や老化関連疾患12,13,18,20,21,24を調査するために使用されます。 C...
開示事項
利害の衝突は宣言されません。
謝辞
この作品は、老化の国立研究所(AG04418)、国立薬物乱用研究所、健康、カロリンスカ研究所大学院のパートナーシッププログラムの国立研究所、カロリンスカ研究所、スウェーデン研究評議会、スウェーデンの頭脳パワー、およびスウェーデンの脳の財団によってサポートされていました。多くの、それぞれ図1と2、創造的サポートのためのマティアスカーレンと博士ジュゼッペCoppotelliのおかげで、技術支援のためのPernoldカリン、と博士。バリーJ.ホッファー、非常に有益な助言と議論するためのラースオルソン、そしてニルス-ゴランラーション。
資料
| 試薬の名前 | 会社 | カタログ番号 | コメント(省略可能) |
| ドライアイス | AGAガスAB | ブロックの形 | |
| イソペンタン(2 - メチルブタン) | シグマアルドリッチ | 277258 CAS:78-78-4 | |
| Cyrostat埋め込みソリューション | サクラファインテック | 組織テック4583 | |
| クライオスタット | Microm | MicromモデルHM 500M | |
| スライド | サーモサイエンティフィック | スーパーフロストプラス メンツェルグレイザー J1800AMWZ | |
| カバーガラス ホウケイ酸ガラス | VWRインターナショナル | 16004-098 | 24 × 50ミリメートル |
| ろ紙 | テルフィルターAB | 品質:1350 記事番号:242 001 | 430 × 430ミリメートル |
| 3,3' - ジアミノベンジジン四塩酸塩(DAB) | シグマアルドリッチ | シグマ液体基質システム、D7304 | |
| シトクロム c(タイプIII、ウマ心臓から) | シグマアルドリッチ | C2506 CAS:9007-43-6 | |
| (肝臓から)カタラーゼ、ウシ | シグマアルドリッチ | C9322 CAS:9001-05-2 | |
| ニトロブルーテトラゾリウム(NBT) | シグマアルドリッチ | N6876 CAS:298-83-9 | |
| コハク酸ナトリウム | シグマアルドリッチ | S2378 CAS:6106-21-4 | |
| フェナジンメトサルフェート(PMS) | シグマアルドリッチ | P9625 CAS:299-11-6 | PMSは、光に敏感です。光の盾。 |
| アジ化ナトリウム | シグマアルドリッチ | S8032 CAS:26628-22-8 | |
| キシレン | VWRインターナショナル | EM - XX0060 - 4 | |
| Entellan | VWRインターナショナル | 100503-870 | |
| マロン酸エステル (マロン酸) | シグマアルドリッチ | M1296 CAS:141-82-2 |
参考文献
- Larsson, N. G. Somatic mitochondrial DNA mutations in mammalian aging. Annu. Rev. Biochem. 79, 683-706 (2010).
- Cottrell, D. A. Role of mitochondrial DNA mutations in disease and aging. Ann. NY Acad. Sci. 908, 199-207 (2000).
- Harman, D. The biologic clock: the mitochondria. J. Am. Geriatr. Soc. 20, 145-147 (1972).
- Wallace, D. C. Mitochondrial genetics - a paradigm for aging and degenerative diseases. Science. 256, 628-632 (1992).
- Trifunovic, A. Premature ageing in mice expressing defective mitochondrial DNA polymerase. Nature. 429, 417-423 (2004).
- Ameur, A. Ultra-deep sequencing of mouse mitochondrial DNA: mutational patterns and their origins. PLoS Genet. 7, e1002028-e1002028 (2011).
- Safdar, A. Endurance exercise rescues progeroid aging and induces systemic mitochondrial rejuvenation in mtDNA mutator mice. Proc. Natl. Acad. Sci. U. S. A. 108, 4135-4140 (2011).
- DiMauro, S., Bonilla, E., Zeviani, M., Nakagawa, M., DeVivo, D. C. Mitochondrial myopathies. Ann. Neurol. 17, 521-538 (1985).
- Old, S. L., Johnson, M. A. Methods of microphotometric assay of succinate dehydrogenase and cytochrome c oxidase activities for use on human skeletal muscle. Histochem. J. 21, 545-555 (1989).
- Chaturvedi, R. K. Impaired PGC-1alpha function in muscle in Huntington's disease. Hum. Mol. Genet. 18, 3048-3065 (2009).
- Edgar, D. Random point mutations with major effects on protein-coding genes are the driving force behind premature aging in mtDNA mutator mice. Cell. Metab. 10, 131-138 (2009).
- Ross, J. M. High brain lactate is a hallmark of aging and caused by a shift in the lactate dehydrogenase A/B ratio. Proc. Natl. Acad. Sci. U. S. A. 107, 20087-20092 (2010).
- Crugnola, V. Mitochondrial respiratory chain dysfunction in muscle from patients with amyotrophic lateral sclerosis. Arch. Neurol. 67, 849-854 (2010).
- Nonaka, I. Muscle pathology in cytochrome c oxidase deficiency. Acta. Neuropathol. 77, 152-160 (1988).
- DiMauro, S. Mitochondrial encephalomyopathies. Neurol. Clin. 8, 483-506 (1990).
- Bonilla, E. New morphological approaches to the study of mitochondrial encephalomyopathies. Brain. Pathol. 2, 113-119 (1992).
- Brierley, E. J., Johnson, M. A., Lightowlers, R. N., James, O. F., Turnbull, D. M. Role of mitochondrial DNA mutations in human aging: implications for the central nervous system and muscle. Ann. Neurol. 43, 217-223 (1998).
- Borthwick, G. M., Johnson, M. A., Ince, P. G., Shaw, P. J., Turnbull, D. M. Mitochondrial enzyme activity in amyotrophic lateral sclerosis: implications for the role of mitochondria in neuronal cell death. Ann. Neurol. 46, 787-790 (1999).
- Gellerich, F. N. Mitochondrial respiratory rates and activities of respiratory chain complexes correlate linearly with heteroplasmy of deleted mtDNA without threshold and independently of deletion size. Biochim. Biophys. Acta. 1556, 41-52 (2002).
- Larsson, N. G. Mitochondrial transcription factor A is necessary for mtDNA maintenance and embryogenesis in mice. Nat. Genet. 18, 231-236 (1998).
- Ekstrand, M. I. Progressive parkinsonism in mice with respiratory-chain-deficient dopamine neurons. Proc. Natl. Acad. Sci. U. S. A. 104, 1325-1330 (2007).
- Seligman, A. M., Karnovsky, M. J., Wasserkrug, H. L., Hanker, J. S. Nondroplet ultrastructural demonstration of cytochrome oxidase activity with a polymerizing osmiophilic reagent, diaminobenzidine (DAB). J. Cell. Biol. 38, 1-14 (1968).
- Dubowitz, V., Brooke, M. Muscle Biopsy: A Modern Approach. , (1973).
- Cottrell, D. A. Cytochrome c oxidase deficient cells accumulate in the hippocampus and choroid plexus with age. Neurobiol. Aging. 22, 265-272 (2001).
- Blanco, C. E., Sieck, G. C., Edgerton, V. R. Quantitative histochemical determination of succinic dehydrogenase activity in skeletal muscle fibres. Histochem. J. 20, 230-243 (1988).
- Moraes, C. T., Ricci, E., Bonilla, E., DiMauro, S., Schon, E. A. The mitochondrial tRNA(Leu(UUR)) mutation in mitochondrial encephalomyopathy, lactic acidosis, and strokelike episodes (MELAS): genetic, biochemical, and morphological correlations in skeletal muscle. Am. J. Hum. Genet. 50, 934-949 (1992).
- Petruzzella, V. Extremely high levels of mutant mtDNAs co-localize with cytochrome c oxidase-negative ragged-red fibers in patients harboring a point mutation at nt 3243. Hum. Mol. Genet. 3, 449-454 (1994).
- Tulinius, M. H., Holme, E., Kristiansson, B., Larsson, N. G., Oldfors, A. Mitochondrial encephalomyopathies in childhood. I. Biochemical and morphologic investigations. J. Pediatr. 119, 242-250 (1991).
- Haas, R. H. The in-depth evaluation of suspected mitochondrial disease. Mol. Genet. Metab. 94, 16-37 (2008).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved