Для просмотра этого контента требуется подписка на Jove Войдите в систему или начните бесплатную пробную версию.
Method Article
Визуализация митохондриальной дыхательной функции использованием цитохрома C Оксидазы / сукцинатдегидрогеназы (ЦОГ / SDH) Дважды маркировки гистохимии
В этой статье
Резюме
Цитохром с оксидазы / натрия дегидрогеназы (ЦОГ / SDH) двойной маркировки метод позволяет для прямой визуализации митохондриальных дыхательных ферментов недостатки в свежезамороженных срезах тканей. Это просто гистохимические техники и полезен в расследовании митохондриальных болезней, старения и связанных со старением заболеваний.
Аннотация
Mitochondrial DNA (mtDNA) defects are an important cause of disease and may underlie aging and aging-related alterations 1,2. The mitochondrial theory of aging suggests a role for mtDNA mutations, which can alter bioenergetics homeostasis and cellular function, in the aging process 3. A wealth of evidence has been compiled in support of this theory 1,4, an example being the mtDNA mutator mouse 5; however, the precise role of mtDNA damage in aging is not entirely understood 6,7.
Observing the activity of respiratory enzymes is a straightforward approach for investigating mitochondrial dysfunction. Complex IV, or cytochrome c oxidase (COX), is essential for mitochondrial function. The catalytic subunits of COX are encoded by mtDNA and are essential for assembly of the complex (Figure 1). Thus, proper synthesis and function are largely based on mtDNA integrity 2. Although other respiratory complexes could be investigated, Complexes IV and II are the most amenable to histochemical examination 8,9. Complex II, or succinate dehydrogenase (SDH), is entirely encoded by nuclear DNA (Figure 1), and its activity is typically not affected by impaired mtDNA, although an increase might indicate mitochondrial biogenesis 10-12. The impaired mtDNA observed in mitochondrial diseases, aging, and age-related diseases often leads to the presence of cells with low or absent COX activity 2,12-14. Although COX and SDH activities can be investigated individually, the sequential double-labeling method 15,16 has proved to be advantageous in locating cells with mitochondrial dysfunction 12,17-21.
Many of the optimal constitutions of the assay have been determined, such as substrate concentration, electron acceptors/donors, intermediate electron carriers, influence of pH, and reaction time 9,22,23. 3,3'-diaminobenzidine (DAB) is an effective and reliable electron donor 22. In cells with functioning COX, the brown indamine polymer product will localize in mitochondrial cristae and saturate cells 22. Those cells with dysfunctional COX will therefore not be saturated by the DAB product, allowing for the visualization of SDH activity by reduction of nitroblue tetrazolium (NBT), an electron acceptor, to a blue formazan end product 9,24. Cytochrome c and sodium succinate substrates are added to normalize endogenous levels between control and diseased/mutant tissues 9. Catalase is added as a precaution to avoid possible contaminating reactions from peroxidase activity 9,22. Phenazine methosulfate (PMS), an intermediate electron carrier, is used in conjunction with sodium azide, a respiratory chain inhibitor, to increase the formation of the final reaction products 9,25. Despite this information, some critical details affecting the result of this seemly straightforward assay, in addition to specificity controls and advances in the technique, have not yet been presented.
протокол
1. Ткань подготовки к cryosectioning
- Жертва животного или шейки дислокации или обезглавливание, в соответствии с имеющимися этических разрешения.
- Быстро собирать тканей интерес (например,. Головной мозг), и быстро заморозить на сухом льду (ткани может потребовать замораживания в изопентан или пропан охлажденной жидким азотом для получения оптимального морфологии). Магазин тканей в алюминиевую фольгу при температуре -80 ° С до готовности разделе.
- Добавить замороженные ткани при подготовке к cryosectioning.
- Сбор 14-мкм разделы криостате при -21 ° C (возможно, потребуется скорректировать температуры ± 1-2 ° С). Оттепель разделы на слайдах использованием нагревательного блока, и хранить слайды без coverslipping при температуре -20 ° С до готовности к использованию.
2. ЦОГ гистохимии
- Разрешить слайды высохнуть при комнатной температуре в течение 1 часа. Положите слайды в режиме слайд-окрашивания камере с мокрым фильтровальной бумаги, нарезать полосками. Для получения consistenт результатов в каждом эксперименте, рекомендуется обрабатывать не более десяти слайдов на эксперимент, чтобы минимизировать время задержки.
- Подготовка под капот химические 1X DAB, 100 мкМ цитохром-с-в 0.1 М PBS рН = 7,0. Vortex быстро.
- Добавить 2 мкг бычьей каталазы (2 мкг мл -1 или около 4 МЕ мл -1). Хорошо перемешайте на вортексе, чтобы разбить все зерна каталазы.
- Применение 150 - 200 мкл инкубационной среды для каждого слайда, использование пипетки, чтобы равномерно распределить на все разделы.
- Инкубируйте слайды в течение 40 минут при температуре 37 ° C.
- Удалите излишки раствора из слайдов. Вымойте слайды 4 раза по 10 минут времени, в 0,1 М PBS рН = 7,0.
- Вернуться слайды в слайд-окрашивания камере мокрыми полосами бумаги.
3. SDH гистохимии
- Подготовка под капотом химических 1,5 мМ НБТ, 130 мМ сукцинат натрия, 0,2 мМ ПМС, и 1,0 мМ азид натрия в 0,1 М PBS рН = 7,0. Будьте осторожны, чтобы оградитьPMS от света месте. Vortex быстро.
- Применить 150-200 мкл инкубационной среды для каждого слайда, использование пипетки, чтобы равномерно распределить на все разделы.
- Инкубируйте слайды в течение 40 минут при температуре 37 ° C.
- Удалите излишки раствора из слайдов. Вымойте слайды 4 раза по 10 минут времени, в 0,1 М PBS рН = 7,0.
- Дегидрировать слайды на 2 минуты в следующих концентрациях этанола: 70%, 70%, 95%, 95%, 99,5%. Затем дайте 10 минут в дополнительных 99,5% шаг.
- Место слайды в ксилоле в течение 10 минут. Установить при помощи Entellan и покровное. Разрешить слайды для высыхания на ночь или, по крайней мере 1-2 часов в проветриваемом помещении.
4. Определение митохондриальная дисфункция
- Количество митохондриальной дисфункции указывается количество клеточного синего окрашивания. Для полу-количественного эти суммы, слайды должны быть закодированы и визуализируются при ярком микроскопии. Полу-количественное должны быть выполнены на слепого основе с использованием масштаба, например, с 0-4 (0, без синего окрашивания; 4, только синее окрашивание). Лучше всего для выполнения такого рода полу-количественная на нескольких участках от данного предмета / животного, чтобы вычислить среднее значение для каждого предмета / животного.
- Статистика должна проводиться с использованием непараметрических тестов, например, Манна-Уитни и Крускала-Уоллиса.
5. Соответствующие управления специфичность
- Для контроля за специфики деятельности ЦОГ, повторите "ЦОГ гистохимии" шаги, и добавить 2,5 мМ азид натрия, цепи терминала дыхательных ингибитора.
- Для контроля за специфики деятельности SDH, повторите "SDH гистохимии" шаги с удалением натрия сукцината и добавлением 50 мМ малонат, конкурентный ингибитор SDH.
- Вымойте и обезвоживают секций в серии этанола, а затем смонтировать и покровное слайды как описано в пунктах 3.4 - 3.6.
6. Представитель Результаты:
палатка "> Общая схема ЦОГ / SDH двойной маркировки гистохимического анализа показано на рисунке 2. Типичные примеры соответствующих ЦОГ / SDH двойной маркировки гистохимии в мозге секций от дикого типа и преждевременно стареющих мышей мтДНК мутатор показаны на рисунке 3. темно-коричневой окраски в мышей дикого типа (рис. 3, слева) показал нормальную активность ЦОГ. Клетки с дыхательной цепи недостатков, обозначенных синей окраски, были выявлены в 12-недельным мышам мтДНК мутатор, и эти недостатки стали более широко, как мтДНК мутатор мышей в возрасте до 46 недель (рис. 3, в центре и справа).Примеры неправильного ЦОГ / SDH двойной маркировки в мозгу секций от мышей дикого типа из-за недостаточной маркировки ЦОГ показано на рисунке 4. Недостаточное время инкубации для демонстрации активности ЦОГ, или снижение доступности молекулярного кислорода coverslipping слайдов во время инкубации, привело к уменьшению отложения DAB реагироватьионное произведение, и таким образом позволили образованию сине конечного продукта формазана во время инкубационного SDH.
ЦОГ и SDH деятельности можно исследовать по отдельности (рис. 5, слева и в центре), однако последовательная маркировка помогает в выявлении клеток с недостатками ЦОГ, в связи с образованием синего осадка при инкубации SDH (рис. 3, в центре и справа). Специфика управления в отношении ЦОГ и SDH деятельность также может быть сделано (рис. 5, справа).
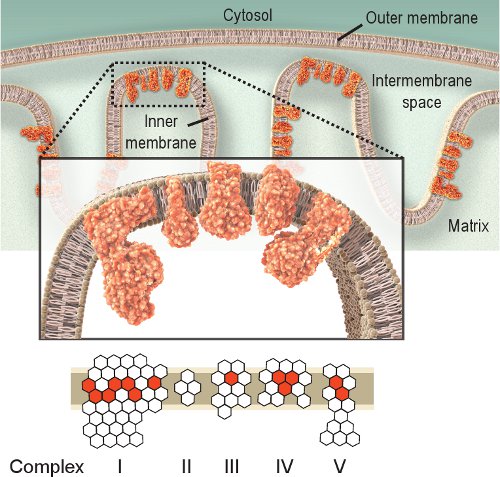
Рисунок 1. Митохондриальной дыхательной комплексы IV. Дыхательной цепи митохондрий находится в пределах внутренней мембране и включает в себя пять комплексов. Целью дыхательной цепи для транспортировки электронов от комплекса я к IV и при этом он создает протонный градиент через внутреннюю мембрану используется комплекс V (АТФазы), чтобы произвести АТФ. Красный represe шестиугольниковнт субъединиц, кодируемых мтДНК. Белый шестиугольников представляют субъединиц, кодируемых ядерной ДНК (заметим, что комплекс II полностью закодирован от ядерного генома). Таким образом, мутации в митохондриального генома может привести к дисфункции дыхательной цепи из-за мутации в подразделениях органов дыхания цепных комплексов.
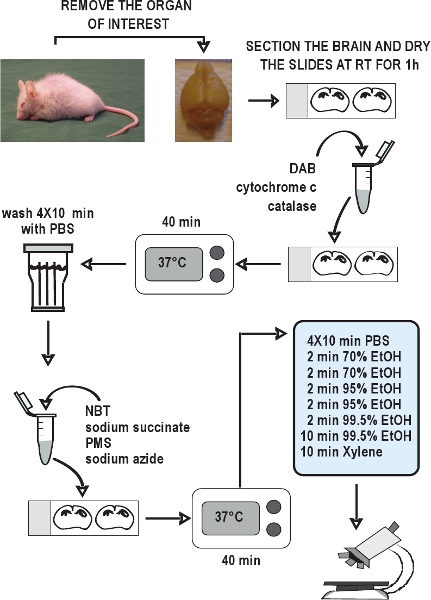
Рисунок 2. Блок-схема ЦОГ / SDH двойной маркировки гистохимического анализа. Рассеките органов интерес, быстро заморозить ткани на сухом льду, и хранить их при - 80 ° C. Сбор криостат разделов и хранить при - 20 ° C до использования. Разрешить разделы высохнуть на воздухе при комнатной температуре в течение 1 часа. Подготовка среду инкубации для гистохимии КОКС, применить его к слайдам и инкубировать 40 минут при температуре 37 ° C. Вымойте секций в 4 раза PBS в течение 10 минут каждого мытья. Подготовка среду инкубации для гистохимии SDH, применить его к SLIде, и снова инкубировать 40 минут при температуре 37 ° C. Вымойте разделы снова в PBS, обезвоживают в серии этанола, а затем смонтировать и покровное слайдов. ЦОГ / SDH дважды помечены разделы готовы, чтобы просмотреть при ярком микроскопии в течение 1-2 часов.

Рисунок 3. Типичными примерами ЦОГ / SDH двойной маркировки. Мозг секций от дикого типа и преждевременно стареющих мышей мтДНК мутатор были последовательно маркировку, указывающую на ЦОГ и SDH деятельности. (Масштаб по сайту:. 200 мкм) Нормальная активность ЦОГ (обозначены темно-коричневого цвета) было показано в гиппокампе от мышей дикого типа (слева). ЦОГ недостатков (обозначен синим цветом) были выявлены в гиппокампе мышей от мтДНК мутатор (в центре и справа). Существовал дальнейшее снижение активности ЦОГ на 46-недельного возраста, в мтДНК мышей мутатор, предлагая широкое обострение дыхательной дисфункции цепи. Наблюдается митоchondrial дисфункции у мышей мтДНК мутатор 12 вызвано высокими уровнями точечных мутаций мтДНК, а также повышение уровня линейных удалений 5.

Рисунок 4. Примеры неправильного ЦОГ / SDH двойной маркировки. Мозг секций от мышей дикого типа были последовательно маркировку, указывающую на ЦОГ и SDH деятельности. (Масштаб по сайту:. 200 мкм) Недостаточное время инкубации (10 и 25 минут) для демонстрации активности ЦОГ привело к уменьшению отложения продукта реакции коричневый DAB, по сравнению с 40-минутной инкубации времени (слева и в центре). Короткий инкубационный раз позволили образованию сине конечного продукта формазана во время инкубационного SDH, ошибочно предполагая наличие клеток с недостатками ЦОГ. Coverslipping слайдах во время инкубационного ЦОГ также привело к неточным образование и отложение DAB реагироватьионное произведение (справа).
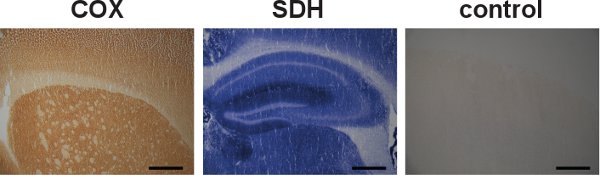
Рисунок 5. Я ndividual ЦОГ и SDH маркировки и специфику управления. Мозг секций от мышей дикого типа были отдельно помечены для ЦОГ и SDH деятельности, указывает темно-коричневый цвет и синий цвет, соответственно (слева и в центре). Хотя ЦОГ и SDH деятельности могут быть снабжены индивидуальными этикетками, последовательной маркировки оказалось выгодным в расположении клеток с митохондриальной дисфункцией. Примером специфика управления ЦОГ и SDH деятельности в мозг от дикого типа мышей показало отсутствие маркировки (справа). (Масштаб по сайту:. 200 мкм)
Обсуждение
Комбинированный ЦОГ / SDH гистохимические метод позволяет визуализации клеток с митохондриальной дисфункцией. Этот метод, с ранних исследований, начиная с 1968 года, остается популярным, и многие считая его «золотым стандартом» для выявления митохондриальных заболеваний у пациентов, 1...
Раскрытие информации
Нет конфликта интересов объявлены.
Благодарности
Работа выполнена при поддержке Национального института старения (AG04418), Национальный институт по злоупотреблению наркотиками, Национальный Институт Здоровья-Каролинского института Высшей Программа партнерства Каролинского института, шведского исследовательского совета, шведский Питание мозга, и шведский фонд мозга. Большое спасибо Маттиас Карлен и доктор Джузеппе Coppotelli для творческой поддержки с рисунком 1 и 2 соответственно; Карин Pernold для оказания технической помощи, а также д-ра. Барри Дж. Хоффер, Ларс Олсон, и Нильс-Горан Ларссон на протяжении большей полезные советы и обсуждения.
Материалы
| Название реагента | Компания | Номер по каталогу | Комментарии (необязательно) |
| Сухой лед | AGA AB газа | блочном виде | |
| Изопентан (2-метилбутан) | Sigma-Aldrich | 277258 CAS: 78-78-4 | |
| Cyrostat вложение решение | Сакура Finetek | Ткань Tek 4583 | |
| Криостат | Microm | Microm Модель HM 500M | |
| Слайды | Thermo Scientific | Супер Фрост Плюс Менцель Глезер J1800AMWZ | |
| Обложка очки Боросиликатного стекла | VWR International | 16004-098 | 24 х 50 мм |
| Фильтровальная бумага | Munktell фильтра AB | Качество: 1350 СтатьяКоличество: 242 001 | 430 х 430 мм |
| 3,3 '-диаминобензидина tetrahydrochloride (DAB) | Sigma-Aldrich | Sigma Система жидкостного субстрата, D7304 | |
| Цитохром с (тип III, от лошадиного сердца) | Sigma-Aldrich | C2506 CAS: 9007-43-6 | |
| Говядина каталазы (из печени) | Sigma-Aldrich | C9322 CAS: 9001-05-2 | |
| Нитросинего тетразолия (NBT) | Sigma-Aldrich | N6876 CAS: 298-83-9 | |
| Натрия сукцинат | Sigma-Aldrich | S2378 CAS: 6106-21-4 | |
| Феназинметасульфат (ПМС) | Sigma-Aldrich | P9625 CAS: 299-11-6 | ПМС светочувствительным. Щит от света месте. |
| Азид натрия | Sigma-Aldrich | S8032 CAS: 26628-22-8 | |
| Ксилол | VWR International | ЭМ-XX0060-4 | |
| Entellan | VWR International | 100503-870 | |
| Малонат (Малоновая кислоты) | Sigma-Aldrich | M1296 CAS: 141-82-2 |
Ссылки
- Larsson, N. G. Somatic mitochondrial DNA mutations in mammalian aging. Annu. Rev. Biochem. 79, 683-706 (2010).
- Cottrell, D. A. Role of mitochondrial DNA mutations in disease and aging. Ann. NY Acad. Sci. 908, 199-207 (2000).
- Harman, D. The biologic clock: the mitochondria. J. Am. Geriatr. Soc. 20, 145-147 (1972).
- Wallace, D. C. Mitochondrial genetics - a paradigm for aging and degenerative diseases. Science. 256, 628-632 (1992).
- Trifunovic, A. Premature ageing in mice expressing defective mitochondrial DNA polymerase. Nature. 429, 417-423 (2004).
- Ameur, A. Ultra-deep sequencing of mouse mitochondrial DNA: mutational patterns and their origins. PLoS Genet. 7, e1002028-e1002028 (2011).
- Safdar, A. Endurance exercise rescues progeroid aging and induces systemic mitochondrial rejuvenation in mtDNA mutator mice. Proc. Natl. Acad. Sci. U. S. A. 108, 4135-4140 (2011).
- DiMauro, S., Bonilla, E., Zeviani, M., Nakagawa, M., DeVivo, D. C. Mitochondrial myopathies. Ann. Neurol. 17, 521-538 (1985).
- Old, S. L., Johnson, M. A. Methods of microphotometric assay of succinate dehydrogenase and cytochrome c oxidase activities for use on human skeletal muscle. Histochem. J. 21, 545-555 (1989).
- Chaturvedi, R. K. Impaired PGC-1alpha function in muscle in Huntington's disease. Hum. Mol. Genet. 18, 3048-3065 (2009).
- Edgar, D. Random point mutations with major effects on protein-coding genes are the driving force behind premature aging in mtDNA mutator mice. Cell. Metab. 10, 131-138 (2009).
- Ross, J. M. High brain lactate is a hallmark of aging and caused by a shift in the lactate dehydrogenase A/B ratio. Proc. Natl. Acad. Sci. U. S. A. 107, 20087-20092 (2010).
- Crugnola, V. Mitochondrial respiratory chain dysfunction in muscle from patients with amyotrophic lateral sclerosis. Arch. Neurol. 67, 849-854 (2010).
- Nonaka, I. Muscle pathology in cytochrome c oxidase deficiency. Acta. Neuropathol. 77, 152-160 (1988).
- DiMauro, S. Mitochondrial encephalomyopathies. Neurol. Clin. 8, 483-506 (1990).
- Bonilla, E. New morphological approaches to the study of mitochondrial encephalomyopathies. Brain. Pathol. 2, 113-119 (1992).
- Brierley, E. J., Johnson, M. A., Lightowlers, R. N., James, O. F., Turnbull, D. M. Role of mitochondrial DNA mutations in human aging: implications for the central nervous system and muscle. Ann. Neurol. 43, 217-223 (1998).
- Borthwick, G. M., Johnson, M. A., Ince, P. G., Shaw, P. J., Turnbull, D. M. Mitochondrial enzyme activity in amyotrophic lateral sclerosis: implications for the role of mitochondria in neuronal cell death. Ann. Neurol. 46, 787-790 (1999).
- Gellerich, F. N. Mitochondrial respiratory rates and activities of respiratory chain complexes correlate linearly with heteroplasmy of deleted mtDNA without threshold and independently of deletion size. Biochim. Biophys. Acta. 1556, 41-52 (2002).
- Larsson, N. G. Mitochondrial transcription factor A is necessary for mtDNA maintenance and embryogenesis in mice. Nat. Genet. 18, 231-236 (1998).
- Ekstrand, M. I. Progressive parkinsonism in mice with respiratory-chain-deficient dopamine neurons. Proc. Natl. Acad. Sci. U. S. A. 104, 1325-1330 (2007).
- Seligman, A. M., Karnovsky, M. J., Wasserkrug, H. L., Hanker, J. S. Nondroplet ultrastructural demonstration of cytochrome oxidase activity with a polymerizing osmiophilic reagent, diaminobenzidine (DAB). J. Cell. Biol. 38, 1-14 (1968).
- Dubowitz, V., Brooke, M. Muscle Biopsy: A Modern Approach. , (1973).
- Cottrell, D. A. Cytochrome c oxidase deficient cells accumulate in the hippocampus and choroid plexus with age. Neurobiol. Aging. 22, 265-272 (2001).
- Blanco, C. E., Sieck, G. C., Edgerton, V. R. Quantitative histochemical determination of succinic dehydrogenase activity in skeletal muscle fibres. Histochem. J. 20, 230-243 (1988).
- Moraes, C. T., Ricci, E., Bonilla, E., DiMauro, S., Schon, E. A. The mitochondrial tRNA(Leu(UUR)) mutation in mitochondrial encephalomyopathy, lactic acidosis, and strokelike episodes (MELAS): genetic, biochemical, and morphological correlations in skeletal muscle. Am. J. Hum. Genet. 50, 934-949 (1992).
- Petruzzella, V. Extremely high levels of mutant mtDNAs co-localize with cytochrome c oxidase-negative ragged-red fibers in patients harboring a point mutation at nt 3243. Hum. Mol. Genet. 3, 449-454 (1994).
- Tulinius, M. H., Holme, E., Kristiansson, B., Larsson, N. G., Oldfors, A. Mitochondrial encephalomyopathies in childhood. I. Biochemical and morphologic investigations. J. Pediatr. 119, 242-250 (1991).
- Haas, R. H. The in-depth evaluation of suspected mitochondrial disease. Mol. Genet. Metab. 94, 16-37 (2008).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеThis article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены