Bu içeriği görüntülemek için JoVE aboneliği gereklidir. Oturum açın veya ücretsiz deneme sürümünü başlatın.
Method Article
Sitokrom kullanarak Mitokondriyal Solunum Fonksiyon Görselleştirme C Oksidaz / Succinat Dehidrogenaz (COX / SDH) Çift-etiketleme Histokimya
Bu Makalede
Özet
Sitokrom c oksidaz / sodyum dehidrogenaz (COX / SDH) çift etiketleme yöntemi, doğrudan bir görünüm için taze dondurulmuş doku kesitlerinde mitokondriyal solunum enzim eksiklikleri sağlar. Bu basit bir histokimyasal teknik ve mitokondriyal hastalıklar, yaşlanma, yaşlanma ile ilişkili bozukluklar araştıran yararlıdır.
Özet
Mitokondriyal DNA (mtDNA) kusurlar, önemli bir hastalık nedenidir ve değişiklikler 1,2 yaşlanmaya ve yaşlanma ile ilgili temelini olabilir . Mitokondriyal teorisi yaşlanma, yaşlanma süreci 3, biyoenerjetik homeostazı ve hücresel fonksiyon değiştirebilir mtDNA mutasyonlarının için bir rol göstermektedir . Kanıtların bir servet bu teori 1,4, 5 mtDNA Mutator fare bir örnek destek derlenmiştir, ancak, yaşlanma mtDNA hasarı kesin rolü 6,7 tamamen anlaşılmış değildir.
Solunum enzimleri aktivite Gözlem mitokondriyal disfonksiyonu araştırmak için basit bir yaklaşımdır. Kompleks IV veya sitokrom c oksidaz (COX), mitokondriyal fonksiyon için çok önemlidir. COX katalitik alt birimden mtDNA tarafından kodlanan ve karmaşık montaj (Şekil 1) için gereklidir. Böylece, doğru sentezi ve işlevi büyük ölçüde mtDNA bütünlüğünü 2 dayanmaktadır .Konusu olsa da, diğer solunum yolu kompleksleri incelenmiştir Kompleksleri IV ve II histokimyasal inceleme 8,9 için en müsait. Kompleks II veya süksinat dehidrogenaz (SDH), mitokondriyal biyogenezi 10-12 bir artış gösteriyor olabilir rağmen, tamamen nükleer DNA (Şekil 1) tarafından kodlanır ve faaliyet genellikle etkilenen engelli mtDNA değildir. Engelli mtDNA yaşlanma, mitokondriyal hastalıklarda gözlenen ve yaşla ilişkili hastalıklar genellikle, düşük ya da hiç COX aktivitesi 2,12-14 hücrelerin varlığı yol açar . COX ve SDH faaliyetleri ayrı ayrı incelenmiştir olmasına rağmen, 15,16 ardışık çift etiketleme yöntemi, 12,17-21 mitokondriyal disfonksiyon hücrelerin yerini avantajlı olduğu kanıtlanmıştır.
Testin en uygun anayasaların çoğu substrat konsantrasyonu, elektron alıcısı / donörler, ara elektron taşıyıcıları, pH etkisi, ve reaksiyon t gibi tespit edilmiştirime 9,22,23. 3,3 '-diaminobenzidin (DAB), etkili ve güvenilir bir elektron donörü 22 . , Kahverengi indamine polimer ürünü işleyen COX hücrelerinde mitokondriyal cristae yerelleştirme ve hücreler 22 doyurabilecek. Bu nedenle, işlevsiz COX ile bu hücrelerin mavi formazan son ürün 9,24 nitroblue tetrazolium (NBT), bir elektron alıcısı azaltılması SDH aktivite görselleştirme için izin DAB ürün doymuş olmaz. Sitokrom c ve sodyum süksinat substratlar kontrolü ve mutant / hastalıklı dokuların 9 arasında endojen düzeylerini normalleştirmek için eklenir. Katalaz peroksidaz aktivitesini 9,22 mümkün kirlenmesine neden olan reaksiyonları önlemek için bir önlem olarak eklenir. Phenazine methosulfate (PMS), bir ara elektron taşıyıcı, son reaksiyon ürünlerinin 9,25 oluşumunu arttırmak için sodyum azid, bir solunum zinciri inhibitörü ile birlikte kullanılır. Bu bilgilendirmek rağmenation, bu yakışık alır basit bir testin sonucu etkileyen bazı kritik detayları, özgüllük kontrolleri ve tekniği gelişmeler yanı sıra, henüz sunulmuş değil.
Protokol
1. Cryosectioning için doku hazırlanması
- Mevcut etik izni ile uygun olarak, servikal dislokasyon ya da baş kesme ya da hayvan kurban.
- Ilgi hızla dokuları (örn. Beyin) toplamak ve kuru buz (dokuların en iyi morfoloji elde etmek için sıvı nitrojen ile soğutulmuş isopentane veya propan donma gerekebilir) hızla dondurmak . -80 Alüminyum folyo Mağaza dokuların bölümüne ° C 'ye kadar hazır.
- Cryosectioning hazırlık dondurulmuş doku gömme.
- -21 14 mikron Kriyostat bölümleri toplayın ° C (sıcaklığını ayarlamak gerekebilir ± 1-2 ° C). Kullanıma hazır olana kadar -20 ° C'de coverslipping olmadan ısıtma bloğu, ve mağaza slaytlar kullanarak Slaytlarınıza çözülme bölümleri.
2. COX histokimya
- Slaytlar, oda sıcaklığında 1 saat süreyle kurumaya bırakın. Islak filtre kağıdı ile bir slayt boyama odasında slaytlar koyun, şeritler halinde kesilir. Consisten almak içinHer deneme t sonuçlar, zaman gecikmeleri en aza indirmek için en fazla on slaytlar Deneme başına işlemek için tavsiye edilir.
- Kimyasal bir kaput 1X DAB altında hazırlanın, 100 mcM 0.1 M PBS pH = 7.0 c sitokrom. Hızlı Vortex.
- Katalaz sığır 2 mg (2 mg ml -1 veya yaklaşık 4 IU ml -1) ekleyin. Katalaz tüm tahıllar break up vorteks ile iyice karıştırın.
- Uygula 150 - 200 mcL inkübasyon orta her slayt tüm bölümler üzerine eşit şekilde yaymak için pipet kullanın.
- 37 slaytlar 40 dakika inkübe ° C
- Slaytları fazla çözüm çıkarın. Yıkama 0.1 M PBS pH = 7.0 4 kez, her seferinde 10 dakika, slaytlar.
- Islak kağıt şeritler ile slayt boyama odasına slaytlar dönün.
3. SDH histokimya
- Bir kimyasal kaputu altında 1.5 mM NBT, 130 mM sodyum süksinat, 0.2 mM PMS, 1.0, 0.1 M PBS pH = 7.0 mM sodyum azid hazırlayın. Take korumak için dikkatli olunIşıktan PMS. Hızlı Vortex.
- Her bir slayt için inkübasyon orta 150-200 mcL uygulayın, tüm bölümleri üzerine eşit olarak yaymak için pipet kullanın.
- 37 slaytlar 40 dakika inkübe ° C
- Slaytları fazla çözüm çıkarın. Yıkama 0.1 M PBS pH = 7.0 4 kez, her seferinde 10 dakika, slaytlar.
- % 70,% 70,% 95,% 95,% 99.5: etanol aşağıdaki konsantrasyonları 2 dakika için slaytlar dehydrate. Ardından% 99,5 oranında ek bir adımda 10 dakika izin verir.
- Place 10 dakika için ksilen slaytlar. Entellan ve kapak ile monte edin. Slaytlar havalandırılan bir alanda bir gecede, ya da en azından 1-2 saat kurumasını bekleyin.
4. Mitokondriyal disfonksiyon Belirlenmesi
- Mitokondriyal disfonksiyon miktarı, hücresel mavi boyanma miktarı ile gösterilir. Bu miktarlar yarı-ölçmek için, slaytlar kodlu ve parlak alan mikroskobu altında görüntülendi olmalıdır. Yarı kantifikasyon kör bir yapılmalıdır temelinde bir ölçek kullanılarak, örneğin 0-4 (0 mavi boyama, 4, sadece mavi boyama). Bu her konu / hayvan için ortalama değerini hesaplamak için belirli bir konuda / hayvan çeşitli bölümler bu tür yarı-kantifikasyon gerçekleştirmek için en iyisidir.
- İstatistik non-parametrik Mann-Whitney veya Kruskal-Wallis testi kullanılarak yapılmalıdır.
5. Uygun özgüllük kontrolleri
- COX aktivitesi için özgüllük kontroller için, "COX histokimya" adımları yineleyin ve 2.5 mM sodyum azid, bir terminal solunum zinciri inhibitörü ekleyin.
- SDH aktivite için özgüllük kontroller için, ortadan kaldırılması ve 50 mM malonat, SDH rekabetçi bir inhibitörü ilavesi ile sodyum süksinat "SDH histokimya" adımları tekrarlayın.
- Yıkayın ve bir etanol dizi bölümleri kurutmak ve sonra adımları 3.4 'de açıklandığı gibi slaytların montajı ve kapak - 3.6.
6. Temsilcisi Sonuçlar:
çadır "> yabani tip ve erken yaşlanma mtDNA Mutator farelerin beyin bölümlerinde uygun COX / SDH çift etiketleme histokimya COX / SDH çift etiketleme histokimyasal assay Şekil 2'de gösterilmiştir. Temsilcisi örnekler genel şeması Şekil gösterilmiştir 3. koyu kahverengi lekelere (Şekil 3, sol panel) wild-tip farelerde, mavi boyama belirtilen solunum zinciri eksiklikleri, hücreler normal COX faaliyet gösterdi 12 haftalık mtDNA Mutator fareler ortaya çıkarıldı ve bu eksiklikler oldu 46 hafta (Şekil 3, orta ve sağ panel) yaş mtDNA Mutator fareler gibi daha yaygın.Yetersiz COX etiketleme nedeniyle wild-tip farelerden alınan beyin bölümlerinde Uygunsuz COX / SDH çift etiketleme örnekleri Şekil 4'te gösterilmiştir. Yetersiz inkübasyon gösteri COX aktivite için zaman, ya da moleküler oksijen inkübasyon sırasında slayt coverslipping durumu azaltarak, DAB tepki azaltılmış birikimi ile sonuçlandı.böylece iyon ürün ve SDH inkübasyon sırasında mavi formazan son ürün oluşumu için izin verdi.
(Sol Şekil 5 ve merkez) COX ve SDH faaliyetleri de ayrı ayrı araştırılmalıdır olabilir, ancak sıralı etiketleme SDH inkübasyon sırasında mavi çökelti oluşumu (Şekil 3, orta ve COX eksiklikler nedeniyle hücreleri, tanımlamada yardımcı olur sağda). COX ve SDH faaliyetleri için Özgüllük kontrolleri de yapılabilir (Şekil 5, sağ).
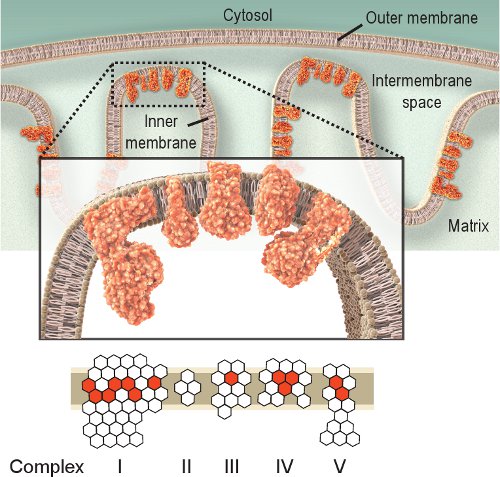
Şekil 1 Mitokondriyal solunum Kompleksleri IV. Mitokondriyal solunum zinciri iç zarı içinde bulunan ve beş kompleksleri içerir. Solunum zincirinin amacı, IV ve ATP üretmek için Kompleksi V (ATPaz) tarafından kullanılan iç zarından bir proton degrade oluşturur Bunu yaparken Kompleksi elektron taşıma. Kırmızı altıgenler huknt altbirimden mtDNA tarafından kodlanan. Beyaz altıgenler nükleer DNA (Kompleksi II nükleer genomu tamamen kodlanmış olduğunu unutmayın) tarafından kodlanan alt birimden temsil eder. Bu nedenle, mitokondriyal genom mutasyonları solunum zinciri kompleksleri altbirimden mutasyonlar nedeniyle solunum zinciri disfonksiyona neden olabilir.
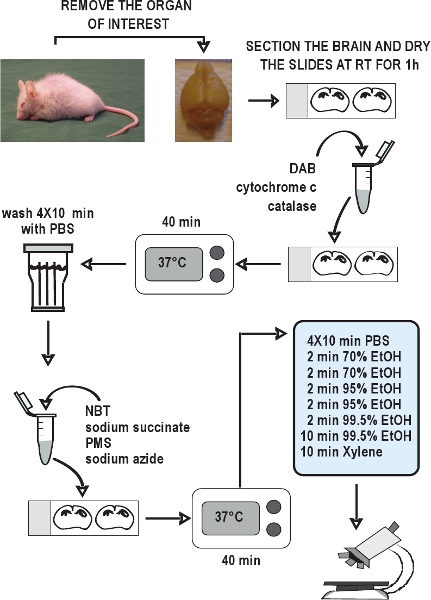
Şekil 2. COX / SDH çift etiketleme histokimyasal testinin Akış çizelgesi. Ilgi organlarını teşrih, kuru buz dokuların hızla dondurmak ve saklayın - 80 ° C Kriyostat bölümleri toplayın ve tutmak - 20 ° C kadar kullanımda. 1 saat süreyle oda sıcaklığında kurumaya bölümleri izin ver. COX histokimya inkübasyon ortamı hazırlayın, slaytlara uygulamak, 37, 40 dakika boyunca inkübe ° C PBS 4 kez bölümlerde her bir yıkama için 10 dakika yıkayın. SDH histokimya inkübasyon ortamı hazırlayın, sli uygulamakdes ve yine 37 ° C'de 40 dakika inkübe PBS içinde bölümleri tekrar yıkayın, bir etanol serisi kurutmak ve ardından montaj ve slaytlar lamel. COX / SDH çift işaretli bölümleri 1-2 saat içinde aydınlık alan mikroskobu altında görüntülemek için hazır.

Şekil 3. COX / SDH çift etiketleme Temsilcisi örnekler. Yabani tip ve erken yaşlanma mtDNA Mutator farelerin beyin bölümleri sırayla COX ve SDH faaliyetleri için etiketli. (Ölçek çubuğu: 200 mikron) Normal COX aktivitesi (koyu kahverengi renk ile gösterilir), wild-tip farelerden (solda) hippocampus bölgesinde görülmüştür. COX eksiklikleri (mavi renkle gösterilir) mtDNA Mutator fareler (merkez sağ) hippocampus bölgesinde ortaya çıkarılmıştır. MtDNA Mutator farelerde yaşı 46 hafta COX aktivitesi daha fazla azalma, solunum zinciri disfonksiyon yaygın alevlenme düşündüren vardı. Gözlenen mitomtDNA Mutator fareler 12 chondrial disfonksiyon mtDNA nokta mutasyonlarının yanı sıra lineer silmeler 5 düzeylerinde artış yüksek düzeyde neden olur.

Şekil 4 Uygunsuz COX / SDH çift etiketleme örnekleri. Wild-tip farelerden alınan Beyin bölümleri sırayla COX ve SDH faaliyetleri için etiketli. (Ölçek çubuğu: 200 mikron) COX faaliyet gösterilmesi için yetersiz inkübasyon sürelerinde (10 ve 25 dakika) 40 dakikalık bir inkübasyon süresi (solda ve ortada) ile karşılaştırıldığında, kahverengi DAB reaksiyon ürünü daha düşük bir birikimi sonuçlandı. SDH inkübasyon sırasında mavi formazan son ürün oluşumu için izin kısaltılmış inkübasyon sürelerinde, yanıltıcı COX eksiklikleri bulunan hücrelerin varlığını düşündürmektedir. COX inkübasyon sırasında slaytlar Coverslipping DAB tepki yanlış oluşumu ve birikimi ile sonuçlandıiyon ürün (sağda).
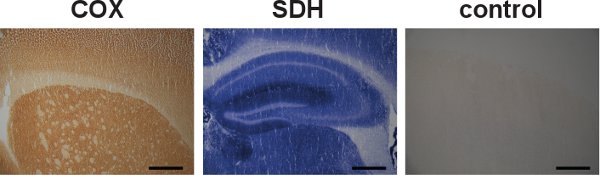
Şekil 5. Ndividual COX ve SDH etiketleme ve özgüllük kontrolü. Wild-tip farelerden alınan Beyin bölümleri koyu kahverengi renk ve mavi renk sırasıyla (sol ve merkez) tarafından belirtilen COX ve SDH etkinlikler için ayrı ayrı etiketlenir. COX ve SDH faaliyetleri tek tek etiketli olmasına rağmen, ardışık etiketleme mitokondriyal disfonksiyonu olan hücreleri bulma konusunda avantajlı olduğu kanıtlanmıştır. Yabani tip bir fare beyin COX ve SDH faaliyetleri için özgüllük kontrol etiketleme yokluğu (sağ) bir örnek gösterdi. (Ölçek çubuğu: 200 mikron).
Tartışmalar
Kombine COX / SDH histokimyasal yöntemi mitokondriyal disfonksiyonu olan hücrelerin görselleştirme sağlar. Bu teknik, erken çalışmalar 1968 yılına kadar uzanan, birçok hasta 14,19,26,27 mitokondriyal hastalıkların belirlenmesi için "altın standart" dikkate alınarak, popüler olmaya devam etmektedir. Şimdi, mtDNA mutasyonu odaklı yaşlanmaya ve yaşlanma ile ilişkili bozukluklar 12,13,18,20,21,24 araştırmak için sık sık kullanılır. COX / SDH çift etiketleme yönt...
Açıklamalar
Çıkar çatışması ilan etti.
Teşekkürler
Bu çalışma, Ulusal Yaşlanma Enstitüsü (AG04418), İlaç Suistimali Ulusal Enstitüsü, Sağlık-Karolinska Enstitüsünde Lisansüstü Ortaklıkları Programı Ulusal Enstitüsü, Karolinska Enstitüsünde, İsveç Araştırma Konseyi, İsveç Beyin Gücü ve İsveç Beyin Vakfı tarafından desteklenmiştir. Birçok yaratıcı destek için sırasıyla Şekil 1 ve 2, Mattias Karlen ve Dr. Giuseppe Coppotelli sayesinde, teknik yardım için Pernold Karin ve Dr. Barry J. Hoffer, çok yararlı öneriler ve tartışma Lars Olson ve Nils-Göran Larsson.
Malzemeler
| Reaktifi Adı | Şirket | Katalog numarası | Yorumlar (isteğe bağlı) |
| Donmuş karbondioksit | AGA Gaz AB | blok biçimiyle | |
| Isopentane (2 methylbutane) | Sigma-Aldrich | 277258 CAS: 78-78-4 | |
| Cyrostat gömme çözümü | Sakura Finetek | Doku Tek 4583 | |
| Kriyostat | Microm | Microm Model HM 500M | |
| Slaytlar | Thermo Scientific | Super Frost Plus Menzel Gläser J1800AMWZ | |
| Kapak gözlük Borosilikat cam | VWR Uluslararası | 16004-098 | 24 x 50 mm |
| Filtre Kağıdı | Munktell Filtre AB | Kalite: 1350 MakaleSayı: 242 001 | 430 x 430 mm |
| 3,3 '-diaminobenzidin tetrahydrochloride (DAB) | Sigma-Aldrich | Sigma Sıvı Yüzey Sistemi, D7304 | |
| Sitokrom c (Tip III, kalp at) | Sigma-Aldrich | C2506 CAS: 9007-43-6 | |
| Katalaz Sığır (karaciğer) | Sigma-Aldrich | C9322 CAS: 9001-05-2 | |
| Nitroblue tetrazolium (NBT) | Sigma-Aldrich | N6876 CAS: 298-83-9 | |
| Sodyum süksinat | Sigma-Aldrich | S2378 CAS: 6106-21-4 | |
| Phenazine methosulfate (PMS) | Sigma-Aldrich | P9625 CAS: 299-11-6 | PMS ışığa duyarlı. Işıktan koruyun. |
| Sodyum azid | Sigma-Aldrich | S8032 CAS: 26628-22-8 | |
| Ksilen | VWR Uluslararası | EM-XX0060-4 | |
| Entellan | VWR Uluslararası | 100503-870 | |
| Malonat (Asit malonik) | Sigma-Aldrich | M1296 CAS: 141-82-2 |
Referanslar
- Larsson, N. G. Somatic mitochondrial DNA mutations in mammalian aging. Annu. Rev. Biochem. 79, 683-706 (2010).
- Cottrell, D. A. Role of mitochondrial DNA mutations in disease and aging. Ann. NY Acad. Sci. 908, 199-207 (2000).
- Harman, D. The biologic clock: the mitochondria. J. Am. Geriatr. Soc. 20, 145-147 (1972).
- Wallace, D. C. Mitochondrial genetics - a paradigm for aging and degenerative diseases. Science. 256, 628-632 (1992).
- Trifunovic, A. Premature ageing in mice expressing defective mitochondrial DNA polymerase. Nature. 429, 417-423 (2004).
- Ameur, A. Ultra-deep sequencing of mouse mitochondrial DNA: mutational patterns and their origins. PLoS Genet. 7, e1002028-e1002028 (2011).
- Safdar, A. Endurance exercise rescues progeroid aging and induces systemic mitochondrial rejuvenation in mtDNA mutator mice. Proc. Natl. Acad. Sci. U. S. A. 108, 4135-4140 (2011).
- DiMauro, S., Bonilla, E., Zeviani, M., Nakagawa, M., DeVivo, D. C. Mitochondrial myopathies. Ann. Neurol. 17, 521-538 (1985).
- Old, S. L., Johnson, M. A. Methods of microphotometric assay of succinate dehydrogenase and cytochrome c oxidase activities for use on human skeletal muscle. Histochem. J. 21, 545-555 (1989).
- Chaturvedi, R. K. Impaired PGC-1alpha function in muscle in Huntington's disease. Hum. Mol. Genet. 18, 3048-3065 (2009).
- Edgar, D. Random point mutations with major effects on protein-coding genes are the driving force behind premature aging in mtDNA mutator mice. Cell. Metab. 10, 131-138 (2009).
- Ross, J. M. High brain lactate is a hallmark of aging and caused by a shift in the lactate dehydrogenase A/B ratio. Proc. Natl. Acad. Sci. U. S. A. 107, 20087-20092 (2010).
- Crugnola, V. Mitochondrial respiratory chain dysfunction in muscle from patients with amyotrophic lateral sclerosis. Arch. Neurol. 67, 849-854 (2010).
- Nonaka, I. Muscle pathology in cytochrome c oxidase deficiency. Acta. Neuropathol. 77, 152-160 (1988).
- DiMauro, S. Mitochondrial encephalomyopathies. Neurol. Clin. 8, 483-506 (1990).
- Bonilla, E. New morphological approaches to the study of mitochondrial encephalomyopathies. Brain. Pathol. 2, 113-119 (1992).
- Brierley, E. J., Johnson, M. A., Lightowlers, R. N., James, O. F., Turnbull, D. M. Role of mitochondrial DNA mutations in human aging: implications for the central nervous system and muscle. Ann. Neurol. 43, 217-223 (1998).
- Borthwick, G. M., Johnson, M. A., Ince, P. G., Shaw, P. J., Turnbull, D. M. Mitochondrial enzyme activity in amyotrophic lateral sclerosis: implications for the role of mitochondria in neuronal cell death. Ann. Neurol. 46, 787-790 (1999).
- Gellerich, F. N. Mitochondrial respiratory rates and activities of respiratory chain complexes correlate linearly with heteroplasmy of deleted mtDNA without threshold and independently of deletion size. Biochim. Biophys. Acta. 1556, 41-52 (2002).
- Larsson, N. G. Mitochondrial transcription factor A is necessary for mtDNA maintenance and embryogenesis in mice. Nat. Genet. 18, 231-236 (1998).
- Ekstrand, M. I. Progressive parkinsonism in mice with respiratory-chain-deficient dopamine neurons. Proc. Natl. Acad. Sci. U. S. A. 104, 1325-1330 (2007).
- Seligman, A. M., Karnovsky, M. J., Wasserkrug, H. L., Hanker, J. S. Nondroplet ultrastructural demonstration of cytochrome oxidase activity with a polymerizing osmiophilic reagent, diaminobenzidine (DAB). J. Cell. Biol. 38, 1-14 (1968).
- Dubowitz, V., Brooke, M. Muscle Biopsy: A Modern Approach. , (1973).
- Cottrell, D. A. Cytochrome c oxidase deficient cells accumulate in the hippocampus and choroid plexus with age. Neurobiol. Aging. 22, 265-272 (2001).
- Blanco, C. E., Sieck, G. C., Edgerton, V. R. Quantitative histochemical determination of succinic dehydrogenase activity in skeletal muscle fibres. Histochem. J. 20, 230-243 (1988).
- Moraes, C. T., Ricci, E., Bonilla, E., DiMauro, S., Schon, E. A. The mitochondrial tRNA(Leu(UUR)) mutation in mitochondrial encephalomyopathy, lactic acidosis, and strokelike episodes (MELAS): genetic, biochemical, and morphological correlations in skeletal muscle. Am. J. Hum. Genet. 50, 934-949 (1992).
- Petruzzella, V. Extremely high levels of mutant mtDNAs co-localize with cytochrome c oxidase-negative ragged-red fibers in patients harboring a point mutation at nt 3243. Hum. Mol. Genet. 3, 449-454 (1994).
- Tulinius, M. H., Holme, E., Kristiansson, B., Larsson, N. G., Oldfors, A. Mitochondrial encephalomyopathies in childhood. I. Biochemical and morphologic investigations. J. Pediatr. 119, 242-250 (1991).
- Haas, R. H. The in-depth evaluation of suspected mitochondrial disease. Mol. Genet. Metab. 94, 16-37 (2008).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır