È necessario avere un abbonamento a JoVE per visualizzare questo. Accedi o inizia la tua prova gratuita.
Method Article
Visualizzazione della funzione respiratoria mitocondriale utilizzando Citocromo C Ossidasi / succinato deidrogenasi (COX / SDH) Doppio etichettatura Istochimica
In questo articolo
Riepilogo
Il citocromo c ossidasi / sodio deidrogenasi (COX / SDH) doppio metodo di etichettatura permette di visualizzare direttamente mitocondriale deficit enzimatici respiratori nei fresco congelato sezioni di tessuto. Questa è una tecnica semplice istochimiche ed è utile nelle indagini malattie mitocondriali, invecchiamento e patologie legate all'invecchiamento.
Abstract
DNA mitocondriale (mtDNA) difetti sono una causa importante di malattia e può essere alla base dell'invecchiamento e all'invecchiamento 1,2 alterazioni. La teoria mitocondriale dell'invecchiamento suggerisce un ruolo per le mutazioni del mtDNA, che possono alterare l'omeostasi bioenergetica e la funzione cellulare, nel processo di invecchiamento 3. Una ricchezza di prove è stato redatto a sostegno di questa teoria 1,4, un esempio è il mtDNA mutator mouse 5, tuttavia, il ruolo preciso dei danni del DNA mitocondriale nell'invecchiamento non è del tutto compreso 6,7.
Osservando l'attività degli enzimi respiratori è un approccio semplice per lo studio disfunzione mitocondriale. Complesso IV o citocromo c ossidasi (COX), è essenziale per la funzione mitocondriale. La subunità catalitica del COX sono codificati da mtDNA e sono essenziali per l'assemblaggio del complesso (Figura 1). Così, la sintesi corretta e la funzione sono in gran parte sulla base di mtDNA integrità 2.Anche se altri complessi respiratori potrebbero essere indagati, Complessi IV e II sono i più suscettibili di esame istochimico 8,9. Complesso II, o succinato deidrogenasi (SDH), è interamente codificato dal DNA nucleare (Figura 1), e la sua attività non è in genere affetti da compromissione del mtDNA, anche se un aumento potrebbe indicare la biogenesi mitocondriale 10-12. Il mtDNA alterato osservati in malattie mitocondriali, invecchiamento e malattie legate all'età conduce spesso alla presenza di cellule con scarsa o assente attività COX 2,12-14. Anche se le attività COX e SDH possono essere analizzati individualmente, il sequenziale a doppia etichettatura 15,16 metodo ha dimostrato di essere vantaggioso per localizzare le cellule con disfunzione mitocondriale 12,17-21.
Molte delle costituzioni ottimale del test sono stati determinati, come la concentrazione del substrato, accettori di elettroni / donatori, intermedio trasportatori di elettroni, l'influenza del pH, e t reazioneime 9,22,23. 3,3 '-diaminobenzidina (DAB) è un donatore di elettroni efficace ed affidabile 22. Nelle cellule con il funzionamento della COX, il marrone indamine polimero prodotto sarà localizzare in creste mitocondriali e saturare le cellule 22. Queste cellule disfunzionali con COX quindi non sarà saturata dal prodotto DAB, consentendo la visualizzazione di attività SDH con la riduzione del tetrazolio (NBT), accettore di elettroni, di un blu prodotto finale formazan 9,24. Citocromo c e substrati succinato di sodio vengono aggiunte per normalizzare i livelli endogeni tra controllo e malati / mutante tessuti 9. Catalasi viene aggiunto come precauzione per evitare possibili reazioni contaminazione da attività di perossidasi 9,22. Methosulfate Phenazine (PMS), un vettore intermedio di elettroni, viene utilizzato in combinazione con sodio azide, un inibitore della catena respiratoria, per aumentare la formazione di prodotti di reazione finale di 9,25. Nonostante questo informarezione, alcuni dettagli fondamentali che influenzano il risultato di questo test conveniente semplice, in aggiunta ai controlli specificità e avanzamenti nella tecnica, non sono ancora stati presentati.
Protocollo
1. Preparazione dei tessuti per criosezionamento
- Sacrificare l'animale da una dislocazione cervicale o la decapitazione, secondo disponibili permettono di etica.
- Raccogliere velocemente i tessuti di interesse (ad es. Cervello), e congelare rapidamente in ghiaccio secco (può richiedere il congelamento dei tessuti in isopentano o propano refrigerata con azoto liquido per ottenere morfologia ottimale). Negozio di tessuti in fogli di alluminio a -80 ° C fino al momento di sezione.
- Incorpora tessuti congelati in preparazione criosezionamento.
- Colleziona 14 micron sezioni al criostato a -21 ° C (potrebbe essere necessario regolare la temperatura ± 1-2 ° C). Scongelare sezioni su vetrini con blocco riscaldante, e conservare i vetrini senza coprire i vetrini a -20 ° C fino al momento dell'uso.
2. COX istochimica
- Permettere che i vetrini ad asciugare a temperatura ambiente per 1 ora. Mettete le diapositive in una slide-colorazione da camera con carta da filtro bagnata, tagliata a strisce. Per ottenere consistenrisultati t in ogni esperimento, si raccomanda di elaborare un massimo di dieci diapositive per esperimento per minimizzare i ritardi di tempo.
- Preparare sotto cappa chimica 1X DAB, 100 mM citocromo c in 0.1 M PBS pH = 7.0. Vortex rapidamente.
- Aggiungere 2 mcg bovina catalasi (2 mg ml -1 o circa 4 UI ml -1). Mescolare bene nel vortex per rompere tutti i granelli di catalasi.
- Applicare 150-200 ml di mezzo di incubazione di ogni diapositiva, utilizzare puntale a diffondersi in modo uniforme su tutte le sezioni.
- Incubare i vetrini per 40 minuti a 37 ° C.
- Rimuovere la soluzione in eccesso dalle diapositive. Lavare i vetrini 4 volte, 10 minuti ogni volta, di 0,1 M PBS pH = 7.0.
- Ritorna diapositive slide-colorazione da camera con strisce di carta bagnata.
3. SDH istochimica
- Preparare sotto cappa chimica 1,5 mM NBT, 130 mM sodio succinato, 0,2 PMS mM e 1,0 mM di sodio azide in 0.1 M PBS pH = 7.0. Fare attenzione a proteggere ilPMS dalla luce. Vortex rapidamente.
- Applicare 150-200 ml di mezzo di incubazione di ogni diapositiva, utilizzare puntale a diffondersi in modo uniforme su tutte le sezioni.
- Incubare i vetrini per 40 minuti a 37 ° C.
- Rimuovere la soluzione in eccesso dalle diapositive. Lavare i vetrini 4 volte, 10 minuti ogni volta, di 0,1 M PBS pH = 7.0.
- Disidratano le diapositive per 2 minuti a le seguenti concentrazioni di etanolo: 70%, 70%, 95%, 95%, 99,5%. Quindi consentire 10 minuti in un ulteriore passaggio al 99,5%.
- Collocare le diapositive in xilene per 10 minuti. Montare con Neo Entellan e coprioggetto. Lasciare che il vetrini si asciughino ore durante la notte, o almeno 1-2 in una zona ventilata.
4. Determinazione della disfunzione mitocondriale
- La quantità di disfunzione mitocondriale è indicata dal numero di cellulare colorazione blu. Per semi-quantificare tali somme, vetrini devono essere codificati e visualizzati sotto la luce-microscopia campo. Semi-quantificazione deve essere effettuata su un cieco base utilizzando una scala, per esempio 0-4 (0, nessuna colorazione blu, 4, solo colorazione blu). E 'meglio effettuare questo tipo di semi-quantificazione in diverse sezioni di un dato soggetto / animale per calcolare un valore medio per ciascun soggetto / animale.
- Le statistiche devono essere eseguiti utilizzando un test non parametrico, come Mann-Whitney o Kruskal-Wallis.
5. Specificità controlli appropriati
- Per i controlli di specificità per l'attività COX, ripetere "COX istochimica" passi e aggiungere 2,5 mM di sodio azide, un inibitore terminale della catena respiratoria.
- Per i controlli di specificità per l'attività SDH, ripetere "SDH istochimica" passi con la rimozione di sodio succinato e l'aggiunta di 50 malonato mM, un inibitore competitivo di SDH.
- Lavare e disidratare le sezioni in una serie di etanolo, e poi montare e applicare il coprioggetto le diapositive come descritto nei punti 3,4-3,6.
6. Rappresentante dei risultati:
tenda "> Lo schema complessivo della COX / SDH a doppia etichettatura saggio istochimico è illustrato in Figura 2. esempi rappresentativi di appropriati COX / SDH a doppia etichettatura istochimica in sezioni cerebrali da wild-type e prematuro invecchiamento topi mutatore mtDNA sono illustrate nella figura 3. La colorazione marrone scuro in topi wild-type (Figura 3, pannello di sinistra) ha mostrato la normale attività COX. cellule con difetti della catena respiratoria, indicato dalla colorazione blu, sono stati rivelati in 12 settimane di età topi mutatore mtDNA, e queste carenze si più diffusa come topi mutator mtDNA di età compresa a 46 settimane (Figura 3, il centro e il pannello di destra).Esempi di inappropriati COX / SDH a doppia etichettatura in sezioni cerebrali di topi a causa di insufficiente etichettatura COX wild-type sono mostrati in figura 4. Tempo di incubazione inadeguata per la dimostrazione di attività COX, o riducendo la disponibilità di ossigeno molecolare da montavetrini la diapositiva durante l'incubazione, ha provocato una deposizione ridotta del reazione DABione del prodotto e, quindi, ha permesso per la formazione del prodotto finale formazan blu durante l'incubazione SDH.
Attività COX e SDH possono essere indagati separatamente (Figura 5, sinistra e centro), ma l'etichettatura sequenziale è utile per identificare cellule con carenze COX, a causa della formazione del precipitato blu durante l'incubazione SDH (figura 3, centro e a destra). Controlli di specificità per le attività COX e SDH può essere fatto anche (Figura 5, a destra).
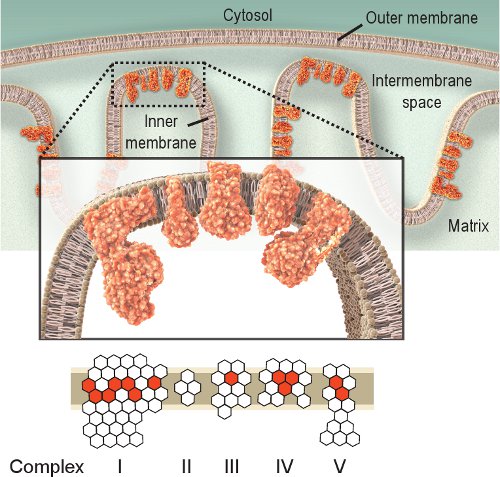
Figura 1. Respiratoria mitocondriale Complessi IV. La catena respiratoria mitocondriale si trova all'interno della membrana interna e comprende cinque complessi. Lo scopo della catena respiratoria è per il trasporto di elettroni dal complesso I al IV, e così facendo crea un gradiente di protoni attraverso la membrana interna utilizzata da Complesso V (ATPasi) per produrre ATP. Rosso esagoni represent subunità codificata dal mtDNA. Esagoni bianchi rappresentano subunità codificate dal DNA nucleare (si noti che Complesso II è completamente codificata dal genoma nucleare). Così, le mutazioni nel genoma mitocondriale può causare disfunzione della catena respiratoria dovuta a mutazioni nel subunità dei complessi della catena respiratoria.
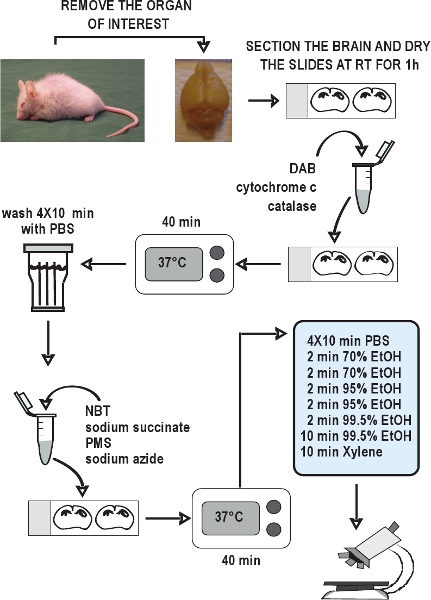
Figura 2. Diagramma di flusso del COX / SDH a doppia etichettatura saggio istochimico. Sezionare gli organi di interesse, rapidamente congelare i tessuti in ghiaccio secco, e conservarli a - 80 ° C. Raccogliere sezioni congelate e tiene a - 20 ° C fino al momento dell'uso. Lasciare sezioni per asciugare a temperatura ambiente per 1 ora. Preparare il mezzo di incubazione per istochimica COX, si applicano le diapositive, e incubare per 40 minuti a 37 ° C. Lavare le sezioni in PBS 4 volte per 10 minuti ogni lavaggio. Preparare il mezzo di incubazione per istochimica SDH, si applicano alle slides, e ancora incubare per 40 minuti a 37 ° C. Lavare le sezioni di nuovo in PBS, disidratano in una serie di etanolo, e poi montare e applicare il coprioggetto le diapositive. La COX / SDH a doppia etichetta sezioni sono pronti a vedere in campo chiaro microscopia entro 1-2 ore.

Figura 3. Esempi rappresentativi di COX / SDH a doppia etichettatura. Sezioni di cervello da wild-type e prematuramente l'invecchiamento nei topi mutatore mtDNA sono stati etichettati in modo sequenziale per le attività COX e SDH. (Bar Scala:. 200 micron) Attività normale COX (indicata dal colore marrone scuro) è stato mostrato in ippocampo di topi wild-type (a sinistra). Carenze COX (indicata dal colore blu) sono stati rivelati in ippocampo dal mtDNA topi mutatore (centro ea destra). C'è stato un ulteriore calo dell'attività COX da 46 settimane di età nel mtDNA topi mutatore, suggerendo esacerbazione diffusa di disfunzione della catena respiratoria. Il osservato mitoDisfunzione mitocondriale nel mtDNA mutator topi 12 è causato da alti livelli di mutazioni puntiformi del mtDNA come pure un aumento dei livelli di delezioni lineari 5.

Figura 4. Esempi di inappropriati COX / SDH a doppia etichettatura. Sezioni di cervello da topi wild-type sono stati etichettati in modo sequenziale per le attività COX e SDH. (Bar Scala:. 200 micron) i tempi di incubazione inadeguata (10 e 25 minuti) per la dimostrazione di attività COX comportato una ridotta deposizione del prodotto marrone reazione DAB, rispetto ai 40 minuti di tempo di incubazione (a sinistra e al centro). I tempi di incubazione ridotto permesso per la formazione del prodotto finale formazan blu durante l'incubazione SDH, fuorviante suggerire la presenza di cellule con deficienze COX. Montavetrini le diapositive durante l'incubazione della COX ha portato anche nella formazione imprecise e deposizione delle reagire DABione del prodotto (a destra).
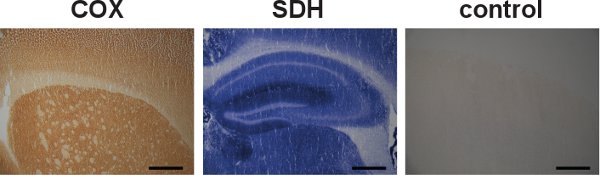
Figura 5. Ndividual I COX SDH e di etichettatura e di controllo specificità. Sezioni di cervello da topi wild-type sono stati etichettati separatamente per le attività COX e SDH, indicato dal colore marrone scuro e il colore azzurro, rispettivamente, (a sinistra e al centro). Anche se le attività COX e SDH possono essere etichettate singolarmente, l'etichettatura sequenziale si è dimostrata vantaggiosa in localizzare le cellule con disfunzione mitocondriale. Un esempio di controllo di specificità per le attività COX e SDH nel cervello da una wild-type topi ha dimostrato una mancanza di etichettatura (a destra). (Bar Scala:. 200 micron)
Discussione
Il combinato COX / SDH metodo istochimico permette la visualizzazione di cellule con disfunzione mitocondriale. Questa tecnica, con i primi studi risalgono al 1968, resta popolare, con molti considerato il "gold standard" per identificare le malattie mitocondriali nei pazienti 14,19,26,27. Ora è spesso utilizzato per indagare mutazioni del mtDNA-driven invecchiamento e patologie legate all'invecchiamento 12,13,18,20,21,24. La COX / SDH a doppia etichettatura metodo viene spesso utili...
Divulgazioni
Nessun conflitto di interessi dichiarati.
Riconoscimenti
Questo lavoro è stato sostenuto dal National Institute of Aging (AG04418), National Institute on Drug Abuse, National Institute of Health, Karolinska Institutet Programma Graduate Partnership, Karolinska Institutet, Consiglio svedese della ricerca, Brain Power svedese, e Brain Foundation svedese. Molte grazie a Mattias Karlen e il Dr. Giuseppe Coppotelli per il supporto creativo di figura 1 e 2, rispettivamente; Karin Pernold di assistenza tecnica; e Drs. Barry J. Hoffer, Lars Olson, e Nils-Göran Larsson per molti consigli utili e di discussione.
Materiali
| Nome del reagente | Azienda | Numero di catalogo | Commenti (opzionale) |
| Ghiaccio secco | AGA Gas AB | blocco modulo | |
| Isopentano (2-metilbutano) | Sigma-Aldrich | 277258 CAS: 78-78-4 | |
| Cyrostat embedding soluzione | Sakura Finetek | Tissue Tek 4583 | |
| Criostato | Microm | Microm modello HM 500M | |
| Diapositive | Thermo Scientific | Super gelo Plus. Menzel Gläser J1800AMWZ | |
| Coprire gli occhiali Vetro borosilicato | VWR International | 16004-098 | 24 x 50 mm |
| Filtro di carta | Munktell Filtro AB | Qualità: 1350 ArticoloNumero: 242 001 | 430 x 430 mm |
| 3,3 '-diaminobenzidina tetraidrocloruro (DAB) | Sigma-Aldrich | Sigma sistema substrato liquido, D7304 | |
| Citocromo c (Tipo III, dal cuore equino) | Sigma-Aldrich | C2506 CAS: 9007-43-6 | |
| Bovina catalasi (dal fegato) | Sigma-Aldrich | C9322 CAS: 9001-05-2 | |
| Tetrazolio (NBT) | Sigma-Aldrich | N6876 CAS: 298-83-9 | |
| Sodio succinato | Sigma-Aldrich | S2378 CAS: 6106-21-4 | |
| Phenazine methosulfate (PMS) | Sigma-Aldrich | P9625 CAS: 299-11-6 | PMS è sensibile alla luce. Scudo dalla luce. |
| Di sodio azide | Sigma-Aldrich | S8032 CAS: 26628-22-8 | |
| Xilene | VWR International | EM-XX0060-4 | |
| Entellan | VWR International | 100503-870 | |
| Malonato (Acido malonico) | Sigma-Aldrich | M1296 CAS: 141-82-2 |
Riferimenti
- Larsson, N. G. Somatic mitochondrial DNA mutations in mammalian aging. Annu. Rev. Biochem. 79, 683-706 (2010).
- Cottrell, D. A. Role of mitochondrial DNA mutations in disease and aging. Ann. NY Acad. Sci. 908, 199-207 (2000).
- Harman, D. The biologic clock: the mitochondria. J. Am. Geriatr. Soc. 20, 145-147 (1972).
- Wallace, D. C. Mitochondrial genetics - a paradigm for aging and degenerative diseases. Science. 256, 628-632 (1992).
- Trifunovic, A. Premature ageing in mice expressing defective mitochondrial DNA polymerase. Nature. 429, 417-423 (2004).
- Ameur, A. Ultra-deep sequencing of mouse mitochondrial DNA: mutational patterns and their origins. PLoS Genet. 7, e1002028-e1002028 (2011).
- Safdar, A. Endurance exercise rescues progeroid aging and induces systemic mitochondrial rejuvenation in mtDNA mutator mice. Proc. Natl. Acad. Sci. U. S. A. 108, 4135-4140 (2011).
- DiMauro, S., Bonilla, E., Zeviani, M., Nakagawa, M., DeVivo, D. C. Mitochondrial myopathies. Ann. Neurol. 17, 521-538 (1985).
- Old, S. L., Johnson, M. A. Methods of microphotometric assay of succinate dehydrogenase and cytochrome c oxidase activities for use on human skeletal muscle. Histochem. J. 21, 545-555 (1989).
- Chaturvedi, R. K. Impaired PGC-1alpha function in muscle in Huntington's disease. Hum. Mol. Genet. 18, 3048-3065 (2009).
- Edgar, D. Random point mutations with major effects on protein-coding genes are the driving force behind premature aging in mtDNA mutator mice. Cell. Metab. 10, 131-138 (2009).
- Ross, J. M. High brain lactate is a hallmark of aging and caused by a shift in the lactate dehydrogenase A/B ratio. Proc. Natl. Acad. Sci. U. S. A. 107, 20087-20092 (2010).
- Crugnola, V. Mitochondrial respiratory chain dysfunction in muscle from patients with amyotrophic lateral sclerosis. Arch. Neurol. 67, 849-854 (2010).
- Nonaka, I. Muscle pathology in cytochrome c oxidase deficiency. Acta. Neuropathol. 77, 152-160 (1988).
- DiMauro, S. Mitochondrial encephalomyopathies. Neurol. Clin. 8, 483-506 (1990).
- Bonilla, E. New morphological approaches to the study of mitochondrial encephalomyopathies. Brain. Pathol. 2, 113-119 (1992).
- Brierley, E. J., Johnson, M. A., Lightowlers, R. N., James, O. F., Turnbull, D. M. Role of mitochondrial DNA mutations in human aging: implications for the central nervous system and muscle. Ann. Neurol. 43, 217-223 (1998).
- Borthwick, G. M., Johnson, M. A., Ince, P. G., Shaw, P. J., Turnbull, D. M. Mitochondrial enzyme activity in amyotrophic lateral sclerosis: implications for the role of mitochondria in neuronal cell death. Ann. Neurol. 46, 787-790 (1999).
- Gellerich, F. N. Mitochondrial respiratory rates and activities of respiratory chain complexes correlate linearly with heteroplasmy of deleted mtDNA without threshold and independently of deletion size. Biochim. Biophys. Acta. 1556, 41-52 (2002).
- Larsson, N. G. Mitochondrial transcription factor A is necessary for mtDNA maintenance and embryogenesis in mice. Nat. Genet. 18, 231-236 (1998).
- Ekstrand, M. I. Progressive parkinsonism in mice with respiratory-chain-deficient dopamine neurons. Proc. Natl. Acad. Sci. U. S. A. 104, 1325-1330 (2007).
- Seligman, A. M., Karnovsky, M. J., Wasserkrug, H. L., Hanker, J. S. Nondroplet ultrastructural demonstration of cytochrome oxidase activity with a polymerizing osmiophilic reagent, diaminobenzidine (DAB). J. Cell. Biol. 38, 1-14 (1968).
- Dubowitz, V., Brooke, M. Muscle Biopsy: A Modern Approach. , (1973).
- Cottrell, D. A. Cytochrome c oxidase deficient cells accumulate in the hippocampus and choroid plexus with age. Neurobiol. Aging. 22, 265-272 (2001).
- Blanco, C. E., Sieck, G. C., Edgerton, V. R. Quantitative histochemical determination of succinic dehydrogenase activity in skeletal muscle fibres. Histochem. J. 20, 230-243 (1988).
- Moraes, C. T., Ricci, E., Bonilla, E., DiMauro, S., Schon, E. A. The mitochondrial tRNA(Leu(UUR)) mutation in mitochondrial encephalomyopathy, lactic acidosis, and strokelike episodes (MELAS): genetic, biochemical, and morphological correlations in skeletal muscle. Am. J. Hum. Genet. 50, 934-949 (1992).
- Petruzzella, V. Extremely high levels of mutant mtDNAs co-localize with cytochrome c oxidase-negative ragged-red fibers in patients harboring a point mutation at nt 3243. Hum. Mol. Genet. 3, 449-454 (1994).
- Tulinius, M. H., Holme, E., Kristiansson, B., Larsson, N. G., Oldfors, A. Mitochondrial encephalomyopathies in childhood. I. Biochemical and morphologic investigations. J. Pediatr. 119, 242-250 (1991).
- Haas, R. H. The in-depth evaluation of suspected mitochondrial disease. Mol. Genet. Metab. 94, 16-37 (2008).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon